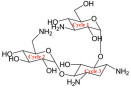
卡那霉素(kanamycin, 图 1) 由Hamao Umezawa于1957年发现[1], 1958年由日本明治制果药业株式会社首先开发生产, 1966年我国从云南西双版纳土壤中分离得到卡那霉素链霉菌, 并研究试制成功国产的卡那霉素[2], 临床主要剂型为注射液。我国生产的硫酸卡那霉素注射液共有129个批准文号, 其他来源包括国内企业A (供出口) 和日本明治制果药业株式会社(原研)。不同来源的硫酸卡那霉素注射液辅料使用情况详见表 1。

|
Figure 1 Structure of kanamycin |
| Table 1 Excipients used in kanamycin injection from different sources |
在杂质谱研究过程中发现: 国内企业A的产品中杂质数量和杂质含量明显较其他企业的产品高[3-5]。经分析, 处方中使用了高浓度的枸橼酸钠。处方中同样含有枸橼酸钠的原研注射液及不含枸橼酸钠的国内企业C的产品在相应保留时间处并未见明显杂质。采用经优化的HPLC-ELSD系统, 将含卡那霉素和较高浓度枸橼酸钠的混合溶液加热破坏后(121 ℃), 在枸橼酸保留时间附近均出现明显的色谱峰, 而这些杂质在其他破坏条件下得到的样品色谱图中均未检出。故需探讨是否加热条件催化了卡那霉素与枸橼酸钠的反应。
鉴于HPLC-ELSD法的检测灵敏度较低, 故采用新建的灵敏度较高的柱后衍生-HPLC-FLD法验证枸橼酸钠和卡那霉素的相容性。同时对原研及国内企业A产品中的枸橼酸钠含量进行测定, 以期探讨处方及相应灭菌工艺的合理性。
为了进一步考察反应机制, 通过离线二维HPLC-MS手段对上述杂质的裂解规律进行分析, 并对主要杂质的结构进行了推测, 以便为处方的合理设计提供依据。
材料与方法仪器 1100型高效液相色谱仪(美国Agilent公司, 配备荧光检测器); 2000ES型蒸发光散射检测器(美国Alltech公司); VECTOR PCX柱后衍生化系统(美国Pickering公司); 1290-6550 Q/TOF质谱仪(美国Agilent公司)。
对照品与试剂 卡那霉素对照品(批号R088K0, 纯度79%, 美国药典对照品); 卡那霉素B(批号130548-200501, 中国食品药品检定研究院); 2-脱氧链霉胺(批号BCBT5899, 97%, 美国Aldrich公司); 脱氧链霉胺卡那胺(批号7-APD-119-1, 加拿大TRC对照品); 枸橼酸(批号L570R59, 99.5%)、邻苯二甲醛(批号: LS20R22) (北京百灵威科技有限公司); 三氟乙酸(美国Tedia公司, 批号: 14100608); 庚烷磺酸钠(日本TCI公司, 批号: AKXUG-DQ); 无水硫酸钠(美国Sigma公司, 批号: BCBZ9014); 甲醇(美国Merck公司, 批号: I1074107 006); 水为Milli-Q超纯水; 其余试剂均为分析纯。
试药 硫酸卡那霉素注射液来自不同的生产企业: 企业A、企业B (原研) 和企业C。
HPLC-ELSD色谱条件 采用十八烷基硅烷键合硅胶色谱柱(Welch LP-C18, 4.6 mm×250 mm, 5 μm), 以0.2 mol·L-1三氟乙酸溶液-甲醇(98∶2) 为流动相; 流速为0.3 mL·min-1; 柱温为30 ℃; 进样体积为20 μL; 蒸发光散射检测器检测(漂移管温度: 80 ℃, 载气流量3.0 L·min-1)。
HPLC-FLD色谱条件 采用十八烷基硅烷键合硅胶色谱柱(Zorbax Eclipse Plus C18, 4.6 mm×100 mm, 3.5 μm), 以pH3.4缓冲液(取庚烷磺酸钠8.7 g和无水硫酸钠32 g, 加水溶解并稀释制成2 L, 用冰醋酸调节pH值至3.4 ± 0.1)-甲醇(95∶5) 为流动相A, pH 3.4缓冲液-甲醇(60∶40) 为流动相B, 进行梯度洗脱; 0~30 min, 100% A→80% B; 30~31 min, 80% B→100% B; 31~35 min, 100% B。流速为1.1 mL·min-1; 柱温为35 ℃; 进样体积为5 μL。
柱后衍生化试液: 取邻苯二甲醛0.8 g, 加甲醇300 mL使溶解, 加巯基乙醇2 mL和硼酸盐缓冲液(取硼酸36 g和氢氧化钠21.5 g, 加水溶解并稀释至2 L, 调节pH值至10.4 ± 0.1) 700 mL, 混匀, 滤过; 流速为0.3 mL·min-1; 衍生化反应温度为35 ℃; 荧光检测器激发波长为340 nm, 发射波长为455 nm。
HPLC-MS条件 液相条件: 采用二羟基丙基硅烷键合硅胶为色谱柱(Inertsil DIOL, 4.6 mm×250 mm, 5 μm), 以0.1%甲酸溶液-甲醇(10∶90) 为流动相, 流速为0.5 mL·min-1, 进样量为20 μL。质谱条件: 电喷雾离子源(ESI), 正离子扫描; 毛细管电压3 500 V, 鞘气温度225 ℃, 鞘气流速11 L·min-1, CID电压20~40 eV。
HPLC-ELSD系统样品溶液
供试品溶液 分别精密量取来源为A~C的硫酸卡那霉素注射液适量, 加水定量稀释制成每1 mL中分别约含卡那霉素2 mg的溶液。
酸破坏溶液 量取来源为A的硫酸卡那霉素注射液2 mL, 置25 mL量瓶中, 加25%的硫酸溶液2 mL, 80 ℃水浴加热30 min, 取出, 放置至室温。精密量取1 mL, 置10 mL量瓶中, 用水稀释至刻度, 摇匀。
碱破坏溶液 量取来源为A的硫酸卡那霉素注射液2 mL, 置25 mL量瓶中, 加5 mol·L-1的氢氧化钠溶液2 mL, 121 ℃加热2 h, 取出, 放置至室温, 用水稀释至刻度, 摇匀。精密量取1 mL, 置10 mL量瓶中, 用水稀释至刻度, 摇匀。
氧化破坏溶液 量取来源为A的硫酸卡那霉素注射液2 mL, 置25 mL量瓶中, 加30%过氧化氢溶液5 mL, 90 ℃加热1 h, 取出, 放置至室温, 用水稀释至刻度, 摇匀。精密量取1 mL, 置10 mL量瓶中, 用水稀释至刻度, 摇匀。
高温破坏溶液 量取来源为A的硫酸卡那霉素注射液2 mL, 置20 mL顶空瓶中, 121 ℃加热2 h, 取出, 放置至室温, 用水将内容物全部逐渐转移至25 mL量瓶中, 用水稀释至刻度, 摇匀。精密量取1 mL, 置10 mL量瓶中, 用水稀释至刻度, 摇匀。
光照破坏溶液 量取来源为A的光照(照度5 000 lx, 紫外灯能量100 μw) 10天的硫酸卡那霉素注射液适量, 加水溶解并定量稀释制成每1 mL中约含2 mg的溶液。
枸橼酸对照品溶液 取枸橼酸对照品适量, 精密称定, 加水溶解并定量稀释制成每1 mL中分别约含0.1、0.2和0.3 mg的溶液。
HPLC-FLD系统样品溶液
供试品溶液及高温破坏溶液 分别精密量取“HPLC-ELSD系统样品溶液”项下相应溶液, 加水定量稀释制成每1 mL中分别约含卡那霉素0.5 mg的溶液。
企业A高温破坏溶液2(添加0.1% W/V枸橼酸钠) 量取硫酸卡那霉素注射液2 mL, 加0.1% W/V枸橼酸钠, 照“HPLC-ELSD系统样品溶液”项下的高温破坏条件实验, 精密量取适量, 加水定量稀释制成每1 mL中约含卡那霉素0.5 mg的溶液。
企业A高温破坏溶液3(添加0.2% W/V枸橼酸钠) 量取硫酸卡那霉素注射液2 mL, 加0.2% W/V枸橼酸钠, 照“高温破坏溶液2”项下的高温破坏条件实验, 精密量取适量, 加水定量稀释制成每1 mL中约含卡那霉素0.5 mg的溶液。
企业A模拟处方溶液(不含枸橼酸钠) 取处方量卡那霉素原料、亚硫酸氢钠和硫酸适量, 加水溶解并定量稀释制成每1 mL中约含卡那霉素0.5 mg的溶液。
企业A高温破坏溶液4 量取上述溶液2 mL, 照“高温破坏溶液2”项下的高温破坏条件实验, 精密量取适量, 加水定量稀释制成每1 mL中约含卡那霉素0.5 mg的溶液。
结果 1 HPLC-ELSD色谱系统测定HPLC-ELSD系统样品溶液典型色谱图见图 2。结果显示, 企业A样品中的杂质峰明显多于原研和国内企业C; 在高温(121 ℃) 条件下, 杂质8、杂质9和杂质10的量明显增加; 同样均含有枸橼酸钠, 企业A中枸橼酸钠的量明显比原研高。
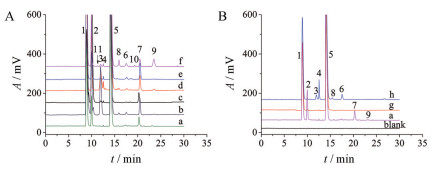
|
Figure 2 HPLC chromatograms in ELSD system. A: Typical chromatograms of specificity tests of kanamycin sulfate injection; B: Chromatograms of kanamycin sulfate injection from different manufacturers. a: Sample solution from manufacturer A; b: Acid degradation sample solution; c: Base degradation sample solution; d: Oxidation sample solution; e: Light sample solution; f: Heat degradation sample solution; g: Sample solution from manufacturer B; h: Sample solution from manufacturer C. 1: SO42- and SO32-; 2: Na+; 3: Deoxystreptamine-kanosaminide and 4-O-(6-amino-6-deoxy-α-D-glucopyranosyl)-2-deoxy-D-streptamine); 4: Kanamycin D; 5: Kanamycin; 6: Kanamycin B; 7: Citric acid; 8-10: Unknown impurities; 11: 2-Deoxystreptamine |
经计算, 企业A中枸橼酸钠含量约为22 mg·mL-1, 原研样品中枸橼酸钠含量约为0.6 mg·mL-1。企业A的样品中枸橼酸钠含量是原研的近40倍。
2 HPLC-FLD色谱系统测定HPLC-FLD系统样品溶液典型色谱图见图 3。
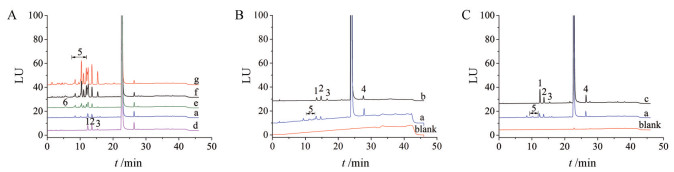
|
Figure 3 HPLC Chromatograms in FLD system. A: Heat degradation solutions of kanamycin sulfate; B: Chromatograms of kanamycin sulfate injection from manufacturer A and B; C: Chromatograms of kanamycin sulfate injection from manufacturer A and C. a: Sample solution from manufacturer A; b: Sample solution from manufacturer B; c: Sample solution from manufacturer C; d: Heat degradation solution of simulated sample solution; e: Heat degradation solution of kanamycin sulfate injection from manufacturer A; f: Heat degradation solution of kanamycin sulfate injection from manufacturer A added 0.1% sodium citrate; g: Heat degradation solution of kanamycin sulfate injection from manufacturer A added 0.2% sodium citrate. 1: Kanamycin D; 2: 4-O-(6-Amino-6-deoxy-α-D-glucopyranosyl)- 2-deoxy-D-streptamine); 3: Deoxystreptamine-kanosaminide; 4: Kanamycin B; 5: Unknown impurities; 6: 2-Deoxystreptamine |
结果显示, 和原研及企业C相比, 企业A样品的色谱图中出现一系列色谱保留行为比卡那霉素D弱的色谱峰; 上述杂质在不含枸橼酸钠的处方溶液经加热破坏后未检出(图 3d); 图 3a、3e、3f和3g对比显示, 企业A的供试品溶液121 ℃加速加热破坏后, 2-脱氧链霉胺和卡那霉素D之间的杂质峰总量明显增加, 这些杂质含量的增加和溶液中枸橼酸钠含量具有一定的相关性。经初步推测, 上述杂质可能为高温下枸橼酸钠和卡那霉素的系列反应产物。HPLC-ELSD系统中卡那霉素主峰后所有杂质(除卡那霉素B峰外) 均在HPLC-FLD系统中的2-脱氧链霉胺和卡那霉素D之间洗脱, 枸橼酸钠和卡那霉素系列反应产物在两个色谱系统中相互对应。
3 枸橼酸钠和卡那霉素主要反应产物结构的质谱推测结合卡那霉素的质谱裂解规律(图 4) 和图 2中色谱峰8~10的质谱信息, 结构推测见图 5和表 2。

|
Figure 4 Fragmentation pattern of kanamycin |

|
Figure 5 Line spectra of impurity 8 (A), 9 (B) and 10 (C) in positive ESI mode |
| Table 2 MS data and fragments of impurities formed in kanamycin injection with high concentration of sodium citrate |
结果显示, 模拟处方样品溶液在121 ℃条件下加热处理后出现的多个未知杂质峰为卡那霉素和枸橼酸钠的一系列反应产物。
讨论枸橼酸钠在注射液中常被用作pH调节剂及抗氧剂的协同剂, 使用范围为0.02%~0.4%[6]。研究发现: 国内企业A样品中的杂质数量明显大于原研和国内企业C样品中的杂质数量。专属性实验显示, 在高温(121 ℃) 条件下, 样品溶液中各杂质的含量明显增加; 经处方分析, 企业A样品中枸橼酸钠的含量是(2.2% W/V) 原研产品的近40倍, 并且已远超出推荐使用量; 杂质含量的增加和溶液中枸橼酸钠含量的增加具有相关性。对加热破坏样品中杂质进行离线HPLC半制备及质谱分析, 结果显示样品溶液加热后产生的杂质为枸橼酸和卡那霉素的一系列反应产物。提示生产企业在处方筛选时, 未关注辅料和主成分的相容性, 并且未考察灭菌工艺对产品关键质量属性的影响, 最终造成产品有效性和安全性方面的隐患。
辅料的选择对制剂的质量起着关键的作用[7, 8], 特别是对于含活泼氨基的药物, 在辅料筛选时, 应特别关注药物和含活泼基团辅料的相容性, 确保产品的安全性[9]。辅料并不完全是惰性的, 很多辅料与药物主要成分的相互作用会影响制剂的质量、安全性和有效性, 一致性评价中应关注功能性辅料可能对产品质量的影响。
作者贡献: 赵敬丹主要完成了所有实验的操作、数据处理、文章撰写及编辑部修改意见的核修等。刘浩主要进行了相关技术指导。张含智主要参与卡那霉素质谱裂解规律的指导。
利益冲突: 无任何利益冲突。
| [1] |
Umezawa H, Ueda M, Maeda K, et al. Production and isolation of a new antibiotic: kanamycin[J]. J Antibiot (Tokyo), 1957, 10: 181-188. |
| [2] |
Zhang YH, Jiang MH, Qin F, et al. Determination of the content in kanamycin sulfate injection and eye drops by HPLC with post-column derivatization[J]. Chin J Antibio (中国抗生素杂志), 2019, 44: 88-93. |
| [3] |
Zhao JD, Liu H. Comparison of determination methods for related substances of kanamycin sulfate injection by HPLC-ELSD and HPLC-FLD[J]. Chin J Pharm (中国医药工业杂志), 2020, 51: 1311-1316. |
| [4] |
Zhao JD, Liu H. Evaluation and application of HPLC-ELSD in impurity profile detection of kanamycin sulfate injection[J]. Chin J Pharm Anal (药物分析杂志), 2021, 41: 117-123. |
| [5] |
Jiang MH, Zhao JD, Zhang HZ, et al. Impurity Profile of Kanamycin Monosulfate[J]. Chin J Pharm (中国医药工业杂志), 2018, 49: 656-661. |
| [6] |
Rowe RC, Sheskey PJ. Handbook of Pharmaceutical Excipients (药用辅料手册)[M]. 4th Ed. Beijing: Chemical Industry Press, 2004: 7.
|
| [7] |
Constantinides PP, Chakraborty S, Shukla D. Considerations and recommendations on traditional and non-traditional uses of excipients in oral drug products[J]. AAPS Open, 2016, 2: 3-8. DOI:10.1186/s41120-016-0004-3 |
| [8] |
Bharete SS, Bharate SB, Bajaj AN. Interactions and incompatibilities of pharmaceutical excipients with active pharmaceutical ingredients: a comprehensive review[J]. J Excip Food Chem, 2010, 1: 3-26. |
| [9] |
Zhang HZ, Shi JG, He J, et al. Impurity detection method and preparation method of metaraminol bitartrate injection: CN, 201911329897.1[P]. 2020-04-10.
|
 2021, Vol. 56
2021, Vol. 56