2. 军事科学院军事医学研究院辐射医学研究所, 北京 100850;
3. 安康正大制药有限公司, 陕西 安康 725000
2. Institute of Radiation Medicine, Academy of Military Medical Science, Academy of Military Sciences, Beijing 100850, China;
3. AnKang Chia Tai Pharmaceutical Co. Ltd., Ankang 725000, China
绞股蓝为我国常用中药和保健茶品, 资源丰富, 应用历史久远, 现代药理研究表明其具有调血脂、降血糖和抗肿瘤等重要的药理作用[1-3]。绞股蓝作为可用于保健食品的中药品种, 也被纳入保健食品原料目录中。达玛烷型三萜皂苷是绞股蓝中的主要化学成分[4], 被认为是中药绞股蓝发挥药理作用的主要活性物质基础, 其具有良好的降糖降脂、抗肝纤维化、抗肿瘤细胞增殖作用, 对氧化应激和细胞凋亡也具有调节作用[5]。因此, 以往对绞股蓝的化学研究和质量控制研究都聚焦于达玛烷型三萜皂苷类化合物上[6]。
中药绞股蓝是一种多基原药材, 来源于葫芦科绞股蓝属多种植物的全草[7]。目前市场上常见主要包括绞股蓝[Gynostemma pentaphyllum (Thunb.) Makino]、长梗绞股蓝(G. longipes C.Y.Wu) 等[8]。以往针对绞股蓝(G. pentaphyllum) 这个种的研究较多, 对其化学成分研究较为透彻, 但是对绞股蓝属其他种的研究有待进一步系统化。陕西安康平利县是我国绞股蓝主要产区之一, 出产的绞股蓝最为有名。长梗绞股蓝作为陕西安康平利县中药绞股蓝的重要生产品种, 系统研究其化学成分, 对阐述其活性物质以及建立相应质量控制方法具有基础性的重要作用。
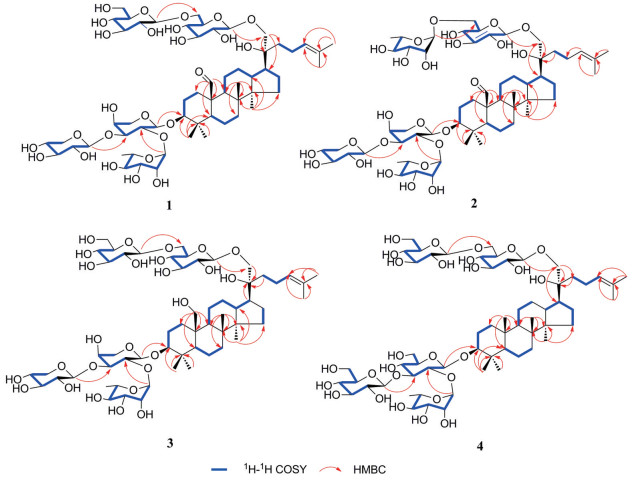
本课题组前期利用UHPLC-QTOF/MS对长梗绞股蓝中的三萜皂苷进行了系统的定性分析, 明确了长梗绞股蓝中大部分达玛烷型三萜皂苷类的结构[9]。但在分析过程中发现长梗绞股蓝总皂苷中有一部分含量较低、极性偏大的三萜皂苷类成分的结构尚不明确, 质谱分析推断集中在该部位中的三萜皂苷多含有5~6个糖基, 该类型三萜皂苷在以往有关长梗绞股蓝化学研究中报道很少。因此, 本课题组利用多种分离手段和波谱学技术对长梗绞股蓝总皂苷中这类大极性成分进行分离鉴定, 最终从中分离得到4个新化合物(1~4), 结构见图 1。本文主要介绍新化合物1~4的分离纯化及结构鉴定。

|
Figure 1 Structures of compounds 1-4 |
化合物1 白色无定形粉末, 易溶于吡啶、乙腈、甲醇。HR-ESI-MS (negative): m/z 1 207.614 0 [M-H]- (C58H95O26, 计算值1 207.611 2), 推导其分子式为C58H96O26。根据HR-ESI-MS (negative) 高能量下碎片离子峰m/z 1 207.614 0 [M-H]-、1 075.567 7 [M-H-132]-、913.513 5 [M-H-132-162]-、751.467 0 [M-H-132-162-162]-、605.398 7 [M-H-132-162-162-146]-、473.364 4 [M-H-132-162-162-146-132]-可以推测化合物中含有2个五碳糖、1个甲基五碳糖、2个六碳糖。酸水解实验进一步确认化合物1中的五碳糖为D-吡喃木糖和L-吡喃阿拉伯糖、甲基五碳糖为L-吡喃鼠李糖、六碳糖为D-吡喃葡萄糖。1H NMR (pyridine-d5, 600 MHz) 信号中, δ 0.87 (3H, s)、0.97 (3H, s)、1.09 (3H, s)、1.26 (3H, s)、1.66 (3H, s)、1.67 (3H, s) 为苷元上6个甲基氢信号; δ 1.62 (3H, d, J = 6.1 Hz) 为鼠李糖基的甲基质子信号; δ 4.90 (1H, overlap)、4.97 (1H, d, J = 8.0 Hz)、5.02 (1H, d, J = 7.1 Hz)、5.03 (1H, d, J = 7.7 Hz)、6.17 (1H, brs) 为5个糖基的端基氢信号; δ 10.26 (1H, s) 为醛基氢信号。13C NMR (pyridine-d5, 150 MHz) 信号中, δ 102.1、104.8、105.2、105.3、106.2分别为5个糖基的端基碳信号; δ 125.9 (C-24)、131.0 (C-25) 为烯碳信号; δ 205.6 (C-19) 为醛基碳信号; δ 16.0、16.5、17.2、17.8、25.8、26.4为6个甲基碳信号。将该化合物的核磁数据与文献[10]报道的化合物19-oxo-3β, 20(S), 21-trihydroxydammar-24-ene-3-O-{[α-L-rhamnopyranosyl(1→2)]-[β-D-xylopyranosyl(1→3)]-α-L-arabinopyranosyl}-21-O-β-D-glucopyranoside比对发现, 化合物1较该已知化合物多一个葡萄糖基。在HMBC谱中δ 4.97 (H-21-O-Glc-1) 与δ 77.0 (C-21) 相关、δ 5.03 (H-6'-O-Glc-1) 与δ 74.6 (C-21-O-Glc-6) 相关(图 2), 进一步证明该葡萄糖基连接在C-21位糖链中内端葡萄糖基的C-6位上。经过综合分析HSQC、HMBC和1H-1H COSY等波谱学数据, 最终对化合物1的结构进行了确证, 并对其1H NMR、13C NMR数据进行了归属(表 1)。综上所述, 化合物1的结构最终鉴定为(20S)-3β, 20, 21-三羟基达玛烷-19-醛-24-烯-3-O-{[α-L-吡喃鼠李糖基(1→2)]-[β-D-吡喃木糖基(1→3)]-α-L-吡喃阿拉伯糖基}-21-O-[β-D-吡喃葡萄糖基(1→6)]-β-D-吡喃葡萄糖苷, 为一个新化合物。
|
Figure 2 Key HMBC and 1H-1H COSY correlations of 1-4 |
| Table 1 NMR data of 1-4 in pyridine-d5 (600 MHz for 1H NMR, 150 MHz for 13C NMR, J in Hz) |
化合物2 白色无定形粉末, 易溶于吡啶、乙腈、甲醇。HR-ESI-MS (negative): m/z 1191.6212 [M-H]- (C58H95O25, 计算值1 191.616 2), 推导化合物分子式为C58H96O25。根据HR-ESI-MS (negative) 高能量下碎片离子峰m/z 1 191.621 2 [M-H]-、1 059.558 34 [M-H-132]-、913.548 1 [M-H-132-146]-、751.477 5 [M-H-132-146-162]-、605.408 1 [M-H-132-146-162-146]-、473.364 4 [M-H-132-146-162-146-132]-可以推测化合物中含有2个五碳糖、2个甲基五碳糖、1个六碳糖。酸水解实验进一步确认化合物2中的五碳糖有D-吡喃木糖和L-吡喃阿拉伯糖、甲基五碳糖均为L-吡喃鼠李糖、六碳糖为D-吡喃葡萄糖。1H NMR (pyridine-d5, 600 MHz) 信号中, δ 0.88 (3 H, s)、0.96 (3H, s)、1.09 (3H, s)、1.25 (3H, s)、1.66 (3H, s)、1.66 (3H, s) 为苷元上6个甲基氢信号; δ 1.62 (3H, d, J = 6.2 Hz)、1.64 (3H, d, J = 6.2 Hz) 为两个鼠李糖基的甲基质子信号; δ 4.91 (1H, d, J = 5.5 Hz)、5.00 (1H, d, J = 7.1 Hz)、5.03 (1H, overlap)、5.52 (1H, brs)、6.17 (1H, brs) 为5个糖基的端基氢信号; δ 10.29 (1H, s) 为醛基氢信号。13C NMR (pyridine-d5, 150 MHz) 信号中, δ 102.1、102.7、104.7、105.2、106.0分别为5个糖基的端基碳信号; δ 126.1 (C-24)、130.8 (C-25) 为烯碳信号; δ 205.7 (C-19) 为醛基碳信号; δ 16.0、16.5、17.2、17.8、18.6、18.7、25.8、26.4为8个甲基碳信号。详细比对化合物2与化合物1的核磁数据发现, 二者结构高度相似, 差别只在于C-21位糖链中末端糖基不同。化合物2的质谱糖基中性丢失碎片信息和糖基的核磁数据共同提示其C-21位糖链上的末端糖基应该是一个鼠李糖基, 且HMBC谱中, δ 5.00 (H-21-O-Glc-1) 与δ 77.1 (C-21) 相关、δ 5.52 (H-6'-O-Rha-1) 与δ 70.1 (C-21-O-Glc-6) 相关, 进一步证明该鼠李糖基连接在内端葡萄糖基的C-6位上。综合分析HMQC、HMBC和1H-1H COSY等波谱学数据, 最终对化合物2的结构进行了确证, 并对其1H NMR、13C NMR数据进行了归属(表 1)。综上所述, 化合物2的结构鉴定为(20S)-3β, 20, 21-三羟基达玛烷-19-醛-24-烯-3-O-{[α-L-吡喃鼠李糖基(1→2)]-[β-D-吡喃木糖基(1→3)]-α-L-吡喃阿拉伯糖基}-21-O-α-L-吡喃鼠李糖基(1→6)-β-D-吡喃葡萄糖苷, 为一个新化合物。
化合物3 白色无定形粉末, 易溶于吡啶、乙腈、甲醇。HR-ESI-MS (negative): m/z 1 209.625 6 [M-H]- (C58H97O26, 计算值1 209.626 8), 推导化合物分子式为C58H98O26。根据HR-ESI-MS (negative) 高能量下碎片离子峰m/z 1 209.625 6 [M-H]-、1 077.574 7 [M-H-132]-、915.536 3 [M-H-132-162]-、753.476 3 [M-H-132-162-162]-、607.424 7 [M-H-132-162-162-146]-、475.760 6 [M-H-132-162-162-146-132]-可以推测化合物中含有2个五碳糖、1个甲基五碳糖、2个六碳糖。酸水解实验进一步确认化合物3中的五碳糖有D-吡喃木糖和L-吡喃阿拉伯糖、甲基五碳糖为L-吡喃鼠李糖、六碳糖均为D-吡喃葡萄糖。1H NMR (pyridine-d5, 600 MHz) 信号中, δ 1.03 (3 H, s)、1.26 (3H, s)、1.26 (3H, s)、1.29 (3H, s)、1.64 (3H, s)、1.66 (3H, s) 为苷元上6个甲基氢信号; δ 1.62 (3H, d, J = 5.3 Hz) 为鼠李糖基的甲基质子信号; δ 4.95 (1H, d, J = 7.7 Hz)、4.98 (1H, d, J = 5.3 Hz)、5.03 (1H, d, J = 7.7 Hz)、5.03 (1H, d, J = 7.2 Hz)、6.15 (1H, brs) 为5个糖基的端基氢信号。13C NMR (pyridine-d5, 150 MHz) 信号中, δ 102.1、104.8、105.1、105.2、106.3分别为5个糖基的端基碳信号; δ 126.0 (C-24)、130.9 (C-25) 为烯碳信号; δ 16.2、17.0、17.2、17.9、18.6、25.8、28.6为7个甲基碳信号。将化合物3的核磁数据与化合物1进行对比发现, 二者的区别在于C-19位附近存在差异, 其余基本一致。与化合物1相比, 化合物3核磁信号中未见特征的醛基碳信号和醛基氢信号, 但出现了δ 61.5的碳信号以及δ 4.17 (overlap) 和4.25 (m) 的氢信号, 推测化合物3中C-19位是被羟基取代。HMBC谱中δ 4.17/4.25 (H-19) 与δ 35.0 (C-1)、57.3 (C-5)、53.1 (C-9) 和42.1 (C-10) 的远程相关信号进一步证明这一点。综合分析1H-1H COSY、HMQC和HMBC等波谱学数据, 最终对化合物3的结构进行了确证, 并对其1H NMR、13C NMR数据进行了归属(表 1)。综上所述, 化合物3的结构鉴定为(20S)-3β, 19, 20, 21-四羟基达玛烷-24-烯-3-O-{[α-L-吡喃鼠李糖基(1→2)]-[β-D-吡喃木糖基(1→3)]-α-L-吡喃阿拉伯糖基}-21-O-[β-D-吡喃葡萄糖基(1→6)]-β-D-吡喃葡萄糖苷, 为一个新化合物。
化合物4 白色无定形粉末, 易溶于吡啶、乙腈、甲醇。HR-ESI-MS (negative): m/z 1 253.650 5 [M-H]- (C60H101O27, 计算值1 253.653 0), 推导化合物分子式为C60H102O27。根据HR-ESI-MS (negative) 高能量下碎片离子峰m/z 1 253.650 5 [M-H]-、1 091.621 3 [M-H-162]-、929.549 4 [M-H-162-162]-、767.510 8 [M-H-162-162-162]-、621.442 3 [M-H-162-162-162-146]-、459.386 3 [M-H-162-162-162-146-162]-可以推测化合物中含有1个甲基五碳糖、4个六碳糖。酸水解实验进一步确认化合物4中的五碳糖和六碳糖分别为D-吡喃木糖和D-吡喃葡萄糖。1H NMR (pyridine-d5, 600 MHz) 信号中, δ 0.76 (3H, s)、0.94 (3H, s)、0.95 (3H, s)、1.18 (3H, s)、1.25 (3H, s)、1.68 (3H, s)、1.66 (3H, s) 为苷元上7个甲基氢信号; δ 1.71 (3H, d, J = 6.2 Hz) 为鼠李糖基的甲基质子信号; δ 4.88 (1H, d, J = 7.9 Hz)、4.98 (1H, d, J = 7.8 Hz)、5.04 (1H, d, J = 7.7 Hz)、5.16 (1H, overlap)、6.52 (1H, brs) 为5个糖基的端基氢信号。13C NMR (pyridine-d5, 150 MHz)信号中, δ 101.7、103.9、105.0、105.2、106.3分别为5个糖基的端基碳信号; δ 126.0 (C-24)、131.0 (C-25) 为烯碳信号; δ 15.8、16.6、16.7、16.9、17.9、25.8、26.9为7个甲基碳信号。将该化合物4核磁数据与文献[11]中化合物3β, 20S, 21-trihydroxydammar-24-ene-3-O-{[α-L-rhamnopyranosyl(1→2)]-[β-D-glucopyranosyl(1→3)]-β-D-glucopyranosyl}-21-O-β-D-glucopyranoside进行比对发现, 化合物4较该已知化合物多1个葡萄糖基。在HMBC谱中, δ 4.98 (H-21-O-Glc-1) 与δ 77.0 (C-21) 相关、δ 5.04 (H-6'-O-Glc-1) 与δ 70.2 (C-21-O-Glc-6) 相关, 表明该葡萄糖基连接在C-21位糖链中内端葡萄糖基的C-6位上。化合物4和化合物1完全一致的C-21位糖链核磁信号也进一步证实了上述结论。综合分析1H-1H COSY、HMQC和HMBC等波谱学数据, 最终对化合物4的结构进行了确证, 并对其1H NMR、13C NMR数据进行了归属(表 1)。综上所述, 化合物4的结构被鉴定为(20S)-3β, 20, 21-三羟基达玛烷-24-烯-3-O-{[α-L-吡喃鼠李糖基(1→2)]-[β-D-吡喃葡萄糖基(1→3)]-β-D-吡喃葡萄糖基}-21-O-[β-D-吡喃葡萄糖基(1→6)]-β-D-吡喃葡萄糖苷, 为一个新化合物。
本文在课题组前期工作基础上, 通过经典的植物化学研究手段, 从长梗绞股蓝中分离得到4个新达玛烷型三萜皂苷单体化合物。该4个新三萜皂苷结构中均含有5个糖基, 是极性偏大的一类三萜皂苷成分, 在以往的长梗绞股蓝及其他绞股蓝属植物的化学成分研究报道中较少见。本研究结果有助于更深入地认识长梗绞股蓝中达玛烷型三萜皂苷成分的组成, 同时为后续揭示长梗绞股蓝活性物质基础以及开展相应的药材质量控制研究工作奠定了基础。
实验部分Waters 2695高效液相色谱仪(美国Waters公司) 配置ELSD检测器(美国奥泰科技有限公司); 液质联用系统(UHPLC-QTOF/MS): 超高效液相色谱仪为Waters ACQUITYTM UHPLC系统, 质谱为Waters SYNAPT G1 MS质谱系统(美国Waters公司), ESI源; Bruker Avance Ⅲ 600核磁共振仪(德国Bruker公司); 制备型液相色谱仪: Hannon Newstyle NP7000 Serial Pump (江苏汉邦科技有限公司); 动态轴向压缩系统DAC150 (江苏汉邦科技有限公司); 示差遮光检测器Shodex RI-102 (日本Showa Denko Group); 色谱柱: Phenomenex Kinetex C18 (2.6 μm, 4.6 mm×150 mm)、Phenomenex Kinetex C18 (5 μm, 10 mm×150 mm) (美国Phenomenex公司); Waters HSS T3 (1.8 μm, 2.1 mm×100 mm) (美国Waters公司); MCI树脂(日本三菱公司); 柱色谱硅胶200~300目(青岛海洋化工厂); 薄层色谱板(天津思利达科技有限公司); 甲醇、乙醇、乙腈、氯仿(分析纯, 国药集团化学试剂有限公司); 甲醇、乙腈(色谱纯, 美国Fisher公司); 蒸馏水(屈臣氏集团)。
长梗绞股蓝药材采收自陕西省安康市平利县, 经中国医学科学院药用植物研究所郭宝林研究员鉴定为葫芦科绞股蓝属植物长梗绞股蓝(Gynostemma longipes C.Y.Wu) 的干燥匍匐根茎。
1 提取分离长梗绞股蓝总皂苷由安康正大制药有限公司代加工, 提取方法为: 长梗绞股蓝的匍匐根, 粉碎, 用水提取3次(8、8、6倍体积; 每次1.5 h), 趁热过滤, 合并滤液, 减压浓缩至适量体积。浓缩液经D101树脂柱色谱分离, 依次用水、80%甲醇梯度洗脱。收集80%甲醇洗脱部分, 减压浓缩至无醇味, 冷冻干燥, 得到长梗绞股蓝总皂苷。
长梗绞股蓝总皂苷600 g, 用30%乙腈回流加热溶解, 冷却至室温。取上清液使用动态轴向压缩系统DAC150 (直径150 mm, 柱长400 mm) 进行MCI (37~75 μm) 柱色谱分离, 以20%、50%、80%乙腈梯度洗脱, 各流分经HPLC检测分析后合并相同流分, 得到Fr.A~E共6个组分。Fr.B、Fr.C合并后经UHPLC-QTOF/MS分析确定为长梗绞股蓝总皂苷中的大极性成分所在部分。
Fr.B/C部位共30 g, 以氯仿-甲醇(8∶1→6∶1→3∶1) 为洗脱剂, 进行硅胶(200~300目) 柱色谱分离。各流分经TLC检测分析, 合并后得Fr.B/C-1~Fr.B/C-12共12个组分。Fr.B/C-11经制备液相制备(Phenomenex Kinetex C18, 5 μm, 100 Å, 10 mm×150 mm, 乙腈-水28∶72), 得到化合物1 (70 mg)、化合物2 (20 mg); Fr.B/C-12经制备液相制备(Phenomenex Kinetex C18, 5 μm, 100 Å, 10 mm×150 mm), 流动相为乙腈-水(28∶72), 得到化合物1 (15 mg)、化合物3 (9 mg)、化合物4 (13 mg)。
2 酸水解和单糖种类的确定取D-葡萄糖、D-木糖、L-鼠李糖、L-阿拉伯糖各5 mg, 用5 mL无水吡啶溶解, 向其中分别加入5 mg L-半胱氨酸盐酸盐, 60 ℃水浴加热1 h, 再分别加入10 μL邻苯异硫氰酸酯, 60 ℃水浴加热1 h, 各样品进行液质分析。取化合物1~4个各1 mg, 溶于1 mL 6 mol·L-1的三氟乙酸中, 90 ℃水浴2 h, 冷却后分别用氯仿萃取3次, 水层减压浓缩至干, 再分别加入1 mL吡啶和1 mg L-半胱氨酸盐酸盐, 60 ℃水浴加热1 h, 再加入5 μL邻甲基苯异硫氰酸酯, 60 ℃水浴加热1 h, 进行液质分析。液质分析条件: Waters ACQUITYTM UHPLC-QTOF/MS; Waters HSS T3 (1.8 μm, 2.1 mm×100 mm); 梯度洗脱: 0.1%甲酸水(A)-乙腈(B), (0~8 min) 20%~30% B; 柱温40 ℃, 流速0.6 mL·min-1; 质谱条件: 负离子模式。通过与单糖对照品衍生物的保留时间和质谱数据对比, 从而确定了化合物中糖基的种类: D-葡萄糖(tR 3.68 min, m/z 447.124 3 [M-H]-)、D-木糖(tR 4.11 min, m/z 417.114 2 [M-H]-)、L-鼠李糖(tR 5.38 min, m/z 431.131 8 [M-H]-)、L-阿拉伯糖(tR 4.00 min, m/z 417.114 6 [M-H]-)。
3 结构鉴定化合物1 白色无定形粉末; [α]D20-4.65 (c 0.043, MeOH); HR-ESI-MS (negative): m/z 1 207.614 0 [M-H]- (C58H95O26, 计算值1 207.611 2), 确定其分子式为C58H96O26; 1H NMR (pyridine-d5, 600 MHz) 和13C NMR (pyridine-d5, 150 MHz) 数据见表 1。
化合物2 白色无定形粉末; [α]D20-17.39 (c 0.046, MeOH); HR-ESI-MS (negative): m/z 1 191.621 2 [M-H]- (C58H95O25, 计算值1 191.616 2), 确定其分子式为C58H96O25; 1H NMR (pyridine-d5, 600 MHz) 和13C NMR (pyridine-d5, 150 MHz) 数据见表 1。
化合物3 白色无定形粉末; [α]D20-12.90 (c 0.031, MeOH); HR-ESI-MS (negative): m/z 1 209.625 6 [M-H]- (C58H97O26, 计算值1 209.626 8), 确定其分子式为C58H98O26; 1H NMR (pyridine-d5, 600 MHz) 和13C NMR (pyridine-d5, 150 MHz) 数据见表 1。
化合物4 白色无定形粉末; [α]D20-12.50 (c 0.032, MeOH); HR-ESI-MS (negative): m/z 1 253.650 5 [M-H]- (C60H101O27, 计算值1 253.653 0), 确定其分子式为C60H102O27; 1H NMR (pyridine-d5, 600 MHz) 和13C NMR (pyridine-d5, 150 MHz) 数据见表 1。
作者贡献: 李齐负责研究实验工作及数据分析处理, 并撰写稿件; 庞旭参与研究工作的思路设计, 协助数据分析总结, 稿件修改; 卢彭信协助研究工作实际操作; 张洁参与研究工作的思路设计; 张军、师东晓为研究工作提供了原药材, 以及提取粗分工作; 马百平对研究工作进行设计、监督、指导, 对工作各个方面承担责任。
利益冲突: 本文的研究无任何利益冲突。
| [1] |
Zhang T, Yuan SD. Effective components of Gynostemma pentaphyllum and research advances in gypenosides[J]. Acta Agric JiangXi (江西农业学报), 2008, 20: 60-63. |
| [2] |
Yuan ZY, Xie MZ, Huang HY. Advance in the chemical constituents and pharmacological studies of Gynostemma pentaphyllum[J]. Asia-Pacific Tradit Med (亚太传统医药), 2019, 15: 190-197. |
| [3] |
Bao FX, Tao LX, Zhang HY. Research progress on pharmacological effects of Gynostemma pentaphyllum active ingredients[J]. Chin J New Drugs Clin Remed (中国新药与临床杂志), 2018, 37: 11-17. |
| [4] |
Nguyen NH, Ha TKQ, Yang JL, et al. Triterpenoids from the genus Gynostemma: chemistry and pharmacological activities[J]. J Ethnopharmacol, 2020, 268: 113574. |
| [5] |
Li KJ, Ma C, Li HY, et al. Medicinal value and potential therapeutic mechanisms of Gynostemma pentaphyllum (Thunb.) Makino and its derivatives: an overview[J]. Curr Top Med Chem, 2019, 19: 2855-2867. |
| [6] |
Fan DD, Kuang YH, Xiang SX, et al. Research progress in chemical constituents and pharmacological activities of Gynostemma pentaphyllum[J]. Chin Pharm J (中国药学杂志), 2017, 52: 342-352. |
| [7] |
Editorial Board of Flora of China, Chinese Academy of Sciences. Flora of China (中国植物志)[M]. Beijing: Science Press, 1986: 269.
|
| [8] |
Zhang T, Yuan DS. Advance in studies on Gynostemma germplasm resources in China[J]. J Yunnan Agric Univ (云南农业大学学报), 2009, 24: 459-465. |
| [9] |
Zhang MM, Zheng W, Zhang J, et al. Qualitative analysis of Gynostemma longipes for medicinal usage[J]. China J Chin Mater Med (中国中药杂志), 2021, 46: 951-965. |
| [10] |
Takemoto T, Arihara S, Yoshikawa K, et al. Studies on the constituents of Cucurbitaceae plants. XII. On the saponin constituents of Gynostemma pentaphyllum MAKINO (8)[J]. Yakugaku Zasshi, 1984, 104: 1155-1162. DOI:10.1248/yakushi1947.104.11_1155 |
| [11] |
Yin F, Hu L, Lou F, et al. Dammarane-type glycosides from Gynostemma pentaphyllum[J]. J Nat Prod, 2004, 67: 942-952. DOI:10.1021/np0499012 |
 2021, Vol. 56
2021, Vol. 56


