2. 释药技术与药物代谢动力学国家重点实验室 (天津药物研究院), 天津 300462;
3. 浙江康恩贝中药有限公司, 浙江 丽水 323400;
4. 天津医科大学, 天津 300070;
5. 浙江康恩贝制药股份有限公司, 浙江 杭州 310052
2. State KeyLaboratory of Drug Delivery and Pharmacokinetics, Tianjin Institute of Pharmaceutical Research, Tianjin 300462, China;
3. Zhejiang CONBA Chinese Medicine Co., LTD., Lishui 323400, China;
4. Tianjin Medical University, Tianjin 300070, China;
5. Zhejiang CONBA Pharmaceutical Co., LTD., Hangzhou 310052, China
复方鱼腥草合剂由鱼腥草、黄芩、板蓝根、连翘和金银花5味药材组成, 具有清热解毒之功效, 用于外感风热引起的咽喉肿痛、急性咽炎、扁桃体炎有风热证候者, 收录于2020版《中国药典》一部。该方以鱼腥草为君药, 具有清热解毒、利尿除湿和清热止痢的功效。黄芩为臣药, 具有清热燥湿、泻火解毒之功。其余为佐药, 共同协助发挥药效, 板蓝根具有清热解毒、凉血利咽功效; 连翘具有清热解毒、消肿散结功效; 金银花具有清热解毒、疏散风热功效。目前, 针对复方鱼腥草合剂的文献报道多为其用于治疗小儿肺炎的临床观察以及主要成分的定量分析研究[1-5], 而关于其发挥清热解毒功效的药效物质基础及其多成分、多靶点、多途径的网络调节机制尚未见报道。
网络药理学是运用网络可视化等技术揭示药物、基因、疾病、靶点之间复杂的生物网络关系的学科, 能从分子、基因水平上分析药物作用于不同靶点、细胞和器官的行为, 系统地预测和揭示药物的作用及机制[6]。运用网络药理学, 根据药物之间的结构、功效来构建药物-靶点网络, 可有效地预测中药及其复方制剂的药效成分及作用机制[7]。因此, 本研究利用网络药理学方法, 对复方鱼腥草合剂中多个化合物进行了作用靶点和通路预测, 通过构建“化合物-靶点-通路-药理作用-功效”网络探讨复方鱼腥草合剂清热解毒作用机制, 同时利用脂多糖(lipopolysaccharide, LPS) 诱导的RAW264.7细胞炎症模型, 验证复方鱼腥草合剂及方中10个重要单体成分的抗炎作用。
材料与方法主要材料及仪器 Swiss Target Prediction服务器(http://new.swisstargetprediction.ch/); 中药系统药理学数据库与分析平台(TCMSP, http://lsp.nwu.edu.cn/tcmspsearch.php); UniProt数据库(http://www.uniprot.org/); 京都基因与基因组百科全书(Kyoto Gene and Genome Encyclopedia, KEGG) 通路数据库(http://www.genome.jp/kegg/); STRING 10数据库(http://string-db.org/); Omicsbean在线分析软件(http://www.omicsbean.cn/); Omicshare Tools在线制图软件(https://www.omicshare.com); ChemBioOffice2010; Cytoscape3.6.1软件。
RAW264.7小鼠腹腔巨噬细胞系购于上海生科院。地塞米松、LPS (美国Sigma公司); MTS (美国Promega公司); 白介素-6 (interleukin-6, IL-6)、肿瘤坏死因子-α (tumor necrosis factor-α, TNF-α) 试剂盒(上海西唐生物科技有限公司); 一氧化氮(nitric oxide, NO) 试剂盒(上海碧云天生物技术有限公司); 异槲皮苷标准品(天津士兰科技有限公司); 木犀草苷、连翘酯苷A、异绿原酸A、獐牙菜苷标准品(成都曼斯特生物科技有限公司); 连翘苷标准品(成都普思生物科技股份有限公司); 黄芩素、汉黄芩素、黄芩苷、绿原酸标准品(中国食品药品检定研究院)。酶标仪(德国Berthold公司); 倒置显微镜、细胞培养箱(日本Olympus公司)。
目标化合物的选取 对于本实验目标化合物的选择主要基于以下原则: 首先, 其必须是复方鱼腥草合剂中的主要成分; 其次, 中药虽有众多成分, 但有效成分必须被吸收进入血液才会在体内起作用, 所以还应选择其入血成分进行研究; 再者, 兼顾药材中的主要结构类型, 应选取各类型的代表性化合物。因此, 在本网络药理学实验研究中, 根据以上3个原则并结合本课题组化学物质组及血中移行成分实验结果, 选取了25个关键化合物为研究对象, 详细信息见表 1。
| Table 1 Information of 25 key compounds. 1: Houttuynia cordata Thunb.; 2: Scutellaria baicalensis Georgi; 3: Isatis indigotica Fort.; 4: Forsythia suspensa (Thunb.) Vahl; 5: Lonicera japonica Thunb. |
目标化合物靶点的预测分析 登录Swiss Target Prediction服务器, 在线绘制复方鱼腥草合剂25个化合物的化学结构, 采用反向药效团匹配方法得到虚拟匹配筛选结果。由于检索到的药物靶标存在命名不规范等问题, 因此, 本实验使用UniProt数据库中UniProtKB搜索功能, 通过输入蛋白名称并限定物种为“human”, 将检索得到的所有蛋白校正为其官方名称; 另外, 在TCMSP数据库检索, 获取相关靶点信息并整合二者得到的蛋白靶点。
构建蛋白互作网络(protein-protein interaction, PPI) 及筛选关键靶点蛋白 将整合的靶点信息导入STRING10数据库中, 物种限定为“Homo sapiens”, 获得蛋白间相互作用信息, 将结果文件导入Cytoscape 3.6.1软件中绘制PPI网络, 分析其网络拓扑参数, 筛选出关键蛋白靶点。
生物信息学分析 运用Omicsbean软件对靶点蛋白进行生物信息学分析, 探究靶点蛋白在生物过程(biological process)、分子功能(molecular function) 和细胞组分(cellular component) 方面的GO (gene ontology) 功能富集分析。然后, 通过STRING 10数据库得到与靶点相关的通路过程, 利用KEGG数据库以及查阅相关文献, 对得到的通路进行分析。
“化合物-靶点-通路-药理作用-功效”网络构建 根据上述复方鱼腥草合剂25个化学成分的靶点及通路预测结果, 在Excel表格中建立化合物-靶点、靶点-通路、通路-药理作用、药理作用-功效的相互对应关系, 然后导入Cytoscape 3.6.1软件中构建网络, 并运用其插件Network Analyzer计算网络的特征。网络中节点(node) 表示化合物、靶点以及作用通路、药理作用、功效。边(edge) 表示化合物-靶点、靶点-通路以及靶点-药理作用、药理作用-功效相互作用。经处理后, 得到25个成分的相关靶点、通路预测图, 以该图来表示复方鱼腥草合剂“化合物-靶点-作用通路-药理作用-功效”之间的相互关系。
复方鱼腥草合剂及单体化合物对LPS诱导RAW264.7细胞炎症反应的影响 RAW264.7细胞用DMEM高糖完全培养基(含1%双抗和20%胎牛血清) 培养于37 ℃、5% CO2的细胞培养箱。取生长至80%~90%的RAW264.7, 调整细胞密度为每毫升2×105个均匀接种于96孔板, 于37 ℃、5% CO2培养箱培养过夜后吸去上清, 按实验分组, 每组设3个复孔, 空白对照组(control) 每孔加入100 μL含2%血清的DMEM, 模型组加入100 μL终浓度为0.1 μg·mL-1 LPS, 阳性药地塞米松组(Dex) 为加入100 μL终浓度为100 μmol·L-1地塞米松和0.1 μg·mL-1 LPS的混合溶液, 复方鱼腥草合剂给药组中每孔加入100 μL终浓度为稀释100、500、2 500倍的复方鱼腥草合剂及0.1 μg·mL-1 LPS混合溶液, 异槲皮苷、木犀草苷、黄芩素、汉黄芩素、黄芩苷、连翘苷、连翘酯苷A、绿原酸、异绿原酸A和獐牙菜苷溶液给药组每组加入100 μL终浓度为1、10、100 μmol·L-1样品和0.1 μg·mL-1 LPS混合溶液。各组细胞处理后, 置于37 ℃、5% CO2培养箱中培养24 h。收集细胞培养上清液, 用试剂盒检测NO、TNF-α、IL-6的含量变化, 具体实验步骤参照试剂盒说明书。
统计学方法 使用GraphPad Prism 5软件进行数据统计, 计量资料用均数±标准差(x±s) 表示, 多组间比较采用单因素方差分析(oneway analysis of variance, one-way ANOVA), P < 0.05认为差异有统计学意义。
结果 1 化合物潜在靶点分析结果通过Swiss Target Prediction服务器反向对接实验和TCMSP数据库检索, 得到25个化合物共211个相关靶点。从STRING 10数据库中获得蛋白间相互作用关系(PPI), 然后利用Cytoscape 3.6.1软件构建PPI网络图, 见图 1。对网络进行分析发现, 处于复方鱼腥草合剂PPI网络中心的15个靶点蛋白(表 2) 即丝氨酸/苏氨酸-蛋白激酶(serine/threonine-protein kinase, AKT1)、胰岛素(insulin, INS)、血管内皮生长因子(vascular endothelial growth factor A, VEGFA)、白介素-6 (interleukin-6, IL-6)、细胞肿瘤抗原p53 (cellular tumor antigen p53, TP53)、肿瘤坏死因子(tumor necrosis factor, TNF)、转录因子AP-1 (transcription factor AP-1, JUN)、半胱氨酸天冬氨酸蛋白酶3 (caspase-3, CASP3)、基质金属蛋白酶-9 (matrix metalloproteinase-9, MMP9)、白介素-8 (interleukin-8, IL-8)、前列腺素G/H合酶2 (prostaglandin G/H synthase 2, PTGS2)、原癌基因c-fos (proto-oncogene c-Fos, FOS)、酪氨酸蛋白激酶SRC (tyrosine-protein kinase SRC, SRC)、丝裂原活化蛋白激酶-8 (mitogen-activated protein kinase 8, MAPK8)、雌激素受体1 (estrogen receptor 1, ESR1) 度值较高, 拥有较多相互作用关系, 推测其为蛋白网络的核心靶点, 这些蛋白涉及炎症反应、免疫调节和中枢神经系统等方面, 提示复方鱼腥草合剂发挥清热解毒作用的药效机制与这些蛋白密切相关。
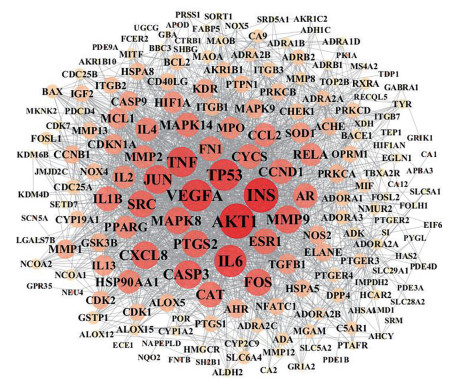
|
Figure 1 Protein-protein interaction (PPI) network of related protein targets. Circle nodes represent protein targets, circle size and color depth represent closeness interaction between targets and proteins |
| Table 2 Information of 15 key targets |
利用OmicsBean分析软件对相关靶点蛋白进行GO功能注释分析, 包含细胞组分、分子功能和生物过程3个方面, 选取P值最小的前10个进行作图呈现, 见图 2。结果发现, 这些蛋白在细胞组分方面主要参与构成细胞质、胞质溶胶、细胞囊泡等过程; 在分子功能方面主要参与酶结合、大分子复合物结合以及蛋白结合绑定等功能; 在生物过程方面主要涉及对细胞过程的正调控、有机物或含氧化合物的应激反应等过程, 推测复方鱼腥草合剂清热解毒功效可能与以上功能过程相关。
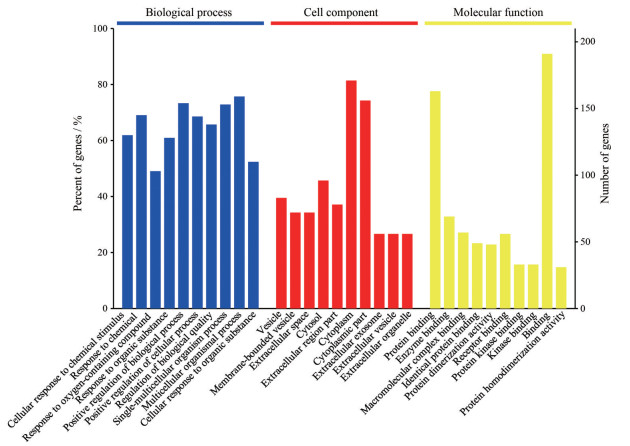
|
Figure 2 Gene onto logy (GO) enrichment analysis of related protein targets |
利用STRING 10数据库得到false discovery rate < 0.01的通路共97条, 通过KEGG通路分析及相关文献查阅, 得到46条相关信号通路, 具体信息见表 3。推测复方鱼腥草合剂清热解毒的机制可能与干预这些通路过程有关。
| Table 3 Information of 46 related pathways |
其中与炎症相关的信号通路: 白介素-17信号通路(IL-17 signaling pathway)、丝裂原活化蛋白激酶信号通路(MAPK signaling pathway)、花生四烯酸代谢(arachidonic acid metabolism)、核转录因子κB信号通路(NF-kappa B signaling pathway) 等; 与免疫调节相关的信号通路: T细胞受体信号通路(T cell receptor signaling pathway)、B细胞受体信号通路(B cell receptor signaling pathway)、Th1和Th2细胞分化(Th1 and Th2 cell differentiation)、自然杀伤细胞介导的细胞毒性(natural killer cell mediated cytotoxicity)、抗原处理和呈递(antigen processing and presentation) 等; 与镇痛相关的信号通路: 环磷酸腺苷信号通路(cAMP signaling pathway)、TRP通道炎性介质调节(inflammatory mediator regulation of TRP channels)、钙离子信号通路(calcium signaling pathway)、神经组织的配体-受体相互作用(neuroactive ligand-receptor interaction) 等; 与解热相关的信号通路: 环磷酸腺苷信号通路、花生四烯酸代谢等。
4 “化合物-靶点-通路-药理作用-功效”网络构建根据对应关系, 在Cytoscape 3.6.1软件中构建“化合物-靶点-通路-药理作用-功效”的网络关系图, 见图 3 (蓝色正方形表示化合物, 绿色圆形表示靶点, 紫色菱形表示通路, 红色三角形表示药理作用, 黄色六边形表示功效)。运用软件的Network Analyzer插件分析发现, 该网络有287个节点(包括25个化合物、211个靶点、46条通路、4个药理作用和1个功效) 和884条边。网络拓扑学结构分析显示, 网络平均度值为6.048, 其中大于度值中位数的化合物有12个, 分别为汉黄芩素、黄芩素、千层纸素A、异绿原酸A、依靛蓝酮、木犀草苷、连翘苷、绿原酸、异槲皮苷、黄芩苷、白杨素、连翘酯苷A; 靶点有9个, 分别为AKT1、丝裂原活化蛋白激酶-9 (mitogen-activated protein kinase 9, MAPK9)、转录因子p65 (transcription factor p65, RELA)、蛋白激酶C α (protein kinase C alpha, PRKCA)、MAPK8、蛋白激酶C β (protein kinase C beta, PRKCB)、丝裂原活化蛋白激酶14 (mitogen-activated protein kinase 14, MAPK14)、JUN、TNF。网络中既存在一个分子与多个靶点蛋白的相互作用, 也存在同一个靶点蛋白与不同分子作用的现象, 显示了复方鱼腥草合剂的多成分与多靶点之间共同作用的机制, 符合中药复方的作用特点。
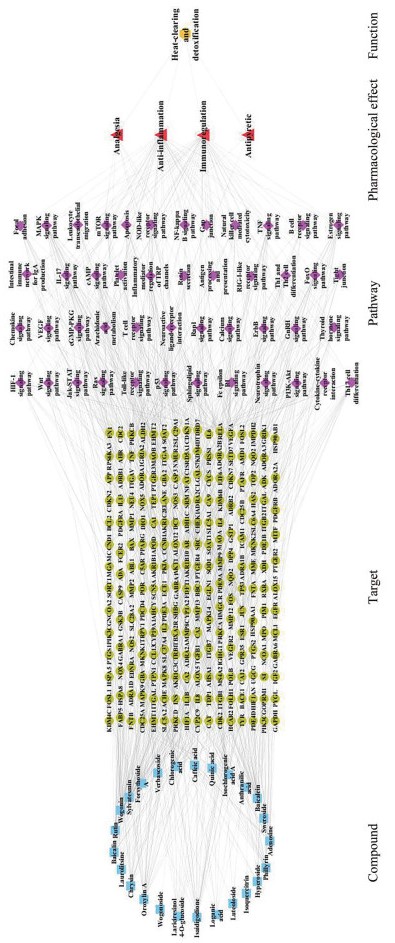
|
Figure 3 The compound-target-pathway-pharmacological effect-function network of Fufang Yuxingcao Mixture (FYM) |
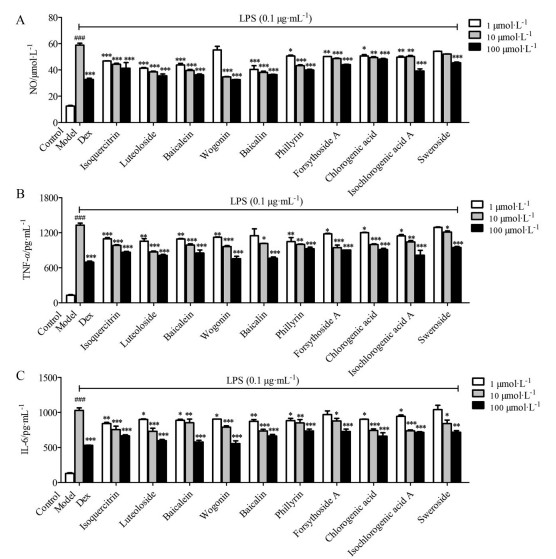
通过检测, 得到复方鱼腥草合剂及10个代表性单体对RAW264.7细胞上清液中NO、TNF-α和IL-6释放量的影响(图 4、5)。从结果图可以看出, LPS作用于细胞后, 细胞上清液中的NO、TNF-α和IL-6分泌量明显增加, 与空白对照组比较有显著性差异(P < 0.001), 阳性药地塞米松给药浓度为100 μmol·L-1时能显著抑制NO、TNF-α和IL-6的释放(P < 0.001)。复方鱼腥草合剂各浓度细胞上清液中的NO、TNF-α和IL-6含量明显低于LPS组(P < 0.05), 并且呈现剂量依赖性。与LPS组比较, 汉黄芩素低浓度给药组对细胞上清中NO的释放无显著抑制作用, 黄芩苷低浓度给药组细胞上清中TNF-α的含量无显著性差异, 连翘酯苷A低浓度给药组对细胞上清中IL-6的含量无显著性差异, 獐牙菜苷在低浓度给药组对NO、TNF-α和IL-6的含量均无显著性差异, 其他单体化合物在高、中、低浓度时对细胞上清NO、TNF-α和IL-6的释放均有显著性抑制作用, 并且呈现剂量依赖性。
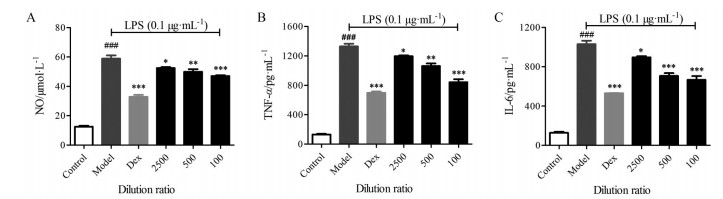
|
Figure 4 Effects of FYM on the release of NO (A), TNF-α (B), and IL-6 (C) in the Raw264.7 cell supernatant. n = 3, x±s. ###P < 0.001 vs control; *P < 0.05, **P < 0.01, ***P < 0.001 vs model |
|
Figure 5 Effects of compounds on the release of NO (A), TNF-α (B) and IL-6 (C) in the Raw264.7 cell supernatant. n = 3, x±s. ###P < 0.001 vs control; *P < 0.05, **P < 0.01, ***P < 0.001 vs model |
中医“外感”、“感冒”即为西医中急性上呼吸道感染, 其通常是指由病毒和细菌感染引起的咽喉、扁桃体等部位的呼吸道黏膜急性炎症的总称[8, 9]。当病原体侵袭机体时可与免疫细胞上Toll样受体(TLRs) 结合, 然后通过TLR-NF-κB信号通路产生后续一系列特定基因表达, 最后产生诸如IL-1、IL-6、IL-12和TNF-α等炎症因子, 调节机体的炎症反应[10, 11]。同时, IL-1、IL-6和TNF-α的增加将活化B淋巴细胞受体介导的免疫通路, 产生抗体, 伴随进一步激活MAPK、PI3K-AKT和NF-κB信号途径, 从而引起一系列的炎症反应, 诱发全身性免疫应答。IL-6增高可以刺激T细胞增殖, 增强细胞免疫反应[12]。这些细胞因子一方面可直接或间接地作用于伤害性感受器, 从而在持续性痛或病理性痛中起到关键性作用[13]; 另一方面, 其还可直接或间接通过中枢介质作用于体温调节中枢, 体温调定点上移, 引起产热增加, 散热减少, 使体温升高[14]。另外, 在炎症反应中花生四烯酸的代谢起着关键的作用。花生四烯酸经环氧化酶(COX) 途径和脂氧化酶(LOX) 途径分别代谢产生前列腺素(PGs) 及白三烯类(LTs) 等炎性递质[15]。PGs是重要的致炎、致痛和致热介质, 前列腺素E2 (PGE2) 通过其受体和其他前列腺类物质一起以条件依赖方式参与了炎症不同阶段的调节[16, 17], 并且PGE2是中枢性正调节介质之一, 很容易弥散透过血脑屏障, 作用于下丘脑温度敏感神经的PGE2受体, 通过提高细胞内cAMP使调定点升高[18]。白三烯作为重要的炎症介质参与了支气管哮喘、慢性阻塞性肺疾病、毛细支气管炎和急性肺损伤等多种肺部疾病的病理生理过程[19]。白三烯B4是重要的白细胞活化物质, 刺激白细胞的趋化、聚集、释放氧自由基及溶酶体酶, 可增加血管壁通透性, 刺激支气管平滑肌细胞分泌黏液, 促进炎症细胞在气道聚集, 从而加剧炎症反应[20]。
本研究的靶点预测及作用通路分析结果提示, 复方鱼腥草合剂中的黄酮类成分芦丁、金丝桃苷、木犀草苷、汉黄芩素、黄芩素、黄芩苷、千层纸素A、异槲皮苷, 木脂素类成分连翘脂素、连翘苷, 苯乙醇苷类成分连翘酯苷A、毛蕊花糖苷, 有机酸类成分绿原酸、异绿原酸A、生物碱类成分依靛蓝酮及环烯醚萜类成分獐牙菜苷等化合物可通过作用于IL-1B、IL-8、IL-6、TNF、诱导型一氧化氮合酶2 (NOS2)、转录因子p65 (RELA)、转录因子AP-1 (JUN)、环氧化酶(PTGS1、PTGS2)、蛋白激酶C (PRKCA、PRKCB、PRKCD)、丝氨酸/苏氨酸蛋白激酶(AKT1)、丝裂原活化蛋白激酶(MAPK8、MAPK9、MAPK14) 等靶点, 调节如白介素17、MAPK、PI3K-AKT、TNF、Toll样受体、NF-κB、cAMP、花生四烯酸代谢等信号通路, 发挥抗炎及解热镇痛的作用。
研究显示, 黄芩中黄酮类活性成分黄芩素和黄芩苷可以通过干扰花生四烯酸代谢、NF-κB和MAPK等信号通路, 抑制核因子的活性以及细胞因子的分泌、释放而发挥解热镇痛抗炎的作用[21]。千层纸素A通过阻断NF-κB的活化, 汉黄芩素通过阻止巨噬细胞中c-Jun氨基末端激酶(JNKs)、原癌基因c-Jun蛋白及AP-1的活化使iNOS和COX-2基因表达下调, 减少NO和PGE2的产生[22-24]。金银花中的黄酮类成分木犀草苷可抑制IL-1β诱导的兔软骨细胞MAPKs (ERK1/2、JNK和p38) 的磷酸化和NF-κB p65亚基向细胞核的移位, 进而抑制MMPs、NO、PGE2和促炎细胞因子的释放, 发挥抗炎作用[25]。有机酸类成分绿原酸、异绿原酸A通过减弱NF-κB/NLRP3和JNK/AP-1信号通路活化, 降低LPS诱导的COX-2和iNOS的表达, 并逆转IL-6、TNF-α、IL-1β、MCP-1和PGE2的表达, 减轻LPS所致炎症反应[26, 27]; 环烯醚萜类成分獐牙菜苷通过激活SIRT1调控SIRT1/NF-κB和SIRT1/FOXO1信号通路, 改善LPS诱导的RAW264.7细胞炎症反应[28]。连翘药材中的连翘苷[29]及连翘酯苷A[30]通过抑制MAPK和NF-κB信号通路的激活, 降低促炎细胞因子(TNF-α、IL-1β和IL-6) 的表达, 并且连翘酯苷A亦可通过抑制TLR4/MyD88/NF-κB信号通路, 下调参与调节性T细胞(Tregs) 免疫抑制功能的分子Foxp3、IL-10和TGF-β1, 发挥抗内毒素作用[31]。鱼腥草及板蓝根中的金丝桃苷、异槲皮苷通过抑制LPS诱导的iNOS表达, 抑制NO的产生, 其机制可能是通过抑制p44/42丝裂原活化蛋白激酶(MAPK)、p38MAPK和JNK的磷酸化, 参与了抗炎作用[32]。
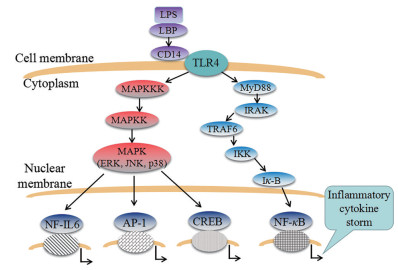
LPS是革兰阴性菌致病的主要因素, 能通过与细胞膜受体相互作用, 作用于宿主细胞, 并通过细胞内信号传递级联基因表达发生变化[33]。当RAW264.7被LPS刺激时, 通过作用于细胞膜上的膜受体, 激活诱导细胞内各种炎症信号通路, 进而调节相关炎症因子基因的表达, 最终合成和释放众多内源性生物活性因子, 如NO、PGE2、TNF-α、IL-6和IL-1β等[34] (机制图见图 6)。本研究以LPS刺激RAW264.7细胞作为炎症实验模型, 对复方鱼腥草合剂及异槲皮苷、木犀草苷、黄芩素、汉黄芩素、黄芩苷、连翘苷、连翘酯苷A、绿原酸、异绿原酸A、獐牙菜苷10个关键化学成分的抗炎活性进行验证, 结果表明复方鱼腥草合剂及10个成分均表现出显著的抗炎活性。因此推测, 该10个成分可能为复方鱼腥草合剂发挥抗炎作用的关键药效物质基础。
|
Figure 6 Mechanism of inflammatory response in macrophages induced by lipopolysaccharide (LPS) |
综上, 本研究通过网络药理学手段及体外细胞实验分析了复方鱼腥草合剂可能的作用靶点及途径, 初步阐释了其清热解毒功效的作用机制及药效物质基础, 为后续进行深入作用机制及质量标志物的研究奠定了基础。
作者贡献: 韩彦琪、陈志霖、许浚共同设计了文章的研究方法与思路; 张洪兵、刘建庭、张杨完成了文献搜索与整理; 韩彦琪、刘耀晨、陈志霖完成了实验工作及初稿与终稿的撰写; 韩彦琪、刘耀晨、胡江宁分析并整理了实验数据; 刘昌孝、张铁军提供了文章主题中心思想并完成了论文的修改。
利益冲突: 所有作者均声明没有利益冲突。
| [1] |
Tang ZW. Effect Observation on compound Yuxingcao mixture combined with ambroxol hydrochloride oral liquid for bronchopneumonia in children[J]. J New Chin Med (新中医), 2018, 12: 160-162. |
| [2] |
Huang XZ, Wang HF. Clinical analysis of compound cordate houttuynia mixture combined with cefaclor in the treatment of children with pneumonia[J]. China Mod Doct (中国现代医生), 2015, 24: 96-98. |
| [3] |
Liu SC, Wu JJ, Xu JZ. Observation on the clinical effect of pediatric Qingfeiyin and compound houttuynia cordata mixture on pneumonia in children[J]. China Foreign Med Treat (中外医疗), 2014, 22: 159-160, 163. |
| [4] |
He HH, Yao JB, Chang WQ, et al. Analysis of chemical material basis of compound Yuxingcao mixture based on HPLC-LTQ-orbitrap MS/MS technology[J]. Asia Pacific Tradit Med (亚太传统医药), 2020, 16: 37-44. |
| [5] |
Feng ML, Liu M, Wu CQ, et al. Content determination of five components in compound Yuxingcao mixture by UPLC-MS/MS[J]. China Pharm (中国药师), 2020, 23: 968-971. |
| [6] |
Han YQ, Xu J, Zhang XM, et al. Network pharmacology-based study on mechanism of Yuanhu Zhitong Dropping Pills in the treatment of primary dysmenorrhea[J]. Acta Pharm Sin (药学学报), 2016, 51: 380-387. |
| [7] |
Zhong RX, Ding ZH, Yang YN, et al. Study on the pharmacodynamic material basis and mechanisms of Ju-Hong Tan-Ke liquid for the treatment of "phlegm, cough, and asthma" based on network pharmacology[J]. Acta Pharm Sin (药学学报), 2020, 55: 2134-2144. |
| [8] |
Manoharan A, Winter J. Tackling upper respiratory tract infections[J]. Practitioner, 2010, 254: 25-28. |
| [9] |
Eccles R. Understanding the symptoms of the common cold and influenza[J]. Lancet Infect Dis, 2005, 5: 718-725. DOI:10.1016/S1473-3099(05)70270-X |
| [10] |
De Nardo D. Toll-like receptors: activation, signalling and transcriptional modulation[J]. Cytokine, 2015, 74: 181-189. DOI:10.1016/j.cyto.2015.02.025 |
| [11] |
Satoh T, Akira S. Toll-like receptor signaling pathways[J]. Front Immunol, 2014, 5: 461. |
| [12] |
Kücüksezer UC, Palomares O, Rückert B, et al. Triggering of specific Toll-like receptors and proinflammatory cytokines breaks allergen-specific T-cell tolerance in human tonsils and peripheral blood[J]. J Allergy Clin Immun, 2013, 131: 875-885. DOI:10.1016/j.jaci.2012.10.051 |
| [13] |
Bastien D, Lacroix S. Cytokine pathways regulating glial and leukocyte function after spinal cord and peripheral nerve injury[J]. Exp Neurol, 2014, 258: 62-77. DOI:10.1016/j.expneurol.2014.04.006 |
| [14] |
Conti B, Tabarean I, Andrei C, et al. Cytokines and fever[J]. Front Biosci, 2004, 9: 1433-1449. DOI:10.2741/1341 |
| [15] |
Tao YQ, Liang T, Zhou KY. Three arachidonic acid metabolic pathways involved in inflammation[J]. Int J Immunol (国际免疫学杂志), 2010, 33: 303-306. |
| [16] |
Xue R, Miao YF, Yang JC, et al. Prosgladin (PG) E2 in regulation of immunity and inflammatory diseases[J]. Prog Physiol Sci (生理科学进展), 2011, 42: 165-168. |
| [17] |
Ricciotti E, FitzGerald GA. Prostaglandins and inflammation[J]. Arterioscler Thromb Vasc Biol, 2011, 31: 986-1000. DOI:10.1161/ATVBAHA.110.207449 |
| [18] |
Dinarello CA. Infection, fever, and exogenous and endogenous pyrogens: some concepts have changed[J]. J Endotoxin Res, 2004, 10: 201-222. |
| [19] |
Wu H, Chen XQ. Research progress of leukotrienes and leukotriene receptor antagonists in pulmonary diseases[J]. Chin J Obstet Gynecol Pediat (中华妇幼临床医学杂志), 2017, 13: 234-239. |
| [20] |
Peters-Golden M, Henderson WR. Leukotrienes[J]. N Engl J Med, 2007, 357: 1841-1854. DOI:10.1056/NEJMra071371 |
| [21] |
Xin WS, Song JK, He GR, et al. Progress in pharmacological study and the underlying mechanism of baicalein and baicalin[J]. Chin J New Drugs (中国新药杂志), 2013, 22: 647-653, 659. |
| [22] |
Chen Y, Yang L, Lee TJ. Oroxylin A inhibition of lipopolysaccharide-induced iNOS and COX-2 gene expression via suppression of nuclear factor-kappaB activation[J]. Biochem Pharmacol, 2000, 59: 1445-1457. DOI:10.1016/S0006-2952(00)00255-0 |
| [23] |
Huang GC, Chow JM, Shen SC, et al. Wogonin but not nor-wogonin inhibits lipopolysaccharide and lipoteichoic acid-induced iNOS gene expression and NO production in macrophages[J]. Int Immunopharmacol, 2007, 7: 1054-1063. DOI:10.1016/j.intimp.2007.04.001 |
| [24] |
Chen LG, Hung LY, Tsai KW, et al. Wogonin, a bioactive flavonoid in herbal tea, inhibits inflammatory cyclooxygenase-2 gene expression in human lung epithelial cancer cells[J]. Mol Nutr Food Res, 2008, 52: 1349-1357. DOI:10.1002/mnfr.200700329 |
| [25] |
Lee SA, Park BR, Moon SM, et al. Chondroprotective effect of cynaroside in IL-1β-induced primary rat chondrocytes and organ explants via NF-κB and MAPK signaling inhibition[J]. Oxid Med Cell Longev, 2020, 2020: 9358080. |
| [26] |
Wang Q, Li X. Isochlorogenic acid A attenuates acute lung injury induced by LPS via Nf-κB/NLRP3 signaling pathway[J]. Am J Transl Res, 2019, 11: 7018-7026. |
| [27] |
Shan J, Fu J, Zhao Z, et al. Chlorogenic acid inhibits lipopolysaccharide-induced cyclooxygenase-2 expression in RAW264.7 cells through suppressing NF-κB and JNK/AP-1 activation[J]. Int Immunopharmacol, 2009, 9: 1042-1048. DOI:10.1016/j.intimp.2009.04.011 |
| [28] |
Wang R, Dong ZY, Lan XZ, et al. Sweroside alleviated LPS-induced inflammation via SIRT1 mediating NF-κB and FOXO1 signaling pathways in RAW264.7 cells[J]. Molecules, 2019, 24: 872. DOI:10.3390/molecules24050872 |
| [29] |
Zhong WT, Wu YC, Xie XX, et al. Phillyrin attenuates LPS-induced pulmonary inflammation via suppression of MAPK and NF-κB activation in acute lung injury mice[J]. Fitoterapia, 2013, 90: 132-139. DOI:10.1016/j.fitote.2013.06.003 |
| [30] |
Zhang JL, Zhang Y, Huang HL, et al. Forsythoside A inhibited S. aureus stimulated inflammatory response in primary bovine mammary epithelial cells[J]. Microb Pathog, 2018, 116: 158-163. DOI:10.1016/j.micpath.2018.01.002 |
| [31] |
Zeng XY, Yuan W, Zhou L, et al. Forsythoside A exerts an anti-endotoxin effect by blocking the LPS/TLR4 signaling pathway and inhibiting Tregs in vitro[J]. Int J Mol Med, 2017, 40: 243-250. DOI:10.3892/ijmm.2017.2990 |
| [32] |
Lee S, Park HS, Notsu Y, et al. Effects of hyperin, isoquercitrin and quercetin on lipopolysaccharide-induced nitrite production in rat peritoneal macrophages[J]. Phytother Res, 2008, 22: 1552-1556. DOI:10.1002/ptr.2529 |
| [33] |
Lu YC, Yeh WC, Ohashi PS. LPS/TLR4 signal transduction pathway[J]. Cytokine, 2008, 42: 145-151. DOI:10.1016/j.cyto.2008.01.006 |
| [34] |
Rogero MM, Calder PC. Obesity, inflammation, Toll-like receptor 4 and fatty acids[J]. Nutrients, 2018, 10: 432. DOI:10.3390/nu10040432 |
 2021, Vol. 56
2021, Vol. 56


