2. 广西中医药大学, 广西中药药效研究重点实验室, 广西 南宁 530200
2. Guangxi Key Laboratory of Efficacy Studyon Chinese Materia Medica, Guangxi Traditional Chinese Medicine University, Nanning 530200, China
类风湿性关节炎(rheumatoid arthritis, RA) 是一种病因未明的, 以慢性、对称性、多关节滑膜炎和关节结构破坏为主要特征的自身免疫性疾病[1]。RA的病理变化主要是关节滑膜慢性炎症、滑膜细胞增生、滑膜血管新生, 形成血管翳、软骨和骨组织破坏, 最终造成关节畸形和功能丧失[2]。RA病灶局部关节滑膜、软骨常可见到大量巨噬细胞浸润, 巨噬细胞在RA的病理过程中发挥了关键作用, 参与RA炎症的启动和维持、白细胞的黏附和迁移、基质的降解和血管新生。经典活化的M1巨噬细胞能够大量表达黏附分子、趋化因子受体和其他表面抗原, 分泌多种趋化因子、细胞因子、生长因子、蛋白酶和其他炎症介质, 成为RA炎症和血管增生的关键病理机制[3]。抑制巨噬细胞的经典活化有助于减轻RA的炎症损伤, 减少RA的继发症, 改善RA病理进程的转归。
配对免疫球蛋白样受体B (paired immunoglobulin-like receptor B, PIR-B) 是一种跨膜糖蛋白, 存在于单核-巨噬细胞、多形核白细胞、自然杀伤细胞、树突状细胞等免疫细胞表面, 具有多种抑制性生物学效应, 可使其下游的酪氨酸激酶去磷酸化而传递抑制性信号, 抑制细胞活化相关的钙离子动员等细胞内活动, 进而负性调控巨噬细胞遵循经典活化途径而极化为M1巨噬细胞。增加PIR-B表达可抑制巨噬细胞的经典活化, 从而负调控巨噬细胞经典活化介导的炎症损伤, 对于RA的治疗可能具有潜在的价值。
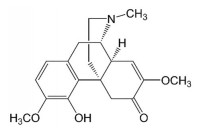
青风藤是防己科植物青藤[Sinomenium acutum (Thunb.) Rehd. et Wils.] 及毛青藤[Sinomenium acutum (Thunb.) Rehd. et Wils. var. cinereum Rehd. et Wils.] 的干燥藤茎, 为广西壮族先民习用于治疗RA等骨关节疾病的常用壮药, 具有祛风除湿、活血通络、消肿止痛之功效。近年来研究显示, 青风藤的主要药理活性成分为青藤碱(sinomenine, 图 1), 具有显著抑制RA炎症的作用, 可以抑制巨噬细胞的经典活化, 显著减少M1巨噬细胞产生肿瘤坏死因子α (tumor necrosis factor α, TNF-α)、白细胞介素8 (interleukin 8, IL-8) 等多种趋化因子和促炎细胞因子, 但尚不清楚该作用是否与其上调PIR-B表达水平有关[4]。本研究以人THP-1单核细胞诱导分化的巨噬细胞为研究对象, 探讨青藤碱对于巨噬细胞经典活化过程中PIR-B表达水平以及巨噬细胞M1极化的影响, 有助于在分子水平理解青藤碱用于RA治疗的分子机制。
|
Figure 1 Chemical structure of sinomenine |
主要试剂 青藤碱、大鼠抗人PIR-B单抗、小鼠抗人磷酸甘油醛脱氢酶(reduced glyceraldehyde-phosphate dehydrogenase, GAPDH) 单抗、小鼠抗人CD80-FITC单抗、小鼠抗人CD86-PE/Cy7单抗(美国Abcam公司, 批号分别为GR152096-4、GR235409-1、GR202362-1、GR230810-1和GR2325704-1); 人γ干扰素(interferon-gamma, IFN-γ) (美国Pepro Tech公司, 批号101227); 脂多糖(lipopolysaccharide, LPS, from Escherichia coli O55:B5) 和佛波酯(phorbol myristate acetate, PMA) (美国Sigma公司, 批号分别为032M4082V和4AD221411C); RPMI-1640细胞培养液、胎牛血清(fetal bovine serum, FBS) 和磷酸盐缓冲液(phosphate buffered saline, PBS) (美国Gibco公司, 批号分别为2003787、1828728和8117266); Accutase胶原酶细胞解离液(美国eBioscience公司, 批号E00023-1662); 细胞计数试剂盒-8 (cell counting kit-8, CCK-8) (日本同仁化学研究所, 批号DV652)。总RNA提取试剂盒、Quant cDNA第一链合成试剂盒、SuperReal PreMix (SYBR Green) 预混试剂盒(北京天根生化科技有限公司, 批号分别为Q5821、Q5317和M1729), PIR-B和GAPDH引物由上海生工公司合成。人TNF-α和IL-8的酶联免疫吸附检测(enzyme-linked immunosorbent assay, ELISA) 试剂盒(武汉华美公司, 批号D27014434和E15014428)。组织细胞放射免疫沉淀分析(radioimmunoprecipitation assay, RIPA) 裂解液、双金鸡宁酸(bicinchoninic acid, BCA) 蛋白浓度测定试剂盒和蛋白电泳预制胶(北京索莱宝公司, 批号分别为20190903、20190910和20190923)。Image-it Fix-Perm kit细胞固定与透化试剂盒(美国Life Technologies公司, 批号1968179), NucBlue Fixed Cell ReadyProbes Reagent细胞核4, 6-二氨基-2-苯基吲哚(4, 6-diamino-2-phenyl indole, DAPI) 染料(美国Life Technologies公司, 批号1921604)。辣根过氧化物酶(horseradish peroxidase, HRP) 标记兔抗大鼠IgG、HRP标记羊抗小鼠IgG和Alexa Fluor 488标记羊抗大鼠IgG (上海生工公司, 批号分别为E814AA0010、E326AA0001和E703AA0016)。
主要仪器 Mini-PROTEAN型垂直电泳仪、Mini Trans-blot型转印仪和ChemiDoc成像系统(美国Bio-Rad公司); 5430R型高速冷冻离心机(德国Eppendorf公司); Infinite 200 Pro酶标仪(瑞士Tecan公司); LightCycler 480Ⅱ实时荧光PCR仪(瑞士Roche公司); SP5Ⅱ激光扫描共聚焦显微分析系统(德国Leica公司); LSR Fortessa多色分析流式细胞仪(美国Becton Dickinson公司)。
THP-1细胞培养 THP-1人单核细胞白血病细胞株购自中国科学院昆明细胞库, 培养于RPMI-1640培养液(含10% FBS、100 u·mL-1青霉素和100 mg·L-1链霉素), 初始细胞浓度为每毫升2×105个, 接种于细胞培养瓶中, 置于CO2培养箱(37 ℃、5% CO2, 饱和湿度) 进行培养, 传代周期约4天。
青藤碱的细胞安全性测试[5-7] 取对数生长期的THP-1细胞接种于96孔细胞培养板, 初始细胞浓度每毫升1×105个。THP-1细胞以200 nmol·L-1的PMA刺激3天诱导分化为巨噬细胞, 然后移去含PMA的培养液, 更换为新鲜的RPMI-1640培养液。取巨噬细胞, 设置无药物处理的正常(normal) 组, 以及每孔加入青藤碱终浓度分别为10、25、50、100和200 μmol·L-1的青藤碱各浓度处理组, 各设置3个复孔。细胞培养箱孵育24 h, 加入CCK-8溶液10 μL, 继续孵育2 h。收集培养上清液, 以酶标仪于450 nm处测定光吸收度。根据细胞安全性测试数据选择后续实验的青藤碱安全浓度。
经典活化巨噬细胞模型的建立[8] 取对数生长期的THP-1细胞接种于96孔细胞培养板, 初始细胞浓度每毫升1×105个。THP-1细胞以200 nmol·L-1的PMA刺激3天诱导分化为巨噬细胞, 然后移去含PMA的培养液, 更换为新鲜的RPMI-1640培养液。取巨噬细胞, 设置正常(normal) 组、经典活化巨噬细胞模型(model) 组, 后者加入LPS (1 μg·mL-1) 与IFN-γ (20 ng·mL-1) 孵育4 h诱导巨噬细胞经典活化。收集培养上清液, 严格按照ELISA试剂盒说明书方法检测培养上清液TNF-α和IL-8浓度, 流式细胞分析检测CD80+/CD86+的M1巨噬细胞, 评价建模方法的有效性。
青藤碱干预巨噬细胞经典活化 取对数生长期的THP-1细胞接种于细胞培养板, 初始细胞浓度每毫升1×105个。THP-1细胞以200 nmol·L-1的PMA刺激3天诱导分化为巨噬细胞, 然后移去含PMA的培养液, 更换为新鲜的RPMI-1640培养液。取巨噬细胞接种于细胞培养板, 初始细胞浓度每毫升1×105个。设置正常(normal) 组、经典活化巨噬细胞模型(model) 组、青藤碱干预(sinomenine) 组, 其中的青藤碱干预组以适宜终浓度的青藤碱预孵育12 h, 其他两组不进行药物干预。12 h后, 经典活化巨噬细胞模型组与青藤碱干预组加入LPS (1 μg·mL-1) 与IFN-γ (20 ng·mL-1) 孵育4 h诱导巨噬细胞经典活化。收集细胞培养上清液, ELISA法检测培养上清液TNF-α和IL-8浓度; 收集细胞, 部分细胞用于蛋白免疫印迹检测PIR-B的表达水平; 剩余细胞用于激光扫描共聚焦显微分析细胞PIR-B原位表达情况及流式细胞分析检测CD80+/CD86+的M1巨噬细胞。
激光扫描共聚焦显微镜观察细胞PIR-B原位表达 接续“青藤碱干预巨噬细胞经典活化”实验部分的操作, 取接种有接受不同处理的巨噬细胞的96孔细胞培养板, 去除培养液, PBS洗3次。以Image-it Fix-Perm kit进行细胞固定与透化, 加入1∶500稀释的PIR-B一抗, 4 ℃避光孵育过夜。一抗孵育结束, PBS洗3次, 加入Alexa Fluor 488标记二抗(稀释度1∶1 000), 25 ℃避光孵育2 h。二抗孵育结束, PBS洗3次, 加入NucBlue Fixed Cell ReadyProbes Reagent细胞核DAPI染料, 25 ℃避光孵育15 min。PBS洗3次, 以Leica SP5Ⅱ激光扫描共聚焦显微分析系统成像。
实时荧光逆转录聚合酶链反应(reverse transcription-polymerase chain reaction, RT-PCR) 法检测细胞PIR-B基因表达 接续“青藤碱干预巨噬细胞经典活化”实验部分的操作, 取接种有接受不同处理的巨噬细胞的6孔细胞培养板, 去除培养液, PBS洗3次, 胶原酶细胞解离液消化10 min, 加入适量4 ℃预冷的PBS, 1 000 r·min-1离心5 min。小心去除上清, 采用总RNA提取试剂盒提取细胞总RNA, 以Quant cDNA第一链合成试剂盒完成cDNA第一链合成。PIR-B引物序列ACCTCTATGCTGCTGTGA (正向)、ATCTGCCT GTCCTCTTCC (反向), GAPDH引物序列CAGTGCC AGCCTCGTCTCAT (正向)、AGGGGCCATCCACAG TCTTC (反向)。PCR反应条件: 95 ℃预变性10 min; 95 ℃变性10 s, 60 ℃退火20 s, 72 ℃延伸20 s, 循环40次, 最后72 ℃延伸5 min。以2-△△Ct表示PIR-B基因相对表达水平。
Western blot法检测细胞PIR-B蛋白表达 接续“青藤碱干预巨噬细胞经典活化”实验部分的操作, 取接种有接受不同处理的巨噬细胞的6孔细胞培养板, 去除培养液, PBS洗3次, 胶原酶细胞解离液消化10 min, 加入适量4 ℃预冷的PBS, 1 000 r·min-1离心5 min。小心去除上清, 加入10倍体积裂解液4 ℃孵育20 min, 12 000 r·min-1离心5 min, 取上清并蛋白定量。准备蛋白电泳预制胶, 蛋白上样量20 μg。垂直电泳条件为恒压100 V, 指示剂泳动至凝胶中下部时停止。采用湿法转膜, 封闭, 4 ℃摇床一抗孵育过夜, PIR-B单抗和GAPDH单抗稀释倍数均为1∶1 200。一抗孵育结束, 二抗(1∶3 000稀释) 室温孵育60 min, 增强化学发光(enhanced chemiluminescence, ECL) 超敏化学发光液孵育3 min, 即以ChemiDoc成像系统测定并计算目的蛋白PIR-B与内参蛋白GAPDH条带灰度的比值作为蛋白的相对表达水平。
流式细胞术分析CD80+/CD86+的M1巨噬细胞 接续“经典活化巨噬细胞模型的建立”和“青藤碱干预巨噬细胞经典活化”实验部分的操作, 取接种有接受不同处理的巨噬细胞的6孔细胞培养板, 去除培养液, PBS洗3次, 胶原酶细胞解离液消化10 min, 加入适量4 ℃预冷的PBS, 1 000 r·min-1离心5 min。小心去除上清, PBS重悬细胞, 加入CD80-FITC和CD86-PE/Cy7单抗(1∶1 000稀释), 于4 ℃避光孵育60 min。孵育结束之后以PBS洗细胞2次, 以LSR Fortessa流式细胞仪进行流式细胞分析, 前向散射光和侧向散射光用于圈定细胞群并测量其大小与颗粒度, 非染色细胞用于记录自发荧光, CD80+/CD86+设门圈选双阳性的M1巨噬细胞。
统计学处理 数据以均数±标准差(x±s) 表示, 以SPSS 12.0统计软件进行组间均数比较。方差齐性数据采用独立样本t检验(两组间均数比较) 或单因素方差分析LSD检验(多组间均数比较), 方差不齐数据采用秩和检验。以P < 0.05为差异具有统计学意义。
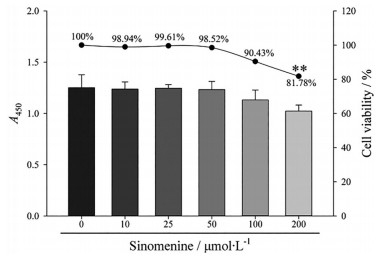
结果 1 青藤碱的细胞安全性与未经青藤碱处理的正常组比较, 以终浓度为10、25、50和100 μmol·L-1的青藤碱孵育巨噬细胞24 h, 对细胞的活力无明显影响; 以终浓度为200 μmol·L-1的青藤碱孵育巨噬细胞24 h, 细胞活力显著降低, 其差异有统计学意义(P < 0.01), 故选择100 μmol·L-1为后续细胞实验的青藤碱适宜浓度。结果见图 2。
|
Figure 2 Cell safety test for sinomenine. Incubating macrophages with sinomenine at 10, 25, 50, and 100 μmol·L-1 for 24 h has no significant effect on cell viability. However, incubating with sinomenine at 200 μmol·L-1 for 24 h, cell viability is significantly reduced. n = 3, x±s. **P < 0.01 vs cells without sinomenine treatment |
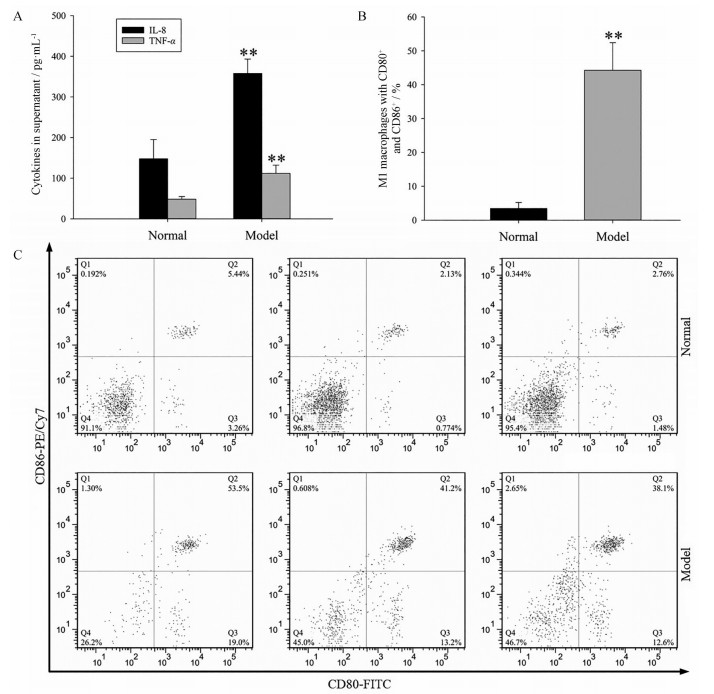
与未经青藤碱处理的正常组比较, 模型组细胞培养上清液中的TNF-α、IL-8水平以及M1巨噬细胞百分比显著提升, 两组间差异具有统计学意义(P < 0.01)。结果见图 3。
|
Figure 3 Establishment of macrophage classic activation model. A: The comparisons of interleukin 8 (IL-8) and tumor necrosis factor α (TNF-α) in cell culture supernatants between normal control and model group were shown; B: Bar charts were made to display comparison of M1 macrophage percentage; C: The comparisons of appropriate flow scatter plots between normal control and model group were exhibited. M1 macrophages with CD80+ and CD86+ were located in the Q2 quadrant, and the number in upper right corner of Q2 quadrant indicates the percentage of M1 macrophages. n = 3, x±s. **P < 0.01 vs normal group. FITC: Fluorescein isothiocyanate; PE/Cy7: Phycoerythrin/cyanine 7 |
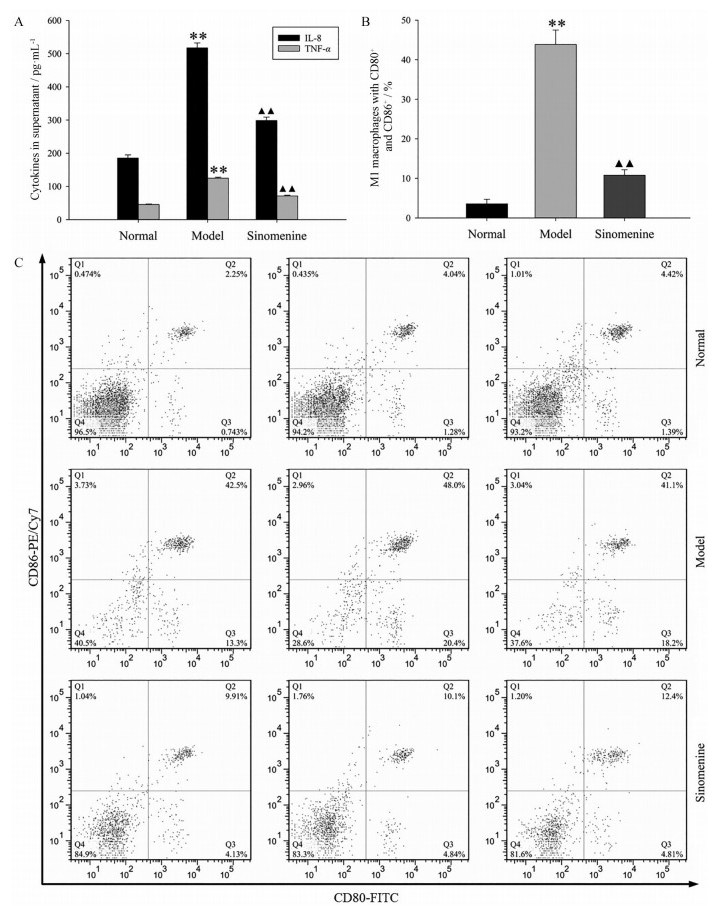
与未经LPS+IFN-γ联合诱导活化的正常组比较, 模型组细胞培养上清液中的TNF-α和IL-8水平显著提升, M1巨噬细胞占比百分率显著增加, 两组间差异具有统计学意义(P < 0.01)。与模型对照组比较, 青藤碱预处理组细胞培养上清液中的TNF-α和IL-8水平明显降低, 可见CD80+/CD86+的M1巨噬细胞占比百分率显著减少, 两组间差异具有统计学意义(P < 0.01)。结果见图 4。
|
Figure 4 Inhibition of sinomenine on macrophage classic activation. A: The comparisons of IL-8 and TNF-α in cell culture supernatants among normal control, model group, and sinomenine treatment group were shown; B: Bar charts were made to display comparisons of M1 macrophage percentage in each group; C: The comparisons of appropriate flow scatter plots were exhibited in each group. M1 macrophages with CD80+ and CD86+ were located in the Q2 quadrant, and the number in upper right corner of Q2 quadrant indicates the percentage of M1 macrophages. n = 3, x±s. **P < 0.01 vs normal group; ▲▲P < 0.01 vs model group |
实时荧光RT-PCR检测结果显示, 与正常组比较, 模型组细胞PIR-B基因表达水平显著降低, 两组间差异具有统计学意义(P < 0.01, 图 5A); Western blot检测结果显示, 模型组细胞PIR-B蛋白表达水平低于正常组, 两组间差异具有统计学意义(P < 0.05, 图 5B、C)。激光扫描共聚焦显微分析PIR-B蛋白原位表达情况, 镜下可见青藤碱预处理组细胞膜PIR-B表达明显多于模型组, 正常组的细胞膜PIR-B表达水平则介于模型组和青藤碱预处理组之间(图 5D)。

|
Figure 5 Regulation of sinomenine on cell PIR-B expression in macrophage classic activation. A: The comparisons of macrophage PIR-B gene expressions among normal control, model group, and sinomenine treatment group were shown; B: The comparisons of macrophage PIR-B protein expressions were shown in each group with bar charts; C: The Western blot bands of PIR-B protein expressions in each group; D: Cell PIR-B proteins were stained using Alexa Fluor 488-labelled antibody (green). Blue pseudo color indicates DAPI. Scale bar: 100 μm. n = 3, x±s. *P < 0.05, **P < 0.01 vs normal group; ▲▲P < 0.01 vs model group. PIR-B: Paired immunoglobulin-like receptor B; GAPDH: Reduced glyceraldehyde-phosphate dehydrogenase; DAPI: 4, 6-Diamino-2-phenyl indole |
RA的滑膜与软骨炎症产生的大量趋化因子, 吸引外周血单核细胞移动并聚集于RA病灶局部, 分化为组织巨噬细胞[9]。RA局部存在多种可溶性介质, 包括促炎细胞因子、生长因子和免疫球蛋白等, 巨噬细胞借助这些可溶性介质与病灶局部的其他细胞相互影响, 这些复杂的相互作用很大程度上导致了巨噬细胞的经典活化, 其主要结果就是巨噬细胞进一步极化为具有强烈促炎作用的M1巨噬细胞, 引起TNF-α、IL-8和其他细胞因子、趋化因子和生长因子的释放[10]。值得注意的是, 此病理过程可以自我循环而持久存在, 并可能在某些特定的病理因素作用下获得加强, RA漫长而反复的临床过程即与此密切相关[11, 12]。可溶性介质需要与巨噬细胞的特定受体结合以便发挥其生物学作用, PIR-B即为其中具有关键作用的一种受体。PIR-B是一种跨膜糖蛋白, 具有广泛的生物学作用, 能够负调节整合素、Toll样受体(Toll-like receptor, TLR) 等信号转导途径, 调节巨噬细胞的吞噬与分泌功能, 抑制移植物抗宿主反应, 负调节炎症反应, 抑制组织纤维化, 维持免疫应答与内环境的稳态[13-17]。PIR-B介导的受体后信号转导途径活化对于RA的病理进程具有多个层级的调节作用, 不仅抑制炎症损伤, 也有助于组织修复, 并维持正常的内环境平衡[16, 18]。因此, 适当上调PIR-B受体表达, 可以期待其对于改善RA临床转归具有良好治疗效应, 具备成为RA治疗潜在靶点的价值。
上述推测获得了体外研究与模式动物研究的验证与正面支持。敲除了PIR-B基因的小鼠骨髓巨噬细胞, 经大肠杆菌刺激后的促炎细胞因子分泌明显增多; 正常个体接受PIR-B基因敲除的小鼠骨髓巨噬细胞移植后, 可观察到类似的炎症增强反应, 其结肠炎的发生率显著提升; PIR-B基因敲除的小鼠感染沙门氏菌后也出现了类似的炎症难以控制的现象, 导致高水平的促炎细胞因子释放; PIR-B基因敲除的模式动物, 感染金葡菌后的存活率显著低于正常个体, 其原因也与无法控制的过度炎症反应有关[19]。此外, PIR-B可以调节酪氨酸激酶磷酸化而负调节TLR9, 抑制自身抗体产生[20]。由上可知, PIR-B及其介导的信号转导途径对于巨噬细胞经典活化参与的过度炎症损伤具有抑制作用。
经典活化的巨噬细胞即M1巨噬细胞, 其表面标记已被逐渐确认。有研究报道, M1巨噬细胞表达高水平的CD80和CD86细胞表面标记, 而且其表达上调与大量的促炎细胞因子的释放有关, 因而CD80+/CD86+的细胞表面标记已被广泛接受为M1巨噬细胞的标记[21, 22]。本研究中, LPS/IFN-γ刺激之前巨噬细胞仅表达很少的CD80/CD86, 而且细胞培养上清液中的促炎细胞因子以及细胞PIR-B的表达水平也很低; LPS/IFN-γ刺激显著提升了细胞表面CD80/CD86表达和培养上清液中的促炎细胞因子水平, 符合巨噬细胞经典活化的变化规律[23], 与此同时, 细胞PIR-B表达出现明显下调, 其确切原因尚无法确定。有研究报道, 人类RA患者的白细胞PIR-B表达水平较高, 并在免疫抑制剂治疗12~36个月后其PIR-B表达水平显著下调, 然而这些患者的病程长达数十年, 其PIR-B表达水平的变化, 或许更有可能是缘于免疫抑制剂导致的炎症细胞反应性降低后机体不再需要通过高水平表达PIR-B抑制炎症, 而疾病活动期的高水平PIR-B表达则是机体试图恢复慢性炎症损伤-组织修复的动态平衡的结果[24]。然而, 为何较高水平的PIR-B表达未能导致这些患者的RA获得自然缓解, 则仍然是有待探究的问题。RA的发病机制仍然不够清楚, 普遍认为RA的持续性炎症损伤不是单一原因的结果, 或许可以合理推测: RA患者的炎症自限机制发生了某些尚未完全清楚的障碍, 在此情况下, 即使较高水平的PIR-B表达也未能达到炎症缓解的目的。虽然目前尚无有关巨噬细胞经典活化介导的急性炎症期是否存在PIR-B表达水平下调的文献报道, 但本研究的体外实验结果确实提示了这样的趋势。同样地, 也尚无明确证据证明存在某种机制, 在巨噬细胞经典活化过程中持续发挥正反馈效应, 从而下调PIR-B表达水平, 持续增强巨噬细胞的M1极化。然而, 无论何种原因导致的细胞PIR-B表达下调, 在具有巨噬细胞经典活化介导的过度炎症损伤的疾病状态下, 均不利于炎症范围局限化以及炎症损伤趋于可控, 应当是合理的认知。研究RA病程早期与晚期的患者的巨噬细胞的PIR-B表达水平, 并试图寻找其关键的控制因素, 有助于理解此现象的发生机制以及找到RA治疗的新的潜在靶点。
本研究的另一个结果, 即青藤碱预处理显著抑制了LPS与IFN-γ联合刺激诱导的巨噬细胞经典活化, 同时可见PIR-B表达水平显著上调, 提示青藤碱可能通过上调PIR-B的表达而发挥抑制巨噬细胞经典活化的药理作用。青藤碱用于临床治疗RA的有效性结果表明, 青藤碱极有可能不是仅通过上调PIR-B的表达而获得RA临床缓解的疗效, 如果青藤碱的药效机制仅基于此, 则无法解释RA活动期患者白细胞较高水平的PIR-B表达与炎症水平之间的矛盾表象。青藤碱治疗RA的药效机制应为基于多途径和/或多靶点的方式, 而其上调PIR-B表达水平抑制巨噬细胞经典活化则是包括于该多途径和/或多靶点药效机制之中的一部分。
迄今为止, 对于RA发病机制的复杂性尚存在许多有待填补的未知区域, 其中的部分原因来自缺乏可以良好模拟人类RA病理过程的模式动物, 现有的RA动物模型均无法良好重现人类RA的复杂病理过程, 该问题的存在极大地限制了体外测试有效的药物继续验证其体内有效性的尝试。所幸青风藤与青藤碱均已在长期的RA临床治疗实践中获得了足够的正面支持证据, 虽然其确切的药理作用机制依然不够清晰。已经有青藤碱基于代谢重编程机制调控巨噬细胞极化的部分研究证据, 表明青藤碱在RA炎症微环境中调控巨噬细胞的极化及后续的有益作用, 有助于更为深刻地认识青藤碱治疗RA的药理作用机制, 也是青藤碱作为RA治疗药物进行增效减毒等深入研究的良好开端[25]。
作者贡献: 卫智权负责课题实施、数据整理、统计分析和论文初稿撰写; 包传红负责细胞学实验; 陈仪新负责实验样本收集与前处理; 阎莉负责课题设计、实验指导及论文终稿审查。
利益冲突: 所有作者均声明不存在利益冲突。
| [1] |
Felson DT, Klareskog L. The genetics of rheumatoid arthritis: new insights and implications[J]. JAMA, 2015, 313: 1623-1624. DOI:10.1001/jama.2015.1710 |
| [2] |
Viatte S, Plant D, Han B, et al. Association of HLA-DRB1 haplotypes with rheumatoid arthritis severity, mortality, and treatment response[J]. JAMA, 2015, 313: 1645-1656. DOI:10.1001/jama.2015.3435 |
| [3] |
Hanaoka BY, Ithurburn MP, Rigsbee CA, et al. Chronic inflammation in rheumatoid arthritis and mediators of skeletal muscle pathology and physical impairment: a review[J]. Arthritis Care Res (Hoboken), 2019, 71: 173-177. DOI:10.1002/acr.23775 |
| [4] |
Yue M, Zhang X, Dou Y, et al. Gut-sourced vasoactive intestinal polypeptide induced by the activation of α7 nicotinic acetylcholine receptor substantially contributes to the anti-inflammatory effect of sinomenine in collagen-induced arthritis[J]. Front Pharmacol, 2018, 9: 675-687. DOI:10.3389/fphar.2018.00675 |
| [5] |
Yin N, Xiong Y, Tao W, et al. Sinomenine alleviates lipopolysaccharide-induced inflammatory responses in RAW264.7 macrophages[J]. Immunopharmacol Immunotoxicol, 2020, 42: 147-155. DOI:10.1080/08923973.2020.1732407 |
| [6] |
Zhu RL, Zhi YK, Yi L, et al. Sinomenine regulates CD14/TLR4, JAK2/STAT3 pathway and calcium signal via α7nAChR to inhibit inflammation in LPS-stimulated macrophages[J]. Immunopharmacol Immunotoxicol, 2019, 41: 172-177. DOI:10.1080/08923973.2019.1568451 |
| [7] |
Yi L, Luo JF, Xie BB, et al. α7 Nicotinic acetylcholine receptor is a novel mediator of sinomenine anti-inflammation effect in macrophages stimulated by lipopolysaccharide[J]. Shock, 2015, 44: 188-195. DOI:10.1097/SHK.0000000000000389 |
| [8] |
Wei Z, Yan L, Chen Y, et al. Mangiferin inhibits macrophage classical activation via downregulating interferon regulatory factor 5 expression[J]. Mol Med Rep, 2016, 14: 1091-1098. DOI:10.3892/mmr.2016.5352 |
| [9] |
Bruijnen S, Verweij N, Gent Y, et al. Imaging disease activity of rheumatoid arthritis by macrophage targeting using second generation translocator protein positron emission tomography tracers[J]. PLoS One, 2019, 14: e0222844. DOI:10.1371/journal.pone.0222844 |
| [10] |
Tardito S, Martinelli G, Soldano S, et al. Macrophage M1/M2 polarization and rheumatoid arthritis: a systematic review[J]. Autoimmun Rev, 2019, 18: 102397-102417. DOI:10.1016/j.autrev.2019.102397 |
| [11] |
Rana AK, Li Y, Dang Q, et al. Monocytes in rheumatoid arthritis: circulating precursors of macrophages and osteoclasts and, their heterogeneity and plasticity role in RA pathogenesis[J]. Int Immunopharmacol, 2018, 65: 348-359. DOI:10.1016/j.intimp.2018.10.016 |
| [12] |
Aota K, Yamanoi T, Kani K, et al. Inverse correlation between the number of CXCR3+ macrophages and the severity of inflammatory lesions in Sjögren's syndrome salivary glands: a pilot study[J]. J Oral Pathol Med, 2018, 47: 710-718. DOI:10.1111/jop.12756 |
| [13] |
Yuan R, Yang M, Fan W, et al. Paired immunoglobulin-like receptor B inhibition in Müller cells promotes neurite regeneration after retinal ganglion cell injury in vitro[J]. Neurosci Bull, 2020, 36: 972-984. DOI:10.1007/s12264-020-00510-w |
| [14] |
Lu XM, Mao M, Xiao L, et al. Nucleic acid vaccine targeting nogo-66 receptor and paired immunoglobulin-like receptor B as an immunotherapy strategy for spinal cord injury in rats[J]. Neurotherapeutics, 2019, 16: 381-393. DOI:10.1007/s13311-019-00718-3 |
| [15] |
Zhang J, Chen L, Gu YD. Changes in expressions of major histocompatibility complex class I, paired-immunoglobulin-like receptor B, and cluster of differentiation 3ζ in motor cortical representations of the brachial plexus after avulsion in rats[J]. World Neurosurg, 2017, 106: 211-218. DOI:10.1016/j.wneu.2017.06.133 |
| [16] |
Rothe K, Raulien N, Köhler G, et al. Autoimmune arthritis induces paired immunoglobulin-like receptor B expression on CD4+ T cells from SKG mice[J]. Eur J Immunol, 2017, 47: 1457-1467. DOI:10.1002/eji.201646747 |
| [17] |
Wang H, Wu J. 17β-Estradiol suppresses hyperoxia-induced apoptosis of oligodendrocytes through paired-immunoglobulin-like receptor B[J]. Mol Med Rep, 2016, 13: 2892-2898. DOI:10.3892/mmr.2016.4808 |
| [18] |
Yugami M, Odagiri H, Endo M, et al. Mice deficient in angiopoietin-like protein 2(angptl2) gene show increased susceptibility to bacterial infection due to attenuated macrophage activity[J]. J Biol Chem, 2016, 291: 18843-18852. DOI:10.1074/jbc.M116.720870 |
| [19] |
Nakayama M, Underhill DM, Petersen TW, et al. Paired Ig-like receptors bind to bacteria and shape TLR-mediated cytokine production[J]. J Immunol, 2007, 178: 4250-4259. DOI:10.4049/jimmunol.178.7.4250 |
| [20] |
Kollnberger S, Bird LA, Roddis M, et al. HLA-B27 heavy chain homodimers are expressed in HLA-B27 transgenic rodent models of spondyloarthritis and are ligands for paired Ig-like receptors[J]. J Immunol, 2004, 173: 1699-1710. DOI:10.4049/jimmunol.173.3.1699 |
| [21] |
Mulens-Arias V, Rojas JM, Perez-Yague S, et al. Polyethylenimine-coated SPIONs trigger macrophage activation through TLR-4 signaling and ROS production and modulate podosome dynamics[J]. Biomaterials, 2015, 52: 494-506. DOI:10.1016/j.biomaterials.2015.02.068 |
| [22] |
Cullis J, Siolas D, Avanzi A, et al. Macropinocytosis of nab-paclitaxel drives macrophage activation in pancreatic cancer[J]. Cancer Immunol Res, 2017, 5: 182-190. DOI:10.1158/2326-6066.CIR-16-0125 |
| [23] |
Rao Muvva J, Parasa VR, Lerm M, et al. Polarization of human monocyte-derived cells with vitamin D promotes control of Mycobacterium tuberculosis infection[J]. Front Immunol, 2019, 10: 3157-3169. |
| [24] |
Huynh OA, Hampartzoumian T, Arm JP, et al. Down-regulation of leucocyte immunoglobulin-like receptor expression in the synovium of rheumatoid arthritis patients after treatment with disease-modifying anti-rheumatic drugs[J]. Rheumatology (Oxford), 2007, 46: 742-751. DOI:10.1093/rheumatology/kel405 |
| [25] |
Yu Y, Cai WW, Zhou J, et al. Metabolic reprogramming regulates macrophage polarization and its role in rheumatoid arthritis[J]. Acta Pharm Sin (药学学报), 2020, 55: 2027-2034. |
 2021, Vol. 56
2021, Vol. 56


