2. 湖北大学中药生物技术省重点实验室, 药物高通量筛选技术国家地方联合工程研究中心, 湖北 武汉 430062
2. Hubei Province Key Laboratory of Biotechnology of Chinese Traditional Medicine, National and Local JointEngineering Research Center of High-throughput Drug Screening Technology, Hubei University, Wuhan 430062, China
非酒精性脂肪肝病(nonalcoholic fatty liver disease, NAFLD) 是世界范围内最普遍的慢性肝病之一, 影响着全世界25%的普通人群和85%~98%的病态肥胖患者[1, 2]。NAFLD通常被认为是代谢综合征(胰岛素抵抗、肥胖和高脂血症) 的肝脏表现, 包括肝脂肪变性和非酒精性脂肪性肝炎(nonalcoholic steatohepatitis, NASH)[3, 4]。NASH是脂质堆积、肝细胞死亡、炎症和纤维化的结合, 使其成为肝硬化、肝细胞癌(hepato-cellular carcinoma, HCC) 和最终肝疾病相关死亡的重要危险因素[5]。因此, NAFLD在世界范围内的日益流行是相当值得临床关注的。NAFLD的发病机制以及从单纯脂肪变性发展为NASH的机制尚未完全阐明。目前“多重打击”假说已经取代了“二次打击”假说[6], NAFLD的发病机制现在可以描述为多种平行因素, 如久坐不动的生活方式、高脂饮食(high fat diet, HFD) 以及环境和遗传因素的协同作用, 引起胰岛素抵抗下降, 肝细胞内脂肪的过度积累, 导致细胞内脂肪空泡增多, 从而降低线粒体β氧化能力, 诱导内质网应激、氧化应激和肝细胞凋亡[7, 8]。越来越多研究表明, 内质网应激参与了NAFLD脂肪变性的发生和进展[9-11]。NAFLD中脂质过度积累造成的脂毒性环境直接影响内质网稳态并激活内质网应激, 导致各种细胞内应激途径的激活, 从而引发或加剧胰岛素抵抗和炎症, 在某些情况下, 最终导致肝细胞死亡和肝脏损伤[12, 13]。NAFLD患者肝细胞凋亡增加, 与疾病严重程度密切相关, 因此, 凋亡被认为是NAFLD进展的一个重要标志[14]。
梓醇(catalpol) 是一种主要从地黄根中提取的环烯醚萜苷类物质, 具有许多生物活性, 包括抗氧化、抗炎和抗凋亡等作用[15, 16]。本课题组前期研究发现, 梓醇通过激活腺苷酸活化蛋白激酶(AMP-activated protein kinase, AMPK) 信号通路, 抑制脂肪酸从头合成途径, 促进脂肪酸β氧化, 从而抑制NAFLD的脂质堆积[17]。此外, 还发现梓醇可能通过减少肝脏脂质蓄积和炎症反应以及抑制肝细胞凋亡降低HFD对小鼠肝脏的损伤[18]。然而, 梓醇抑制NAFLD状态下肝细胞凋亡的作用机制尚未明确。本文通过HFD诱导的小鼠NAFLD体内模型和棕榈酸(palmitate, PA) 诱导的人肝癌细胞HepG2体外脂毒性模型, 研究了梓醇对NAFLD状态下肝细胞凋亡的影响及其潜在的作用机制。
材料与方法实验动物 SPF级C57BL/6J小鼠购自北京维通利华实验动物技术有限公司(合格证号: 11400700213032), 饲养于江汉大学医学实验动物中心[许可编号: SYXK (鄂) 2012-0042], 环境温度控制在22~24 ℃, 实验动物自由采食及饮水。实验获得江汉大学实验动物伦理委员会授权。
细胞系 人肝癌细胞系HepG2, 购买于中国科学院上海细胞库。
药物与试剂 梓醇(纯度 > 98%, 成都德斯特生物技术有限公司); 阿托伐他汀钙(atorvastatin calcium, ATC, 阿拉丁公司); 总甘油三脂(total glyceride, TG) 试剂盒、总胆固醇(total cholesterol, TC) 试剂盒、谷丙转氨酶(alanine aminotransferase, ALT) 试剂盒和谷草转氨酶(aspartate transaminase, AST) 试剂盒(南京建成生物工程研究所); TUNEL细胞凋亡检测试剂盒(美国Promega公司); PA (美国Sigma-Aldrich公司); 胎牛血清(fetal bovine serum, FBS) 和DMEM (Dulbecco's modified eagle medium) 高糖培养基(美国Gibco公司); 0.25%胰蛋白酶溶液、PBS溶液和青霉素-链霉素溶液(美国Hyclone公司); 牛血清白蛋白(bovine serum albumin, BSA) 粉剂(美国Equitech-Bio公司); Annexin V & Dead Cell Kit (美国Millipore公司); 对应HRP标记的二抗、BCA (bicinchoninic acid) 蛋白定量分析试剂盒和RIPA (radio immunoprecipitation assay) 裂解液(武汉博士德生物工程有限公司); ECL化学发光显色液(上海碧云天生物技术有限公司); 衣霉素(tunicamycin, TM)、BiP (binding immunoglobulin protein, 3177S)、PERK (protein kinase RNA-like ER kinase, 3192S)、IRE1α (inositol-requiring enzyme-1α, 3294P)、CHOP (C/EBP-homologous protein, 2895)、JNK (c-Jun N-terminal kinase, 9252)、p-JNK (4668)、Bcl-2 (B-cell lymphoma 2, 2870S)、Bax (Bcl-2-associated X, 2772)、cleaved caspase-12 (2202) 一抗(美国Cell Signaling Technology公司); p-PERK (sc-32577) 和ATF6 (activating transcription factor 6, sc-22799) 一抗(美国Santa Cruz公司); cleaved caspase-9 (cleaved cysteinyl aspartate specific proteinase 9, abs131335) 和cleaved caspase-3 (abs132005) 一抗[爱必信(上海) 生物科技有限公司]。
主要仪器 1300 SERIES A2生物安全柜、3308 CO2培养箱和MULTISKAN GO酶标仪(美国Thermo公司); ChemiDoc Touch化学发光分析仪(美国BIO-RAD公司); MULTIFUGF X1R低温高速离心机(德国Heraeus公司); Muse细胞分析仪(美国Millipore公司); BX51正置显微镜(日本Olympus公司); DD5台式低速离心机(湖南赫西仪器装备有限公司)。
动物分组与处理 SPF级C57BL/6J小鼠48只, 雄性, 6周龄, 体重约18~22 g, 随机分为6组, 每组8只, 分别为正常对照组、HFD模型组、梓醇低剂量组(100 mg·kg-1)、梓醇中剂量组(200 mg·kg-1)、梓醇高剂量组(400 mg·kg-1)和阳性对照ATC组(30 mg·kg-1)。正常对照组喂食低脂纯化配方饲料(MD12031, 江苏美迪森生物医药有限公司), 其他组喂食高脂纯化配方饲料(MD12032, 江苏美迪森生物医药有限公司)。梓醇和ATC溶解于生理盐水中, 每天灌胃给药1次, 正常对照组和HFD模型组每天给予等剂量生理盐水, 连续给药18周。
血清生化指标检测 给药处理结束后, 实验小鼠统一禁食不禁水12 h, 1%戊巴比妥钠溶液麻醉小鼠, 然后眼科弯镊摘取眼球取血至1.5 mL EP管中, 静置2 h后, 4 ℃、3 000 r·min-1离心10 min, 分离上清, 用于检测TG、TC、ALT和AST含量。
TUNEL染色法检测小鼠肝细胞凋亡 小鼠脱颈处死后, 快速分离出完整的肝脏, 取大小适宜的部分肝小叶, 于4%多聚甲醛溶液中浸泡固定, 石蜡包埋切片, 并进行TUNEL染色, 于BX51正置显微镜下观察肝细胞凋亡情况。
细胞培养与分组 人肝癌细胞HepG2使用含有10% FBS和1%双抗的DMEM高糖培养液, 在37 ℃、5%的CO2培养箱中进行常规培养。梓醇用1% BSA的DMEM高糖培养液配制成终浓度为25 mmol·L-1的母液, 使用时用相同培养液稀释到相应浓度, 现用现配。HepG2细胞分组及处理如下: ①正常对照组: 1% BSA的DMEM高糖培养液培养细胞24 h; ②模型组: 500 μmol·L-1 PA处理细胞24 h; ③低剂量梓醇处理组: 100 μmol·L-1梓醇+ 500 μmol·L-1 PA共同处理细胞24 h; ④中剂量梓醇处理组: 200 μmol·L-1梓醇+ 500 μmol·L-1 PA共同处理细胞24 h; ⑤高剂量梓醇处理组: 400 μmol·L-1梓醇+ 500 μmol·L-1 PA共同处理细胞24 h。
流式细胞术检测细胞凋亡 将对数生长期的HepG2细胞消化、重悬, 接种到6孔板中(2×105个细胞/孔), 放入到37 ℃、5% CO2培养箱中进行培养, 按实验设计分组处理后, 收集每孔细胞上清液和消化液, 以1 000 r·min-1离心5 min; 离心结束后, 弃上清, 用PBS缓冲液漂洗细胞2次, 倒掉上清液, 在吸水纸上轻拍, 尽量无液体残留, 然后加入缓冲液调整细胞密度每毫升含有1.0×106个细胞, 每管取100 μL细胞悬液, 同时加入100 μL染液, 常温避光染色20 min, 染色结束后, 上机进行检测。
Western blot检测目的蛋白表达水平 肝组织或处理后的细胞中加入RIPA裂解液, 冰浴裂解30 min, 收集裂解液, 4 ℃、12 000 ×g离心15 min, 上清液即为提取的细胞总蛋白原液, 测定蛋白浓度。取30 μg变性总蛋白经SDS-PAGE (10%分离胶, 5%浓缩胶) 电泳分离目的蛋白, 转膜, 5%脱脂奶粉室温封闭1 h, 分别加入一抗BiP (1∶1 000)、PERK (1∶1 000)、p-PERK (1∶1 000)、IRE1α (1∶1 000)、ATF6 (1∶1 000)、JNK (1∶1 000)、p-JNK (1∶1 000)、CHOP (1∶1 000)、Bcl-2 (1∶1 000)、Bax (1∶1 000)、cleaved caspase-12 (1∶1 000)、cleaved caspase-9 (1∶1 000)、cleaved caspase-3 (1∶1 000) 和GAPDH (1∶3 000) 于4 ℃孵育过夜, TBST漂洗3遍, 分别加入对应的HRP标记的二抗(1∶3 000) 室温孵育1 h, TBST洗膜3次后, ECL显色, 化学发光成像分析系统曝光成像, 并用BandScan软件对成像条带进行灰度定量分析。
统计学分析 所有实验数据以Excel进行统计整理, 采用SPSS 20.0软件进行统计分析, 各组数据使用均数±标准差(x±s) 表示, 采用GraphPad Prism 8.0软件进行绘图, 数据采用单因素方差分析(one-way ANOVA), 组间数据差异比较采用LSD, 其中P < 0.05为差异显著且具有统计学意义。
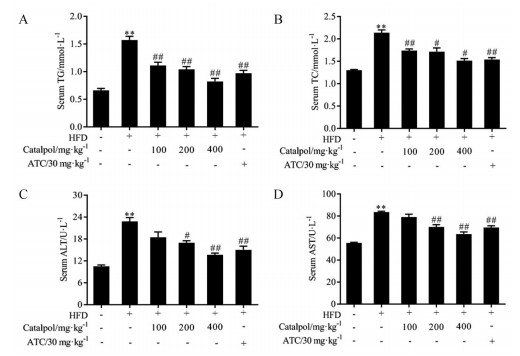
结果 1 梓醇对HFD饮食小鼠血脂和肝损伤的影响结果如图 1所示, 与正常对照组小鼠相比, 模型组小鼠血清中TG、TC、ALT和AST含量显著升高, 表明HFD导致小鼠出现了脂代谢紊乱和肝脏脂质蓄积, 并造成了小鼠肝脏损伤; 经梓醇和ATC连续灌胃给药18周后, 小鼠血清中TG、TC、ALT和AST含量显著降低, 与模型组小鼠相比具有显著性差异(P < 0.05或P < 0.01)。
|
Figure 1 Effects of catalpol on serum lipid and liver damages in HFD-fed mice. A, B: Serum levels of TG and TC; C, D: Serum levels of ALT and AST. n = 8, x±s. **P < 0.01 vs control group; #P < 0.05, ##P < 0.01 vs HFD group. HFD: High fat diet; ATC: Atorvastatin calcium; TG: Total glyceride; TC: Total cholesterol; ALT: Alanine aminotransferase; AST: Aspartate transaminase |
采用TUNEL染色检测梓醇是否能够抑制HFD饮食诱导的小鼠肝细胞凋亡, 显微镜下观察组织切片上凋亡的细胞为棕褐色, 细胞核为蓝色或蓝黑色, 使用Image J软件进行统计, 结果如图 2所示, 正常对照组小鼠肝细胞排列整齐, 核仁清晰, 未见或偶见凋亡细胞; 模型组小鼠大量肝细胞被染成褐色, 与正常对照组相比, 发生了显著的肝细胞凋亡; 梓醇和ATC干预后, 凋亡细胞数量较模型组小鼠显著降低。

|
Figure 2 Effect of catalpol on hepatocytes apoptosis in HFD-fed mice (400×). A: Hepatocytes apoptosis was determined via TUNEL staining. 1: Control; 2: HFD; 3: HFD + Catalpol (100 mg·kg-1); 4: HFD + Catalpol (200 mg·kg-1); 5: HFD + Catalpol (400 mg·kg-1); 6: HFD + ATC (30 mg·kg-1); B: Statistical results of TUNEL staining using Image J. **P < 0.01 vs control group; #P < 0.05, ##P < 0.01 vs HFD group |
通过Western blot方法检测梓醇对HFD饮食诱导的小鼠肝组织内质网应激相关蛋白表达水平的影响, 结果如图 3所示, 与正常对照组相比, HFD饮食小鼠肝组织中内质网应激相关蛋白BiP、p-PERK/PERK、IRE1α和ATF6表达显著上调(P < 0.01), 梓醇和ATC干预能剂量依赖性降低内质网应激相关蛋白的表达, 与模型组相比具有统计学意义(P < 0.05或P < 0.01)。

|
Figure 3 Effects of catalpol on hepatic endoplasmic reticulum stress-related protein expressions in HFD-fed mice. A: Representative blots of BiP, p-PERK, PERK, IRE1α, and ATF6; B: Quantified expression of BiP; C: Quantified expression of p-PERK/PERK; D: Quantified expression of IRE1α; E: Quantified expression of ATF6. n = 3, x±s. **P < 0.01 vs control group; #P < 0.05, ##P < 0.01 vs HFD group. BiP: Binding immunoglobulin protein; p-PERK: Phosphorylated PKR-like endoplasmic reticulum kinase; IRE1α: Inositol-requiring enzyme 1α; ATF6: Activating transcription factor 6 |
为了研究梓醇能否抑制HFD饮食诱导的NAFLD小鼠肝细胞凋亡, 进一步检测了CHOP、p-JNK、cleaved caspase (-12、-9和-3) 蛋白表达水平, 结果如图 4所示, 与正常对照组比较, HFD饮食喂养的小鼠肝组织中CHOP、p-JNK、cleaved caspase (-12、-9和-3) 的蛋白表达水平显著上调(P < 0.01), 梓醇和ATC干预可以下调CHOP、p-JNK、cleaved caspase (-12、-9和-3) 的蛋白表达水平, 且与模型组相比具有统计学差异(P < 0.05或P < 0.01)。

|
Figure 4 Effects of catalpol on apoptosis-related protein expressions in HFD-fed mice. A: Representative blots of CHOP, p-JNK, JNK, and cleaved caspases (-12, -9, and -3); B: Quantified expression of CHOP and p-JNK/JNK; C: Quantified expression of cleaved caspases (-12, -9, and -3). n = 3, x±s. **P < 0.01 vs control group; #P < 0.05, ##P < 0.01 vs HFD group. CHOP: C/EBP homology protein; p-JNK: Phosphorylated c-Jun N-terminal kinase; Caspase: Cysteinyl aspartate specific proteinase |
为了研究梓醇是否能够抑制PA诱导的HepG2细胞凋亡, 采用流式细胞术分析了各实验组细胞凋亡率, 结果如图 5所示, PA诱导的HepG2细胞凋亡率为28.2%, 与正常对照组相比, 具有显著性差异(P < 0.01); 与PA模型组相比, 梓醇各处理组的细胞凋亡率剂量依赖性显著降低(P < 0.05或P < 0.01)。

|
Figure 5 The effect of catalpol on apoptosis in PA-treated HepG2 cells by flow cytometry. n = 3, x±s. **P < 0.01 vs control group; #P < 0.05, ##P < 0.01 vs PA group. PA: Palmitate |
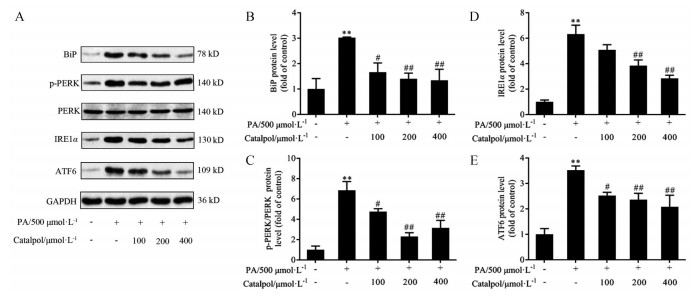
结果如图 6所示, 与正常对照组相比, PA诱导HepG2细胞中BiP、p-PERK、IRE1α和ATF6蛋白表达量显著增加, 差异均具有统计学意义(P < 0.01); 与PA模型组相比, 同时加入不同剂量的梓醇干预24 h后, HepG2细胞中BiP、p-PERK、IRE1α和ATF6蛋白表达量显著降低(P < 0.05或P < 0.01), 表明梓醇抑制了PA对HepG2细胞诱导产生的内质网应激反应。
|
Figure 6 Effects of catalpol on endoplasmic reticulum stress-related protein expressions in PA-treated HepG2 cells. A: Representative blots of BiP, p-PERK, PERK, IRE1α, and ATF6; B: Quantified expression of BiP; C: Quantified expression of p-PERK/PERK; D: Quantified expression of IRE1α; E: Quantified expression of ATF6. n = 3, x±s. **P < 0.01 vs control group; #P < 0.05, ##P < 0.01 vs PA group |
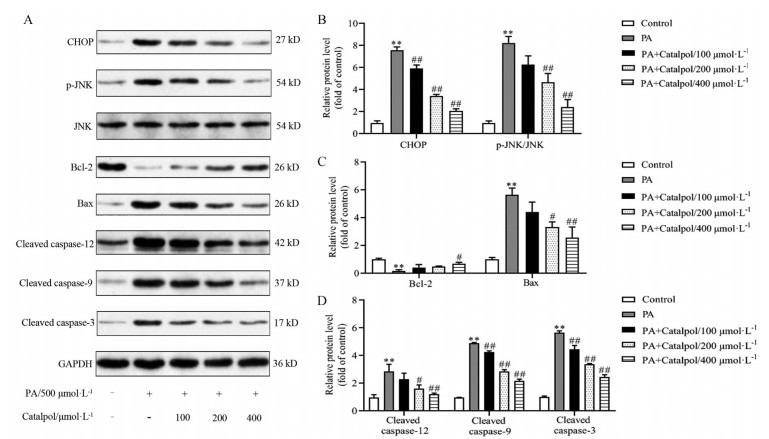
结果如图 7所示, 与正常对照组相比, PA处理HepG2细胞导致CHOP、p-JNK、cleaved caspase (-12、-9和-3) 蛋白表达水平以及促凋亡蛋白Bax表达水平上调, 抗凋亡蛋白Bcl-2表达水平下调, 差异均具有统计学意义(P < 0.01); 加入不同剂量的梓醇与PA同时处理HepG2细胞24 h后, 不仅显著下调了PA诱导的HepG2细胞中CHOP、p-JNK、cleaved caspase (-12、-9和-3) 以及促凋亡Bax的蛋白表达水平, 而且显著上调了抗凋亡Bcl-2的蛋白表达(P < 0.05或P < 0.01), 且呈现剂量依赖性。
|
Figure 7 Effects of catalpol on apoptosis-related protein expressions in PA-treated HepG2 cells. A: Representative blots of CHOP, p-JNK, JNK, Bcl-2, Bax, and cleaved caspases (-12, -9, and -3); B: Quantified expression of CHOP and p-JNK/JNK; C: Quantified expression of Bcl-2 and Bax; D: Quantified expressions of cleaved caspases (-12, -9, and -3). n = 3, x±s. **P < 0.01 vs control group; #P < 0.05, ##P < 0.01 vs PA group |
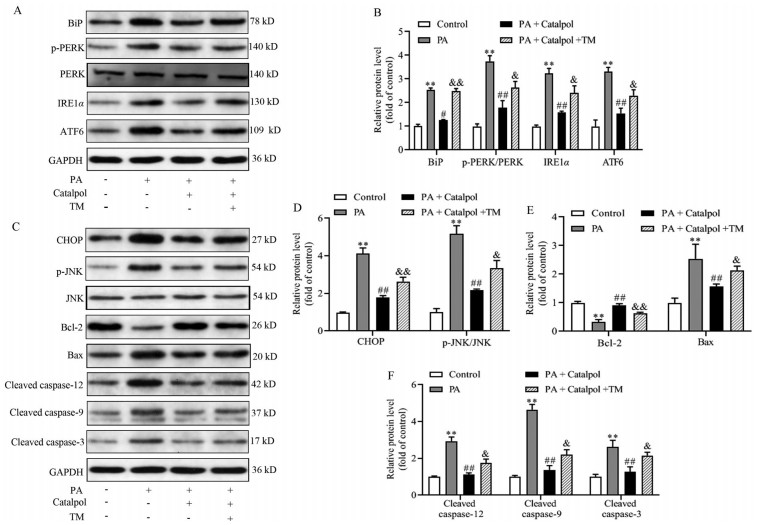
为了进一步探讨梓醇是否能够通过抑制PA诱导的内质网应激反应缓解肝细胞凋亡, 从而发挥对肝脏损伤的保护作用, 在梓醇与PA共处理HepG2细胞的同时加入TM (5 μg·mL-1) 刺激内质网应激反应, 检测对内质网应激和凋亡通路相关蛋白表达水平的影响, 结果如图 8A所示, 400 μmol·L-1梓醇显著抑制了PA诱导HepG2细胞中内质网应激标志性的BiP、p-PERK、IRE1α和ATF6蛋白表达水平, 使用内质网应激激动剂TM处理HepG2细胞显著降低了梓醇对BiP、p-PERK、IRE1α、ATF6蛋白表达水平的抑制作用(P < 0.05或P < 0.01); 由图 8B也观察到梓醇对凋亡相关蛋白CHOP、p-JNK/JNK、Bcl-2、Bax、cleaved caspase (-12、-9和-3) 的调控作用在加入TM刺激后显著被抑制(P < 0.05或P < 0.01)。以上结果表明, 梓醇对PA诱导的HepG2细胞凋亡通路的抑制作用可能是通过调控内质网应激反应来实现的。
|
Figure 8 Catalpol inhibits apoptosis in PA-treated HepG2 cells by regulating endoplasmic reticulum stress pathway. A: Representative blots of BiP, p-PERK, PERK, IRE1α, and ATF6; B: Quantified expressions of BiP, p-PERK/PERK, IRE1α, and ATF6; C: Representative blots of CHOP, p-JNK, JNK, Bcl-2, Bax, and cleaved caspases (-12, -9, and -3); D: Quantified expressions of CHOP and p-JNK/JNK; E: Quantified expressions of Bcl-2 and Bax; F: Quantified expressions of cleaved caspases (-12, -9, and -3). n = 3, x±s. **P < 0.01 vs control group; #P < 0.05, ##P < 0.01 vs PA group; & P < 0.05, & & P < 0.01 vs PA + Catalpol group. TM: Tunicamycin |
NAFLD发病的确切机制仍知之甚少, “多重打击假说”是目前最公认的解释该疾病发展和进展的理论[19]。最初的打击触发脂质堆积和单纯的脂肪变性, 而随后的打击包括线粒体功能障碍、氧化应激、脂肪和细胞因子改变、脂质过氧化、库普弗细胞活化等, 引起肝细胞氧化应激、炎症和凋亡, 最终导致NAFLD从简单脂肪变性发展为NASH。其中, 细胞凋亡在NAFLD的进展过程中是至关重要。本课题组的研究也发现NAFLD小鼠发生了细胞凋亡现象[18]。近年来有文献报道了一些凋亡抑制剂对NAFLD的缓解作用, 以及对肝硬化和HCC发生的预防作用[20, 21]。本课题组前期研究亦发现, 梓醇可以抑制肝细胞凋亡从而降低HFD对小鼠肝脏的损伤作用[18], 本文则重点研究了梓醇对HFD诱导的小鼠肝细胞内质网应激反应及肝细胞凋亡的影响机制。
越来越多研究表明, 过度的内质网应激启动的肝细胞凋亡在NAFLD的发生和进展过程中是重要的始动环节, 并参与整个发病过程[10, 11]。内质网是钙储存、碳水化合物代谢、蛋白质合成和折叠以及脂质和类固醇合成的主要场所, 这些过程中的任何不平衡都可能导致内质网应激, 从而通过激活3个内质网膜结合的传感蛋白PERK、IRE1和ATF6, 启动未折叠蛋白反应(unfolded protein response, UPR) 以恢复内质网功能[22]。过度的内质网应激持续导致内质网功能紊乱, 主要通过3种信号转导通路介导下游细胞凋亡: ① CHOP的转录激活; ② JNK通路的激活; ③内质网应激特有的caspase-12的激活。CHOP是一种UPR调控的典型内质网应激介导的细胞凋亡的关键标志物, 其表达受IRE1α、PERK和ATF6三条途径调节, 在诱导细胞凋亡过程中起着关键作用[23, 24]。CHOP可上调促凋亡基因Bax, 下调抗凋亡基因Bcl-2, 导致线粒体相关功能障碍、caspase-12和caspase-9激活, caspase级联反应启动, 最终导致凋亡的发生[25]。Caspase-3激活和肝细胞凋亡是各种不同NAFLD实验模型的显著特征, NAFLD患者肝细胞凋亡增加, 与疾病严重程度密切相关[14]。UPR通过PERK途径激活ATF4和CHOP介导的转录反应, 抑制CHOP下游抗凋亡蛋白Bcl-2, 激活促凋亡蛋白Bax, 导致内质网应激诱导的细胞凋亡[26, 27]。IRE1α也是一种跨膜蛋白, 激活的IRE1α结合并剪切X盒结合蛋白1 (X-box-binding protein 1, XBP1), 成熟活化的XBP1上调CHOP表达[28, 29]。另外, 激活的IRE1α还能将促凋亡信号如肿瘤坏死因子受体相关因子2募集到内质网膜, 招募凋亡信号调节激酶1并激活下游JNK通路, 介导凋亡的发生[30, 31]。ATF6是一种转录因子, 在内质网应激条件下转运到高尔基体被激活, 随后ATF6可以激活XBP1的转录, 调节CHOP的表达, 从而诱导细胞凋亡[32, 33]。本实验结果显示, HFD饮食喂养小鼠18周后导致肝脏发生内质网应激, 表现为内质网标志性蛋白BiP、p-PERK、IRE1α和ATF6表达水平均被显著上调, 且与凋亡相关蛋白p-JNK、CHOP、cleaved caspase (-12、-9和-3) 表达水平均被上调, 加入梓醇和ATC干预后, 以上这些蛋白的表达趋势均能被逆转。本课题组前期研究发现, HFD饮食小鼠肝组织中Bcl-2蛋白表达水平显著降低, Bax蛋白表达水平显著升高, 梓醇和ATC干预促进了Bcl-2的蛋白表达水平, 抑制了Bax蛋白表达水平[18]。以上结果表明, 梓醇抑制了HFD诱导的小鼠肝细胞凋亡, 其作用机制可能与缓解内质网应激通路有关。
接着, 本研究采用PA诱导HepG2细胞构建体外脂毒性模型, 在细胞水平进一步研究梓醇对PA诱导的HepG2细胞内质网应激和肝细胞凋亡的影响。众所周知, 游离脂肪酸可分为饱和脂肪酸和不饱和脂肪酸两类, 其中饱和脂肪酸(如PA) 与肝脏脂毒性关联性更强, 并且是肝细胞死亡的更有效的诱导剂, 可通过内质网应激激活线粒体凋亡途径而对肝细胞产生更大的毒性作用[34, 35]。文献[18, 36, 37]报道PA在HepG2和Huh7等肝细胞中可明显地诱导内质网应激和细胞凋亡。本研究体外结果显示, 与正常对照组相比, PA处理HepG2细胞24 h后发生明显的内质网应激反应, 表现为内质网应激标志性蛋白BiP、p-PERK、IRE1α和ATF6表达水平显著增加, 与内质网应激相关的凋亡蛋白CHOP、p-JNK、Bax、cleaved caspase (-12、-9和-3) 表达水平也显著增加, 抗凋亡蛋白Bcl-2表达水平显著降低。以上结果表明, PA导致HepG2发生了内质网应激和细胞凋亡, 可能由于持续的PA处理HepG2引发不可逆的内质网应激, 造成内质网功能紊乱, 持续和过度的内质网应激导致细胞发生凋亡。梓醇干预后, 内质网应激和凋亡相关蛋白的表达水平均被逆转, 表明梓醇能够缓解PA诱导的内质网应激反应, 抑制肝细胞凋亡。为了验证这一结论, 本研究在给予梓醇干预的同时加入内质网应激激动剂TM, 观察在发生内质网应激启动UPR情况下, 梓醇对细胞凋亡相关蛋白的作用是否发生变化。实验结果显示, 与梓醇干预组相比, 加入TM后, BiP、p-PERK、IRE1α和ATF6蛋白表达显著上调, 说明TM减弱了梓醇对PA诱导的内质网应激反应的抑制作用, 随后梓醇对凋亡相关分子CHOP、p-JNK、Bax、Bcl-2、cleaved caspase (-12、-9和-3) 的调控作用也相应地被减弱, 表明梓醇干预可以通过缓解内质网应激通路抑制肝细胞凋亡, 从而保护肝损伤。
综上, 本文研究结果表明梓醇可通过缓解HFD诱导的持续内质网应激反应, 抑制肝细胞凋亡, 进而缓解NAFLD的发生与发展。本文只在细胞水平研究了梓醇抑制肝细胞凋亡的作用机制, 后续还将通过给HFD小鼠注射TM, 在动物水平进一步验证梓醇抑制NAFLD状态下肝细胞凋亡的机制。
作者贡献: 田香负责查阅文献、设计实验方案、实验操作、数据分析以及文章撰写; 熊琪负责细胞培养; 乐凯和周梅负责统计分析; 林款和马宝苗负责小鼠饲养与灌胃; 陈勇和茹琴负责实验方案设计和指导论文写作及修改。
利益冲突: 本文中所有作者声明无任何利益冲突。
| [1] |
Younossi ZM, Koenig AB, Abdelatif D, et al. Global epidemiology of nonalcoholic fatty liver disease-meta-analytic assessment of prevalence, incidence, and outcomes[J]. Hepatology, 2016, 64: 73-84. DOI:10.1002/hep.28431 |
| [2] |
Machado M, Marques-Vidal P, Cortez-Pinto H. Hepatic histology in obese patients undergoing bariatric surgery[J]. J Hepatol, 2006, 45: 600-606. DOI:10.1016/j.jhep.2006.06.013 |
| [3] |
Demir M, Lang S, Steffen HM. Nonalcoholic fatty liver disease - current status and future directions[J]. J Dig Dis, 2015, 16: 541-557. DOI:10.1111/1751-2980.12291 |
| [4] |
Francque SM, van der Graaff D, Kwanten WJ. Non-alcoholic fatty liver disease and cardiovascular risk: pathophysiological mechanisms and implications[J]. J Hepatol, 2016, 65: 425-443. DOI:10.1016/j.jhep.2016.04.005 |
| [5] |
Hardy T, Oakley F, Anstee QM, et al. Nonalcoholic fatty liver disease: pathogenesis and disease spectrum[J]. Annu Rev Pathol, 2016, 11: 451-496. DOI:10.1146/annurev-pathol-012615-044224 |
| [6] |
Rinella ME. Nonalcoholic fatty liver disease: a systematic review[J]. JAMA, 2015, 313: 2263-2273. DOI:10.1001/jama.2015.5370 |
| [7] |
Colak Y, Yesil A, Mutlu HH, et al. A potential treatment of non-alcoholic fatty liver disease with SIRT1 activators[J]. J Gastrointestin Liver Dis, 2014, 23: 311-319. DOI:10.15403/jgld.2014.1121.233.yck |
| [8] |
Gallego-Duran R, Romero-Gomez M. Epigenetic mechanisms in non-alcoholic fatty liver disease: an emerging field[J]. World J Hepatol, 2015, 7: 2497-2502. DOI:10.4254/wjh.v7.i24.2497 |
| [9] |
Lebeaupin C, Vallee D, Hazari Y, et al. Endoplasmic reticulum stress signalling and the pathogenesis of non-alcoholic fatty liver disease[J]. J Hepatol, 2018, 69: 927-947. DOI:10.1016/j.jhep.2018.06.008 |
| [10] |
Liu X, Green RM. Endoplasmic reticulum stress and liver diseases[J]. Liver Res, 2019, 3: 55-64. DOI:10.1016/j.livres.2019.01.002 |
| [11] |
Maiers JL, Malhi H. Endoplasmic reticulum stress in metabolic liver diseases and hepatic fibrosis[J]. Semin Liver Dis, 2019, 39: 235-248. DOI:10.1055/s-0039-1681032 |
| [12] |
Leamy AK, Egnatchik RA, Young JD. Molecular mechanisms and the role of saturated fatty acids in the progression of non-alcoholic fatty liver disease[J]. Prog Lipid Res, 2013, 52: 165-174. DOI:10.1016/j.plipres.2012.10.004 |
| [13] |
Zhang XQ, Xu CF, Yu CH, et al. Role of endoplasmic reticulum stress in the pathogenesis of nonalcoholic fatty liver disease[J]. World J Gastroenterol, 2014, 20: 1768-1776. DOI:10.3748/wjg.v20.i7.1768 |
| [14] |
Kanda T, Matsuoka S, Yamazaki M, et al. Apoptosis and non-alcoholic fatty liver diseases[J]. World J Gastroenterol, 2018, 24: 2661-2672. DOI:10.3748/wjg.v24.i25.2661 |
| [15] |
Zhang HG, Jia RC, Wang FJ, et al. Catalpol protects mice against lipopolysaccharide/D-galactosamine-induced acute liver injury through inhibiting inflammatory and oxidative response[J]. Oncotarget, 2018, 9: 3887-3894. DOI:10.18632/oncotarget.23242 |
| [16] |
Zhu HF, Shao Y, Qin L, et al. Catalpol enhances neurogenesis and inhibits apoptosis of new neurons via BDNF, but not the BDNF/Trkb pathway[J]. Drug Des Devel Ther, 2019, 13: 4145-4157. DOI:10.2147/DDDT.S223322 |
| [17] |
Tian X, Ru Q, Xiong Q, et al. Catalpol attenuates hepatic steatosis by regulating lipid metabolism via AMP-activated protein kinase activation[J]. Biomed Res Int, 2020, 2020: 6708061. |
| [18] |
Tian X, Xiong Q, Chen L, et al. Intervention of catalpol on high-fat diet induced nonalcoholic fatty liver disease in mice[J]. Acta Acad Med Sin (中国医学科学院学报), 2019, 41: 746-755. |
| [19] |
Tilg H, Moschen AR. Evolution of inflammation in nonalcoholic fatty liver disease: the multiple parallel hits hypothesis[J]. Hepatology, 2010, 52: 1836-1846. DOI:10.1002/hep.24001 |
| [20] |
Zhang J, Zhang H, Deng X, et al. Baicalin attenuates non-alcoholic steatohepatitis by suppressing key regulators of lipid metabolism, inflammation and fibrosis in mice[J]. Life Sci, 2018, 192: 46-54. DOI:10.1016/j.lfs.2017.11.027 |
| [21] |
Shi T, Yang X, Zhou H, et al. Activated carbon N-acetylcysteine microcapsule protects against nonalcoholic fatty liver disease in young rats via activating telomerase and inhibiting apoptosis[J]. PLoS One, 2018, 13: e0189856. DOI:10.1371/journal.pone.0189856 |
| [22] |
Schwarz DS, Blower MD. The endoplasmic reticulum: structure, function and response to cellular signaling[J]. Cell Mol Life Sci, 2016, 73: 79-94. DOI:10.1007/s00018-015-2052-6 |
| [23] |
Liu Z, Shi Q, Song X, et al. Activating transcription factor 4(ATF4)-ATF3-C/EBP homologous protein (CHOP) cascade shows an essential role in the ER stress-induced sensitization of tetrachlorobenzoquinone-challenged PC12 cells to ROS-mediated apoptosis via death receptor 5(DR5) signaling[J]. Chem Res Toxicol, 2016, 29: 1510-1518. DOI:10.1021/acs.chemrestox.6b00181 |
| [24] |
Chen Y, Gui D, Chen J, et al. Down-regulation of PERK-ATF4-CHOP pathway by astragaloside Ⅳ is associated with the inhibition of endoplasmic reticulum stress-induced podocyte apoptosis in diabetic rats[J]. Cell Physiol Biochem, 2014, 33: 1975-1987. DOI:10.1159/000362974 |
| [25] |
Woo CW, Kutzler L, Kimball SR, et al. Toll-like receptor activation suppresses ER stress factor CHOP and translation inhibition through activation of eIF2B[J]. Nat Cell Biol, 2012, 14: 192-200. DOI:10.1038/ncb2408 |
| [26] |
Chen MT, Huang RL, Ou LJ, et al. Pollen typhae total flavone inhibits endoplasmic reticulum stress-induced apoptosis in human aortic-vascular smooth muscle cells through down-regulating PERK-eIF2alpha-ATF4-CHOP pathway[J]. Chin J Integr Med, 2019, 25: 604-612. DOI:10.1007/s11655-019-3052-4 |
| [27] |
Gorman AM, Healy SJ, Jager R, et al. Stress management at the ER: regulators of ER stress-induced apoptosis[J]. Pharmacol Ther, 2012, 134: 306-316. DOI:10.1016/j.pharmthera.2012.02.003 |
| [28] |
Madhusudhan T, Wang H, Dong W, et al. Defective podocyte insulin signalling through p85-XBP1 promotes ATF6-dependent maladaptive ER-stress response in diabetic nephropathy[J]. Nat Commun, 2015, 6: 6496. DOI:10.1038/ncomms7496 |
| [29] |
Yang Y, Liu L, Naik I, et al. Transcription factor C/EBP homologous protein in health and diseases[J]. Front Immunol, 2017, 8: 1612. DOI:10.3389/fimmu.2017.01612 |
| [30] |
Urano F, Wang X, Bertolotti A, et al. Coupling of stress in the ER to activation of JNK protein kinases by transmembrane protein kinase IRE1[J]. Science, 2000, 287: 664-666. DOI:10.1126/science.287.5453.664 |
| [31] |
Li Y, Jiang W, Niu Q, et al. eIF2alpha-CHOP-BCl-2/JNK and IRE1alpha-XBP1/JNK signaling promote apoptosis and inflammation and support the proliferation of Newcastle disease virus[J]. Cell Death Dis, 2019, 10: 891. DOI:10.1038/s41419-019-2128-6 |
| [32] |
Zhou L, Tan JH, Cao RC, et al. ATF6 regulates the development of chronic pancreatitis by inducing p53-mediated apoptosis[J]. Cell Death Dis, 2019, 10: 662. DOI:10.1038/s41419-019-1919-0 |
| [33] |
Zhou X, Lu B, Fu D, et al. Huoxue Qianyang decoction ameliorates cardiac remodeling in obese spontaneously hypertensive rats in association with ATF6-CHOP endoplasmic reticulum stress signaling pathway regulation[J]. Biomed Pharmacother, 2020, 121: 109518. DOI:10.1016/j.biopha.2019.109518 |
| [34] |
Hirsova P, Ibrahim SH, Gores GJ, et al. Lipotoxic lethal and sublethal stress signaling in hepatocytes: relevance to NASH pathogenesis[J]. J Lipid Res, 2016, 57: 1758-1770. DOI:10.1194/jlr.R066357 |
| [35] |
Volmer R, van der Ploeg K, Ron D. Membrane lipid saturation activates endoplasmic reticulum unfolded protein response transducers through their transmembrane domains[J]. Proc Natl Acad Sci U S A, 2013, 110: 4628-4633. DOI:10.1073/pnas.1217611110 |
| [36] |
Weiss TS, Lupke M, Ibrahim S, et al. Attenuated lipotoxicity and apoptosis is linked to exogenous and endogenous augmenter of liver regeneration by different pathways[J]. PLoS One, 2017, 12: e0184282. DOI:10.1371/journal.pone.0184282 |
| [37] |
Lee HJ, Cui R, Choi SE, et al. Bitter melon extract ameliorates palmitate-induced apoptosis via inhibition of endoplasmic reticulum stress in HepG2 cells and high-fat/high-fructose-diet-induced fatty liver[J]. Food Nutr Res, 2018, 62: 1319. |
 2021, Vol. 56
2021, Vol. 56


