2. 中国医学科学院、北京协和医学院药物研究所, 活性物质发现与适药化研究北京市重点实验室, 北京 100050
2. Beijing Key Laboratory of Active Substance Discovery and Druggability Evaluation, Institute of Materia Medica, Chinese Academy of Medical Sciences and Peking Union Medical College, Beijing 100050, China
尿酸(uric acid, UA) 是嘌呤代谢的终产物。体内尿酸合成过多或经肾脏、肠道排泄减少, 均可导致血尿酸水平升高, 造成高尿酸血症(hyperuricemia, HUA)[1]。临床上, 男性与女性血尿酸浓度分别高于7与6 mg·dL-1时诊断为高尿酸血症。一般认为, 高尿酸血症易造成尿酸在体内形成尿酸盐结晶, 沉积于关节腔中, 发展为痛风, 是痛风发病的生化基础[2]。而近年来的研究表明, 高尿酸血症还与代谢综合征、心脑血管疾病、慢性肾病等疾病的进展密切相关[3-5]。有效治疗高尿酸血症对降低以上疾病的发病风险有重要作用。目前, 治疗高尿酸血症的机制主要分为两类——降低尿酸合成与促进尿酸排泄。其中, 体内约2/3尿酸经由肾脏排泄, 目前临床使用的促排药物主要通过调节尿酸盐转运体1 (urate transporter 1, URAT1)、葡萄糖转运体9 (glucose transporter 9, GLUT9) 等肾脏尿酸转运体活性而达到促进尿酸排泄的作用, 如苯溴马隆、雷西纳德等[6, 7]。
作为尿酸生成的催化酶, 黄嘌呤氧化酶(xanthine oxidase, XOD) 催化次黄嘌呤氧化成为黄嘌呤, 并进一步氧化生成尿酸, 并且在此氧化反应过程中, 过氧化物(reactive oxygen species, ROS) 作为副产物生成, 引起氧化应激, 对组织产生损害[7]。因此, 抑制XOD在减少尿酸生成的同时, 减少了ROS生成, 对高尿酸血症可能引起的其他组织损伤产生了保护作用。目前, 以XOD为靶点的临床一线药物有非布索坦(febuxostat, FBX)、别嘌呤醇等。其中, FBX较别嘌呤醇有更高效的XOD抑制作用, 然而近期临床研究发现其可能增加心血管疾病的病死风险[8]。新型XOD抑制剂的研发十分必要。
针对XOD为靶点, 在前期工作中作者经计算机辅助模拟设计合成并通过筛选发现了对体外XOD有抑制作用的化合物CC18022。本研究进一步对CC18022的体外XOD抑制活性及其在小鼠高尿酸血症模型中的药效进行了探索, 为CC18022作为新型抗高尿酸血症药物的后续研发提供了实验基础。
材料与方法主要试剂及材料 牛奶来源XOD、次黄嘌呤(hypoxanthine, HA) 和黄嘌呤(xanthine, XA) (德国默克Sigma-Aldrich公司); 羧甲基纤维素钠(sodium carboxymethyl cellulose, CMCS, 国药集团化学试剂有限公司); 氧嗪酸钾(oteracil potassium, OP, 美仑生物公司); FBX (日本TCI公司); 化合物CC18022由中国医学科学院药物研究所肖志艳研究员课题组合成, 并进行结构鉴定; XOD活性测定试剂盒和肌酐试剂盒(南京建成生物科技有限公司); 尿酸测定试剂盒、谷丙转氨酶(alanine aminotransferase, ALT) 活性测定试剂盒、谷草转氨酶(aspartate aminotransferase, AST) 活性测定试剂盒和尿素试剂盒(北京中生北控生物技术有限公司)。
仪器 低温高速离心机(德国Heraeus公司); pH计(瑞士METTLER TOLEDO公司); HYG-A型全温空气恒温震荡器(江苏太仓科教仪器厂); 酶标仪(美国Bio Tek公司)。
分子对接分析 采用MOE 2018.01软件包来产生分子结构和进行分子模拟, 采用DS 2016生成对接图。选取共晶配体为托吡司他的PDB结构1V97作为对接受体。活性位点采用Site Finder程序来定义, 托吡司他的复位对接RMSD值为1.56 Å。采用打分函数London DG和GBVI/WSA DG来优选对接构象。
体外XOD活性实验 以3 U·L-1 XOD, 50 μmol·L-1底物XA, pH 7.4为反应体系, 加入不同浓度的化合物CC18022, 于37 ℃恒温反应20 min, 使用酶标仪在293 nm波长读取吸光度A值, 通过GraphPad Prism 8进行数据分析, 采用Sigmoidal dose-response (variable slope) 拟合计算半数抑制浓度(half maximal inhibitory concentration, IC50)。
动物 雄性ICR小鼠初始体质量18~22 g [北京维通利华生物科技股份有限公司(SCXK (京) 2016-0006)]。动物饲养于中国医学科学院药物研究所实验动物管理中心, 饲养温度为22~25 ℃, 湿度为40%~60%, 光照/黑暗时间各12 h交替, 并给予小鼠自由进食及饮水。所有动物实验按标准操作规程操作, 经过中国医学科学院药物研究所实验动物管理与动物福利委员会审核并批准。
HA-OP-HUA小鼠模型 将小鼠随机分为正常对照A组(Con-A)、模型A组(HUA-A)、非布索坦A组(FBX-A) 和CC18022低剂量A (CC18022-L-A)、中剂量A (CC18022-M-A)、高剂量A (CC18022-H-A) 组, 每组10只。模型A组及各给药组小鼠均单次灌胃500 mg·kg-1 HXA、腹腔注射300 mg·kg-1 OP造成急性高尿酸血症, HUA-A组与FBX-A组小鼠另分别灌胃给予纯水与FBX 5 mg·kg-1。量效实验设置CC18022低、中、高剂量A组, 分别灌胃化合物CC18022 0.2、1和5 mg·kg-1。分别于给药造模后0、1、2、4 h时尾尖取血, 测定小鼠血尿酸水平。于4 h后处死小鼠, 迅速取出小鼠心脏、肺脏、肝脏、脾脏、小肠和肾脏于-80 ℃冰箱保存, 用于测定各组织XOD活性。取全血用于检测血清XOD活性。
OP-HUA小鼠模型 将小鼠随机分为对照B组(Con-B) 与OP-HUA造模组。其中, Con-B组小鼠每天皮下注射溶剂0.5% CMCS混悬液, OP-HUA造模组小鼠每天皮下注射OP 300 mg·kg-1, 连续诱导14天。将血尿酸水平稳定升高的小鼠挑出, 随机分为模型B组(HUA-B)、非布索坦B组(FBX-B) 和CC18022低剂量B (CC18022-L-B)、中剂量B (CC18022-M-B)、高剂量B (CC18022-H-B) 组, 每组8只, 分别灌胃给予纯水、FBX 1 mg·kg-1和化合物CC18022 0.1、0.5和1 mg·kg-1。于给药6天后尾尖取血, 测定小鼠血尿酸水平。
血清XOD活性、尿酸、ALT、AST、肌酐、尿素水平测定 取血后3 500 r·min-1离心4 min, 将上层血清取出, 于-80 ℃冰箱保存。测定时根据试剂盒说明书进行操作。
组织XOD活性测定 将取出的组织称重, 按试剂盒说明书指导, 以一定比例加入预冷的生理盐水, 机械匀浆, 离心后取上清测定各组织XOD活性, BCA (bicinchoninic acid) 法测定蛋白浓度进行校准。
组织苏木精-伊红(hematoxylin and eosin, H & E)染色 处死小鼠时将一小叶肝脏、一侧肾脏固定于4%多聚甲醛中, 脱水后进行石蜡包埋, 切片, 根据标准步骤进行H & E染色。
统计学分析 实验数据均以x ± SEM (standard error of mean) 表示, 应用GraphPad Prism 8统计软件进行统计分析和IC50计算, 采用one-way ANOVA进行多组间分析, P < 0.05认为具有统计学差异。
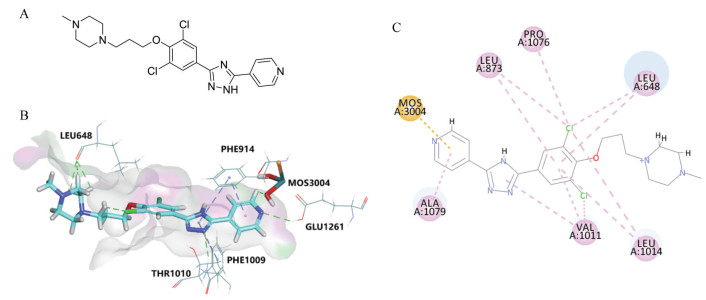
结果 1 CC18022与XOD的分子对接分析通过MOE软件包产生XOD的化学结构并与CC18022 (化学结构如图 1A) 进行分子对接分析, 探索二者的结合模式。结果显示, CC18022的吡啶环深入XOD疏水通道内部与钼喋呤区域结合, 吡啶环上的氮及其邻位氢分别与钼喋呤羟基及GLUT1261产生氢键相互作用。吡啶环、三氮唑及苯环占据XOD疏水空腔, 与PHE914、PHE1009、ALA1078、ALA1079、VAL1011、LEU1014、PRO1076和LEU648形成广泛疏水作用, 三氮唑上的氮与SER876也存在氢键相互作用。另外, 其吗啉环延伸至XOD疏水通道外部, 与LEU648发生氢键相互作用(图 1B、C)。
|
Figure 1 The interaction between CC18022 and xanthine oxidase (XOD). Molecular structure of CC18022 was shown (A). Binding mode of CC18022 was revealed by molecular docking (PDB code: 1V97). Hydrogen bond interactions and π-π interactions were shown as green and purple dotted lines, respectively (B). Hydrophobic interactions were shown as pink dotted lines (C) |
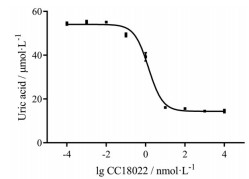
以黄嘌呤为反应底物, 牛奶来源的XOD酶作为催化剂, 在恒定温度、时间和pH环境下进行反应, 于特定波长下检测生成尿酸的水平, 对CC18022的体外XOD抑制活性进行初筛, 发现1×104 nmol·L-1 CC18022对XOD的抑制率为(106.0 ± 1.7)%, 同体系下100 nmol·L-1 FBX的XOD活性抑制率为(98.8 ± 1.6)%。接下来, 分别从1×10-4~1×104 nmol·L-1以10倍浓度梯度递增作为终浓度加入CC18022, 拟合得到尿酸-药物浓度曲线, 并计算IC50。结果表明, CC18022对牛奶来源的XOD酶活性具有显著抑制作用, IC50达到1.4 nmol·L-1 (图 2), 说明CC18022针对XOD为靶点, 在体外具有较强的抑制活性。
|
Figure 2 The XOD-catalyzed uric acid synthesis curve with different doses of CC18022 |
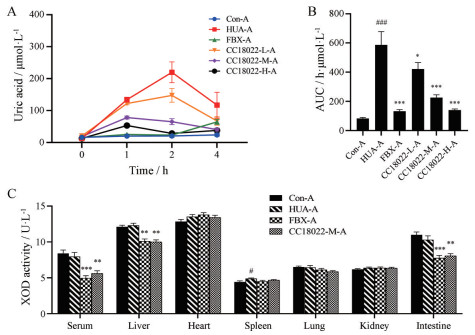
利用HA-OP-HUA小鼠模型研究CC18022在体内的抗高尿酸血症药效。HA-OP-HUA小鼠由单次皮下注射OP合并单次灌胃次黄嘌呤诱导形成。于造模0、1、2和4 h后检测小鼠血尿酸水平, 得到血尿酸-时间曲线(图 3A)。结果显示, 造模后模型对照HUA-A组小鼠血尿酸水平逐渐升高, 于2 h血尿酸水平达到峰值, 相比正常对照Con-A组升高约964.0%, 并于4 h回落。单次给药5 mg·kg-1 FBX可使2 h血尿酸水平较HUA-A组显著下降约89.4%。而CC18022在0.2、1和5 mg·kg-1三个剂量条件下单次给药, 可分别相比HUA-A组2 h血尿酸降低约32.9%、70.4%和87.0%。HUA-A组的曲线下面积(area under curve, AUC) 较Con-A组升高约604.8%, 单次给药5 mg·kg-1 FBX使其显著降低约77.5%, CC18022-L-A、-M-A、-H-A组较HUA-A组的AUC均显著降低, 抑制率分别为28.3%、61.6%和76.1% (图 3B)。
|
Figure 3 Effects of CC18022 on uric acid levels and tissue-specific XOD activity in HA-OP-HUA mice model. The serum uric acid level was measured after the induction at 0, 1, 2, and 4 h, respectively (A). The area under curve (AUC) was analyzed (B). XOD activities of serum, liver, heart, spleen, lung, kidney, and intestine were evaluated (C). n = 10, x ± SEM. #P < 0.05, ###P < 0.001 vs Con-A; *P < 0.05, **P < 0.01, ***P < 0.001 vs HUA-A. HA-OP-HUA: Hypoxanthine-oteracil potassium-hyperuricemia; Con-A: Control group; HUA-A: HA-OP-HUA group; FBX-A: 5 mg·kg-1 febuxostat group; CC18022-L-A, -M-A, and -H-A: 0.2, 1, and 5 mg·kg-1 CC18022 groups, respectively |
为进一步探究CC18022在体内对XOD活性的抑制作用, 选取中剂量CC18022-M-A组, 检测其对HA-OP-HUA小鼠的血清及肝脏、心脏、脾脏、肺脏、肾脏、小肠等组织中XOD活性的影响。其中, HUA-A组血清及各组织XOD活性较Con-A组基本没有明显变化, 肝脏、心脏、脾脏、肾脏XOD活性较Con-A组分别升高约1.7%、5.5%、10.7%、3.1%, 血清、肺脏、小肠较Con-A组XOD活性分别下降约4.8%、0.2%、6.3%; FBX-A与CC18022-M-A在血清、肝脏和小肠中均对XOD活性产生显著抑制作用, 二者抑制率分别为37.8%与29.6%、17.9%与18.9%、24.5%与21.7% (图 3C)。
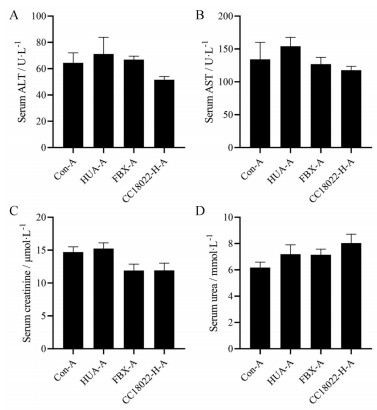
随后, 通过检测血清ALT、AST活性, 以及血清肌酐、尿素水平, 对5 mg·kg-1高剂量CC18022在HA-OP-HUA小鼠模型中对肝肾功能的影响进行了初步评价。与HUA-A组比较, CC18022-H-A组血ALT、AST、肌酐和尿素指标在各组间没有显著差异(图 4)。对各组小鼠的肝、肾组织进行H & E染色, 发现各组小鼠的肝、肾组织结构均无显著异常(图 5)。
|
Figure 4 Effects of CC18022 on liver and kidney function in HA-OP-HUA mice. Mice serum alanine aminotransferase (ALT, A), aspartate aminotransferase (AST, B), creatinine (C), and urea (D) levels were measured after 4 h of induction. n = 10, x ± SEM |

|
Figure 5 Effects of CC18022 on liver and kidney structures in HA-OP-HUA mice. Mice livers and kidneys were collected and applied for hematoxylin and eosin (H & E) staining after 4 h of induction. Liver and kidney structures were observed under microscope (×200). Scale bar: 50 μm |
OP-HUA小鼠模型由连续多次皮下注射OP诱导形成。成模后分别以1 mg·kg-1 FBX, 0.1、0.5和1 mg·kg-1 CC18022分组给药, 给药6天后, 各组血尿酸水平如图 6所示, HUA-B组血尿酸显著升高约56.2%, FBX-B组较HUA-B组显著降低约96.0%。而CC18022-L-B、-M-B和-H-B组血尿酸水平较HUA-B组分别降低约89.1%、88.4%和93.2%。

|
Figure 6 Effect of CC18022 on serum uric acid level in OP-HUA mice model. The serum uric acid level was evaluated after FBX or different doses of CC18022 was administrated for 24 h in OP-HUA mice. n = 8, x ± SEM. ##P < 0.01 vs Con-B; ***P < 0.001 vs HUA-B. OP-HUA: Oteracil potassium-hyperuricemia; Con-B: Control group; HUA-B: OP-HUA group; FBX-B: 1 mg·kg-1 febuxostat group; CC18022-L-B, -M-B, and -H-B: 0.1, 0.5, and 1 mg·kg-1 CC18022 groups, respectively |
嘌呤代谢紊乱和尿酸排泄降低是引发高尿酸血症的重要因素。XOD在嘌呤代谢生成终产物尿酸的过程中作为关键催化酶, 成为抗高尿酸血症的重要靶点。
本研究以XOD为靶点, 计算机辅助设计合成与XOD活性区域钼喋呤形成氢键结合并在XOD疏水空腔中形成广泛疏水作用的化合物CC18022, 于体外进行XOD活性抑制实验, 发现CC18022对体外XOD有明显抑制作用, IC50达到1×10-9 mol·L-1数量级。根据已有研究的结果, 临床一线药物XOD抑制剂FBX在同体系下对XOD的IC50同样在1×10-9 mol·L-1数量级[9], 说明CC18022在体外具有与FBX相当的强XOD抑制性。
为验证CC18022在体内的药效, 作者分别利用了HA-OP-HUA与OP-HUA两种小鼠模型, 二者分别具有血尿酸水平一过性升高和“长”期稳定升高的特点。HA-OP-HUA高尿酸血症模型通过增加底物HA促进尿酸生成, 并通过尿酸酶抑制剂OP抑制尿酸分解为尿囊素, 达到迅速升高血尿酸水平的效果。在此模型中, CC18022剂量依赖性地降低了小鼠血尿酸水平, 最低有效剂量达到0.2 mg·kg-1, 且CC18022-H-A (5 mg·kg-1) 与FBX-A (5 mg·kg-1) 组较模型组血尿酸水平分别降低76.1%和77.5%, 效果基本相当。OP-HUA模型由多日连续给予OP使尿酸分解减少而在体内堆积形成。对尿酸稳定升高的小鼠连续给药6天后, CC18022三个剂量组小鼠血尿酸均显著降低并具一定剂量依赖性。以上结果说明, CC18022在高尿酸血症小鼠模型中可显著降低血尿酸水平, 与阳性药FBX在同剂量下效果相当, 并具有良好的剂量依赖性。对肝肾功能指标的检测和H & E染色结果说明, CC18022在最高使用剂量(5 mg·kg-1) 时, 对HA-OP-HUA小鼠肝肾功能没有显著影响。
作者还探究了CC18022在体内对XOD活性的抑制作用(HA-OP-HUA小鼠模型)。XOD在全身各组织中均有分布, 在心脏、肝脏、小肠中较高, 脾脏、肺脏和肾脏中较低。结果发现在血清、小肠与肝脏中, CC18022与FBX均表现出显著的XOD抑制作用, 而小肠与肝脏也分别是嘌呤被吸收与代谢的主要场所[10, 11], 具有较高XOD活性。CC18022可能通过抑制以上高活性组织的XOD活性达到减少尿酸生成, 降低血尿酸水平的效果。
综上所述, 本研究说明CC18022在体外酶学、体内高尿酸血症小鼠模型中均表现出较强的XOD活性抑制作用, 并在体内急性与慢性高尿酸血症小鼠模型中剂量依赖性地发挥降尿酸作用, 相同剂量下的药效不弱于一线临床用药FBX, 其是否可作为新型XOD抑制性药物用于治疗高尿酸血症值得继续深入研究。
作者贡献: 李雪晨、姜楠负责实验设计、完成体内实验和整体数据分析以及撰写文章; 闫祯昕、陈冬婷参与体内实验; 田金英负责体外XOD活性实验; 杨亚军、张露负责CC18022合成、结构鉴定与分子对接分析; 肖志艳参与实验设计与文章审阅; 叶菲负责指导课题与文章审阅。
利益冲突: 所有作者均声明不存在利益冲突。
| [1] |
Li Q, Li X, Wang J, et al. Diagnosis and treatment for hyperuricemia and gout: a systematic review of clinical practice guidelines and consensus statements[J]. BMJ Open, 2019, 9: e026677. DOI:10.1136/bmjopen-2018-026677 |
| [2] |
Dalbeth N, Choi HK, Joosten LAB, et al. Gout[J]. Nat Rev Dis Primers, 2019, 5: 69. DOI:10.1038/s41572-019-0115-y |
| [3] |
King C, Lanaspa MA, Jensen T, et al. Uric acid as a cause of the metabolic syndrome[J]. Contrib Nephrol, 2018, 192: 88-102. |
| [4] |
Zhang S, Wang Y, Cheng J, et al. Hyperuricemia and cardiovascular disease[J]. Curr Pharm Des, 2019, 25: 700-709. DOI:10.2174/1381612825666190408122557 |
| [5] |
Mallat SG, Al Kattar S, BY Tanios, et al. Hyperuricemia, hypertension, and chronic kidney disease: an emerging association[J]. Curr Hypertens Rep, 2016, 18: 74. DOI:10.1007/s11906-016-0684-z |
| [6] |
Gliozzi M, Malara N, Muscoli S, et al. The treatment of hyperuricemia[J]. Int J Cardiol, 2016, 213: 23-27. DOI:10.1016/j.ijcard.2015.08.087 |
| [7] |
Wang YC, Yang YJ, Hou XX, et al. Design, synthesis and biological evaluation of inhibitors of urate transporter 1(URAT1)[J]. Acta Pharm Sin (药学学报), 2019, 54: 1069-1074. |
| [8] |
White WB, Saag KG, Becker MA, et al. Cardiovascular safety of febuxostat or allopurinol in patients with gout[J]. N Engl J Med, 2018, 378: 1200-1210. |
| [9] |
Yan ZX, Yin F, Li XC, et al. Establishment of a screening system for xanthine oxidase (XOD) inhibitors[J]. Chin Pharmacol Bull (中国药理学通报), 2019, 35: 1471-1477. |
| [10] |
Ansari A, Aslam Z, De Sica A, et al. Influence of xanthine oxidase on thiopurine metabolism in Crohn's disease[J]. Aliment Pharmacol Ther, 2008, 28: 749-757. DOI:10.1111/j.1365-2036.2008.03768.x |
| [11] |
Linden J, Koch-Nolte F, Dahl G. Purine release, metabolism, and signaling in the inflammatory response[J]. Annu Rev Immunol, 2019, 37: 325-347. DOI:10.1146/annurev-immunol-051116-052406 |
 2021, Vol. 56
2021, Vol. 56


