2. 中国药科大学生物药物学院, 江苏 南京 211198;
3. 常州南京大学高新技术研究院和江苏靶标生物医药研究所, 江苏 常州 213164
2. College of Biopharmaceuticals, China Pharmaceutical University, Nanjing 211198, China;
3. High-Tech Research Institute of Nanjing University at Changzhou and Jiangsu Target Pharma Laboratories Inc., Changzhou 213164, China
减毒型沙门氏菌VNP20009被用来抗肿瘤已被多篇文献报道, 其不仅可利用自身毒性抗肿瘤[1, 2], 还可作为载体携带质粒和小发夹RNA (short hairpin RNA, shRNA)。通过VNP20009所携带的质粒表达的外源蛋白[例如内皮抑素(endostain)[3]、肿瘤坏死因子相关凋亡诱导配体(tumor necrosis factor-related apoptosis-inducing ligand, TRAIL)[4]和C末端截短型Fas相关死亡域蛋白(C-terminal tail Fas associated via death domain, N-FADD)[5]等] 具有很好抗肿瘤作用。除了在动物模型上验证到良好的抗肿瘤作用外[6], VNP20009已作为抗癌药物进行了临床Ⅰ期的验证[7]。目前围绕VNP20009的研究主要集中于抗肿瘤活性药效学, 其微生物学特点未被仔细研究, 将妨碍人们对该菌株特性的深入认识和了解, 并将限制其应用和转化。为了更好利用VNP20009, 对其进行基础生物学研究是必要的。
细菌生物膜是细菌聚集后形成的黏稠状结构, 该结构可形成自我保护机制, 保护细菌免受外界环境影响。细菌生物膜由细菌、多糖以及细菌分泌物组成, 生物膜中的细菌一般不受环境压力、抗生素[8]、消毒剂和宿主免疫系统[9]的影响。因此细菌生物膜的形成情况与细菌抵御被清除有着密切关系。
本文研究了沙门氏菌VNP20009在不同环境条件(温度、pH值和不同浓度H2O2)的生长状况以及生物膜的形成, 为VNP20009的深入研究及其应用奠定基础和提供理论依据。
材料与方法试剂与仪器 酵母提取物和胰蛋白胨(Oxoid公司); M63培养基缓冲液(合肥博美生物科技公司); 酶标仪(美国Bio Tek公司)、pH仪(瑞士METILER TOLEDO公司)、恒温摇床(上海知楚仪有限公司)、细菌培养箱(德国MEMMERT公司)。
菌株及生长条件 沙门氏菌VNP20009由本实验室保种。将保存于20%甘油(-80 ℃) 的菌种在无抗生素的LB (Luria-Bertani) 琼脂培养基(1%蛋白胨、1% NaCl、0.5%酵母膏和1.5%琼脂粉, 高压灭菌) 进行过夜活化, 挑选单克隆菌接种于LB液体培养基过夜培养后, 按1∶100比例接种于LB培养基, 37 ℃、220 r·min-1培养至对数生长期(A600: 0.6~0.8), 作为样品菌备用。评价VNP20009在3种条件下的生长及细菌生物膜形成: ①温度(37、42和45 ℃); ② pH值(7.0、5.0、6.5和8.5); ③ H2O2 (0、1、1.5、2、2.5和5 mmol·L-1)。
细菌生长曲线的测量 使用酶标仪连续24 h检测不同条件下VNP20009的生长曲线。将样品菌按1%接种量接种于不同条件(pH值、H2O2)的LB培养基中, 每孔加入200 μL菌液至96孔板, 5孔重复, 于37、42和45 ℃连续检测。通过GraphPad Prism 8.0软件, 采用修改的Gompertz模型[10]拟合生长曲线, 公式如下:
| $ y=A+C \exp \left\{-\exp \left[\frac{\mu_{m}}{A}(\lambda-t)+1\right]\right\} $ | (1) |
其中, A: 细菌初始数量; C: 细菌初始数量和最大数量之间的差值; μm: 最大比生长率; λ: 菌株生长滞后时间。将获得的A值和培养时间的数据分别代入上述公式中的y和t, 得到生长拟合曲线。
不同环境条件的细菌菌落形成测试
温度和pH值应激: 样品菌连续10倍稀释, 每个稀释浓度取2 μL点于LB琼脂培养基上, 分别于37、42和45 ℃静置培养12 h。pH值分别为5.0、6.5和8.5, 以pH 7.0的标准LB培养基作为对照, 37 ℃培养12 h。
H2O2应激: 样品菌按1%接种至含H2O2 (0、1、1.5、2、2.5和5 mmol·L-1) 的LB培养基中, 室温静置处理3 h, 分别进行连续10倍稀释, 每个稀释浓度取2 μL点于LB琼脂培养基上, 37 ℃静置培养12 h。
细菌存活率统计: 将1×10-4稀释水平的菌液(2 μL) 于不同条件下培养12 h后进行菌落统计, 每个条件5次重复。
细菌生物膜生成 通过评估细菌细胞在玻璃管上的黏附性, 检测生物膜的形成[11]。①将VNP20009样品菌接种至5 mL新鲜生物膜诱导培养基(上述实验条件的LB培养基中添加5×M63培养基), 分别于37、42或45 ℃、110 r·min-1培养36 h; ②弃菌液, 用去离子水洗去结合松散的细菌, 室温下用1%结晶紫溶液染色30 min后, 在气液交界处出现紫环状生物膜。用去离子水清洗至试管流出液为无色, 倒置烘干; ③用Image J软件对试管上形成的紫色生物膜进行定量分析。
统计学分析 所有数据结果均用GraphPad Prism 8.0统计软件表示成平均值±标准误[mean ± SEM (standard error of mean)], 两组间差异性分析用t检验, P < 0.05表示具有显著性差异。使用GraphPad Prism 8.0对数据进行作图。
结果 1 温度对VNP20009生长的影响如图 1A所示, 在42 ℃时, VNP20009的生长与37 ℃时相比没有显著性差异; 在45 ℃时, 其生长显著减缓。
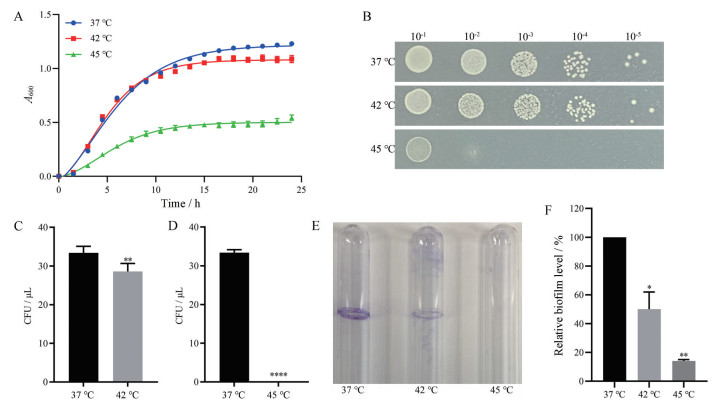
|
Figure 1 Growth and biofilm formation of VNP20009 at different temperatures. A: Growth curves of VNP20009 at optical density of 600 nm; B: Colony tolerance at different temperatures; C: Survival rate of VNP20009 at 42 ℃; D: Survival rate of VNP20009 at 45 ℃. n = 5, mean ± standard error of mean (SEM). Colony-forming unit (CFU) is a unit used in microbiology to estimate the number of viable bacteria or fungal cells in a sample; E: Determination of the biofilm formation of VNP20009 at different temperatures by crystal violet (CV) staining in glass tubes; F: Biofilm was quantified by ImageJ software. n = 3, mean ± SEM. *P < 0.05, **P < 0.01, ****P < 0.000 1 vs 37 ℃ |
为进一步评价不同温度下VNP20009的生长, 统计了不同温度下VNP20009的菌落形成情况(图 1B) 并分析了温度对细菌存活的影响(图 1C、D)。在42 ℃时, 细菌存活率为85.6%, 当暴露于45 ℃时, 存活率为0。
通过评估细菌细胞在玻璃管上的黏附性来检测生物膜的形成, 当在玻璃管中进行细菌培养时, 会在气液交界形成一圈生物膜, 通过结晶紫染色可使其显现。如图 1E所示, 随着温度的升高, 细菌生物膜的形成量逐渐减少, 与37 ℃组相比存在显著差异(图 1F)。
2 pH值对VNP20009生长的影响在37 ℃条件下, 考察pH值对VNP20009生长的影响。结果显示(图 2A), 在pH 6.5~8.5内, VNP20009的生长没有明显差异。但在pH 5.0条件下, VNP20009生长慢于对照组(pH 7.0), 表明VNP20009的生长受到抑制。
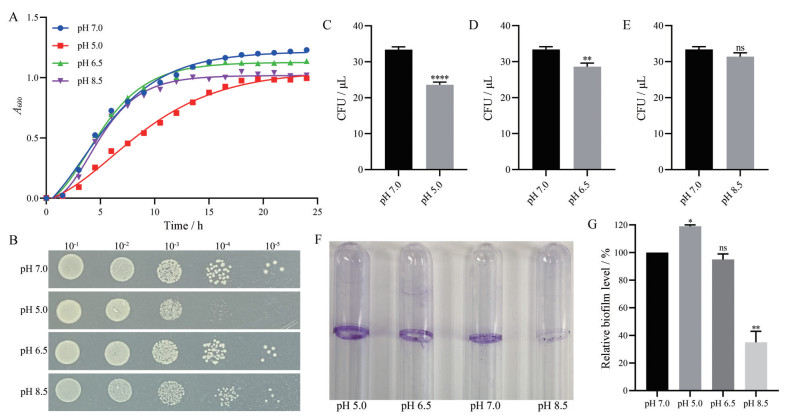
|
Figure 2 Growth and biofilm formation of VNP20009 at pH values. A: Growth curves of VNP20009 at optical density of 600 nm; B: Colony tolerance at different pH values; C-E: Survival rate of VNP20009 at different pH values. n = 5, mean ± SEM; F: Determination of the biofilm formation of VNP20009 at different pH values by CV staining in glass tubes; G: Biofilm was quantified by ImageJ software. n = 3, mean ± SEM. *P < 0.05, **P < 0.01, ****P < 0.000 1 vs pH 7.0. ns: Not significant |
在不同pH条件下, VNP20009的存活率受到影响。当pH值为5时, 细菌存活率为70.7%; pH值为6.5时, 细菌存活率85.6%。而pH值增大到8.5时, 细菌存活率与对照组没有显著性差异, 但菌落面积减小(图 2B~E)。
pH值是细菌生物膜形成的一个重要影响因素。如图 2F所示, pH 7.0时能形成较多的生物膜, 但在pH 5.0时, 生物膜形成量达到最大, pH 8.5时, 生物膜形成量减少, 两者均与pH 7.0时的形成量存在显著差异(图 2G)。
3 H2O2对VNP20009生长的影响本文同时探究了过氧化条件对VNP20009的生长影响。结果表明(图 3A), H2O2对VNP20009的生长有影响。随着H2O2浓度的增加(1.5~2.5 mmol·L-1), VNP20009的生长逐渐减缓直至完全不生长(5 mmol·L-1)。VNP20009可在低浓度H2O2 (1 mmol·L-1) 条件下存活, 生长没有影响。
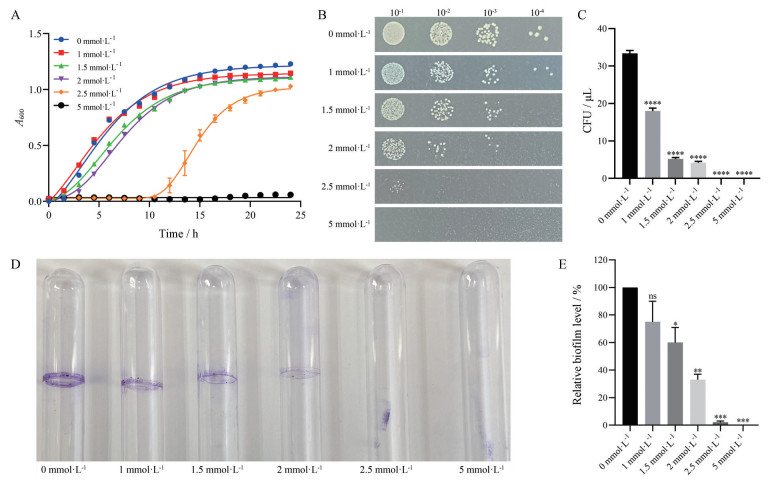
|
Figure 3 Growth and biofilm formation of VNP20009 at different H2O2 concentrations. A: Growth curve of VNP20009 at optical density of 600 nm; B: Colony tolerance at different H2O2 concentrations; C: Survival rate of VNP20009 at different H2O2 concentrations. n = 5, mean ± SEM; D: Determination of the biofilm formation of VNP20009 at different H2O2 concentrations by CV staining in glass tubes; E: Biofilm was quantified by ImageJ software. n = 3, mean ± SEM. *P < 0.05, **P < 0.01, ***P < 0.001, ****P < 0.000 1 vs 0 mmol·L-1 group |
如图 3B所示, 在不同浓度H2O2下, VNP20009的生长受到不同程度的抑制。随着H2O2浓度的增加, 细菌存活率逐渐下降(图 3C)。添加1~2 mmol·L-1 H2O2时, 细菌存活率从53.9%下降至12.6%, 当H2O2浓度达到2.5 mmol·L-1时, 细菌存活率为0。
H2O2处理后, 细菌生物膜形成量与生长表现出一致的趋势(图 3D、E), 1 mmol·L-1 H2O2对生物膜形成影响并不显著, 当含量为1.5 mmol·L-1时出现了显著性差异, 持续增加H2O2含量, 则完全不生成生物膜。
讨论减毒沙门氏菌VNP20009作为抗肿瘤药物已开展临床Ⅰ期研究, 一直未进入临床Ⅱ期试验阶段, 其临床前研究主要集中于药效学研究。本文探究VNP20009的微生物学特征与其作为抗肿瘤药物应用是否一致, 以期为其改造和应用于抗肿瘤提供指导。
肿瘤微环境呈弱酸性(~pH 6.5)[12], 本实验所测试的偏酸性环境中, 在pH 5.0时, VNP20009虽生长显著减缓, 但其存活率大于70%; pH 6.5时, 细菌生长无显著变化, 存活率达到85%以上, 表明VNP20009可在弱酸性环境中生存和复制。细菌生物膜是细菌在恶劣环境中的自我保护机制, 由活细菌和一些多糖组成, 处于生物膜中的细菌可免受广泛的环境挑战, 包括紫外线辐射、金属毒性、pH值、渗透变化、脱水、宿主免疫反应、抗菌剂和消毒剂等[13]。细菌生物膜可黏附在生物或非生物表面。实验结果显示, 并非所有被测试条件都能产生生物膜, 产生的生物膜也存在量的差异。值得注意的是, 在pH 5.0和6.5时, VNP20009的生物膜形成量较多, 这与其仍保持正常生长相关(尤其是pH 6.5时), 提示在肿瘤微环境中, VNP20009可能形成了较多生物膜将自身保护在膜中。鼠伤寒沙门氏菌SL7207 (ΔhisG, ΔaroA) 可通过生物膜发挥抗肿瘤作用[14], 但作用机制不明。另外, 无乳链球菌生物膜可中断肿瘤细胞转移[15]。综上, 生物膜形成可能对VNP20009的抗肿瘤活性有所帮助。如何增强VNP20009在肿瘤组织内的生物膜形成将为今后VNP20009的改造以及抗肿瘤联合治疗方法的选择提供探索方向。
本研究结果表明, 在37与42 ℃时, 细菌生长无显著差异; 但在45 ℃时, VNP20009生长明显减缓, 说明VNP20009具有一定的耐高温特性。光热疗法(photothermal therapy, PTT)[16]是一种新型癌症治疗技术, 具有较高光热转化效率的材料(photothermal agent, PTA) 靶向性聚集于肿瘤组织附近, 在近红外(near-infrared, NIR) 等外部光源照射下, 将光能转化为热能来杀死癌细胞。为达到理想光热治疗效果, 通常需要将肿瘤组织局部温度升高至50 ℃以上。但如此高的温度可能会损伤肿瘤附近的正常组织器官并限制激光的穿透深度。因此, 为最大限度减少对正常组织的伤害, 温度相对温和(< 45 ℃) 的光热疗法(mild photothermal therapy, MPTT)[17]受到关注。MPTT的安全性增加, 效果却减弱, 将MPTT与其他疗法联用很好弥补了这一不足[18, 19]。本研究证明, 减毒沙门氏菌VNP20009可在较高温度下进行生长繁殖, 有望与光热疗法进行联用, 用其携带PTA, 将有可能发挥更好抑瘤效果。
光动力疗法(photodynamic therapy, PDT) 是将光敏剂递送至肿瘤区域, 在特定激光照射下, 光敏剂与氧气或其他分子发生电子转移, 生成对细胞有伤害的各种活性氧和自由基[17, 20]。与正常细胞相比, 肿瘤细胞内H2O2浓度(10 μmol·L-1~1 mmol·L-1)[21]较高。H2O2可被多种催化剂催化分解产生氧气, 针对这一特点, 多种催化H2O2成为氧气的纳米PDT治疗体系均取得了很好效果[22]。在肿瘤微环境中, H2O2浓度可达到1 mmol·L-1; 在PDT治疗下, 肿瘤组织中H2O2的浓度显著降低[23]。通过研究VNP20009对H2O2浓度的忍耐程度, 发现当H2O2浓度为1 mmol·L-1时, VNP20009生长未出现显著减缓; 大于1 mmol·L-1时, 生长出现显著减缓; 2.5 mmol·L-1时, 生长异常; 5 mmol·L-1时, 完全不生长。该结果为利用VNP20009进行光敏因子的递送, 将细菌治疗与光动力治疗联合提供了实验依据。
在抗肿瘤治疗过程中, VNP20009不仅可自身作为药物来抑制肿瘤, 还可作为载体进行药物递送。临床实践结果表明, 单一疗法的抗肿瘤治疗效果有限, 不同药物或疗法的联合治疗已成为目前临床肿瘤治疗的常用疗法。本文通过体外研究并了解VNP20009的微生物生长特性, 为未来通过与其他方法联合(如与光动力疗法或光热疗法联合治疗) 提供了思路和依据, 为VNP20009达到更好抗肿瘤疗效的应用提供了指导。
作者贡献: 李静和包斐斐对本文进行实验设计; 李静为实验实施者; 华子春进行项目设计、总体规划和实验方案审核及评估; 李静执笔、包斐斐审校、李家璜和华子春对本文进行修改。
利益冲突: 文章内容不涉及相关利益冲突, 无作者署名争议
| [1] |
Broadway KM, Modise T, Jensen RV, et al. Complete genome sequence of Salmonella enterica serovar Typhimurium VNP20009, a strain engineered for tumor targeting[J]. J Biotechnol, 2014, 192: 177-178. DOI:10.1016/j.jbiotec.2014.07.006 |
| [2] |
Jia LJ, Wei DP, Sun QM, et al. Oral delivery of tumor-targeting Salmonella for cancer therapy in murine tumor models[J]. Cancer Sci, 2007, 98: 1107-1112. DOI:10.1111/j.1349-7006.2007.00503.x |
| [3] |
Jia LJ, Xu HM, Ma DY, et al. Enhanced therapeutic effect by combination of tumor-targeting Salmonella and endostatin in murine melanoma model[J]. Cancer Biol Ther, 2005, 4: 840-845. DOI:10.4161/cbt.4.8.1891 |
| [4] |
Chen J, Yang B, Cheng X, et al. Salmonella-mediated tumor-targeting TRAIL gene therapy significantly suppresses melanoma growth in mouse model[J]. Cancer Sci, 2012, 103: 325-333. DOI:10.1111/j.1349-7006.2011.02147.x |
| [5] |
Yang YW, Zhang CM, Huang XJ, et al. Tumor-targeted delivery of a C-terminally truncated FADD (N-FADD) significantly suppresses the B16F10 melanoma via enhancing apoptosis[J]. Sci Rep, 2016, 6: 34178. DOI:10.1038/srep34178 |
| [6] |
Han YH, Lai XH, Le ZW, et al. Anti-tumor effect and impact on tumor immune microenvironment of tumor-targeted Salmonella VNP20009[J]. Acta Pharm Sin (药学学报), 2016, 51: 1417-1422. |
| [7] |
Toso JF, Gill VJ, Hwu P, et al. Phase I study of the intravenous administration of attenuated Salmonella typhimurium to patients with metastatic melanoma[J]. J Clin Oncol, 2002, 20: 142-152. DOI:10.1200/JCO.2002.20.1.142 |
| [8] |
Høiby N, Bjarnsholt T, Givskov M, et al. Antibiotic resistance of bacterial biofilms[J]. Int J Antimicrob Agents, 2010, 35: 322-332. DOI:10.1016/j.ijantimicag.2009.12.011 |
| [9] |
Jensen PØ, Givskov M, Bjarnsholt T, et al. The immune system vs. Pseudomonas aeruginosa biofilms[J]. FEMS Immunol Med Microbiol, 2010, 59: 292-305. DOI:10.1111/j.1574-695X.2010.00706.x |
| [10] |
Liu B, Liu H, Pan Y, et al. Comparison of the effects of environmental parameters on the growth variability of vibrio parahaemolyticus coupled with strain sources and genotypes analyses[J]. Front Microbiol, 2016, 7: 994. |
| [11] |
Zhou M, Guo Z, Yang Y, et al. Flagellin and F4 fimbriae have opposite effects on biofilm formation and quorum sensing in F4ac+ enterotoxigenic Escherichia coli[J]. Vet Microbiol, 2014, 168: 148-153. DOI:10.1016/j.vetmic.2013.10.014 |
| [12] |
Zhang JS, Zhou L. Progress in the application of nanomaterials in photodynamic therapy for tumor[J]. Prog Pharm Sci (药学进展), 2019, 43: 349-354. |
| [13] |
Steenackers H, Hermans K, Vanderleyden J, et al. Salmonella biofilms: an overview on occurrence, structure, regulation and eradication[J]. Food Res Int, 2012, 45: 502-531. DOI:10.1016/j.foodres.2011.01.038 |
| [14] |
Crull K, Rohde M, Westphal K, et al. Biofilm formation by Salmonella enterica serovar Typhimurium colonizing solid tumours[J]. Cell Microbiol, 2011, 13: 1223-1233. DOI:10.1111/j.1462-5822.2011.01612.x |
| [15] |
Nallar SC, Xu DQ, Kalvakolanu DV. Bacteria and genetically modified bacteria as cancer therapeutics: current advances and challenges[J]. Cytokine, 2017, 89: 160-172. DOI:10.1016/j.cyto.2016.01.002 |
| [16] |
Beik J, Abed Z, Ghoreishi FS, et al. Nanotechnology in hyperthermia cancer therapy: from fundamental principles to advanced applications[J]. J Control Release, 2016, 235: 205-221. DOI:10.1016/j.jconrel.2016.05.062 |
| [17] |
Huang XX, Liu Y, Zhang RN, et al. Research progress of mild photothermal therapy in cancer treatment[J]. Chin Sci Bull (科学通报), 2020, 65: 3538-3550. DOI:10.1360/TB-2020-0463 |
| [18] |
Wang YT, Huang Q, He X, et al. Multifunctional melanin-like nanoparticles for bone-targeted chemo-photothermal therapy of malignant bone tumors and osteolysis[J]. Biomaterials, 2018, 183: 10-19. DOI:10.1016/j.biomaterials.2018.08.033 |
| [19] |
Peng JR, Xiao Y, Li WT, et al. Photosensitizer micelles together with IDO inhibitor enhance cancer photothermal therapy and immunotherapy[J]. Adv Sci, 2018, 5: 1700891. DOI:10.1002/advs.201700891 |
| [20] |
Zheng RR, Zhao LP, Chen HQ, et al. Tumor microenvironment responsive biomimetic nanoparticles for photodynamic tumor therapy[J]. Acta Pharm Sin (药学学报), 2020, 55: 1672-1679. |
| [21] |
Kim J, Cho HR, Jeon H, et al. Continuous O2-evolving MnFe2O4 nanoparticle-anchored mesoporous silica nanoparticles for efficient photodynamic therapy in hypoxic cancer[J]. J Am Chem Soc, 2017, 139: 10992-10995. DOI:10.1021/jacs.7b05559 |
| [22] |
Lee JE, Lee N, Kim T, et al. Multifunctional mesoporous silica nanocomposite nanoparticles for theranostic applications[J]. Acc Chem Res, 2011, 44: 893-902. DOI:10.1021/ar2000259 |
| [23] |
Chen Q, Liang C, Sun XQ, et al. H2O2-responsive liposomal nanoprobe for photoacoustic inflammation imaging and tumor theranostics via in vivo chromogenic assay[J]. Proc Natl Acad Sci U S A, 2017, 114: 5343-5348. DOI:10.1073/pnas.1701976114 |
 2021, Vol. 56
2021, Vol. 56


