口服和黏膜给药等药物递送途径通常被认为是最方便给药途径, 然而这些给药方式普遍存在生物利用度低的问题。造成药物生物利用度低的最主要原因是生物膜上皮细胞间紧密连接对药物渗透产生阻碍, 特别是BCS Ⅲ类、Ⅳ类药物和肽类等大分子药物的跨膜递送更加困难[1-3]。紧密连接是指生物膜相邻细胞通过阳离子和蛋白质连接形成的致密区域, 是一种不通透的连接方式, 在调节药物经细胞旁路途径的转运中起着决定作用, 一般的大分子物质难以透过, 仅有水和部分小分子可从索条衔接(cable connection) 处的小孔透过[4-6]。近年来, 为解决药物难以透过紧密连接的问题, 研究者进行了诸多尝试, 如对药物进行修饰增加其亲酯性、使用壳聚糖等正电分子对药物进行包裹、添加吸收促进剂作用于紧密连接等。研究证明, 解决这一问题最简单有效的方式就是使用吸收促进剂[7-10]。
吸收促进剂是制剂处方中的一种功能性辅料, 可改善活性药物的透膜吸收, 因其可增强药物的膜渗透也被具体地称为渗透增强剂。理想的吸收促进剂应无毒、无刺激性且产生的吸收增强作用瞬时可逆[11-13]。吸收促进剂的种类繁多, 作用机制也不尽相同, 常用吸收促进剂的种类和作用机制如表 1所示。由于常用的吸收促进剂普遍具有毒性的缺陷, 如聚山梨醇酯和聚氧乙烯在黏膜促透过程中会导致细胞膜结构及成分的溶解[14]; 十二烷基硫酸钠和聚氧乙烯会造成肠壁的不可逆损伤[15]; 月桂酸钠会导致细胞凋亡[16]; 胆盐浓度过高会产生局部刺激和细胞毒性等问题[17]。因此, 由于安全性问题, 真正能运用于临床的吸收促进剂极少。
| Table 1 Classes of penetration enhancers and mechanisms of action |
烷基糖苷(alkyl polyglycoside, APG) 是一类非离子表面活性剂, 具有高效低毒、可生物降解的优势, 已被广泛应用于洗涤、食品、化妆品和制药等各个行业[18]。在药物递送领域, APG作为一种绿色非离子表面活性剂, 由于具有优良的吸收促进性能、抗菌性能、生物降解性和低毒性, 能够有效地改善药物递送系统的稳定性和渗透性。近年来, APG中的十二烷基麦芽糖苷(DDM) 和十四烷基麦芽糖苷(TDM) 均已被证明对小分子化合物和肽类等药物均有较好吸收促进效果[18]。2020年1月, 由Neurelis公司研发的第一个使用DDM的上市制剂—地西泮鼻腔喷雾剂(VALTOCO®) 正式通过FDA批准上市, 有效地提高了地西泮在鼻腔部位的吸收, 这也证实了DDM的促透效果和安全性。本文将对APG的组成、性质、特点、作用机制及目前在口服给药和黏膜给药方面的应用研究进行总结, 并对其在药物递送系统的应用前景进行展望, 为烷基糖苷类吸收促进剂在药物递送系统中的应用提供参考。
1 烷基糖苷的结构及组成APG属于烷基糖苷类, 是一种具有高活性的非离子表面活性剂, 常温下为白色粉末, 具有表面张力低、亲水亲油平衡值(hydrophile lipophilic balance, HLB) 可调、刺激性小、具有抗菌活性和生物降解迅速等特点, 在医药行业主要作为药物递送系统中的吸收促进剂[18]。经典的APG通常是由1个疏水烷基碳链和1个亲水低聚糖通过共价偶联而成, 如图 1所示。烷基糖苷中常见的低聚糖基团有葡萄糖、麦芽糖、蔗糖和海藻糖等, 最为典型基团是葡萄糖和麦芽糖。典型的链接基团一般有糖苷键、硫糖苷键和酰胺键等。烷基链的长度一般为5~16个碳, 目前以DDM和TDM两种APG在药物递送中应用最为广泛[18]。
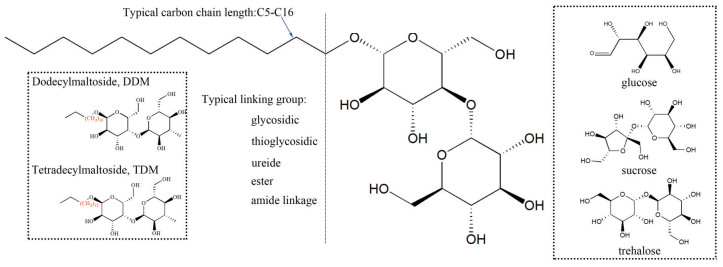
|
Figure 1 The chemical structure plot of typical alkyl polyglycoside (APG). DDM: Dodecylmaltoside; TDM: Tetradecylmaltoside |
近年来, 诸多研究者对APG的作用机制进行了研究, 多数实验研究表明APG的作用机制在于短暂可逆开启细胞间的紧密连接, 以促进药物渗透通过生物膜(图 2)。但也有研究发现, APG可通过加速生物膜流动和细胞膜的内吞作用, 从而加速细胞对药物的摄取。
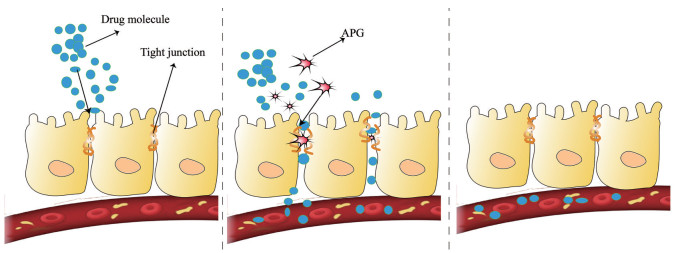
|
Figure 2 The action mechanism diagram of APG. a: Without APG, drug molecules cannot pass through tight junctions; b: APG open tight junctions and drug molecules enter systemic circulation; c: The function of APG is complete and tight connection is closed |
APG可直接作用于细胞膜的紧密连接, 紧密连接程度可通过生物膜上跨细胞电阻(trans epithellal electric resistance, TEER) 的变化间接反映, 紧密连接程度越大, 则TEER越大, 反之则越小[18]。Gradauer等[19]利用TEER的检测技术研究了Caco-2细胞对甘露醇和普萘洛尔两种难透过性药物的摄取, 发现Caco-2细胞经DDM处理后, 细胞两侧的TEER显著降低且细胞内的甘露醇和普萘洛尔含量明显上升, 同时又考察了不同浓度的DDM对细胞TEER的影响, 发现0.16和0.5 mmol·L-1的DDM可分别降低细胞TEER 40%和75%。DDM对细胞膜两侧TEER的减少及对药物的渗透增强, 很好地说明了DDM是通过开启细胞间的紧密连接实现药物促透的, 也反映了其渗透增强能力在很大程度上受DDM浓度的影响。
理论上, APG开启紧密连接的能力应是短暂可逆的, Arnold等[20, 21]选用DDM考察了其对分子量不同的降钙素和生长激素在大鼠鼻腔内的吸收促进作用。分别在使用DDM对大鼠鼻腔处理后, 于第0、60和120 min分别给予降钙素和生长激素, 并在给药后采血测定大鼠体内两种药物的药代动力学特征变化。结果发现, 经DDM处理后立即给药, 对降钙素和生长激素的透膜促进作用最强, 而随着DDM的处理时间延长其对药物的增加透膜作用逐渐减弱; 经DDM处理60 min后其对生长激素吸收几乎没有促进作用。这一研究结果证明了DDM打开生物膜紧密连接是一个短暂可逆的过程, 随着作用时间的延长会逐渐关闭。为进一步研究DDM的作用机制, Gradauer等[19]选用了难以被细胞摄取的Sulfo-NHS-SS-Biotin对DDM促进药物进入Caco-2细胞的跨膜转运过程进行了研究。通过细胞成像结果发现, 经DDM处理的Caco-2细胞间隙中可观察到Sulfo-NHS-SS-Biotin, 更加直观地证明了DDM是通过开启细胞间的紧密连接, 增加药物的细胞旁途径转运而发挥作用的。
APG除了开启细胞间的紧密连接外, 可能还存在其他促进药物透膜的过程。Arnold等[22]通过对胰岛素进行FITC荧光标记, 研究了TDM促进胰岛素在大鼠鼻黏膜的吸收过程。结果发现, 在没有添加TDM的大鼠鼻黏膜细胞中, FITC-胰岛素被排除在细胞之外, 但在暴露于0.125% TDM的大鼠鼻黏膜细胞中, 不仅可在细胞间隙观察到FITC-胰岛素, 也可在细胞内的囊泡中观察到, 这表明TDM不仅开启了细胞间的紧密连接, 增加胰岛素细胞旁路途径的吸收, 同时也可加速细胞膜的流动和内吞作用, 加速胰岛素的吸收。
3 影响烷基糖苷促进吸收效果的因素 3.1 碳链长度对APG渗透增强作用的影响APG是一类非离子型表面活性剂, 碳链是非极性的亲油基团, 通常烷基碳链长度大于8个碳才具有表面活性, 且随着烷基碳链的增长, 活性显著提高, 因此APG的碳链长度会很大程度上影响其促进药物吸收的能力。Maggio等[18]使用EpiAirway®模型来模拟人体鼻黏膜的结构, 通过监测细胞TEER的变化来反映不同种类APG的促透能力。研究发现, 当APG的碳链含碳个数为12和14时能观测到细胞两侧的TEER明显降低; 而当碳链上含碳数量仅为7或8时TEER的变化明显减小。Yang等[21]研究了3种不同碳链长度的烷基蔗糖苷对伊诺肝素吸收的影响, 发现促透作用均以剂量依赖和链长依赖的方式增强依诺肝素的鼻吸收。Pillion等[23]研究了不同碳链个数的APG对胰岛素在大鼠体内吸收的影响。结果发现, 当APG碳链长度从C8增长到C14时大鼠体内的胰岛素血药浓度也随之增大; 但碳链长度增加至C15和C16时胰岛素血药浓度未有明显增加。因此, 在一定范围内, APG的烷基含碳个数与促透能力成正比, C12和C14是最适合作为吸收促进剂的APG烷基碳链长度。
3.2 低聚糖种类对APG渗透增强作用的影响APG的低聚糖基团具有很强的亲水性, 不同种类的低聚糖具有不同的表面活性, 因而低聚糖基团不同的APG对药物的吸收促进能力也有强弱。Pillion等[24]分别研究了多种葡萄糖苷、蔗糖苷和麦芽糖苷等几种具有不同低聚糖基团APG对胰岛素的促透能力。研究发现, 长链的麦芽糖苷渗透增强作用最强, 蔗糖苷次之, 葡萄糖苷最弱, 其中十二烷基麦芽糖苷和十四麦芽糖苷具有最强的渗透增强能力。因此, 与烷基单糖相比, 烷基二糖具有更好的吸收增强能力, 更适用于作为吸收促进剂。
3.3 APG浓度和药物分子量对渗透作用的影响APG对药物的渗透增强能力不仅受碳链长度和低聚糖种类的影响, 也会受到浓度和药物分子量的影响。APG使用浓度越大, 对药物的渗透能力越大; 药物的分子量越大, 渗透能力越小。Arnold等[22]分别考察了不同浓度的十四烷基麦芽糖苷(TDM) 对胰岛素、瘦素、生长激素和促红细胞生长素等不同分子量药物透过大鼠鼻黏膜的渗透增强能力。当TDM用量为0.06%时, 仅有小分子量的胰岛素和瘦素的透过明显增加; 增加TDM浓度至0.125%, 分子量较大的生长激素的透膜吸收有所增加, 继续增大TDM浓度至0.5%时, 并未在细胞内检测到分子量最大的促红细胞生长素摄取的增加, 但却观察到了鼻黏膜的不可逆损伤。因此, 在一定范围内, 增加APG的使用浓度, 能很好增加对药物的促透能力; 但对于分子量太大的药物, 即使增加APG的使用浓度也达不到很好的促透效果, 反而会导致细胞不可逆损伤。
4 烷基糖苷的安全性APG在食品、化妆品等行业一直被认为是无毒和可生物降解的, 但近年来诸多研究表明, 很多APG均具有不同程度的细胞毒性, 会造成黏膜损伤, 损伤程度与APG的碳链长度、单聚糖基团及使用浓度有较大联系。Eley等[25]通过T-84和HT-29Cl19A两种细胞模型研究对比了13种碳链长度在C5~C13之间的APG对细胞膜表面结构的影响。结果发现, 在同一给药浓度下, 13种APG中仅庚基葡萄糖苷、辛基葡萄糖苷、辛基麦芽糖苷和十二烷基麦芽糖苷不会对细胞膜结构造成不可逆损伤, TEER在降低后18 h内可完全恢复至正常水平; 其余9种烷基糖苷均会对细胞膜造成部分不可逆损伤或者完全不可逆损伤, TEER只能恢复部分正常水平或完全消失。Maggio等[18]将活细胞暴露在37 ℃、0.1% DDM溶液中1 h的存活率要高于暴露在磷酸盐缓冲液(PBS) 中; 浓度增大至0.2%时活细胞存活率仅有在PBS中的80%。因此, APG在药物递送系统应用时, 应谨慎选择APG的种类及使用浓度, 以保证药物的安全性。
5 烷基糖苷在药物递送系统中的应用 5.1 在口服给药系统中的应用口服给药通常被认为是最方便快捷的药物递送途径, 但由于生物利用度不足, 许多药物不能口服给药。药物口服生物利用度差可能由溶解性差、胃肠道降解或膜渗透性差等原因引起[26]。在口服递送系统中, APG能较好地解决由于膜渗透性差造成生物利用度不足的问题。Petersen等[27]通过监测Caco-2细胞膜两侧TEER的变化, 验证了DDM和TDM对Caco-2细胞紧密连接的开启作用, 然后研究了两种APG在离体空肠和结肠黏膜的组织病理学和细胞毒性(采用MTT法、HDL乳酸脱氢酶分析及HCA亚致死高含量细胞毒性检测等)。研究结果表明, 即使将离体空肠和结肠组织暴露于高浓度的DDM和TDM中, 也不会对离体组织的结构造成损伤, 其黏膜的离子转运功能仍然存在。因此, APG对于分离的肠道黏膜组织可认为是一种有效的无毒渗透促进剂。
烷基糖苷可促进渗透性差的药物通过肠道吸收, Petersen等[28]首先通过研究发现TDM能显著促进降钙素在人的Caco-2细胞和肠上皮单层细胞的渗透后, 又通过大鼠的在体肠灌注实验, 在0.1% TDM的浓度下分别对空肠、回肠和结肠中降钙素的吸收情况进行了研究。结果发现, 在空肠部位TDM对降钙素吸收有一定程度的增大, 绝对生物利用度能从1.0%提高到4.6%, 而在回肠和空肠没有明显的吸收增强作用。由于离体细胞组织与体内会存在一定差异, 为准确模拟体内环境, Tan等[29]开发了一种用于模拟人体肠道环境的多室微流体肠屏障模型(图 3), 使用该模型对TDM的促透能力进行了研究, 发现0.1%TDM能显著地提高甘露醇、FD4 (荧光标记葡聚糖) 及胰岛素的透膜吸收。
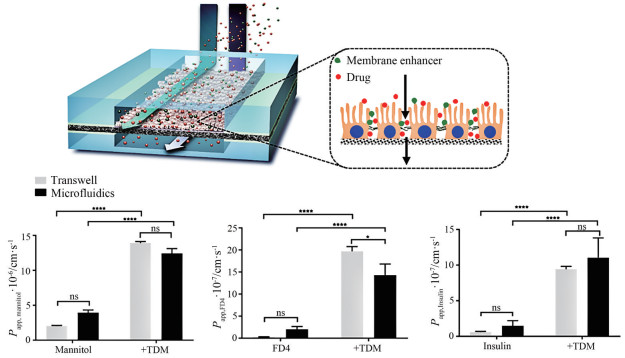
|
Figure 3 The plot of multi compartment microfluidic intestinal barrier model and drug screening. *P < 0.05, ****P < 0.000 1. (Adapted from Ref. 27 with permission. © 2018 Tan et al) |
Deshmukh等[30]研究了DDM对替卢多诺酯和色甘酸两种BCS Ⅲ类药物在肠道吸收的影响, 发现0.1%浓度下的DDM对替卢多诺酯的肠道吸收促进作用较强, 色甘酸相对较弱; 吸收增强能力随着DDM浓度的增加而增强, 但DDM浓度过高时会造成细胞膜的部分溶解。Lee和Novakovic等[31, 32]均通过小鼠体内药代实验证明了0.25% DDM对瘦素类似物([D-Leu-4]-OB3) 的口服吸收具有较好的促进作用, 在瘦素抗肥胖的小鼠中, 口服添加0.25% DDM的[D-Leu-4]-OB3达到理想抗肥胖效果, 且使用剂量可减少至1/10。Maggio等[33]研究发现浓度为0.5% DDM能将醋酸奥曲肽的口服相对生物利用度从1.0%提高至4.0%。
上述研究可得, APG作为药物的吸收促进剂使用时, 能够有效地增加药物在肠道部位的透膜吸收, 提高药物的生物利用度。
5.2 在鼻腔给药系统中的应用鼻腔黏膜给药是重要的药物递送方式之一, 具有吸收迅速、起效快、生物利用度高和无肝脏首过效应的优势, 目前APG在鼻腔给药制剂中的应用最为广泛。Ahsan等[34]在胰岛素的鼻腔给药制剂中添加了0.1%~0.5%的DDM, 发现各浓度水平下的DDM均能显著提高大鼠体内的胰岛素血浆浓度, 使血糖水平降低。Pillion等[35]发现0.125% TDM在胰岛素鼻腔给药制剂中能迅速提高大鼠的鼻腔吸收, 短效胰岛素和缓释胰岛素分别能在15和60 min达到最大血药浓度。Krieter等[36]在纳美芬鼻腔给药制剂中使用DDM作为吸收促进剂, 进行体内药代动力学研究发现, 增加DDM的纳美芬制剂鼻腔给药起效时间与静脉注射相当, Tmax可达到静脉注射的3倍。
舒马曲坦在临床上被用来改善患者偏头痛的症状, 已上市的鼻腔喷雾剂相比注射剂存在生物利用度低和吸收缓慢的劣势, 难以满足快速有效改善偏头疼的临床需求。Munjal等[37]对舒马曲坦鼻腔喷雾的处方进行了改善, 在处方中增加了吸收促进剂DDM, 并对比了市售制剂Imitrex®和自制制剂DFN-02在人体中的体内药代动力学的差异。实验结果表明, DFN-02在人体内的AUC与市售制剂Imitrex®基本一致, 且Tmax和Cmax得到明显改善, Tmax可显著降低至0.25 h, Cmax增加至63.85 ng·mL-1。Sagar Munjal团队也同时开展了DFN-02与皮下注射舒马曲坦的临床试验, 结果表明, DFN-02 (20 mg) 鼻腔给药的药效基本与皮下注射舒马曲坦(4 mg) 一致, 目前DFN-02的临床试验已进行至临床Ⅲ期。
纳洛酮是唯一被批准用于治疗阿片类药物过量的阿片类受体拮抗剂, 临床试验证明添加DDM作为吸收促进剂的纳洛酮鼻腔制剂吸收迅速, 生物利用度高, 能为阿片类药物过量患者的急救赢得了时间。Krieter等[38]进行了14名健康受试者的体内临床试验, 分别对比研究了纳洛酮注射剂、片剂和鼻喷剂(有无0.25% DDM) 4组药代动力学曲线。研究发现, 纳洛酮鼻喷剂组的Cmax均要高于片剂和注射剂组, Tmax均要小于片剂和注射剂组。而添加DDM作为吸收促进剂组较未添加组的Cmax增加了近3倍, 将Tmax从0.5 h减少到0.17 h, 极大的缩短了纳洛酮的起效时间。
地西泮是一种用来治疗癫痫发作的药物, 一直存在鼻腔给药生物利用度低的问题[39]。Neurelis公司开发的地西泮鼻腔喷雾剂, 成功地解决了地西泮鼻腔吸收生物利用度不足的问题, 弥补了地西泮片剂、注射剂用于治疗癫痫急性发作急救的不便。地西泮鼻腔喷雾剂处方中添加了吸收促进剂DDM, DDM显著增加了地西泮的鼻腔吸收, 临床试验结果表明其绝对生物利用度能达到97%, 两个规格制剂的药时曲线与直肠给药基本一致, 且生物变异性较直肠凝胶剂小(图 4)。目前首个应用DDM作为吸收促进剂的地西泮鼻腔喷雾剂(VALTOCO®) 已于2020年1月经过FDA批准正式上市[40-42]。

|
Figure 4 The drug concentration-time curve of DDM application preparations in healthy volunteers. A: Namefen (Adapted from Ref. 36 with permission. Copyright © 2019 Wiley Periodicals, Inc); B: Sumatriptan (Adapted from Ref. 37 with permission. Copyright © 2016 American Headache Society); C: Naltrexone (Adapted from Ref. 38 with permission. Copyright © 2019 Wiley Periodicals, Inc); D: Diazepam (Adapted from Ref. 41with permission. Copyright © FDA Clinical Pharmacology and Biopharmaceutics Review of Diazepam Nasal Spray VALTOCO®) |
药物通过眼部给药系统递送既可用于治疗眼部疾病也可发挥全身作用, 基糖苷类也被应用于眼部给药系统[43]。Morgan等[44]尝试在胰岛素制剂中添加不同浓度的DDM或TDM, 通过比格犬眼部给药, 监测比格犬的血浆中血糖和胰岛素的含量。结果发现, 添加DDM和TDM的胰岛素制剂均能快速降低比格犬体内的血糖浓度。Pillion等[45]也通过大鼠的体内实验验证了DDM和TDM能促进胰岛素的眼部吸收, 从而发挥全身作用。Ahsan等[46]也通过研究确定了在降钙素眼部给药制剂中添加烷基糖苷能显著提高降钙素的眼部吸收, 增加其生物利用度。
5.4 在肺部给药系统中的应用近年来, 肺部给药系统是一种新兴的药物递送方式, 具有比表面积大、毛细血管丰富和代谢反应少等优势, 已成为一些易被酶降解的作用于全身的蛋白质类药物和治疗肺部疾病药物的重要递送方式。Arnold等[47]尝试在低分子肝素中添加TDM, 研究发现含有TDM的制剂具有很好的肺部吸收效果, 说明TDM能很好地促进低分子肝素的肺部吸收, 这也为肺栓塞的治疗提供了更好的治疗途径。
6 总结与展望APG作为一种新型的吸收促进剂, 有其独特高效的渗透增加能力, 可通过打开生物膜细胞间的紧密连接, 促进药物吸收。其已在口腔、鼻腔、肺部和眼部给药系统有了较多的应用, 极大地改善了药物生物利用度不足的难题。目前应用最为广泛的有DDM和TDM。APG的促透能力和细胞毒性不仅受到碳链长度和单聚糖基团类型的影响, 还取决于使用浓度的大小。因此, 在选择APG的种类和使用浓度时, 需重点找到安全性与有效性的平衡点。
APG作为一类功能性的辅料, 暂未见国内企业申报批准上市, 目前仅有DDM (Intravail®) 在美国获准上市。国内市场上的APG均为生物试剂级, 若将试剂级化合物作为制剂辅料使用, 会存在较大的安全性隐患。由于国家食品药品监督管理局未批准该类辅料上市, 若在制剂中使用该类辅料作为吸收促进剂需特别对辅料进行一系列的特性鉴定、质量控制、稳定性研究及药理毒理研究, 这无疑增大了制剂上市的成本。
目前APG在药物递送系统的应用仍处于初始阶段, 大部分研究仍处于细胞和动物实验的水平, 与临床制剂的普遍应用还有较大距离, 但随着地西泮、纳美芬、纳洛酮及舒马曲坦等应用DDM作为吸收促进剂的黏膜给药制剂的上市和进入临床试验阶段, 证明DDM安全性和有效性的同时, 也为后续一些药物改良给药途径提供了思路。目前第一个应用DDM的制剂—地西泮鼻腔喷雾剂已于2020年1月通过FDA批准上市, 相信会有更多的APG在口服给药及其他多种给药途径中作为吸收促进剂使用, 以更好地满足临床需要。
作者贡献: 李先福具体完成文献整理和撰写任务; 张志伟、洪晓轩、韩晓璐和李蒙完成文献检索和筛选; 王增明和郑爱萍确定文章方向及内容组成, 并对文章撰写质量进行把关和审校。
利益冲突: 文章内容不涉及相关利益冲突, 未涉及任何厂家及相关经济组织直接或间接的经济或利益的赞助。内容不涉及泄密, 无与他人课题或专利技术的争执, 无一稿两投, 无作者署名争议。
| [1] |
Maher S, Mrsny RJ, Brayden DJ. Intestinal permeation enhancers for oral peptide delivery[J]. Adv Drug Deliv Rev, 2016, 106: 277-319. DOI:10.1016/j.addr.2016.06.005 |
| [2] |
Brayden DJ, Alonso MJ. Oral delivery of peptides: opportunities and issues for translation[J]. Adv Drug Deliv Rev, 2016, 106: 193-195. DOI:10.1016/j.addr.2016.10.005 |
| [3] |
Lewis AL, Richard J. Challenges in the delivery of peptide drugs: an industry perspective[J]. Ther Deliv, 2015, 6: 149-163. DOI:10.4155/tde.14.111 |
| [4] |
Fasano A, Nataro JP. Intestinal epithelial tight junctions as targets for enteric bacteria-derived toxins[J]. Adv Drug Deliv Rev, 2004, 56: 795-807. DOI:10.1016/j.addr.2003.10.045 |
| [5] |
Hochman J, Artursson P. Mechanisms of absorption enhancement and tight junction regulation[J]. J Control Release, 1994, 29: 253-267. DOI:10.1016/0168-3659(94)90072-8 |
| [6] |
Salama NN, Eddington ND, Fasano A. Tight junction modulation and its relationship to drug delivery[J]. Adv Drug Deliv Rev, 2006, 58: 15-28. DOI:10.1016/j.addr.2006.01.003 |
| [7] |
Ghadiri M, Young PM, Traini D. Strategies to enhance drug absorption via nasal and pulmonary routes[J]. Pharmaceutics, 2019, 11: 113. DOI:10.3390/pharmaceutics11030113 |
| [8] |
Kondoh M, Yagi K. Progress in absorption enhancers based on tight junction[J]. Exp Opin Drug Deliv, 2007, 4: 275-286. DOI:10.1517/17425247.4.3.275 |
| [9] |
Ren J, Deng SQ, Jiang XH, et al. Enhancers on the transmembrane transport of chlorogenic acid[J]. Acta Pharm Sin (药学学报), 2014, 49: 252-255. |
| [10] |
Yang DB, Zhu JB, Zhu H, et al. Deposition of insulin powders for inhalation in vitro and pharmacodynamic evaluation of absorption promoters in rats[J]. Acta Pharm Sin (药学学报), 2005, 40: 1069-1074. |
| [11] |
Williams AC, Barry BW. Penetration enhancers[J]. Adv Drug Deliv Rev, 2004, 56: 603-618. DOI:10.1016/j.addr.2003.10.025 |
| [12] |
Maher S, Brayden DJ, Casettari L, et al. Application of permeation enhancers in oral delivery of macromolecules: an update[J]. Pharmaceutics, 2019, 11: 41. DOI:10.3390/pharmaceutics11010041 |
| [13] |
Aungst BJ. Absorption enhancers: applications and advances[J]. AAPS J, 2012, 14: 10-18. DOI:10.1208/s12248-011-9307-4 |
| [14] |
Dimitrijevic D, Shaw A, Florence AT, et al. Effects of some non-ionic surfactants on transepithelial permeability in Caco-2 cells[J]. J Pharm Pharmacol, 2000, 52: 157-162. |
| [15] |
Aungst BJ. Intestinal permeation enhancers[J]. J Pharm Sci, 2000, 89: 429-442. DOI:10.1002/(SICI)1520-6017(200004)89:4<429::AID-JPS1>3.0.CO;2-J |
| [16] |
Okuda T, Kadotsuji K, Takayama C, et al. Involvement of intracellular Ca2+ dynamics in cytoprotective action by amino acids and cytotoxicity by sodium laurate, an absorption enhancer[J]. J Pharm Sci, 2006, 95: 2256-2265. DOI:10.1002/jps.20712 |
| [17] |
Gordon GS, Moses AC, Silver RD, et al. Nasal absorption of insulin: enhancement by hydrophobic bile salts[J]. Proc Natl Acad Sci U S A, 1985, 82: 7419-7423. DOI:10.1073/pnas.82.21.7419 |
| [18] |
Maggio ET, Pillion DJ. High efficiency intranasal drug delivery using intravail® alkylsaccharide absorption enhancers[J]. Drug Deliv Transl Res, 2013, 3: 16-25. DOI:10.1007/s13346-012-0069-z |
| [19] |
Gradauer K, Iida M, Watari A, et al. Dodecylmaltoside modulates bicellular tight junction contacts to promote enhanced permeability[J]. Mol Pharm, 2017, 14: 4734-4740. DOI:10.1021/acs.molpharmaceut.7b00297 |
| [20] |
Arnold JJ, Fyrberg MD, Meezan E, et al. Reestablishment of the nasal permeability barrier to several peptides following exposure to the absorption enhancer tetradecyl-beta-D-maltoside[J]. J Pharm Sci, 2010, 99: 1912-1920. DOI:10.1002/jps.21977 |
| [21] |
Yang T, Mustafa F, Ahsan F. Alkanoylsucroses in nasal delivery of low molecular weight heparins: in-vivo absorption and reversibility studies in rats[J]. J Pharm Pharmacol, 2004, 56: 53-60. |
| [22] |
Arnold JJ, Ahsan F, Meezan E, et al. Correlation of tetradecylmaltoside induced increases in nasal peptide drug delivery with morphological changes in nasal epithelial cells[J]. J Pharm Sci, 2004, 93: 2205-2213. DOI:10.1002/jps.20123 |
| [23] |
Pillion DJ, Ahsan F, Arnold JJ, et al. Synthetic long-chain alkyl maltosides and alkyl sucrose esters as enhancers of nasal insulin absorption[J]. J Pharm Sci, 2002, 91: 1456-1462. DOI:10.1002/jps.10150 |
| [24] |
Pillion DJ, Atchison JA, Gargiulo C, et al. Insulin delivery in nosedrops: new formulations containing alkylglycosides[J]. Endocrinology, 1994, 135: 2386-2391. DOI:10.1210/endo.135.6.7988421 |
| [25] |
Eley JG, Triumalashetty P. In vitro assessment of alkylglycosides as permeability enhancers[J]. AAPS PharmSciTech, 2001, 2: E19. |
| [26] |
Maher S, Geoghegan C, Brayden DJ. Intestinal permeation enhancers to improve oral bioavailability of macromolecules: reasons for low efficacy in humans[J]. Exp Opin Drug Deliv, 2021, 18: 273-300. DOI:10.1080/17425247.2021.1825375 |
| [27] |
Petersen SB, Nolan G, Maher S, et al. Evaluation of alkylmaltosides as intestinal permeation enhancers: comparison between rat intestinal mucosal sheets and Caco-2 monolayers[J]. Eur J Pharm Sci, 2012, 47: 701-712. DOI:10.1016/j.ejps.2012.08.010 |
| [28] |
Petersen SB, Nielsen LG, Rahbek UL, et al. Colonic absorption of salmon calcitonin using tetradecyl maltoside (TDM) as a permeation enhancer[J]. Eur J Pharm Sci, 2013, 48: 726-734. DOI:10.1016/j.ejps.2013.01.009 |
| [29] |
Tan HY, Trier S, Rahbek UL, et al. A multi-chamber microfluidic intestinal barrier model using Caco-2 cells for drug transport studies[J]. PLoS One, 2018, 13: e0197101. DOI:10.1371/journal.pone.0197101 |
| [30] |
Deshmukh DD, Nagilla R, Ravis WR, et al. Effect of dodecylmaltoside (DDM) on uptake of BCS Ⅲ compounds, tiludronate and cromolyn, in Caco-2 cells and rat intestine model[J]. Drug Deliv, 2010, 17: 145-151. DOI:10.3109/10717541003604882 |
| [31] |
Lee D, Leinung M, Grasso P. Oral delivery of mouse[D-Leu-4]-OB3, a synthetic peptide amide with leptin-like activity, in male Swiss Webster mice: a study comparing the pharmacokinetics of oral delivery to intraperitoneal, subcutaneous, intramuscular, and intranasal administration[J]. Regul Pept, 2010, 160: 129-132. DOI:10.1016/j.regpep.2009.12.008 |
| [32] |
Novakovic Z, Anderson B, Grasso PJP. Myristic acid conjugation of[D-Leu-4]-OB3, a biologically active leptin-related synthetic peptide amide, significantly improves its pharmacokinetic profile and efficacy[J]. Peptides, 2014, 62: 176-182. DOI:10.1016/j.peptides.2014.10.007 |
| [33] |
Maggio ET, Grasso P. Oral delivery of octreotide acetate in intravail® improves uptake, half-life, and bioavailability over subcutaneous administration in male Swiss webster mice[J]. Regul Pept, 2011, 167: 233-238. DOI:10.1016/j.regpep.2011.02.009 |
| [34] |
Ahsan F, Arnold J, Meezan E, et al. Mutual inhibition of the insulin absorption-enhancing properties of dodecylmaltoside and dimethyl-beta-cyclodextrin following nasal administration[J]. Pharm Res, 2001, 18: 608-614. DOI:10.1023/A:1011073008325 |
| [35] |
Pillion DJ, Fyrberg MD, Meezan E. Nasal absorption of mixtures of fast-acting and long-acting insulins[J]. Int J Pharm, 2010, 388: 202-208. DOI:10.1016/j.ijpharm.2010.01.013 |
| [36] |
Krieter P, Gyaw S, Crystal R, et al. Fighting fire with fire: development of intranasal nalmefene to treat synthetic opioid overdose[J]. J Pharmacol Exp Ther, 2019, 371: 409-415. DOI:10.1124/jpet.118.256115 |
| [37] |
Munjal S, Gautam A, Offman E, et al. A randomized trial comparing the pharmacokinetics, safety, and tolerability of DFN-02, an intranasal sumatriptan spray containing a permeation enhancer, with intranasal and subcutaneous sumatriptan in healthy adults[J]. Headache, 2016, 56: 1455-1465. DOI:10.1111/head.12905 |
| [38] |
Krieter P, Gyaw S, Chiang CN, et al. Enhanced intranasal absorption of naltrexone by dodecyl maltopyranoside: implications for the treatment of opioid overdose[J]. J Clin Pharmacol, 2019, 59: 947-957. DOI:10.1002/jcph.1384 |
| [39] |
Kapoor M, Cloyd J, Siegel RA. A review of intranasal formulations for the treatment of seizure emergencies[J]. J Control Release, 2016, 237: 147-159. DOI:10.1016/j.jconrel.2016.07.001 |
| [40] |
Tanimoto S, Pesco Koplowitz L, Lowenthal RE, et al. Evaluation of pharmacokinetics and dose proportionality of diazepam after intranasal administration of NRL-1 to healthy volunteers[J]. Clin Pharmacol Drug Dev, 2020, 9: 719-727. DOI:10.1002/cpdd.767 |
| [41] |
Product quality review(s) of diazepam nasal spray[EB/OL]. https://www.accessdata.fda.gov/drugsatfda_docs/nda/2020/211635Orig1s000ChemR.pdf.
|
| [42] |
Clinical pharmacology and biopharmaceutics review of diazepam nasal spray (VALTOCO)[EB/OL]. https://www.accessdata.fda.gov/drugsatfda_docs/nda/2020/211635Orig1s000ClinPharmR.pdf.
|
| [43] |
Moiseev RV, Morrison PWJ, Steele F, et al. Penetration enhancers in ocular drug delivery[J]. Pharmaceutics, 2019, 11: 321. DOI:10.3390/pharmaceutics11070321 |
| [44] |
Morgan R, Huntzicker M. Delivery of systemic regular insulin via the ocular route in dogs[J]. J Ocul Pharmacol Ther, 1996, 12: 515-526. DOI:10.1089/jop.1996.12.515 |
| [45] |
Pillion D, Hosmer S, Meezan EJ. Dodecylmaltoside-mediated nasal and ocular absorption of lyspro-insulin: independence of surfactant action from multimer dissociation[J]. Pharm Res, 1998, 15: 1637-1639. DOI:10.1023/A:1011975721569 |
| [46] |
Ahsan F, Arnold J, Meezan E, et al. Enhanced bioavailability of calcitonin formulated with alkylglycosides following nasal and ocular administration in rats[J]. Pharm Res, 2001, 18: 1742-1746. DOI:10.1023/A:1013330815253 |
| [47] |
Arnold J, Ahsan F, Meezan E, et al. Nasal administration of low molecular weight heparin[J]. J Pharm Sci, 2002, 91: 1707-1714. DOI:10.1002/jps.10171 |
 2021, Vol. 56
2021, Vol. 56


