肿瘤微环境(tumor microenvironment, TME) 是指肿瘤细胞与浸润的免疫细胞、基质细胞、血管、细胞外基质、分泌因子等共同构成的在肿瘤发生发展过程中形成的一种特殊生物环境。肿瘤微环境由肿瘤产生, 并时刻受到肿瘤的支配和调控, 动态且不稳定, 在肿瘤发展的不同时期不同部位其组成和功能不同, 与肿瘤进程和预后密切相关。1889年Stephen Paget[1]提出肿瘤的种子土壤理论, 即肿瘤及其微环境就如同"种子"和"土壤", 转移发生的部位不仅由肿瘤细胞(种子) 决定, 还由继发转移部位(土壤) 的微环境决定。肿瘤微环境一方面为肿瘤的生长及恶性进展提供适宜环境, 另一方面通过干扰环境中免疫细胞的功能帮助肿瘤逃避宿主的免疫监视, 促进肿瘤转移和耐药[2]。随着对TME研究的不断深入, 人们逐渐认识到靶向TME在抗肿瘤治疗中的重要作用。
自然界是药物孕育的巨大摇篮, 从天然产物中发现新的抗肿瘤活性成分或先导化合物可用以指导新型抗肿瘤药物的开发研究[3]。这些抗肿瘤药物主要类型包括萜类、黄酮类、生物碱类、醌类、多糖类和酚类等[4]。目前已发现的多种抗肿瘤活性成分直接作用于肿瘤细胞, 如紫杉醇、长春碱和长春新碱等调节肿瘤细胞的微管蛋白, 干扰纺锤体的形成而抑制有丝分裂[5]; 一些多酚类和黄酮类成分可以直接诱导肿瘤细胞凋亡。由于肿瘤与肿瘤微环境关系密切, 人们逐渐发现天然产物可以通过靶向TME而发挥抗肿瘤治疗作用, 这也拓展了天然产物的应用范围。因此, 本文主要综述了肿瘤微环境中物质组成及其功能和天然产物靶向肿瘤微环境的研究进展, 为肿瘤治疗的药物研发提供参考。
1 TME构成与功能TME主要包括细胞成分和理化成分。肿瘤细胞与各种免疫细胞、基质细胞等一同被包埋在细胞外基质中并被血管网络营养, 常处于低氧、酸性和高组织间液压力状态。
1.1 TME中相关免疫细胞TME中存在的免疫细胞包括介导先天免疫和适应性免疫的多种免疫细胞。根据其在机体内的功能又可以分为免疫杀伤细胞和免疫抑制细胞。免疫杀伤细胞包括自然杀伤细胞、树突状细胞、细胞毒性T淋巴细胞等; 免疫抑制细胞包括肿瘤相关巨噬细胞、调节性T细胞、骨髓源性抑制细胞等。
自然杀伤细胞(natural killer, NK) 通过释放颗粒酶和穿孔素或通过表面抗原抗体结合而产生强大的细胞杀伤作用。但在TME中, 由于局部环境发生改变如缺氧、酸性、前列腺素E2 (PGE2) 富集、转化生长因子-β (TGF-β) 和肿瘤细胞表面抗原表达异常, NK细胞的数量和细胞活性常常受到抑制[6]。树突状细胞(dendritic cell, DC) 在抗原加工和呈递中具有重要功能[7]。细胞毒性T淋巴细胞(cytotoxic T lymphocyte, CTL) 通过表面T细胞受体(TCR) 识别抗原肽-主要组织相容性复合物(pMHC), 释放多种穿孔素和颗粒酶, 直接杀伤肿瘤细胞[8]。而在TME中, DC的抗原呈递功能受阻, CTL活性也受到抑制, 这有利于肿瘤的恶性进展和转移。
肿瘤相关巨噬细胞(tumor associated macrophage, TAM) 可分为经典激活的M1型和替代激活的M2型巨噬细胞。M1型巨噬细胞由Th1相关细胞因子或其他因子激活, 如干扰素γ (IFN-γ)、脂多糖(LPS) 等, 因其既能直接杀死肿瘤细胞又能辅助其他免疫细胞发挥细胞毒作用, 故通常被认为是"抗肿瘤"表型; M2型巨噬细胞由Th2相关细胞因子, 如白细胞介素4和13 (IL-4和13) 激活, 因其能抑制免疫反应和促进肿瘤血管生成和转移, 被认为是"促肿瘤"表型[9]。TME中的TAMs主要指M2型巨噬细胞, 通过激活人胃癌细胞中环氧合酶2 (COX-2) 促进基质金属蛋白酶(MMPs) 分泌, 增强肿瘤的侵袭性和预后不良[10]。TAMs具有更高水平的人精氨酸酶1 (Arg-1) 活性, 能将精氨酸分解为鸟氨酸, 而鸟氨酸是多胺和胶原蛋白的前体, 这有助于细胞外基质的产生, 促进肿瘤侵袭和转移[9]。TAMs还常过表达程序性死亡受体1 (PD-1), 并随着肿瘤进展而增加, 与吞噬能力呈负相关。此外, TAMs可通过PD-1与其受体PD-L1/L2结合, 诱导T细胞凋亡和抑制T细胞活化和增殖, 促使肿瘤细胞发生免疫逃逸[11]。
调节性T细胞(regulatory T cell, Treg) 为CD4+ T细胞的一个亚群, 其特征在于叉状头转录因子FoxP3的阳性表达, 可分为自然产生的调节性T细胞(natural Treg, nTreg) 和诱导产生的调节性T细胞(induced Treg, iTreg)。Treg能抑制肿瘤宿主的免疫应答, 有助于TME的发展, 从而促进免疫逃避和癌症发展[12]。在TME中Treg数量较正常组织多, 能通过多种接触和非接触的方式发挥活性, 包括释放抑制性细胞因子如TGF-β、IL-10、IL-35等, 上调免疫检查点的表达如CTLA-4、PD-1、LAG-3、TIM-3、ICOS、TIGIT、IDO等, 消耗IL-2而破坏CTL的代谢和诱导耐受性DC的产生, 从而促进T细胞衰竭, 帮助肿瘤细胞发生免疫逃逸[13]。
骨髓源性抑制细胞(myeloid-derived suppressor cell, MDSC) 由骨髓祖细胞在骨髓中生成, 随着血液循环迁移到外周淋巴器官或肿瘤中, 构成肿瘤微环境的一部分。MDSC有两种类型: 多形核MDSC (PMN-MDSC) 和单核MDSC (M-MDSC), 在TME中M-MDSC比PMN-MDSC免疫抑制作用强, 并且能迅速分化为TAMs[14]。TME中MDSCs高表达NADPH氧化酶2 (NOX2), 活性氧(ROS) 释放增加, 包括超氧阴离子(O2-)、过氧化氢(H2O2) 和过氧亚硝酸盐(ONOO-) 的释放增加; 高表达一氧化氮合酶2 (iNOS2), 增加一氧化氮(NO) 生成, 从而激活转录调节因子C/EBPβ和STAT3; 此外, Arg1表达也增加。MDSCs通过抑制机体免疫反应, 促进肿瘤免疫逃逸和转移, 主要靶标为T细胞[15]。
1.2 TME中基质细胞TME中活化的成纤维细胞称为肿瘤相关成纤维细胞(cancer associated fibroblast, CAF)。α-平滑肌肌动蛋白(α-SMA) 阳性的成纤维细胞称为肌成纤维细胞, 常见于大多数肿瘤细胞中, 是CAF的亚型之一[16]。在TME中, CAFs通过多种旁分泌因子与肿瘤细胞相互作用, 如TGF-β、肝细胞生长因子/离散因子(HGF/SF)、基质细胞衍生因子1 (SDF-1)、血管内皮生长因子(VEGF) 和胰岛素样生长因子(IGF-1) 等, 从而促进肿瘤生长和肿瘤血管生成, 加重肿瘤免疫逃逸和耐药[17]。肝癌衍生的CAFs通过分泌过量的IL-6和HGF促进肝癌(HCC) 的上皮间质转化, 增强肿瘤存活、增殖、侵袭和转移[18]。吉西他滨(gemcitabine) 处理的CAFs显著增加外泌体的释放, 同时外泌体中Snail以及下游靶标microRNA-146a的表达增加, 有利于胰腺导管腺癌的增殖和存活[19]。细胞外基质(extracellular matrix, ECM) 是由胶原蛋白、糖蛋白、蛋白聚糖、透明质酸等大分子组成的复杂网络, 其将肿瘤包裹其中, 为肿瘤的发展提供结构支持和屏障。CAFs是ECM合成、分泌、组装和修饰主要参与者[20], 其通过表达MMPs成员在ECM重塑过程中发挥作用。MMPs分为膜型或可溶性型蛋白, 其中MMP-2和MMP-9能选择性降解构成基底膜的Ⅳ型胶原和层粘连蛋白, 促进肿瘤扩散。CAFs通过合成纤连蛋白、胶原蛋白和透明质酸等重塑ECM, 形成致密的胶原组织, 提高了组织间液压力, 影响抗肿瘤药物的渗透。如CAFs可通过释放活性MMP-1作为乳腺癌细胞中蛋白酶激活受体(PAR1) 的激动剂, 促进异种移植模型中乳腺癌细胞的生长和侵袭[21]。
肿瘤血管为肿瘤提供营养支持和氧气, 促进肿瘤恶性进展。肿瘤血管由肿瘤内皮细胞(tumor endothelial cells, TEC) 和血管周细胞组成, 其血管壁不连续, 血管稳定性差, 血液流动异常, 不具有正常血管的动脉-小动脉-毛细血管分层结构, 这些特点使得肿瘤细胞更容易穿透血管[22]。肿瘤血管中周细胞覆盖率低, 其与TECs连接松散, 这和肿瘤预后差和转移增加密切相关。参与调节肿瘤血管生成的信号通路主要有VEGF/VEGFR/NRP信号转导和Notch/Delta信号转导途径[23]。由B细胞淋巴瘤(LCS) 产生的成纤维细胞生长因子4 (FGF4) 激活邻近TECs中的受体FGFR1, 并上调TECs中的Notch配体Jagged1。反过来, TECs上的Jagged1则在LCS中诱导Notch2-Hey信号转导。这种串扰会增加CD44+IGF1R+ CSF1R+的LCS表型, 增加肿瘤的侵袭和耐药性[24]。肿瘤分泌的VEGF又可通过激活TECs中的VEGFR2和Akt, 上调多药耐药蛋白(MDR) 的mRNA水平, 这也是TECs耐药机制之一[25]。
肿瘤相关脂肪细胞(cancer-associated adipocytes, CAA) 是肿瘤基质的重要成分。在肿瘤发生早期, 局部肿瘤浸润导致肿瘤细胞与脂肪细胞发生接触。脂肪细胞一方面直接为肿瘤细胞提供营养物质, 另一方面通过分泌趋化因子、炎症因子、血管内皮生长因子和瘦素等增加肿瘤侵袭和转移[26]。此外, 研究发现与成熟脂肪细胞共培养的鼠源和人源乳腺癌细胞在体内外均表现出更高的侵袭能力, 主要是因为CAAs表型改变, 激素敏感性脂肪酶(HSL) 和血清脂联素(APN) 表达降低; 多种蛋白酶如MMP-11和促炎细胞因子如IL-6、IL-1β的释放增加而促进肿瘤的转移和恶性发展[27]。
上皮间质转化(epithelial-mesenchymal transition, EMT) 是指非活动性极化的上皮细胞向活动性非极化的间充质细胞转换, 其与肿瘤微环境密切相关, 能使肿瘤获得从原发性肿瘤部位迁移到远部器官的潜力并在该器官中生长[28]。EMT的标志蛋白包括E-钙黏附蛋白(E-cadherin)、N-钙黏附蛋白(N-cadherin) 和波形蛋白(vimentin), 触发EMT的关键调控因素主要包括缺氧和TGF-β[29]。TGF-β在肿瘤发生发展过程中起双刃剑的作用, 一方面TGF-β通过引起肿瘤细胞细胞周期阻滞, 诱导肿瘤细胞凋亡和自噬, 是原发性肿瘤发生早期的重要抑制剂; 另一方面TGF-β通过Smad、Wnt、Notch等通路诱导EMT, 改变肿瘤细胞极性, 降低细胞间黏附力, 增加肿瘤细胞的运动性, 是肿瘤晚期进展和转移的正向调节剂[30]。
1.3 TME理化性质的改变由于肿瘤生长速度较快, 代谢旺盛, 肿瘤往往处于乏氧、酸性和生长因子富集的局部环境中[31]。在肿瘤发生早期, 肿瘤细胞为快速生长而大量耗竭局部氧气和营养物质, 造成局部缺氧。缺氧可诱导肿瘤细胞释放缺氧诱导因子-1 (HIF-1)、VEGF、血管紧张素(Ang)、血小板衍生生长因子(PDGF) 等, 这些既能直接诱导和促进TEC的增殖和迁移, 又能吸引内皮祖细胞汇集肿瘤部位以参与肿瘤血管形成。但由于血管稳定性差和输氧能力不足, 无法满足肿瘤细胞的耗氧需求, 进一步加重了局部缺氧状态。Warburg等[32]发现, 即使氧气充足, 肿瘤细胞依旧显示出高水平的葡萄糖摄取和乳酸生成, 这现象被称为有氧糖酵解(Warburg效应)。肿瘤细胞中多种癌基因的激活和抑癌基因的缺失有利于有氧糖酵解。肿瘤细胞中编码丝氨酸/苏氨酸激酶Akt癌基因的激活, 增加了细胞表面葡萄糖转运蛋白(GLUT) 对葡萄糖的摄取和己糖激酶2 (HK2) 的磷酸化和糖酵解通量。MYC癌基因的激活直接激活糖酵解相关全部基因如HK2、烯醇酶和乳酸脱氢酶A (LDHA); 抑癌基因p53通过直接激活细胞色素C氧化合成酶2 (SCO2) 基因来合成SCO2以刺激线粒体有氧呼吸, 而p53或SCO2表达的缺失会导致细胞呼吸转变为有氧糖酵解, 增强Warburg效应[33]。有氧糖酵解产生大量乳酸和代谢产物使TME中pH明显低于正常组织, 同时由于大量消耗环境内葡萄糖和氨基酸等营养物质而使TME处于低葡萄糖水平。
1.4 TME的功能TME为肿瘤的发生发展提供支持和屏障。TME直接营养肿瘤细胞, 提供源源不断的能量, 还增加肿瘤细胞对抗肿瘤药物的耐药性。低氧、酸性和各种炎性因子等改变肿瘤细胞中基因的表达, 降低肿瘤细胞对抗肿瘤药物的敏感性。同时, TME中不成熟的脉管系统、高组织间液压力、ECM重塑等为肿瘤细胞构筑了高密度基质屏障, 而且肿瘤内部中渗透压梯度丧失, 这些均能影响抗肿瘤药物运输和渗透到肿瘤部位[34, 35]。TME有利于肿瘤细胞逃避宿主的免疫监视, 其理化环境的改变不利于效应T细胞和NK细胞的存活和功能发挥, 同时肿瘤细胞还能改变自身表型以逃避宿主的免疫监察。
2 天然产物靶向TME天然产物靶向肿瘤微环境发挥抗肿瘤作用是近年来的研究热点, 其中如萜类、黄酮类、生物碱类、醌类、多糖类和酚类等具有良好的抗肿瘤作用。天然产物大多具有多靶点、作用范围广、易获得等特点, 其不仅能直接作用于肿瘤细胞, 还能通过靶向肿瘤微环境辅助放化疗治疗以增加肿瘤敏感性、提高治疗效果和改善预后。同时, 天然产物能通过调节肿瘤微环境介导肿瘤免疫治疗。
2.1 萜类靶向TME类胡萝卜素(carotenoids) 是一类天然色素, 是从胡萝卜中得到的一类四萜化合物。饮食和人体中的主要类胡萝卜素包括β-胡萝卜素(β-carotene) (1)、叶黄素(lutein) (2) 和番茄红素(lycopene) (3) (图 1)[36]。β-胡萝卜素通过激活IL-6/STAT3信号通路减少肿瘤相关M2型巨噬细胞极化, 抑制TME诱导的肿瘤干细胞和EMT标志物的表达, 并抑制结肠癌细胞的侵袭和迁移[37]。番茄红素通过与PDGF相互作用, 调节ERK1/2、p38MAPK和JNK信号通路, 抑制黑色素瘤诱导的CAFs的迁移[38]。

|
Figure 1 The structures of 1-3 |
青蒿素(artemisinin) (4) 是从菊科植物黄花蒿中得到的一种倍半萜类化合物, 主要用于抗疟治疗。其衍生物包括蒿甲醚(artemether) (5)、双氢青蒿素(dihydroartemisinin) (6) (图 2), 近年来它们的抗肿瘤作用引起人们的广泛关注。青蒿素能诱导肿瘤细胞DNA损伤, 通过调节肿瘤抑制因子p53, 引起肿瘤细胞G1期阻滞, 诱导肿瘤细胞发生凋亡[39]。青蒿素和二氢青蒿素通过抑制TGF-β信号转导, 将L929-CAFs和CAFs从激活状态还原为失活状态, 抑制肿瘤和肿瘤微环境之间的相互作用, 从而抑制CAFs诱导的乳腺癌生长和转移[40]。
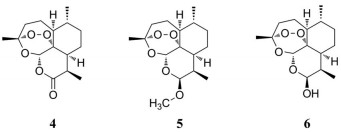
|
Figure 2 The structures of 4-6 |
紫杉醇(taxol) (7) 是从红豆杉属植物红豆杉的树皮中得到的一种复杂的四环二萜类化合物(图 3), 抗肿瘤效果显著, 是临床上重要的抗肿瘤药物, 其能通过诱导微管蛋白的聚合及抑制微管蛋白的解聚发挥抗肿瘤作用。近期研究发现紫杉醇对TME也有影响, 低浓度紫杉醇能抑制TME中MDSCs的聚集和免疫抑制功能, 抑制p38 MAPK、TNF-α和S100A9表达。通过恢复CD8+ T细胞功能, 抑制小鼠自发性黑色素瘤的发展, 延长动物存活率[41]。此外, 研究发现低浓度紫杉醇既不能增加MDSCs的凋亡也不能抑制MDSCs的生成, 但是可以刺激MDSC向树突状细胞的分化, 这个过程是TLR4依赖的[42]。
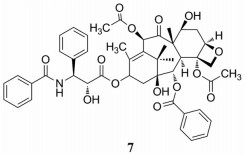
|
Figure 3 The structure of 7 |
槲皮素(quercetin) (8) 是从桑、连翘、红花等植物的花、叶、果实中得到的黄酮类化合物(图 4)。CAFs中Wnt16的表达是导致恶性肿瘤对顺铂耐药的关键因素。槲皮素能显著降低肿瘤相关成纤维细胞NIH3T3中Wnt16的表达, 重塑肿瘤细胞ECM, 抑制肿瘤的增殖和恶性进展[43]。肿瘤诱导的MDSCs通过激活STAT3抑制T细胞功能, 负调节免疫反应, 促进肿瘤从宿主免疫监视中逃脱。槲皮素通过激活ESR2/STAT3信号通路, 促进小鼠和人源性粒细胞髓样来源的抑制细胞(G-MDSC) 的存活, 并促进了T细胞抑制因子的体外分泌。因此, 使用槲皮素抗肿瘤治疗应考虑对MDSCs的促进作用[44]。将HUVEC与膀胱癌T24细胞与微流体装置共同培养模拟体内肿瘤微环境, 槲皮素能显著抑制共培养体系中MCT1和PFKFB3活性, 细胞凋亡增加而增殖减少[45]。
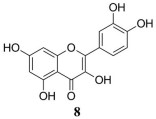
|
Figure 4 The structure of 8 |
黄芩素(baicalein) (9) 是从唇形科植物黄芩中得到的黄酮类化合物(图 5)。黄芩素可以时间和剂量依赖性的抑制M2型巨噬细胞的极化和乳腺癌细胞系活力, 在体内通过抑制TGF-β的释放, 抑制EMT而影响肿瘤的生长和肺转移[46]。黄芩素通过调节LN-322及其下游Rho家族小GTP酶, 介导乳腺上皮细胞与乳腺腺癌细胞之间的旁分泌相互作用, 从而调节癌细胞的运动性和形态可塑性, 抑制癌细胞在体内外的迁移和侵袭[47]。
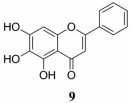
|
Figure 5 The structure of 9 |
水飞蓟素(silymarin) 是从菊科植物水飞蓟(乳蓟) 中得到的一类黄酮类化合物, 主要包括水飞蓟宾(silybin) (10和11)、水飞蓟亭(silychristin) (12和13) 和水飞蓟宁(silydianin) (14) (图 6)。水飞蓟素可以抑制MDSC在肿瘤组织中的比例, 通过降低iNOS2、Arg1和MMP9的mRNA水平抑制MDSC的功能; 增强CD8+ T细胞的浸润和功能, 抑制Lewis肺癌生长, 诱导肿瘤细胞凋亡[48]。TME中的肥大细胞与肿瘤血管生成, 促炎细胞因子的释放密切相关。水飞蓟素能抑制肥大细胞的募集, 降低MMP-2和MMP-9的表达, 从而抑制肿瘤的转移和发展[49]。

|
Figure 6 The structures of 10-14 |
CCR2抑制剂747 (15) 是松科植物长苞冷杉中一种结构上与山柰酚相似的化合物(图 7)。能通过调节CCL2/CCR2轴抑制肝癌中TAMs的浸润, 升高肿瘤中CD8+T细胞数量, 并以CD8+T细胞依赖性方式抑制原位和皮下肿瘤的生长[50]。

|
Figure 7 The structure of 15 |
小檗碱(berberine) (16) 是从毛茛科植物黄连中得到的季铵生物碱(图 8)。小檗碱可以通过抑制肿瘤相关成纤维细胞分泌IL-6, 从而抑制鼻咽癌细胞内STAT3信号转导, 抑制肿瘤生长并诱导细胞凋亡[51]。在结肠炎相关结直肠癌(CACRC) 的TME中, 小檗碱通过干扰TAMs分泌促炎细胞因子IL-6和TNF-α, 影响下游EGFR/ERK信号传导, 抑制CACRC细胞增殖和肿瘤发展[52]。

|
Figure 8 The structure of 16 |
苦参碱(matrine, MT) (17) 和氧化苦参碱(oxymatrine, OMT) (18) 是从豆科植物苦参中得到的两种生物碱(图 9)。研究发现, OMT能影响肺癌TME中DC-Treg系统; 能增加DC中CD83、CD86、CD11c和MHC Ⅱ的表达, 促进DC的分化和成熟; 能增加抗炎和促炎细胞因子的释放, 诱导T细胞分化; 能有效抑制裸鼠原位胰腺癌异种移植瘤的血管生成, 延长小鼠的中位存活时间[53]。将OMT-DCs-T与A549/DDP共同培养, 能增强肺癌细胞凋亡和逆转其对顺铂的耐药性[54]。MT通过增加NK细胞中NKG2D受体和白血病细胞系中和MIC A/B配体的表达, 增强NK和CIK细胞对K562细胞的毒性。MT处理后NK细胞上清中IL-1α、IFN-γ和TNF-α等细胞因子的释放减少, 进而通过调节免疫功能抑制白血病细胞的增殖[55]。
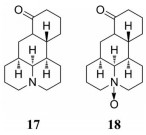
|
Figure 9 The structures of 17 and 18 |
海鞘素(trabectedin, Et-743) (19) 是从海洋被囊动物红树海鞘中得到的结构极为复杂的海洋天然产物(图 10), 其不仅能通过激活巨噬细胞中caspase-8信号转导途径导致巨噬细胞发生凋亡, 还能抑制单核细胞分化为巨噬细胞而抑制促炎因子CCL2和IL-6的产生[56], 并通过调节肿瘤微环境而增强抗肿瘤作用。
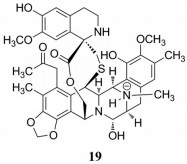
|
Figure 10 The structure of 19 |
大黄素(emodin) (20) 主要是从蓼科植物大黄和虎杖的根及根茎中得到的一种羟基蒽酮类化合物(图 11), 其调节肿瘤微环境活性受到人们广泛关注。大黄素能阻断肿瘤细胞和TAM相互作用, 抑制M2型巨噬细胞极化, 并通过减少肿瘤细胞的旁分泌和邻分泌抑制巨噬细胞向转移部位的迁移和募集, 改善TME的免疫抑制状态[57]。在乳腺癌中, 虽然大黄素对原发肿瘤的生长没有明显影响, 但通过抑制TAM诱导乳腺癌细胞的EMT和肿瘤干细胞的形成, 调节TAM介导的T细胞活化和抑制肿瘤血管的生成, 减少乳腺癌的肺转移[58]。
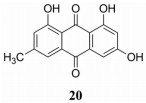
|
Figure 11 The structure of 20 |
紫草素(shikonin) (21) 是从紫草科植物紫草、新疆紫草和藏紫草的根中得到的一种萘醌类化合物(图 12)。紫草素刺激NK细胞增殖并增加其对结肠癌细胞caco-2的细胞毒性, 通过增加NK细胞中Akt和ERK1/2的磷酸化影响信号转导, 以剂量依赖的方式增强了颗粒酶和穿孔素的表达, 但不影响IFN-γ和TNF-α的表达[59]。紫草素能促进DC细胞成熟, 刺激肿瘤细胞的免疫原性细胞死亡, 同时增强Th1细胞和细胞毒性T细胞活性, 增强对肿瘤细胞的杀伤作用[60]。
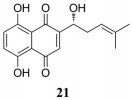
|
Figure 12 The structure of 21 |
多糖是由至少10个单糖通过糖苷键连接而形成的聚合高分子碳水化合物。目前研究发现来自真菌和植物的部分多糖不仅能直接作用于肿瘤细胞, 还能通过增加机体免疫发挥抗肿瘤活性, 如灵芝多糖、铁皮石斛多糖、人参多糖、黄芪多糖、香菇多糖、姬松茸多糖等[61]。灵芝多糖在结肠癌中虽不能直接杀死结肠癌CT26细胞, 但可通过激活腹膜巨噬细胞, 增强巨噬细胞吞噬作用, 显著抑制CT26荷瘤小鼠的肿瘤生长[62]。铁皮石斛多糖通过调节细胞毒性T淋巴细胞的代谢降低PD-1的表达, 增强抗肿瘤免疫应答, 抑制AOM/DSS诱导的小鼠结肠癌形成和生长[63]。人参多糖通过增加免疫抑制小鼠中NK细胞数量, 上调穿孔素和颗粒酶的表达, 从而提高宿主免疫防御和免疫监视能力[64]。黄芪多糖在肝癌微环境中, 通过减少Th2细胞因子的分泌和降低FOXp3 mRNA表达, 以时间和剂量依赖性的抑制CD4+CD25+ Treg细胞活性和向肿瘤部位的迁移募集, 延长肝癌患者的存活率[65]。
2.6 其他成分靶向TME姜黄素(curcumin) (22) 是来源于姜黄、莪术、菖蒲等植物根茎中的一种脂溶性酚类化合物(图 13)。姜黄素增加TME中CD4+ T细胞和CD8+ T细胞数量以及减少CD4+CD25+Foxp3+Treg细胞数量, 同时通过增加IFN-γ分泌并减少IL-4、TGF-β和IL-10的产生, 促进Treg细胞转化为Th1细胞, 从而恢复宿主的免疫监视能力[66, 67]。将人结肠癌细胞HCT116和正常人成纤维细胞MRC-5共同培养以建立高密度肿瘤微环境共培养模型。姜黄素能增加该模型中CD133+的结肠癌干细胞对5-FU的敏感性, 下调HCT116细胞中MMP-13、TGF-β3/TGF-β3R、vimentin和slug表达, 增加E-cadherin的表达, 阻断NF-κB信号通路, 从而抑制CRC与CAF之间的协同串扰和EMT[68]。
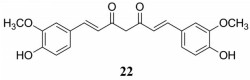
|
Figure 13 The structure of 22 |
白藜芦醇(resveratrol) (23) 是从豆科、百合科、茄科等植物茎叶果实及多种可食用水果中得到的一种酚类化合物(图 14)。在低氧和酸性条件下, 白藜芦醇对人胰腺癌细胞毒性增强, 能诱导DNA片段化和细胞凋亡, 但对正常细胞没有影响。白藜芦醇能抑制HIF-1α诱导的羰基还原酶1 (CBR1) 的表达, 增加低氧乳腺癌细胞对阿霉素的敏感性[69]。白藜芦醇能增强大肠癌细胞对5-FU的敏感性, 主要通过抑制EMT, 降低vimentin和slug表达和增加E-cadherin表达; 抑制NF-κB信号通路及其向细胞核的转运, 下调NF-κB调控的基因终产物MMP-9和caspase-3的表达, 而抑制肿瘤细胞的转移和逆转肿瘤耐药[70]。白藜芦醇抑制低氧诱导的胰腺癌细胞BxPC-3和Panc-1中ROS的产生, 通过下调hedgehog信号通路抑制HIF-1α及转移相关因子表达和低氧诱导的胰腺癌细胞的转移[71]。白藜芦醇通过抑制VEGF-C诱导的人淋巴管内皮细胞(HLEC) 迁移、侵袭和淋巴管生成, 抑制TAMs中M2型巨噬细胞激活和分化[72]。
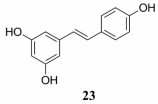
|
Figure 14 The structure of 23 |
表没食子儿茶素没食子酸酯(EGCG) (24) 是从山茶科植物绿茶中得到的一种多酚类化合物(图 15)。EGCG能抑制乳腺癌细胞中CSF-1和CCL-2表达, 通过上调外泌体miR-16水平下调IKKα, 进而诱导TAMs中的IκB积累, 抑制M2型巨噬细胞的极化, 从而抑制肿瘤的生长和恶性进展[73]。EGCG还通过抑制PI3K/AKT/mTOR/HIF1α信号通路, 抑制肿瘤细胞中VEGF-A的释放; 同时, 基质细胞中CXCL12的下调抑制了TECs的浸润, 使其血管生成受阻[74]。

|
Figure 15 The structure of 24 |
基于TME的深入研究对肿瘤治疗具有指导作用。TME与肿瘤密不可分, 充当着肿瘤生长过程中"土壤"的积极角色, 不仅通过新生肿瘤血管为肿瘤生长输送源源不断的营养物质, 还能通过多种免疫抑制细胞和免疫抑制因子帮助肿瘤逃避宿主的免疫检查, 为肿瘤构建坚固的屏障, 这些都有利于肿瘤细胞的恶性进展、转移和耐药[2, 75]。如何打破肿瘤微环境这个坚固的屏障, 抑制微环境中各种"促肿瘤"成分和促进"抑肿瘤"成分, 使肿瘤细胞孤立无援, 是目前抗肿瘤治疗的重点和难点。目前靶向TME中成分, 如靶向内皮细胞和周细胞能减少肿瘤新生血管形成; 靶向抑制TAM细胞的募集和分化, 增加NK细胞、DC细胞、CTL细胞的数量和活性, 能减少免疫抑制, 增强对肿瘤细胞的杀伤力; 靶向缺氧和酸性环境能增强肿瘤细胞的敏感性[76]。因此, 充分了解TME的组成和在肿瘤不同阶段发生的变化, 有助于针对特定肿瘤阶段制定有效的治疗方案。
天然来源的活性分子大多具有多靶点、作用范围广、易获得等特点。来源于传统天然药用植物的天然活性分子是抗肿瘤药物的重要来源[77, 78]。它们不仅能直接作用于肿瘤细胞, 也能靶向作用于TME中多个成分(图 16)。与传统的单靶点专一的放化疗方式相比, 多靶点全面的联合诊疗方式更能增加对肿瘤的杀伤作用, 提高肿瘤细胞对放化疗的敏感性, 减弱放化疗的不良反应, 降低肿瘤耐药和复发的风险。天然活性成分靶向肿瘤微环境是当前肿瘤联合治疗的研究热点。因此, 寻找来源丰富、效果显著、不良反应小的作用于肿瘤微环境的天然活性分子, 将成为今后抗肿瘤治疗的重要方向。本文综述了肿瘤微环境的物质组成及代表的天然产物靶向肿瘤微环境, 希望能为今后开发个性化的多靶点联合抗肿瘤药物提供一定的参考。

|
Figure 16 Natural products targeting tumor microenvironment |
作者贡献: 李玲负责文献检索与整理以及论文初稿的撰写; 汪哲和谭宁华负责论文选题、思路设计和文章修改, 对文章内容提出指导性意见。全体作者都阅读并同意最终的版本。
利益冲突: 本论文所有作者无任何利益冲突。
| [1] |
Liu Q, Zhang HF, Jiang XL, et al. Factors involved in cancer metastasis: a better understanding to "seed and soil" hypothesis[J]. Mol Cancer, 2017, 16: 176. DOI:10.1186/s12943-017-0742-4 |
| [2] |
Gajewski TF, Schreiber H, Fu YX. Innate and adaptive immune cells in the tumor microenvironment[J]. Nat Immunol, 2013, 14: 1014-1022. DOI:10.1038/ni.2703 |
| [3] |
Zhang X, Meng LH. Progress in molecularly targeted anti-tumor drugs derived from natural products or their derivatives[J]. Acta Pharm Sin (药学学报), 2020, 55: 2491-2500. |
| [4] |
Dutt R, Garg V, Khatri N, et al. Phytochemicals in anticancer drug development[J]. Anticancer Agents Med Chem, 2019, 19: 172-183. DOI:10.2174/1871520618666181106115802 |
| [5] |
Singh S, Sharma B, Kanwar SS, et al. Lead phytochemicals for anticancer drug development[J]. Front Plant Sci, 2016, 7: 1667. |
| [6] |
Böttcher JP, Bonavita E, Chakravarty P, et al. NK cells stimulate recruitment of CDC1 into the tumor microenvironment promoting cancer immune control[J]. Cell, 2018, 172: 1022-1037. DOI:10.1016/j.cell.2018.01.004 |
| [7] |
Wculek SK, Cueto FJ, Mujal AM, et al. Dendritic cells in cancer immunology and immunotherapy[J]. Nat Rev Immunol, 2020, 20: 7-24. DOI:10.1038/s41577-019-0210-z |
| [8] |
Basu R, Whitlock BM, Husson J, et al. Cytotoxic T cells use mechanical force to potentiate target cell killing[J]. Cell, 2016, 165: 100-110. DOI:10.1016/j.cell.2016.01.021 |
| [9] |
Shi X, Shiao SL. The role of macrophage phenotype in regulating the response to radiation therapy[J]. Transl Res, 2018, 191: 64-80. DOI:10.1016/j.trsl.2017.11.002 |
| [10] |
Xu J, Yu YJ, He XJ, et al. Tumor-associated macrophages induce invasion and poor prognosis in human gastric cancer in a cyclooxygenase-2/MMP9-dependent manner[J]. Am J Transl Res, 2019, 11: 6040-6054. |
| [11] |
Gordon SR, Maute RL, Dulken BW, et al. PD-1 expression by tumour-associated macrophages inhibits phagocytosis and tumour immunity[J]. Nature, 2017, 545: 495-499. DOI:10.1038/nature22396 |
| [12] |
Liu C, Chikina M, Deshpande R, et al. Treg cells promote the SREBP1-dependent metabolic fitness of tumor-promoting macrophages via repression of CD8+ T cell-derived interferon-γ[J]. Immunity, 2019, 51: 381-397. DOI:10.1016/j.immuni.2019.06.017 |
| [13] |
Toker A, Ohashi PS. Expression of costimulatory and inhibitory receptors in FoxP3+ regulatory T cells within the tumor microenvironment: implications for combination immunotherapy approaches[J]. Adv Cancer Res, 2019, 144: 193-261. |
| [14] |
Kumar V, Patel S, Tcyganov E, et al. The nature of myeloid-derived suppressor cells in the tumor microenvironment[J]. Trends Immunol, 2016, 37: 208-220. DOI:10.1016/j.it.2016.01.004 |
| [15] |
Gabrilovich DI, Ostrand-Rosenberg S, Bronte V. Coordinated regulation of myeloid cells by tumours[J]. Nat Rev Immunol, 2012, 12: 253-268. DOI:10.1038/nri3175 |
| [16] |
Chen XM, Song EW. Turning foes to friends: targeting cancer-associated fibroblasts[J]. Nat Rev Drug Discov, 2019, 18: 99-115. DOI:10.1038/s41573-018-0004-1 |
| [17] |
Ishii G, Ochiai A, Neri S. Phenotypic and functional heterogeneity of cancer-associated fibroblast within the tumor microenvironment[J]. Adv Drug Deliv Rev, 2016, 99: 186-196. DOI:10.1016/j.addr.2015.07.007 |
| [18] |
Jia CC, Wang GY, Wang TT, et al. Cancer-associated fibroblasts induce epithelial-mesenchymal transition via the transglutaminase 2-dependent IL-6/IL6R/STAT3 axis in hepatocellular carcinoma[J]. Int J Biol Sci, 2020, 16: 2542-2558. DOI:10.7150/ijbs.45446 |
| [19] |
Richards KE, Zeleniak AE, Fishel ML, et al. Cancer-associated fibroblast exosomes regulate survival and proliferation of pancreatic cancer cells[J]. Oncogene, 2017, 36: 1770-1778. DOI:10.1038/onc.2016.353 |
| [20] |
Liu TY, Zhou LL, Li DN, et al. Cancer-associated fibroblasts build and secure the tumor microenvironment[J]. Front Cell Dev Biol, 2019, 7: 60. DOI:10.3389/fcell.2019.00060 |
| [21] |
Boire A, Covic L, Agarwal A, et al. PAR1 is a matrix metalloprotease-1 receptor that promotes invasion and tumorigenesis of breast cancer cells[J]. Cell, 2005, 120: 303-313. DOI:10.1016/j.cell.2004.12.018 |
| [22] |
Dudley AC. Tumor endothelial cells[J]. Cold Spring Harb Perspect Med, 2012, 2: a006536. |
| [23] |
Sanctis FD, Ugel S, Facciponte J, et al. The dark side of tumor-associated endothelial cells[J]. Semin Immunol, 2018, 35: 35-47. DOI:10.1016/j.smim.2018.02.002 |
| [24] |
Cao ZW, Ding BS, Guo PP, et al. Angiocrine factors deployed by tumor vascular niche induce B cell lymphoma invasiveness and chemoresistance[J]. Cancer Cell, 2014, 25: 350-365. DOI:10.1016/j.ccr.2014.02.005 |
| [25] |
Akiyama K, Ohga N, Hida Y, et al. Tumor endothelial cells acquire drug resistance by MDR1 up-regulation via VEGF signaling in tumor microenvironment[J]. Am J Pathol, 2012, 180: 1283-1293. DOI:10.1016/j.ajpath.2011.11.029 |
| [26] |
Wu Q, Li B, Li ZY, et al. Cancer-associated adipocytes: key players in breast cancer progression[J]. J Hematol Oncol, 2019, 12: 95. DOI:10.1186/s13045-019-0778-6 |
| [27] |
Dirat B, Bochet L, Dabek M, et al. Cancer-associated adipocytes exhibit an activated phenotype and contribute to breast cancer invasion[J]. Cancer Res, 2011, 71: 2455-2465. DOI:10.1158/0008-5472.CAN-10-3323 |
| [28] |
Yang J, Antin P, Berx G, et al. Guidelines and definitions for research on epithelial-mesenchymal transition[J]. Nat Rev Mol Cell Biol, 2020, 21: 341-352. DOI:10.1038/s41580-020-0237-9 |
| [29] |
Lin YT, Wu KJ. Epigenetic regulation of epithelial-mesenchymal transition: focusing on hypoxia and TGF-β signaling[J]. J Biomed Sci, 2020, 27: 39. DOI:10.1186/s12929-020-00632-3 |
| [30] |
Hao Y, Baker D, Dijke PT. TGF-β-mediated epithelial-mesenchymal transition and cancer metastasis[J]. Int J Mol Sci, 2019, 20: 2767. DOI:10.3390/ijms20112767 |
| [31] |
Chen FF, Li XX, Sun L, et al. Advances in tumor microenvironment and related targeted drugs[J]. Acta Pharm Sin (药学学报), 2018, 53: 676-683. |
| [32] |
Warburg O. On the origin of cancer cells[J]. Science, 1956, 123: 309-314. DOI:10.1126/science.123.3191.309 |
| [33] |
Hsu PP, Sabatini DM. Cancer cell metabolism: warburg and beyond[J]. Cell, 2008, 134: 703-707. DOI:10.1016/j.cell.2008.08.021 |
| [34] |
Sun Y. Tumor microenvironment and cancer therapy resistance[J]. Cancer Lett, 2016, 380: 205-215. DOI:10.1016/j.canlet.2015.07.044 |
| [35] |
Vasan N, Baselga J, Hyman DM. A view on drug resistance in cancer[J]. Nature, 2019, 575: 299-309. DOI:10.1038/s41586-019-1730-1 |
| [36] |
Pan P, Huang YW, Oshima K, et al. The immunomodulatory potential of natural compounds in tumor-bearing mice and humans[J]. Crit Rev Food Sci Nutr, 2019, 59: 992-1007. DOI:10.1080/10408398.2018.1537237 |
| [37] |
Lee NY, Kim Y, Kim YS, et al. β-Carotene exerts anti-colon cancer effects by regulating M2 macrophages and activated fibroblasts[J]. J Nutr Biochem, 2020, 82: 108402. DOI:10.1016/j.jnutbio.2020.108402 |
| [38] |
Chiang HS, Wu WB, Fang JY, et al. Lycopene inhibits PDGF-BB-induced signaling and migration in human dermal fibroblasts through interaction with PDGF-BB[J]. Life Sci, 2007, 81: 1509-1517. DOI:10.1016/j.lfs.2007.09.018 |
| [39] |
Efferth T. From ancient herb to modern drug: Artemisia annua and artemisinin for cancer therapy[J]. Semin Cancer Biol, 2017, 46: 65-83. DOI:10.1016/j.semcancer.2017.02.009 |
| [40] |
Yao YY, Guo QL, Cao Y, et al. Artemisinin derivatives inactivate cancer-associated fibroblasts through suppressing TGF-β signaling in breast cancer[J]. J Exp Clin Cancer Res, 2018, 37: 282. DOI:10.1186/s13046-018-0960-7 |
| [41] |
Sevko A, Michels T, Vrohlings M, et al. Antitumor effect of paclitaxel is mediated by inhibition of myeloid-derived suppressor cells and chronic inflammation in the spontaneous melanoma model[J]. J Immunol, 2013, 190: 2464-2471. DOI:10.4049/jimmunol.1202781 |
| [42] |
Michels T, Shurin GV, Naiditch H, et al. Paclitaxel promotes differentiation of myeloid-derived suppressor cells into dendritic cells in vitro in a TLR4-independent manner[J]. J Immunotoxicol, 2012, 9: 292-300. DOI:10.3109/1547691X.2011.642418 |
| [43] |
Hu K, Miao L, Goodwin TJ, et al. Quercetin remodels the tumor microenvironment to improve the permeation, retention, and antitumor effects of nanoparticles[J]. ACS Nano, 2017, 11: 4916-4925. DOI:10.1021/acsnano.7b01522 |
| [44] |
Ma Z, Xia Y, Hu C, et al. Quercetin promotes the survival of granulocytic myeloid-derived suppressor cells via the ESR2/STAT3 signaling pathway[J]. Biomed Pharmacother, 2020, 125: 109922. DOI:10.1016/j.biopha.2020.109922 |
| [45] |
Hu KY, Wang DG, Liu PF, et al. Targeting of MCT1 and PFKFB3 influences cell proliferation and apoptosis in bladder cancer by altering the tumor microenvironment[J]. Oncol Rep, 2016, 36: 945-951. DOI:10.3892/or.2016.4884 |
| [46] |
Zhao X, Qu J, Liu X, et al. Baicalein suppress EMT of breast cancer by mediating tumor-associated macrophages polarization[J]. Am J Cancer Res, 2018, 8: 1528-1540. |
| [47] |
Terabayashi T, Hanada K, Motani K, et al. Baicalein disturbs the morphological plasticity and motility of breast adenocarcinoma cells depending on the tumor microenvironment[J]. Genes Cells, 2018, 23: 466-479. DOI:10.1111/gtc.12584 |
| [48] |
Wu TC, Liu W, Guo W, et al. Silymarin suppressed lung cancer growth in mice via inhibiting myeloid-derived suppressor cells[J]. Biomed Pharmacother, 2016, 81: 460-467. DOI:10.1016/j.biopha.2016.04.039 |
| [49] |
Komi DEA, Redegeld FA. Role of mast cells in shaping the tumor microenvironment[J]. Clin Rev Allergy Immunol, 2020, 58: 313-325. DOI:10.1007/s12016-019-08753-w |
| [50] |
Yao WB, Ba Q, Li XG, et al. A natural CCR2 antagonist relieves tumor-associated macrophage-mediated immunosuppression to produce a therapeutic effect for liver cancer[J]. EBioMedicine, 2017, 22: 58-67. DOI:10.1016/j.ebiom.2017.07.014 |
| [51] |
Tsang CM, Cheung YC, Lui VWY, et al. Berberine suppresses tumorigenicity and growth of nasopharyngeal carcinoma cells by inhibiting STAT3 activation induced by tumor associated fibroblasts[J]. BMC Cancer, 2013, 13: 619. DOI:10.1186/1471-2407-13-619 |
| [52] |
Li DD, Zhang YY, Liu K, et al. Berberine inhibits colitis-associated tumorigenesis via suppressing inflammatory responses and the consequent EGFR signaling-involved tumor cell growth[J]. Lab Invest, 2017, 97: 1343-1353. DOI:10.1038/labinvest.2017.71 |
| [53] |
Chen H, Zhang JH, Luo J, et al. Antiangiogenic effects of oxymatrine on pancreatic cancer by inhibition of the NF-κB-mediated VEGF signaling pathway[J]. Oncol Rep, 2013, 30: 589-595. DOI:10.3892/or.2013.2529 |
| [54] |
Liu H, Zou M, Li P, et al. Oxymatrine-mediated maturation of dendritic cells leads to activation of FOXP3+/CD4+ Treg cells and reversal of cisplatin‑resistance in lung cancer cells[J]. Mol Med Rep, 2019, 19: 4081-4090. |
| [55] |
Zhang L, Zhang HZ, Zhu ZC, et al. Matrine regulates immune functions to inhibit the proliferation of leukemic cells[J]. Int J Clin Exp Med, 2015, 8: 5591-5600. |
| [56] |
Allavena P, Signorelli M, Chieppa M, et al. Anti-inflammatory properties of the novel antitumor agent yondelis (trabectedin): inhibition of macrophage differentiation and cytokine production[J]. Cancer Res, 2005, 65: 2964-2971. DOI:10.1158/0008-5472.CAN-04-4037 |
| [57] |
Iwanowycz S, Wang J, Altomare D, et al. Emodin bidirectionally modulates macrophage polarization and epigenetically regulates macrophage memory[J]. J Biol Chem, 2016, 291: 11491-11503. DOI:10.1074/jbc.M115.702092 |
| [58] |
Liu Q, Hodge J, Wang JF, et al. Emodin reduces breast cancer lung metastasis by suppressing macrophage-induced breast cancer cell epithelial-mesenchymal transition and cancer stem cell formation[J]. Theranostics, 2020, 10: 8365-8381. DOI:10.7150/thno.45395 |
| [59] |
Boulos JC, Rahama M, Hegazy MEF, et al. Shikonin derivatives for cancer prevention and therapy[J]. Cancer Lett, 2019, 459: 248-267. DOI:10.1016/j.canlet.2019.04.033 |
| [60] |
Lin TJ, Lin HT, Chang WT, et al. Shikonin-enhanced cell immunogenicity of tumor vaccinis mediated by the differential effects of DAMP components[J]. Mol Cancer, 2015, 14: 174. |
| [61] |
Liu LQ, Nie SP, Xie MY. Tumor microenvironment as a new target for tumor immunotherapy of polysaccharides[J]. Crit Rev Food Sci Nutr, 2016, 56(Suppl 1): S85-94. |
| [62] |
Zhang SS, Nie SP, Huang DF, et al. Immunomodulatory effect of Ganoderma atrum polysaccharide on CT26 tumor-bearing mice[J]. Food Chem, 2013, 136: 1213-1219. DOI:10.1016/j.foodchem.2012.08.090 |
| [63] |
Liang J, Li HH, Chen JQ, et al. Dendrobium officinale polysaccharides alleviate colon tumorigenesis via restoring intestinal barrier function and enhancing anti-tumor immune response[J]. Pharmacol Res, 2019, 148: 104417. DOI:10.1016/j.phrs.2019.104417 |
| [64] |
Sun YY, Guo MF, Feng YJ, et al. Effect of Ginseng polysaccharides on NK cell cytotoxicity in immunosuppressed mice[J]. Exp Ther Med, 2016, 12: 3773-3777. DOI:10.3892/etm.2016.3840 |
| [65] |
Li Q, Bao JM, Li XL, et al. Inhibiting effect of Astragalus polysaccharides on the functions of CD4+CD25high Treg cells in the tumor microenvironment of human hepatocellular carcinoma[J]. Chin Med J (Engl), 2012, 125: 786-793. |
| [66] |
Weng WH, Goel A. Curcumin and colorectal cancer: an update and current perspective on this natural medicine[J]. Semin Cancer Biol, 2020. DOI:10.1016/j.semcancer.2020.02.011 |
| [67] |
Mukherjee S, Baidoo JNE, Fried A, et al. Using curcumin to turn the innate immune system against cancer[J]. Biochem Pharmacol, 2020, 176: 113824. DOI:10.1016/j.bcp.2020.113824 |
| [68] |
Buhrmann C, Kraehe P, Lueders C, et al. Curcumin suppresses crosstalk between colon cancer stem cells and stromal fibroblasts in the tumor microenvironment: potential role of EMT[J]. PLoS One, 2014, 9: e107514. DOI:10.1371/journal.pone.0107514 |
| [69] |
Han YJ, Jo HA, Cho JH, et al. Resveratrol as a tumor-suppressive nutraceutical modulating tumor microenvironment and malignant behaviors of cancer[J]. Int J Mol Sci, 2019, 20: 925. DOI:10.3390/ijms20040925 |
| [70] |
Buhrmann C, Shayan P, Kraehe P, et al. Resveratrol induces chemosensitization to 5-fluorouracil through up-regulation of intercellular junctions, epithelial-to-mesenchymal transition and apoptosis in colorectal cancer[J]. Biochem Pharmacol, 2015, 98: 51-68. DOI:10.1016/j.bcp.2015.08.105 |
| [71] |
Li W, Cao L, Chen X, et al. Resveratrol inhibits hypoxia-driven ROS-induced invasive and migratory ability of pancreatic cancer cells via suppression of the Hedgehog signaling pathway[J]. Oncol Rep, 2016, 35: 1718-1726. DOI:10.3892/or.2015.4504 |
| [72] |
Kimura Y, Sumiyoshi M. Resveratrol prevents tumor growth and metastasis by inhibiting lymphangiogenesis and M2 macrophage activation and differentiation in tumor-associated macrophages[J]. Nutr Cancer, 2016, 68: 667-678. DOI:10.1080/01635581.2016.1158295 |
| [73] |
Jang JY, Lee JK, Jeon YK, et al. Exosome derived from epigallocatechin gallate treated breast cancer cells suppresses tumor growth by inhibiting tumor-associated macrophage infiltration and M2 polarization[J]. BMC Cancer, 2013, 13: 421. DOI:10.1186/1471-2407-13-421 |
| [74] |
Wang JZ, Man GCW, Chan TH, et al. A prodrug of green tea polyphenol (-)-epigallocatechin-3-gallate (Pro-EGCG) serves as a novel angiogenesis inhibitor in endometrial cancer[J]. Cancer Lett, 2018, 412: 10-20. DOI:10.1016/j.canlet.2017.09.054 |
| [75] |
Quail DF, Joyce JA. Microenvironmental regulation of tumor progression and metastasis[J]. Nat Med, 2013, 19: 1423-1437. DOI:10.1038/nm.3394 |
| [76] |
Roma-Rodrigues C, Mendes R, Baptista PV, et al. Targeting tumor microenvironment for cancer therapy[J]. Int J Mol Sci, 2019, 20: 840. DOI:10.3390/ijms20040840 |
| [77] |
Cheng YT, Yang CC, Shyur LF. Phytomedicine-modulating oxidative stress and the tumor microenvironment for cancer therapy[J]. Pharmacol Res, 2016, 114: 128-143. DOI:10.1016/j.phrs.2016.10.022 |
| [78] |
Newman DJ, Cragg GM. Natural products as sources of new drugs over the nearly four decades from 01/1981 to 09/2019[J]. J Nat Prod, 2020, 83: 770-803. DOI:10.1021/acs.jnatprod.9b01285 |
 2021, Vol. 56
2021, Vol. 56


