2. 中国科学院上海药物研究所, 上海 201203
2. Shanghai Institute of Materia Medica, Chinese Academy of Sciences, Shanghai 201203, China
肿瘤是机体在内外致癌因素作用下, 细胞发生遗传变异、失去对生长增殖的正常调控、导致异常增生的恶性转化事件, 分为实体瘤和血液系统肿瘤。2018年全球统计报告显示, 全世界有1 810万肿瘤新发病例, 死亡人数约960万, 是严重威胁人类健康和生命的主要公共卫生问题之一。我国国家癌症中心最新统计数据显示, 肿瘤所导致的居民死亡占比为24%, 且随着发病/死亡人数的上升, 每年在肿瘤方面的医疗花费超过2 200亿[1-3]。因此, 针对各种肿瘤的新药研发、现有抗肿瘤药物新应用疗法的发现以及对其新临床治疗策略的探索是重要和迫切的任务。
近年来, 由于生命科学从理论到技术的快速发展, 一些新的肿瘤相关基因和细胞信号通路被发现, 极大地影响着抗肿瘤药物的研发。抗肿瘤药物也从低选择性、高毒性的传统化疗药向高选择性、低毒性的分子靶向药及新兴的肿瘤免疫治疗转变, 并努力开创彼此联合及协同治疗的新局面。此外, 将传统抗肿瘤药物与不断发展、优化的放射治疗相结合, 进一步延长了肿瘤患者的生命, 并提高了患者的生存质量。
虽然分子靶向药物的应用越来越广泛, 但由于尚有很多无明确靶点的肿瘤类型及患者必须依赖传统化疗药, 因此传统化疗药仍然是肿瘤治疗中不可或缺的重要组成部分。目前, 已有150多种应用于临床的传统化疗药具有疗效高、应用广泛等特点, 具有举足轻重的地位。为取得更好的疗效, 对传统抗肿瘤药物的结构进行修饰改造以增加其靶向性、降低毒性, 同时探索新的生物标志物, 实现个性化治疗以及联合给药成为新的研究方向。本文根据传统化疗药物的化学结构和来源分类, 对其临床应用拓展的现状和发展进行了总结和展望。
1 烷化剂类药物烷化剂是一类化学性质高度活泼的细胞毒类化疗药, 可自发进行分解或经酶分解后生成具有活性的亲电子化合物, 进而与细胞中含有丰富电子的生物大分子发生共价结合, 使细胞DNA分子发生断裂或其他生物大分子损伤, 导致肿瘤细胞死亡[4]。临床上常用的烷化剂主要有氮芥类和亚硝基脲类。烷化剂可用于多种肿瘤的治疗, 尤其在胰腺神经内分泌肿瘤(PNETs)治疗中被广泛使用, 对于O6-甲基鸟嘌呤-甲基转移酶(MGMT) 缺陷的PNETs, 烷化剂可延长患者的无进展生存期(PFS) 和总生存期(OS), 提高客观应答率。研究发现, MGMT缺乏可能是一个相关的生物标记物, 同时为了确定与MGMT互补的生物标记物和潜在的抗肿瘤协同作用靶点, 需要探索烷化剂诱导DNA损伤修复的机制, 如聚腺苷二磷酸-核糖聚合酶(poly-ADP-ribose polymerase, PARP) 等[5]。目前, 通过将单功能烷化剂引入新的生物活性基团, 从而使其向多功能烷化剂发展, 具有选择性好、活性高等特点, 近年成为此类抗肿瘤药物研究的热点[6]。
1.1 氮芥类1946年Goodman等[7]首先使用芥子气诊治淋巴瘤, 其后通过结构修饰降低了毒性, 得到了氮芥类抗肿瘤药物。氮芥类药物主要作用于细胞DNA, 可引起DNA分子内碱基复制错误或DNA双螺旋断裂, 导致肿瘤细胞分裂的抑制或死亡[8]。表皮生长因子受体(epidermal growth factor receptor, EGFR) 是一类重要的酪氨酸激酶(tyrosine kinase, TK) 受体, 其高度激活与多种肿瘤密切相关, 已成为肿瘤治疗的重要靶点[9, 10]。Rachid等[11]合成了一系列三氮烯类氮芥组合分子化合物(图 1-1), 能选择性地抑制EGFR, 使胞内信号转导受阻, 对EGFR高表达的前列腺癌细胞DU145具有显著的细胞毒活性。Chen等[12]设计合成了一系列新型环磷酰胺酯氮芥-喹唑啉偶联物(图 1-2), 其中化合物a显著抑制人表皮生长因子受体2 (human epidermal growth factor receptor 2, HER2) 高表达乳腺癌细胞BT474的增殖[半数抑制浓度(IC50) = 0.6 μmol·L-1], 大鼠口服的半衰期为1.7 h。Katsoulas等[13]也设计了一种BCR-ABL (BCR activator of RhoGEF and GTPase-ABL proto-oncogene 1, non-receptor tyrosine kinase) 与DNA的复合靶向化合物AK04 (图 1-3), 既能降低K562细胞中BCR-ABL的磷酸化, 也能诱导DNA损伤, 这使得AK04比传统氮芥具有更好的治疗优势。
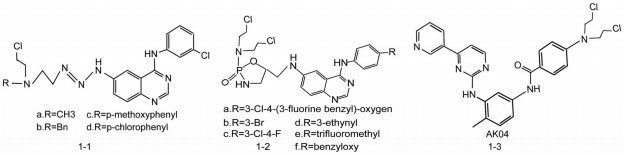
|
Figure 1 The structures of triazene nitrogen mustard and cyclophosphamide nitrogen mustard quinazoline |
亚硝基脲类药物分子中具有氯乙基亚硝基脲(chloroethylnitrosoureas, CENUs) 结构(图 2), 是一类作用于细胞DNA, 导致DNA碱基发生共价交联, 造成DNA损伤、阻碍DNA正常复制和转录, 从而诱导细胞死亡的抗肿瘤药物[14]。1960年, 美国癌症中心的研究者发现N-甲基-N-2-硝基-N-亚硝基胍(MNNG) 抑制小鼠L1210白血病细胞的存活[15]。在对MNNG进行结构修饰过程中, 发现了N-甲基-N-亚硝基脲(MNU) 对颅内移植的L1210细胞移植瘤具有更强的生长抑制活性。当用亲脂性较强的氯乙基取代MNU的N位点甲基基团后, 化合物能够穿过血脑屏障在颅内达到治疗浓度, 提高了该化合物治疗颅内肿瘤的活性。多种CENUs类化合物被合成用于恶性胶质瘤(glioblastoma, GBM)、黑色素瘤、胶质母细胞瘤以及霍奇金病等的治疗[16, 17], 如在临床广泛使用的卡莫司汀(carmustine, BCNU) 和洛莫司汀(lomustine, CCNU) 等药物。BCNU是一种静脉注射的GBM一线化疗药, 当与放疗联合应用, 患者的死亡率可减少15%[18]。目前, 由于类似新药物的发展, 该药的临床应用已基本停止。CCNU是另一种取代BCNU治疗GBM及晚期GBM的口服制剂, 目前许多国家正考虑将其作为替莫唑胺治疗GBM失败后的标准二线治疗方案[19]。但研究发现, 亚硝基脲能够诱发二次肿瘤, 因而也在多种动物肿瘤模型中加以研究和确认。

|
Figure 2 The structures of chloroethylnitrourea and its derivatives |
为加强治疗效果, 研究人员探索了不同的CENUs联合用药以及针对不同肿瘤的辅助治疗方案。Brandes等[20]报道了在GBM手术后早期给药BCNU化疗, 同时使用卡铂-替尼泊苷的放化疗相结合以及放疗后再给予BCNU, 结果显示该方案可行且患者耐受性好。BCNU联合X射线立体定向放射治疗脑转移瘤, 患者中位生存期为12.5个月, 1年生存率为53%[21]。在CCNU和贝伐单抗(bevacizumab, VEGF抗体) 单药以及CCNU-贝伐单抗联合治疗GBM的一项临床Ⅱ期试验中, CCNU-贝伐单抗组合比单药具有更好的治疗响应率(39%) 和更长的PFS (42%)[22]。Chen等[23]也做了亚硝基脲类药物联合贝伐单抗治疗复发高级别胶质瘤的单臂Ⅱ期临床研究, 证实了贝伐单抗联合亚硝基脲类药物治疗复发晚期胶质瘤安全有效。
2 铂类药物20世纪60年代, 自美国教授Rosenberg等[24]首次发现顺铂(cisplatin, DDP) 具有强抗肿瘤活性后, 多种铂类药物相继被研发用于肿瘤治疗。针对各代铂类药物出现的毒副作用及其耐药性, 在以DDP为母体结构的基础上不断进行优化、修饰产生了若干DDP的衍生物, 如卡铂(carboplatin, CBP) 和奈达铂(nedaplatin, NDP) 等。铂类抗癌药物主要通过影响DNA的结构和功能而发挥抗肿瘤作用, 是使用最广泛且最有效的抗肿瘤药物之一。70%~80%的临床化疗方案以铂为主或包含铂类药物。如顺铂或卡铂与西妥昔单抗联用是治疗复发或转移性头颈部肿瘤的一线治疗方案之一。顺铂、吉西他滨和分子靶向药联用对复发或铂耐药的卵巢透明细胞癌(ovarian clear cell carcinoma, OCCC) 具有较高响应率和可接受毒性, 是一种潜在治疗OCCC的方案[25]。由于头颈部肿瘤特殊的解剖位置, 对其器官和功能的保留将明显改善患者的生活质量。一项对MEDLINE、PubMed等数据库多项研究的meta分析发现, 以铂类为主的诱导化疗联合同期放化疗, 降低了眼眶剜除术的可能性[26]。宫颈癌是仅次于乳腺癌的第二大女性生殖系统恶性肿瘤, 以顺铂或顺铂联合氟尿嘧啶(fluorouracil, 5-FU) 为基础的放化疗是初治Ⅰb2~Ⅳa期宫颈癌的标准治疗方案, 患者的5年生存率约60%~75%[27]。
另外, 开发能够有效富集在肿瘤细胞靶点区域, 同时在特定因素刺激下能够迅速活化的抗肿瘤药物能够提高疗效, 同时降低药物的系统毒性。香港城市大学朱光宇教授课题组及其合作者[28]报道了一种能够有效富集在肿瘤细胞核核仁的光笼型四价铂前药coumaplatin (图 3), 该前药在可见光的照射下能够被迅速还原为奥沙利铂, 从而实现药物在肿瘤细胞靶点区域的富集以及选择性活化。南京大学研究团队[29]将顺铂前药(HSPt) 与聚乙二醇(PEG) 修饰的超顺磁氧化铁纳米颗粒(SPION) 连接起来, 得到了HSPt-PEG-SPION的肿瘤诊疗体系。该体系具有良好的生物相容性和磁靶向功能, 能够减少铂类药物使用所产生的系统毒性和克服肿瘤细胞的耐药性。在精准医学理念下, 对有临床意义的相关分子生物标志物的探索是实现个体化治疗的关键所在。研究者对铂类药物个体化治疗进行了探索, 发现了核苷酸切除修复交叉互补组1 (ERCC1)、乳腺及卵巢癌易感基因(breast cancer susceptibility gene, BRCA)、受体相关蛋白80 (receptor-associated protein 80, RAP80) 和硫嘌呤甲基转移酶(thiopurine S-methyltransferase, TPMT), 其中BRCA与TPMT对于铂类药物的个体化临床应用具有一定的指导意义[30, 31]。
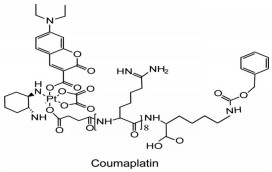
|
Figure 3 The structure of coumaplatin |
通常抗代谢类抗肿瘤药物的化学结构与体内某些代谢物相似, 但不具有相应功能, 从而干扰核酸、蛋白质的生物合成和利用, 导致肿瘤细胞死亡。该类药物大多为核苷类似物, 能特异干扰核酸代谢, 抑制肿瘤细胞的分裂和增殖, 最终导致肿瘤细胞死亡[32]。抗代谢抗肿瘤药按作用原理分为嘧啶拮抗物、嘌呤拮抗物和叶酸拮抗物。抗代谢类药物大大提高了药物应答率和肿瘤患者的生存率, 但其局限性也随着临床的广泛应用而显现。因此, 开发高效、低毒、靶向性强的前药成为新的研究方向。
3.1 嘧啶类拮抗物嘧啶拮抗物包括尿嘧啶衍生物和胞嘧啶衍生物, 如用于临床的尿嘧啶衍生物5-FU、胞嘧啶衍生物阿糖胞苷(cytarabine) (图 4)。该类药物通过干扰肿瘤细胞DNA的合成和复制发挥抗肿瘤作用, 对消化道肿瘤和急性髓细胞白血病(AML) 有良好疗效, 如对5-FU进行结构改造得到的多个衍生物如口服的卡培他滨(capecitabine) 和替加氟等。目前, 阿糖胞苷、5-FU及其衍生物与其他药物联用广泛用于多种肿瘤的治疗。阿糖胞苷和酪氨酸激酶抑制剂奎扎替尼(quizartinib) 联用治疗fms样酪氨酸激酶3 (fms related receptor tyrosine kinase 3, FLT3) 突变的AML可延长患者的总生存率[33]。在一项Ⅱ期临床试验中, 阿糖胞苷联合细胞周期依赖性激酶抑制剂(cyclin dependent kinases inhibitors, CDKIs) flavopiridol和米托蒽醌用于治疗62例AML成年患者, 53%的患者出现自限性的肿瘤细胞溶解, 75%的患者表现出完全缓解, 显示出良好的治疗效果[34]。2020年2月, FDA批准卡培他滨和来那替尼用于治疗已接受过两种或两种以上治疗方案的晚期或转移性HER2阳性乳腺癌患者。同年4月, HER2特异性抑制剂Tukysa (tucatinib) 获批上市, 与曲妥珠单抗和卡培他滨联用, 用于手术无法切除或转移性晚期HER2阳性乳腺癌患者的治疗[35]。此外, 卡培他滨还作为辐射增敏剂, 通常与放疗联合使用, 可使靶点对放疗更敏感[36]。对嘧啶拮抗物进行剂型改造, 以实现更好的肿瘤靶向性是该类药物优化的重要方向。如Wu等[37]研究开发了肿瘤靶向纳米粒(Cet-PEG-PLA-5FU-I), 该纳米粒在抑制细胞活力、诱导细胞凋亡以及在小鼠异种移植瘤模型中都表现出较好的抗肿瘤效果。近期研究显示, 5-FU除抑制肿瘤细胞增殖外, 对机体免疫系统功能亦有调节作用[38, 39]。5-FU与钙泊三醇联用可最佳激活CD4+ T细胞介导的免疫对抗光化性角化病, 对潜在的皮肤癌和其他肿瘤也具有协同治疗作用[40, 41]。默沙东(MSD) 公司研发的程序性死亡受体1 (programmed cell death protein 1, PD-1) 抑制剂Keytruda与5-FU、顺铂联用治疗局部晚期或转移性食管癌, 在关键性Ⅲ期临床试验中达到OS和PFS的主要终点, 显示出具有临床意义的重要改善。
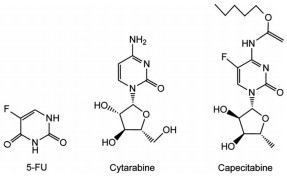
|
Figure 4 The structures of fluorouracil (5-FU) and its derivatives |
已上市的抗肿瘤嘌呤类似物, 包括巯嘌呤(mercaptopurine, 6-MP)、硫鸟嘌呤(tioguanine, 6-TG) 和硫唑嘌呤(azathioprine), 它们能特异性地抑制细胞周期S期嘌呤的合成, 在临床应用已达50余年, 主要用于急性淋巴细胞性白血病(ALL) 缓解期的维持治疗。此外, 硫唑嘌呤和6-MP还可用于缓解溃疡性结肠炎的维持治疗[42]。与单用英夫利昔单抗相比, 硫唑嘌呤联合英夫利昔单抗可更好地缓解克罗恩病[43]。但嘌呤类拮抗药治疗窗窄、选择性差, 严重不良反应发生率较高。如何减少其不良反应的发生, 成为该类药物临床应用面临的挑战, 目前此类药物的研究已少有报道[44]。
3.3 叶酸类拮抗物叶酸拮抗物是最早的一类抗代谢类抗癌药物, 通过抑制叶酸的合成影响DNA和RNA的合成, 能有效抑制肿瘤细胞的增殖。叶酸拮抗物的代表药物为甲氨喋呤(methotrexate, MTX) (图 5), 主要用于急性白血病和绒毛膜上皮癌的治疗, 临床上以高剂量MTX为基础的放化疗联合可用于原发性中枢神经系统淋巴瘤(PCNSL) 的治疗, 同时研究者发现错配修复蛋白(MMP) 和cMYC (MYC proto-oncogene, bHLH transcription factor) 蛋白的表达以及特定的深部位置可能是PCNSL治疗新的预测指标[45]。另有研究显示, 同时接受高剂量MTX和酪氨酸激酶抑制剂(TKI) 治疗的患者与未接受TKI抑制剂治疗的患者相比, MTX的清除率明显减慢, 这可能是由于转运蛋白SLCO1B1 (solute carrier organic anion transporter family member 1B1) 介导, 导致MTX的清除延迟[46]。通过对MTX进行结构修饰和改造, 得到普拉曲沙(pralatrexate) 和培美曲塞(pemetrexed, PEM)。普拉曲沙用于治疗复发性或化疗耐受性的外周T细胞淋巴瘤(peripheral T cell lymphomas, PTCLs)。在一项pralatrexate与罗米地辛(romidepsin) 联用的Ⅰ期临床研究中, 患者总体响应率为71%, 表现出很好的安全性和耐受性, 目前正在进行多中心的Ⅱ期临床研究[47, 48]。PEM对恶性胸膜间皮瘤及非小细胞肺癌等多种肿瘤均有较好的疗效。在复发性胸腺瘤患者中, 培美曲塞的响应率约为25%[49]。单剂量的派姆单抗(pembrolizumab, PD-1抗体)、贝伐单抗或两药联用可用于晚期非鳞状非小细胞肺癌的维持治疗, 在此基础上加用铂类能显著延长患者的PFS且耐受性良好[50, 51]。为克服肿瘤细胞耐药及PEM产生的剂量依赖性毒副作用, 一系列纳米制剂在改善PEM的溶解性、提高靶向性和生物利用度、增强疗效等方面取得了较大进展[52]。此外, 培美曲塞联合放射治疗肺腺癌脑转移瘤较单纯放疗有效, 不良反应减轻, 值得临床应用和推广[53]。Lu等[54]研究也显示培美曲塞联合立体定向消融放疗能使非鳞状非小细胞肺癌在维持治疗中获益最大化。

|
Figure 5 The structures of methotrexate and its derivatives |
抗肿瘤抗生素是指由链霉菌和少数放线菌自然产生的, 能够破坏肿瘤细胞DNA结构或抑制DNA功能的化合物, 其种类众多, 结构多样, 如蒽环类、放线菌素D、丝裂霉素和博来霉素等。其中, 蒽环类抗生素对实体瘤具有较好的抑制作用, 在杀伤癌细胞的同时还能诱导机体对肿瘤细胞产生免疫反应[55], 但该类药物在使用后产生的耐药性和引发的严重心脏毒性成为临床应用的一大障碍。以多柔比星(doxorubicine) 为代表介绍该类药物的研发进展(图 6)。
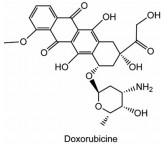
|
Figure 6 The structure of doxorubicine |
多柔比星被认为是肿瘤化疗最有效的药物之一, 通过抑制DNA和RNA合成而抑制肿瘤细胞增殖, 导致肿瘤细胞死亡。由于其广谱的抗肿瘤活性, 广泛用于急慢性白血病、乳腺癌、恶性淋巴瘤和肺癌等恶性肿瘤的治疗。临床上宫颈癌的治疗以放疗及手术治疗为主, 而中晚期宫颈癌患者以放疗与同步化疗为主, 当给予宫颈癌放疗患者多柔比星与顺铂联合化疗, 患者疾病控制率显著提高, 且毒副作用减轻[56]。经典的多柔比星普通制剂不具有靶向性, 如各种盐酸多柔比星注射液, 需经静脉注射进入体内后分布于全身, 在发挥药效的同时产生系统性毒副作用。通过改善剂型实现药物的肿瘤靶向递送是该类药物重要的研究方向。多柔比星脂质体注射液Doxil、多柔比星柠檬酸盐脂质体注射液Myocet已上市。同时, 新靶点和新载体的发现成为多柔比星靶向制剂的研究重点。最近研究发现, 交联环糊精有机骨架(CDF) 具有高度的肺靶向性, 并基于该特性设计了高效的肺靶向递药系统(RCLD) 以协同递送多柔比星和低分子肝素, 实现了多柔比星治疗肺癌时的高效减毒[57]。时间和顺序依赖化疗策略的结合也已显示出增强杀伤癌细胞的效力。EGFR抑制剂厄洛替尼预处理乳腺癌细胞MCF-7和MDA-MB-468可促进pro-caspase-8二聚化, 增强癌细胞对DNA损伤剂多柔比星的敏感性[58]。EGFR酪氨酸激酶抑制剂达克替尼可增强多柔比星的疗效, 尤其是对ABCG2 (ATP binding cassette subfamily G member 2) 过表达的多药耐药(MDR) 癌细胞[59]。此外, 将主动靶向治疗与免疫治疗相结合也初见端倪。研究发现, 多柔比星-牛血清蛋白偶联物可通过免疫治疗和主动靶向药物的双重作用发挥协同作用, 且疗效显著。
5 抗肿瘤植物药从植物中寻找高效低毒的抗肿瘤活性成分是全球抗肿瘤药物研发的重要策略。植物来源的抗肿瘤药来源广, 结构新颖多样, 是抗肿瘤药物的重要组成部分。目前, 应用于临床治疗的药物主要有长春碱类、喜树碱类、三尖杉酯碱类、鬼臼毒素衍生物和紫杉醇等。
5.1 长春碱类长春碱(vinblastine) 是从长春花中提取的一类二聚吲哚类生物碱(图 7), 通过干扰细胞周期的有丝分裂阻止细胞的增殖[60]。该类化合物用于临床治疗的药物包括长春新碱、长春地辛及异长春花碱等。它们具有广泛的抗肿瘤谱, 主要用于何杰金病及非小细胞肺癌、恶性淋巴瘤等的治疗。不同形式的综合治疗是癌症治疗的一种常见方法。长春碱与顺铂、博来霉素联用可作为播散性非精原细胞睾丸癌的一线治疗方案。长春新碱与利妥昔单抗联合环磷酰胺、多柔比星、泼尼松可显著提高弥漫性大B细胞淋巴瘤的疗效[61]。然而, 当长春花生物碱与γ-辐射联用却表现出相互拮抗作用, 进一步分析发现γ-辐射可能特异地阻断G2期细胞, 进而干扰长春花生物碱对细胞有丝分裂的阻滞和诱导凋亡的细胞毒作用[62]。获得性MDR是阻碍化疗效果的关键因素之一, 而MDR的发生多与肿瘤细胞ABC转运蛋白的过表达有关。Sun等[63]首次发现帕纳替尼抑制耐药相关蛋白7 (MRP7) 的功能并下调MRP7蛋白的表达, 从而促进长春新碱、紫杉醇、顺铂等在细胞内的积累, 增加它们的细胞毒性。此外, 长春碱和抗寄生虫药甲苯咪唑能够增强耐药胶质瘤对替莫唑胺的敏感性[64]。为了提高治疗指数和对肿瘤组织的靶向性, 研究人员在非活性位点引入靶向基团(特异性寡肽、单克隆抗体及叶酸等), 合成了一系列肿瘤靶向的长春碱类衍生物前药[65]。利用单克隆抗体药物的靶向特异性, 将长春新碱制成免疫脂质体制剂, 初步实验结果显示其在人B细胞淋巴瘤治疗方面具有潜在的应用前景[66]。

|
Figure 7 The structure of vinblastine |
喜树碱(camptothecin, CPT) 是从珙桐科植物-喜树的果实和皮中提取的一种广谱天然吲哚类生物碱(图 8), 通过抑制拓扑异构酶Ⅰ (topoisomerase Ⅰ, TopoⅠ) 发挥细胞毒活性, 属细胞周期特异性药物。目前主要用于卵巢癌、乳腺癌、白血病、膀胱癌等的治疗, 与其他类抗肿瘤药物没有交叉耐药, 因此对产生耐药的肿瘤也有治疗作用[67]。目前, 在临床上使用的喜树碱类抗肿瘤药物包括其衍生物拓扑替康(topotecan, TPT) 和伊立替康(irinotecan, CPT-11) 等。TPT联合三维适形放疗(3DCRT) 可作为铂耐药复发上皮性卵巢癌的一种替代疗法[68]。TPT和顺铂联合放疗在老年小细胞肺癌的Ⅱ期临床研究中显示出良好的治疗效果[69]。而伊立替康首先在日本批准用于临床, 如今已广泛用于结肠癌和其他实体瘤的治疗。伊立替康通常与其他抗肿瘤药物联用, 如与5-FU和奥沙利铂联用, 也可与单克隆抗体药物、激酶抑制剂和细胞周期检查点抑制剂联用[70]。由于喜树碱类药物在肿瘤治疗中的广泛应用, 该类药物的修饰改造非常活跃, 多个衍生物和含硅喜树碱尚在临床研究中[71, 72]。
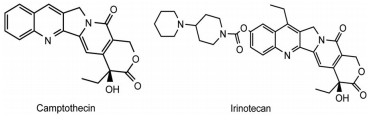
|
图 8 The structures of camptothecin and irinotecan |
纳米技术是提高药物靶向性、稳定性、改善生物利用度的有力工具, 在药物开发中具有很大的应用潜力, 喜树碱类纳米制剂药物的研究已广泛开展。You等[73]制备的新型喜树碱衍生物WCN-21纳米晶, 提高了在小鼠异种移植瘤组织中的积累及抗肿瘤效率。Zhan等[74]也开发了一种广谱的CPT/Ag纳米晶, 对多种敏感和耐药的肿瘤细胞都表现出极强的细胞毒活性, 此外, 肿瘤微环境触发该晶体中CPT的大量释放, 也促进了对细胞DNA的损伤和增加了其中的纳米银对肿瘤细胞凋亡的诱导能力。
5.3 三尖杉酯碱类三尖杉酯碱是从三尖杉及其同属植物中提取的生物碱, 主要有三尖杉酯碱(harringtonine, HT)、高三尖杉酯碱(homoharringtonine, HHT) 和异三尖杉酯碱等(图 9), 其中HT和HHT已被列入全世界36种抗癌药物之列。HT可导致细胞DNA合成障碍和干扰蛋白质合成, 抗瘤谱广, 与烷化剂及嘌呤类无交叉耐药, 可治疗急性早幼粒细胞白血病、急性单核细胞白血病及恶性淋巴瘤等。三尖杉酯碱类药物具有很好的抗肿瘤效果, 但其新的给药方式及机制有待进一步探索。在HT和HHT作用于p53野生型肝癌细胞株HepG2及p53突变型肝癌细胞株HuH-7.5的一系列实验中发现, 对于突变型和野生型的p53的肝癌细胞株, 内质网应激所造成的细胞死亡均与肿瘤坏死因子(TNF) 的诱导有关, 对于HT和HHT的临床应用具有指导意义[75]。Shi等[76]研究报道了HHT靶向EphB4 (EPH receptor B4), 通过抑制下游信号通路如PI3K/Akt及MAPK/Erk1/2来抑制结肠癌细胞LoVo的生长, 提示HHT可能通过抑制EphB4发挥作用, 具有治疗结肠癌的潜力。此外, HHT诱导伊马替尼耐药的人髓性白血病细胞K562中p62所介导的BCR-ABL蛋白自噬降解, 这为伊马替尼耐药的慢性髓细胞白血病(chronic myelocytic leukemia, CML) 提供了一个新的治疗策略[77]。
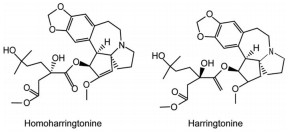
|
Figure 9 The structures of homoharringtonine and harringtonine |
鬼臼毒素(podophyllotoxin) 是1880年从小檗科鬼臼属植物中提取的天然木脂类抗肿瘤成分, 具有强烈的纺锤体毒性, 通过抑制肿瘤细胞的分裂而达到抗肿瘤作用, 曾用于小细胞肺癌、急性髓系白血病和恶性淋巴瘤等的治疗。由于鬼臼毒素不可耐受的毒性, 通过对其结构进行修饰改造得到一系列半合成鬼臼毒素类似物, 如依托泊苷(etoposide, VPl6) 及替尼泊苷(teniposide, VM26) (图 10)[78]。与鬼臼毒素不同, 依托泊苷和替尼泊苷通过诱导拓扑异构酶Ⅱ与DNA形成可切割复合物, 导致DNA损伤而发挥细胞毒作用。目前, 该类药物主要用于肺癌和恶性淋巴瘤等肿瘤的治疗。同时, 鬼臼毒素类似物与其他抗癌药的联合给药策略正在积极探索。在早期接受过铂类治疗的小细胞肺癌患者中, 依托泊苷、卡铂和免疫检查点抑制剂阿特珠单抗联用, 总体响应率和疾病控制率分别为38%和75%, 中位PFS为4个月, 这可能成为曾接受铂类化疗失败的小细胞肺癌的二线治疗选择[79]。Kumamoto等[80]报道指出, 依托泊苷与奈拉滨、福达滨联用, 使得T急性淋巴细胞白血病患者完全得到了缓解。另外, 用依托泊苷、异环磷酰胺、卡铂成功治疗了一例患有罕见病特纳综合征肝血小板性T细胞淋巴瘤的青少年患者[81]。对于ⅢA或ⅢB期非小细胞肺癌患者, 术前采用依托泊苷和顺铂联合高剂量放疗, 显示出有效且安全的特点[82]。另一项多中心Ⅲ期临床试验也表明, 同期胸部放疗与依托泊苷/顺铂联合比与卡铂/紫杉醇联合具有更好的OS[83]。对于原发性中枢神经系统淋巴瘤的治疗, 替尼泊苷联合甲氨蝶呤有效控制了患者肿瘤的生长, 极大地延长了患者的生存时间[84]。
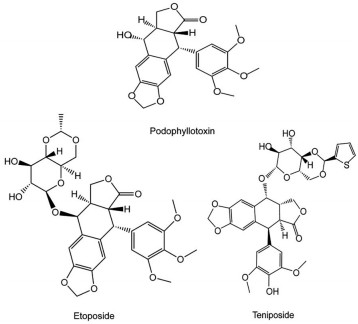
|
Figure 10 The structures of podophyllotoxin and its derivatives |
紫杉醇(taxol) 是1971年由Wani等首先从短叶红豆杉中提取分离得到(图 11)。紫杉醇通过促进微管蛋白聚合, 抑制细胞的分裂和增殖, 从而发挥抗肿瘤作用, 主要用于卵巢上皮癌、转移性乳腺癌和非小细胞肺癌及头颈癌的治疗[85]。由于紫杉醇抗肿瘤疗效显著、适应症不断扩大, 目前已成为全球销量排名第一的抗肿瘤药物。
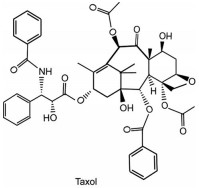
|
Figure 11 The structure of taxol |
紫杉醇水溶性低, 使用助溶剂的紫杉醇注射液会引发一系列过敏反应。因此, 为增强紫杉醇水溶性和靶向性, 研究者们已研发出紫杉醇脂质体、注射用白蛋白结合型紫杉醇、紫杉醇聚合物胶束和聚多巴胺表面功能化叶酸靶向紫杉醇纳米粒等具有靶向特异性的紫杉醇新型释药系统[86, 87]。另外, 紫杉醇的联合给药也正处在不同的临床研究阶段, 如Ⅱ期临床试验已证实紫杉醇联合口服IAP (inhibitor of apoptosis protein) 抑制剂LCL161可降解cIAP1/2, 激活caspase-3引起细胞凋亡, 可用于三阴性乳腺癌治疗[88]。对淋巴结阳性的乳腺癌患者, 紫杉醇同步放疗可缩短治疗时间, 并产生良好的耐受性和局部控制[89, 90]。紫杉醇联合小分子VEGFR-2抑制剂阿帕替尼比单药紫杉醇二线治疗胃癌临床效果更显著[91, 92]。抗体药为肿瘤治疗提供了一个新的选择, PD-1抗体联合紫杉醇可显著增强小鼠乳腺癌治疗的效果[93]。派姆单抗联合紫杉醇-卡铂显著改善了转移性鳞状非小细胞肺癌患者的OS、PFS和客观缓解率, 该临床结果进一步支持使用派姆单抗联合化疗作为转移性鳞状非小细胞肺癌的一线治疗[94]。将紫杉醇与西妥昔单抗联用治疗复发或转移性头颈癌, 患者PFS和总生存率得到了提高, 这可能成为该类肿瘤治疗的一个新方法[95, 96]。
6 结语经过数十年的不懈努力, 传统化疗药(表 1) 在恶性肿瘤的治疗中取得了巨大进步。药理作用越来越明确, 药物递送系统的改进使之更具靶向性, 临床治疗方案呈现多元化。传统化疗药是肿瘤化疗的基石, 虽然存在难以克服的毒性, 但是对现有药物的再定位、再利用和新适应症的发现, 已成为新抗肿瘤药物研究和产业发展的又一重要关注点。目前, 对该类药物的研究还在不断深入, 基于生物标志物的个性化治疗和联合用药方案将进一步拓展传统细胞毒类化疗药的应用, 并由此推动其进入新阶段。
| Table 1 A brief summary of the traditional antitumor drugs. 5-FU: Fluorouracil; PRAD: Prostate adenocarcinoma; BC: Breast carcinoma; LC: Lung carcinoma; GBM: Glioblastoma; AML: Acute myeloid leukemia; AL: Acute leukemia; PTCL: Peripheral T-cell lymphoma; CML: Chronic myelogenous leukemia; SCLC: Small cell lung cancer |
作者贡献: 徐焦负责该综述的文献调研与撰写; 卿晨和蒙凌华负责本文的指导与审阅。
利益冲突: 所有作者均声明不存在利益冲突。
| [1] |
Bray F, Ferlay J, Soerjomataram I, et al. Global cancer statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin, 2018, 68: 394-424. DOI:10.3322/caac.21492 |
| [2] |
Feng RM, Zong YN, Cao SM, et al. Current cancer situation in China: good or bad news from the 2018 Global Cancer Statistics?[J]. Cancer Commun (Lond), 2019, 39: 22. DOI:10.1186/s40880-019-0368-6 |
| [3] |
Zheng RS, Sun KX, Zhang SW, et al. Analysis of the prevalence of malignant tumors in China in 2015[J]. Chin J Oncol (中华肿瘤杂志), 2019, 41: 19-28. |
| [4] |
Kondo N, Takahashi A, Ono K, et al. DNA damage induced by alkylating agents and repair pathways[J]. J Nucleic Acids, 2010, 2010: 543531. |
| [5] |
De Mestier L, Couvelard A, Blazevic A, et al. Critical appraisal of MGMT in digestive NET treated with alkylating agents[J]. Endocr Relat Cancer, 2020, 27: R391-R405. DOI:10.1530/ERC-20-0227 |
| [6] |
Ge Y, Ren T, Cui X, et al. Research progress of novel multifunctional anticancer alkylating agents[J]. Chem Reagents (化学试剂), 2018, 40: 707-713, 720. |
| [7] |
Goodman LS, Wintrobe MM. Nitrogen mustard therapy; use of methyl-bis (beta-chloroethyl) amine hydrochloride and tris (beta-chloroethyl) amine hydrochloride for Hodgkin's disease, lymphosarcoma, leukemia and certain allied and miscellaneous disorders[J]. J Am Med Assoc, 1946, 132: 126-132. DOI:10.1001/jama.1946.02870380008004 |
| [8] |
Zhuang YY, Zhou CH, Wang YF, et al. Research progress of nitrogen mustard antitumor drugs[J]. Chin Pharm J (中国药学杂志), 2008, 43: 1281-1287. |
| [9] |
Asadipour A, Alipour M, Jafari M, et al. Novel coumarin-3-carboxamides bearing N-benzylpiperidine moiety as potent acetylcholinesterase inhibitors[J]. Eur J Med Chem, 2013, 70: 623-630. DOI:10.1016/j.ejmech.2013.10.024 |
| [10] |
Tian H. Research progress of targeted antitumor drugs[J]. World Clin Drugs (世界临床药物), 2008, 29: 494-501. |
| [11] |
Rachid Z, Brahimi F, Qiu Q, et al. Novel nitrogen mustard-armed combi-molecules for the selective targeting of epidermal growth factor receptor overexperessing solid tumors: discovery of an unusual structure-activity relationship[J]. J Med Chem, 2007, 50: 2605-2608. DOI:10.1021/jm070144p |
| [12] |
Chen JB, Zheng YF, Kong WQ, et al. Design, synthesis and anti-tumor activities of cyclic phosphoramidate mustard-quinazoline conjugates[J]. J Chin Pharm Sci (中国药学), 2017, 26: 727-736. |
| [13] |
Katsoulas A, Rachid Z, Brahimi F, et al. Cytokinetics and mechanism of action of AKO4: a novel nitrogen mustard targeted to BCR-ABL[J]. Leuk Res, 2005, 29: 565-572. DOI:10.1016/j.leukres.2004.11.011 |
| [14] |
Nikolova T, Roos WP, Kramer OH, et al. Chloroethylating nitrosoureas in cancer therapy: DNA damage, repair and cell death signaling[J]. Biochim Biophys Acta Rev Cancer, 2017, 1868: 29-39. DOI:10.1016/j.bbcan.2017.01.004 |
| [15] |
Ludlum DB. The chloroethylnitrosoureas sensitivity and resistance to cancer chemotherapy at the molecular level[J]. Cancer Invest, 1997, 15: 588-598. DOI:10.3109/07357909709047601 |
| [16] |
Rajski SR, Williams RM. DNA cross-linking agents as antitumor drugs[J]. Chem Rev, 1998, 98: 2723-2795. DOI:10.1021/cr9800199 |
| [17] |
Van den Bent MJ, Hegi ME, Stupp R. Recent developments in the use of chemotherapy in brain tumours[J]. Eur J Cancer, 2006, 42: 582-588. DOI:10.1016/j.ejca.2005.06.031 |
| [18] |
Stewart LA. Chemotherapy in adult high-grade glioma: a systematic review and meta-analysis of individual patient data from 12 randomised trials[J]. Lancet, 2002, 359: 1011-1018. DOI:10.1016/S0140-6736(02)08091-1 |
| [19] |
Brandes AA, Bartolotti M, Tosoni A, et al. Nitrosoureas in the management of malignant gliomas[J]. Curr Neurol Neurosci Rep, 2016, 16: 13. DOI:10.1007/s11910-015-0611-8 |
| [20] |
Brandes AA, Rigon A, Zampieri P, et al. Early chemotherapy and concurrent radio-chemotherapy in high grade glioma[J]. J Neurooncol, 1996, 30: 247-255. |
| [21] |
Zhao GY, Zhang SP, Zhang W, et al. Clinical efficacy of karazonium mustard combined with X-ray stereotactic radiotherapy in the treatment of brain metastases[J]. Chin J Clin Oncol Rehabil (中国临床肿瘤与康复), 2005, 12: 249-250. |
| [22] |
Taal W, Oosterkamp HM, Walenkamp AM, et al. Single-agent bevacizumab or lomustine versus a combination of bevacizumab plus lomustine in patients with recurrent glioblastoma (BELOB trial): a randomised controlled phase 2 trial[J]. Lancet Oncol, 2014, 15: 943-953. DOI:10.1016/S1470-2045(14)70314-6 |
| [23] |
Chen DK, Ding XJ, Zhang ZY, et al. Bevacizumab in combination with nitroso urea class medicines to treat recurrent high-grade gliomas one-armed Ⅱ period clinical research[J]. China Oncol (中国癌症杂志), 2018, 28: 649-656. |
| [24] |
Rosenberg B, VanCamp L, Trosko JE, et al. Platinum compounds: a new class of potent antitumour agents[J]. Nature, 1969, 222: 385-386. DOI:10.1038/222385a0 |
| [25] |
Simpkins F, Belinson JL, Rose PG. Avoiding bevacizumab related gastrointestinal toxicity for recurrent ovarian cancer by careful patient screening[J]. Gynecol Oncol, 2007, 107: 118-123. DOI:10.1016/j.ygyno.2007.06.004 |
| [26] |
Khoury T, Jang D, Carrau R, et al. Role of induction chemotherapy in sinonasal malignancies: a systematic review[J]. Int Forum Allergy Rhinol, 2019, 9: 212-219. DOI:10.1002/alr.22229 |
| [27] |
Sant M, Chirlaque Lopez MD, Agresti R, et al. Survival of women with cancers of breast and genital organs in Europe 1999-2007: results of the EUROCARE-5 study[J]. Eur J Cancer, 2015, 51: 2191-2205. DOI:10.1016/j.ejca.2015.07.022 |
| [28] |
Deng Z, Wang N, Liu Y, et al. A photocaged, water-oxidizing, and nucleolus-targeted Pt(Ⅳ) complex with a distinct anticancer mechanism[J]. J Am Chem Soc, 2020, 142: 7803-7812. DOI:10.1021/jacs.0c00221 |
| [29] |
Zhu Z, Wang Z, Hao Y, et al. Glutathione boosting the cytotoxicity of a magnetic platinum(iv) nano-prodrug in tumor cells[J]. Chem Sci, 2016, 7: 2864-2869. DOI:10.1039/C5SC04049C |
| [30] |
Olaussen KA, Dunant A, Fouret P, et al. DNA repair by ERCC1 in non-small-cell lung cancer and cisplatin-based adjuvant chemotherapy[J]. New Engl J Med, 2006, 355: 983-991. DOI:10.1056/NEJMoa060570 |
| [31] |
Vilmar AC, Santoni-Rugiu E, Sorensen JB. ERCC1 and histopathology in advanced NSCLC patients randomized in a large multicenter phase Ⅲ trial[J]. Ann Oncol, 2010, 21: 1817-1824. DOI:10.1093/annonc/mdq053 |
| [32] |
Henry JR, Mader MM. Recent advances in antimetabolite cancer chemotherapies[J]. Annu Rep Med Chem, 2004, 39: 161-172. |
| [33] |
Elmeliegy M, Den Haese J, Talati C, et al. Towards better combination regimens of cytarabine and FLT3 inhibitors in acute myeloid leukemia[J]. Cancer Chemother Pharmacol, 2020, 86: 325-337. DOI:10.1007/s00280-020-04114-z |
| [34] |
Karp JE, Smith BD, Levis MJ, et al. Sequential flavopiridol, cytosine arabinoside, and mitoxantrone: a phase Ⅱ trial in adults with poor-risk acute myelogenous leukemia[J]. Clin Cancer Res, 2007, 13: 4467-4473. DOI:10.1158/1078-0432.CCR-07-0381 |
| [35] |
Murthy RK, Loi S, Okines A, et al. Tucatinib, trastuzumab, and capecitabine for HER2-positive metastatic breast cancer[J]. N Engl J Med, 2020, 382: 597-609. DOI:10.1056/NEJMoa1914609 |
| [36] |
Barai S, Gambhir S, Rastogi N, et al. Effects of low-dose capecitabine on samarium-153-EDTMP therapy for painful bone metastases[J]. Indian J Nucl Med, 2015, 30: 111-115. DOI:10.4103/0972-3919.152955 |
| [37] |
Wu P, Zhu H, Zhuang Y, et al. Combined therapeutic effects of (131) I-labeled and 5Fu-loaded multifunctional nanoparticles in colorectal cancer[J]. Int J Nanomedicine, 2020, 15: 2777-2787. DOI:10.2147/IJN.S215137 |
| [38] |
Guo XX. Research progress on immunomodulatory effects of 5-fluorouracil[J]. Chin J Diffic Complicat Cases (疑难病杂志), 2019, 18: 627-630. |
| [39] |
Zhang YH, Zhao LT, Zhu B. Treatment with 5-fluorouracil can improve CD8+ T cell immune response[J]. Immunol J (免疫学杂志), 2014, 30: 293-296, 301. |
| [40] |
Cunningham TJ, Tabacchi M, Eliane JP, et al. Randomized trial of calcipotriol combined with 5-fluorouracil for skin cancer precursor immunotherapy[J]. J Clin Invest, 2017, 127: 106-116. |
| [41] |
Rosenberg AR, Tabacchi M, Ngo KH, et al. Skin cancer precursor immunotherapy for squamous cell carcinoma prevention[J]. JCI Insight, 2019, 4: e125476. DOI:10.1172/jci.insight.125476 |
| [42] |
Timmer A, Patton PH, Chande N, et al. Azathioprine and 6-mercaptopurine for maintenance of remission in ulcerative colitis[J]. Cochrane Database Syst Rev, 2016, 16: CD000478. |
| [43] |
Chande N, Townsend CM, Parker CE, et al. Azathioprine or 6-mercaptopurine for induction of remission in Crohn's disease[J]. Cochrane Database Syst Rev, 2016, 10: CD000545. |
| [44] |
Liu Y, Li MH, Xing XH. Research progress of nucleoside antitumor drugs[J]. Chin J New Drugs (中国新药杂志), 2012, 21: 2493-2498. |
| [45] |
Lee J, Shishido-Hara Y, Suzuki K, et al. Prognostic factors for primary central nervous system lymphomas treated with high-dose methotrexate-based chemo-radiotherapy[J]. Jpn J Clin Oncol, 2017, 47: 925-934. DOI:10.1093/jjco/hyx098 |
| [46] |
Ramsey LB, Mizuno T, Vinks AA, et al. Delayed methotrexate clearance in patients with acute lymphoblastic leukemia concurrently receiving dasatinib[J]. Pediatr Blood Cancer, 2019, 66: e27618. DOI:10.1002/pbc.27618 |
| [47] |
Pralatrexate for lymphoma[J]. Aust Prescr, 2019, 42: 77.
|
| [48] |
Amengual JE, Lichtenstein R, Lue J, et al. A phase 1 study of romidepsin and pralatrexate reveals marked activity in relapsed and refractory T-cell lymphoma[J]. Blood, 2018, 131: 397-407. DOI:10.1182/blood-2017-09-806737 |
| [49] |
Gbolahan OB, Porter RF, Salter JT, et al. A phase Ⅱ study of pemetrexed in patients with recurrent thymoma and thymic carcinoma[J]. J Thorac Oncol, 2018, 13: 1940-1948. DOI:10.1016/j.jtho.2018.07.094 |
| [50] |
Ramalingam SS, Dahlberg SE, Belani CP, et al. Pemetrexed, bevacizumab, or the combination as maintenance therapy for advanced nonsquamous non-small-cell lung cancer: ECOG-ACRIN 5508[J]. J Clin Oncol, 2019, 37: 2360. DOI:10.1200/JCO.19.01006 |
| [51] |
Li X, Abbas M, Li Y, et al. Comparative effectiveness of pemetrexed-platinum doublet chemotherapy with or without bevacizumab as first-line therapy for treatment-naive patients with advanced nonsquamous non-small-cell lung cancer in China[J]. Clin Ther, 2019, 41: 518-529. DOI:10.1016/j.clinthera.2019.02.004 |
| [52] |
Ling JX, Ning Q, Tang SS. Research progress of pemetrexine nano preparation[J]. China Med Herald (中国医药导报), 2019, 16: 63-66. |
| [53] |
Zhang G, Zeng R, Wang K, et al. Clinical efficacy and safety evaluation of pemetrexed combined with radiotherapy in treatment of patients with lung adenocarcinoma brain metastasis[J]. Oncol Lett, 2019, 17: 2874-2880. |
| [54] |
Lu SL, Hsu FM, Chen KY, et al. Maximizing benefits from maintenance pemetrexed with stereotactic ablative radiotherapy in oligoprogressive non-squamous non-small cell lung cancer[J]. Case Rep Oncol, 2016, 9: 474-480. DOI:10.1159/000448804 |
| [55] |
Obeid M, Panaretakis T, Joza N, et al. Calreticulin exposure is required for the immunogenicity of gamma-irradiation and UVC light-induced apoptosis[J]. Cell Death Differ, 2007, 14: 1848-1850. DOI:10.1038/sj.cdd.4402201 |
| [56] |
Li B, Zhang J. Effects of doxorubicin combined with cisplatin on the efficacy survival rate and toxic and side effects of radiotherapy for cervical cancer[J]. J Pract Clin Med (实用临床医药杂志), 2020, 24: 108-110. |
| [57] |
He YP, Xiong T, He SY, et al. Pulmonary targeting crosslinked cyclodextrin metal-organic frameworks for lung cancer therapy[J]. Adv Funct Maters, 2021, 31: 2004550. DOI:10.1002/adfm.202004550 |
| [58] |
Li YT, Qian XJ, Yu Y, et al. EGFR tyrosine kinase inhibitors promote pro-caspase-8 dimerization that sensitizes cancer cells to DNA-damaging therapy[J]. Oncotarget, 2015, 6: 17491-17500. DOI:10.18632/oncotarget.3959 |
| [59] |
Guo X, To KKW, Chen Z, et al. Dacomitinib potentiates the efficacy of conventional chemotherapeutic agents via inhibiting the drug efflux function of ABCG2in vitro and in vivo[J]. J Exp Clin Cancer Res, 2018, 37: 31. DOI:10.1186/s13046-018-0690-x |
| [60] |
Mohan R, Rastogi N, Namboothiri INN, et al. Synthesis and evaluation of alpha-hydroxymethylated conjugated nitroalkenes for their anticancer activity: inhibition of cell proliferation by targeting microtubules[J]. Bioorgan Med Chem, 2006, 14: 8073-8085. DOI:10.1016/j.bmc.2006.07.035 |
| [61] |
Li JT, Zhang QY. Targeted immunotherapy for diffuse large B cell lymphoma[J]. Med Recapit (医学综述), 2019, 25: 2372-2376. |
| [62] |
Sui M, Fan W. Combination of gamma-radiation antagonizes the cytotoxic effects of vincristine and vinblastine on both mitotic arrest and apoptosis[J]. Int J Radiat Oncol Biol Phys, 2005, 61: 1151-1158. DOI:10.1016/j.ijrobp.2004.12.028 |
| [63] |
Sun YL, Kumar P, Sodani K, et al. Ponatinib enhances anticancer drug sensitivity in MRP7-overexpressing cells[J]. Oncol Rep, 2014, 31: 1605-1612. DOI:10.3892/or.2014.3002 |
| [64] |
Kipper FC, Silva AO, Marc AL, et al. Vinblastine and antihelmintic mebendazole potentiate temozolomide in resistant gliomas[J]. Invest New Drugs, 2018, 36: 323-331. DOI:10.1007/s10637-017-0503-7 |
| [65] |
Zhang AH, Zhou BH. Advances in studies on the alkaloid derivatives and targeted prodrugs of vincriana[J]. Chin J New Drugs (中国新药杂志), 2009, 18: 1739-1744. |
| [66] |
Zhang YK, Huang YJ, LI Y, et al. Preparation of vincritin against CD20 immune liposomes and its targeted specific killing effect on human B-cell lymphoma[J]. J Liaocheng Univ (聊城大学学报), 2020, 33: 92-97. |
| [67] |
Borrelli S, Christodoulou MS, Ficarra I, et al. New class of squalene-based releasable nanoassemblies of paclitaxel, podophyllotoxin, camptothecin and epothilone A[J]. Eur J Med Chem, 2014, 85: 179-190. DOI:10.1016/j.ejmech.2014.07.035 |
| [68] |
Wei P, Zhang ZH, Li L, et al. Clinical observational study of conformal radiotherapy combined with topotecan chemotherapy in patients with platinum-resistant recurrent ovarian cancer[J]. Genet Mol Res, 2015, 14: 3833-3842. DOI:10.4238/2015.April.22.12 |
| [69] |
Kubo T, Fujiwara K, Hotta K, et al. A phase Ⅱ study of topotecan and cisplatin with sequential thoracic radiotherapy in elderly patients with small-cell lung cancer: Okayama Lung Cancer Study Group 0102[J]. Cancer Chemother Pharmacol, 2016, 78: 769-774. DOI:10.1007/s00280-016-3135-2 |
| [70] |
Bailly C. Irinotecan: 25 years of cancer treatment[J]. Pharmacol Res, 2019, 148: 104398. DOI:10.1016/j.phrs.2019.104398 |
| [71] |
Lazareva NF, Baryshok VP, Lazarev IM. Silicon-containing analogs of camptothecin as anticancer agents[J]. Arch Pharm (Weinheim), 2018, 351: 1700297. DOI:10.1002/ardp.201700297 |
| [72] |
Liu JJ, Zheng YY, Li TH. Pharmacological activity and rational drug use of alkaloids in antitumor drugs[J]. Chin J Clin Rational Drug Use (临床合理用药杂志), 2018, 11: 178-179. |
| [73] |
You J, Chen Y, Mohamed Alsayeh ZM, et al. Nanocrystals of a new camptothecin derivative WCN-21 enhance its solubility and efficacy[J]. Oncotarget, 2017, 8: 29808-29822. DOI:10.18632/oncotarget.16159 |
| [74] |
Zhan H, Zhou X, Cao Y, et al. Anti-cancer activity of camptothecin nanocrystals decorated by silver nanoparticles[J]. J Mater Chem B, 2017, 5: 2692-2701. DOI:10.1039/C7TB00134G |
| [75] |
Franco DP, de Biazi BI, Zanetti TA, et al. Apoptotic and cell cycle response to homoharringtonine and harringtonine in wild and mutant p53 hepatocarcinoma cells[J]. Hum Exp Toxicol, 2020, 39: 1405-1416. DOI:10.1177/0960327120926257 |
| [76] |
Shi X, Zhu M, Gong Z, et al. Homoharringtonine suppresses LoVo cell growth by inhibiting EphB4 and the PI3K/AKT and MAPK/EKR1/2 signaling pathways[J]. Food Chem Toxicol, 2020, 136: 110960. DOI:10.1016/j.fct.2019.110960 |
| [77] |
Li S, Bo ZL, Jiang Y, et al. Homoharringtonine promotes BCR-ABL degradation through the p62-mediated autophagy pathway[J]. Oncol Rep, 2020, 43: 113-120. |
| [78] |
Zhang X, Rakesh KP, Shantharam CS, et al. Podophyllotoxin derivatives as an excellent anticancer aspirant for future chemotherapy: a key current imminent needs[J]. Bioorgan Med Chem, 2018, 26: 340-355. DOI:10.1016/j.bmc.2017.11.026 |
| [79] |
Ishii H, Azuma K, Kawahara A, et al. Atezolizumab plus carboplatin and etoposide in small cell lung cancer patients previously treated with platinum-based chemotherapy[J]. Invest New Drugs, 2020. DOI:10.1007/s10637-020-00983-6 |
| [80] |
Kumamoto T, Goto H, Ogawa C, et al. FLEND (nelarabine, fludarabine, and etoposide) for relapsed T-cell acute lymphoblastic leukemia in children: a report from Japan Children's Cancer Group[J]. Int J Hematol, 2020, 112: 720-724. DOI:10.1007/s12185-020-02962-2 |
| [81] |
Lauhan CR, Schiff D, Gloude N. Successful treatment of hepatosplenic T cell lymphoma in an adolescent with Turner syndrome using ifosfamide, carboplatin, and etoposide followed by allogeneic hematopoietic stem cell transplant[J]. Pediatr Blood Cancer, 2020, 67: e28528. |
| [82] |
Allen AM, Shochat T, Flex D, et al. High-dose radiotherapy as neoadjuvant treatment in non-small-cell lung cancer[J]. Oncology, 2018, 95: 13-19. DOI:10.1159/000487928 |
| [83] |
Liang J, Bi N, Wu S, et al. Etoposide and cisplatin versus paclitaxel and carboplatin with concurrent thoracic radiotherapy in unresectable stage Ⅲ non-small cell lung cancer: a multicenter randomized phase Ⅲ trial[J]. Ann Oncol, 2017, 28: 777-783. DOI:10.1093/annonc/mdx009 |
| [84] |
Wang YX, Huang Y, Xu XP, et al. Curative effect of methotrexate combined with teniposide in the treatment of primary central nervous system lymphoma[J]. Oncol Lett, 2020, 19: 2097-2106. |
| [85] |
He Z, Schulz A, Wan X, et al. Poly(2-oxazoline) based micelles with high capacity for 3rd generation taxoids: preparation, in vitro and in vivo evaluation[J]. J Control Release, 2015, 208: 67-75. DOI:10.1016/j.jconrel.2015.02.024 |
| [86] |
Qin ZD, Li S, Jin ZY, et al. A brief analysis of taxol research progress[J]. Bull Sci Technol (科技通报), 2018, 34: 15-20. |
| [87] |
Xu JM, Xia XJ, Liu YL. Progress of taxol novel preparations and clinical research[J]. Practi Med Clin (实用药物与临床), 2016, 19: 510-517. |
| [88] |
Yang C, Wang H, Zhang B, et al. LCL161 increases paclitaxel-induced apoptosis by degrading cIAP1 and cIAP2 in NSCLC[J]. J Exp Clin Cancer Res, 2016, 35: 158. DOI:10.1186/s13046-016-0435-7 |
| [89] |
Ali Hassan A, Ibrahim NY, Jassen MAR. Concurrent paclitaxel and radiotherapy for node positive breast cancer[J]. Gulf J Oncolog, 2019, 1: 14-21. |
| [90] |
Chen WC, Kim J, Kim E, et al. A phase Ⅱ study of radiotherapy and concurrent paclitaxel chemotherapy in breast-conserving treatment for node-positive breast cancer[J]. Int J Radiat Oncol Biol Phys, 2012, 82: 14-20. DOI:10.1016/j.ijrobp.2010.08.051 |
| [91] |
Iacovelli R, Pietrantonio F, Maggi C, et al. Combination or single-agent chemotherapy as adjuvant treatment of gastric cancer: a systematic review and meta-analysis of published trials[J]. Crit Rev Oncol Hematol, 2016, 98: 24-28. DOI:10.1016/j.critrevonc.2015.09.002 |
| [92] |
Kang BW, Kwon OK, Chung HY, et al. Taxanes in the treatment of advanced gastric cancer[J]. Molecules, 2016, 21: 651. DOI:10.3390/molecules21050651 |
| [93] |
Zhang FM, Zhu CK, Sun XF, et al. Effect of PD1 antibody combined with paclitaxel on anti-tumor effect in mice with breast cancer[J]. Immunol J (免疫学杂志), 2019, 35: 874-878. |
| [94] |
Mazieres J, Kowalski D, Luft A, et al. Health-related quality of life with carboplatin-paclitaxel or nab-paclitaxel with or without pembrolizumab in patients with metastatic squamous non-small-cell lung cancer[J]. J Clin Oncol, 2020, 38: 271-280. DOI:10.1200/JCO.19.01348 |
| [95] |
Fushimi C, Baba D, Masubuchi T, et al. Weekly cetuximab and paclitaxel for recurrent or metastatic head and neck squamous cell carcinoma[J]. In Vivo, 2020, 34: 2653-2657. DOI:10.21873/invivo.12084 |
| [96] |
Hitt R, Irigoyen A, Cortes-Funes H, et al. Phase Ⅱ study of the combination of cetuximab and weekly paclitaxel in the first-line treatment of patients with recurrent and/or metastatic squamous cell carcinoma of head and neck[J]. Ann Oncol, 2012, 23: 1016-1022. DOI:10.1093/annonc/mdr367 |
 2021, Vol. 56
2021, Vol. 56


