除正常生理性温度调节外, 很多动物还存在一种特殊状态—冬眠, 冬眠通常由食物缺乏导致, 为了降低代谢水平保存能量, 动物进入一种类似于睡眠的状态, 且持续时间通常较长。在这种状态下, 体温调定点降低5~10 ℃左右, 这导致动物体温维持在一个非常低的水平, 耗氧量和运动水平同样大幅降低。虽然动物在此期间保持了一种远低于正常体温的状态, 但其代谢能力依旧正常且恢复后组织器官没有明显损伤, 行为也无异常[1]。此外, 在许多无冬眠习性的动物如啮齿类动物中也发现存在一种类似情况, 在能量供给不足时, 动物会自发出现体温降低、代谢降低和运动水平减弱等情况, 恢复能量供给后可自行恢复正常, 这一状态被称为torpor。
诱导torpor状态可在一些能量供给有限的情况下, 如航空航天领域, 降低人员能量需求; 或者在严重创伤、过度应激以及心脏骤停或复苏时保持患者处于低代谢水平, 减少细胞耗氧, 改善微循环, 免于细胞遭受严重损害, 为治疗争取时间[2]。故对于torpor发生机制的研究是非常必要的。
Torpor常发生在夜间, 这主要由昼夜节律决定。即使整个节律周期无光照, torpor也会在夜间自发启动, 进食可中断torpor状态, 但到下个昼夜节律周期的夜间, torpor会再次发生[3]。
瘦素和交感神经系统活动都已被证明与torpor发生有关, 但均不是调控torpor状态的直接因素[4]。2020年发表在《Nature》杂志上的两篇文章报道脑内QRFP (pyroglutamylated RFamide peptide) 神经元以及avMLPA脑区(anterior and ventral portions of the medial and lateral preoptic area) 的adcyap (adenylate cyclase activating polypeptide) 阳性神经元直接介导了torpor状态的发生。本文对torpor发生的相关机制进行总结, 旨在为torpor发生机制的研究提供思路和启示。
1 Adcyap神经元与torporAdcyap1神经元表达的Adcyap1基因可编码垂体腺苷酸环化酶激活多肽(PACAP), 与能量代谢、神经保护和免疫系统等生理学功能有关[5]。最近有研究发现[4], adcyap1神经元在介导torpor状态发生过程中同样发挥着重要作用。以往的研究都是通过禁食和/或冷暴露的方式来诱导小鼠发生torpor状态, Hrvatin等[4, 6]的实验证实, 不限制能量供应, 仅利用化学遗传学刺激即可诱导torpor状态发生。研究人员将一种受体Gq-DREADD (Gq-coupled designer receptor exclusively activated by designer drug) 及FOS2A-CreERT2重组酶植入小鼠体内, 得到一种FosTRAP-GQ转基因小鼠。Cre依赖性Gq-DREADD是一种化学激活受体, 近年来被广泛用于激活特定神经元, 氯氮平一氧化氮(clozapine N-oxide, CNO)为其特异性激活剂。FOS2A-CreERT2重组酶是一种DNA重组酶, 其表达受Fos启动子调控, 他莫昔芬为该重组酶的激活剂。给予他莫昔芬后, CreERT2被激活随后转移到细胞核内进行重组, 使活跃脑区中的Gq-DREADD持续表达且处于一种可被CNO激活的状态。小鼠禁食诱导torpor状态, 活跃的脑区中的Fos位点被激活, 给予他莫昔芬使Gq-DREADD持续表达, 后给予CNO, 之前活跃的脑区即可被再次激活。
研究人员将小鼠禁食24 h诱导其进入torpor状态, 给予他莫昔芬, 恢复几天后给予CNO重新刺激禁食状态下活跃的脑区, 发现不对小鼠进行禁食处理, 仅依靠化学刺激该转基因小鼠即出现torpor状态: 表现为核心体温下降、代谢率降低以及活动减少。为了找出触发torpor的关键脑区, Hrvatin等[4]向FosTRAP-GQ小鼠下丘脑不同区域注射腺相关病毒(adeno-associated virus, AAV), 禁食诱导其进入torpor状态, 恢复几天后给予CNO, 通过观察激活不同脑区后的体温、代谢和活动水平, 在227个相关脑区中确定avMLPA为关键脑区: 激活该脑区后动物核心体温、代谢和运动水平均明显下降(体温下降4.90 ± 0.68 ℃, 代谢率下降30.4% ± 8.5%, 总运动活性下降58.7% ± 5.2%), 且与空白对照组小鼠有显著性差异。
avMLPA脑区中有很多不同类型的神经元, 为确定起主要作用的神经元, 研究人员通过高通量单核RNA测序以及原位杂交等方法, 确认在avMPLA脑区中确实存在这样一种起主要作用的神经元—adcyap1神经元。将FosTRAP-GQ小鼠avMLPA adcyap1神经元沉默(已验证在正常饲养状态下沉默avMLPA adcyap1神经元不会影响小鼠体温), 并诱导其进入torpor状态, 与禁食诱导进入torpor状态的野生型小鼠以及处于torpor状态的正常FosTRAP-GQ小鼠相比, adcyap1沉默小鼠体温下降幅度变小, 且下降速度明显变慢。这一实验结果证实了avMPLA adcyap1神经元是触发torpor状态的关键因素之一[4]。
在adcyap1神经元中还识别出瘦素受体[4], 瘦素受体同样与torpor状态的产生有关, 这一发现同样为avMPLA adcyap1神经元介导torpor发生提供了一种可能的机制。
2 瘦素与torpor瘦素是一种脂肪细胞分泌的激素, 其含量与脂肪量呈正相关, 且受摄食量调节。其编码基因—ob基因于1994年克隆出来[7]。瘦素可调节葡萄糖稳态, 加速能量代谢, 促进散热, 从而上调体温[8, 9]。瘦素缺乏小鼠(ob/ob) 在环境温度较低或摄食量不足的情况下极易出现torpor状态[10], ob/ob小鼠在禁食期间体温下降超过7 ℃, 且ob/ob小鼠的运动水平与是否禁食无关, 而对照组小鼠在禁食状态下的运动水平与正常饲养状态下相比明显降低, 且无论何种状态, 对照组小鼠的运动水平都明显高于ob/ob小鼠[11]。由此可见, torpor状态的发生可能与瘦素有关。Gavrilova等[12]进一步研究发现, 对禁食后出现torpor状态的ob/ob小鼠每天皮下给予瘦素30 μg, 持续7天, 在第3天时torpor状态被逆转。单次给予处于torpor状态的ob/ob小鼠长效瘦素pasylization (600)-瘦素300 pmol·g-1, 6天后ob/ob小鼠体温及代谢水平恢复正常, 而模型组小鼠由于反复出现torpor状态, 4天内消耗的总能量与瘦素处理组小鼠相比减少了80 kJ, 且最低体温下降至25.7 ± 0.2 ℃[13]。静脉给予每只ob/ob小鼠瘦素60 pmol 6 h后, 小鼠全身耗氧量较对照组相比增加了36%[14]。以上实验结果均表明, 瘦素可以抑制torpor状态的发生。
但瘦素水平降低并不一定会诱导出torpor状态, 且出现torpor状态的小鼠在正常情况下瘦素水平也并不改变, 这说明瘦素并不是调节torpor状态的直接诱因, 瘦素缺乏只是使小鼠处于一种极易诱导出torpor的状态[12], 且其具体作用机制尚未明确, 还有待进一步研究。
3 QRFP神经元与torporQRFP是RFamide神经肽家族成员。在啮齿动物各器官中高表达, 但在脑中仅分布于下丘脑区域且呈离散型分布, 主要有腹内侧核(ventromedial nucleus, VMN)、背内侧核(dorsomedial hypothalamic nucleus, DMH)、弓状核(arcuate hypothalamic nucleus, ARC)、室周核(periventricular nucleus, PeVN)、下丘脑外侧区(lateral hypothalamic area, LHA) 和视交叉后区(retrochiasmatic area, RCh) 等。QRFP神经元是一种谷氨酸能神经元, 功能上与学习认知、调节焦虑、摄食、葡萄糖摄取和交感神经调节等方面有关[15-17]。Takahashi等[18]证明QRFP神经元在诱导torpor发生过程中发挥重要作用。
研究人员使用了Cre依赖型DREADD受体来激活QRFP神经元, 激活后的小鼠(后文表述为QrfpiCre小鼠) 出现体温降低、运动水平减弱、心率减缓和交感神经活性减弱等torpor状态, 且激活一次QrfpiCre小鼠所诱导的torpor状态可维持数天后自行恢复正常, 这一结果初步证明, QRFP神经元与诱导torpor发生有关。
为了找到QRFP神经元发挥作用的准确区域, 研究人员向QRFP神经元中注入腺相关病毒, 并通过原位杂交等方法证实激活后可诱导torpor状态的区域为侧脑室前核(anteroventral petriventricular nucleus, AVPe) 及内侧视前区(medial preoptic area, MPA)[18] (图 1)[19]。
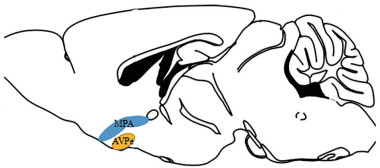
|
Figure 1 Pyroglutamylated RFamide peptide neurons distribution[19]. MPA: Medial preoptic area; AVPe: Anteroventral petriventricular nucleus |
光遗传学实验结果显示[18], QRFP神经元可将信号投射到下游参与体温能量调节的区域, 如DMH。当抑制了处于torpor状态的QrfpiCre小鼠DMH区QRFP神经元向下的投射后, 体温降低的幅度大幅减少, 且单独刺激DMH区的QRFP神经元可导致产热, 表现为外周末梢血管舒张但不引起核心体温的变化, 这说明体温调定点已被重置为低于正常体温的水平, 即出现torpor状态, 这表明DMH区域的QRFP神经元对诱导torpor起重要作用。
研究人员对小鼠的表观行为学进行观察, 暴露于高温环境中(28 ℃) QrfpiCre小鼠表现出伸展的姿势, 而当暴露在低温环境中(12 ℃), 表现为颤栗和耗氧量增加, 与正常动物暴露于热冷环境的表现相同, 这说明QrfpiCre小鼠在低代谢状态下身体功能和行为仍然受到调节。QrfpiCre小鼠呼吸熵降低, 这表明体内的主要能量来源由碳水化合物变成脂肪, 这同样表现出与动物冬眠状态的类似性。且向QrfpiCre小鼠QRFP神经元注入破伤风病毒以沉默其活性后, torpor状态消失。提示, QRFP神经元确为诱导torpor产生的关键因素[18]。
QRFP神经元是一种谷氨酸能神经元, 谷氨酸能神经元分为囊泡谷氨酸转运蛋白2 (vesicular glutamate transporter 2, Vglut2) 阳性(兴奋性) 神经元和氨基丁酸转运蛋白(vesicular GABA transporter, Vgat) 阳性(抑制性) 神经元两种, 研究人员通过原位杂交实验发现, QRFP神经元中既表达Vglut2+神经元, 也表达Vgat+神经元, Vglut2阳性神经元约占80%。通过小鼠杂交获得Vglut缺乏的QrfpiCre小鼠以及Vgat缺乏的QrfpiCre小鼠, CNO激活后两种小鼠体温降低速率均减缓: Vglut缺乏QrfpiCre小鼠出现了短暂的体温下降, 但与QrfpiCre小鼠相比降幅明显减小, 2 h后即恢复至35 ℃以上; 而Vgat缺乏QrfpiCre小鼠降温速度虽减缓, 但6 h后体温即与torpor状态QrfpiCre小鼠无显著性差异。这说明QRFP神经元中Vglut+神经元和Vgat+神经元共同介导小鼠torpor状态产生, Vglut+神经元起主要作用[18]。
4 交感神经系统与torpor中缝苍白球(raphe pallidus, RPa) 是中枢神经系统向效应器传递体温调节命令的关键中转站, 所有的体温信号下传都经过RPa脑区, 且这种体温调节信号通常为交感神经信号。RPa可通过激活交感神经系统调控下游棕色脂肪组织(brown adipose tissue, BAT) 产热, 这种产热方式是非颤栗产热的主要方式: 在寒冷环境下BAT质量会有所增加[20]。其中的棕色脂肪细胞(brownadipocyte, BAC) 内表达的线粒体解偶联蛋白1 (uncoupling protein 1, UCP1) 将脂肪酸氧化并与ATP解偶联, 使得能量直接以热量的形式散失从而维持体温[21]。免疫组化结果显示, torpor小鼠的RPa脑区并未观察到c-Fos表达, 但其上游的脑区如DMH和弓状核ARC等脑区的c-Fos表达量均明显高于对照组[22], 病毒逆行示踪实验显示torpor状态下的小鼠上游脑区的神经元依旧向下游RPa区投射, 这说明torpor状态的小鼠RPa脑区被抑制, 导致体温调节交感神经信号下传途径被阻断[23]。综上, torpor状态与中枢交感神经系统有关(图 2)。
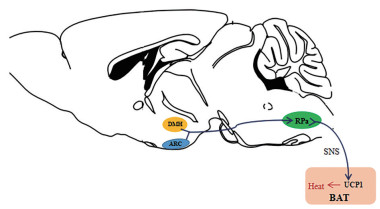
|
Figure 2 Thermoregulatory signaling pathway[19]. DMH: Dorsomedial hypothalamic nucleus; ARC: Arcuate hypothalamic nucleus; RPa: Raphe pallidus; SNS: Sympathetic nerve system; UCP1: Uncoupling protein 1; BAT: Brown adipose tissue |
为了验证外周交感神经系统是否同样参与torpor状态产生, Swoap等[24]使用Dbh-/-小鼠进行实验, Dbh-/-小鼠是一种缺乏产生交感神经递质如去甲肾上腺素和肾上腺素能力的小鼠, 给予这种小鼠禁食处理后未出现torpor状态, 而对照组小鼠均进入torpor状态, 提示torpor状态的产生与外周交感神经系统有关。外周交感神经系统的肾上腺素受体分为α受体和β受体, 禁食冷暴露处理后, 分别给予非选择性肾上腺素α受体激动剂苯肾上腺素以及β受体激动剂异丙肾上腺素, 异丙肾上腺素组Dbh-/-小鼠体温显著下降进入torpor状态, 而苯肾上腺素组小鼠并未进入torpor状态, 这说明激动β受体可诱导小鼠进入torpor状态。后分别给予β1、β2和β3受体激动剂多巴酚丁胺、沙丁胺醇及CL 316243, CL 316243组的Dbh-/-小鼠体温显著降低, 另外两种药物并未诱导torpor状态。给予torpor状态小鼠β3受体拮抗剂SR59230A后, 小鼠逐渐恢复正常状态[24]。以上实验结果提示, torpor状态与交感神经系统中的β3受体有关, 激活β3受体可诱导小鼠进入torpor状态。
综上所述, torpor状态的发生与中枢交感神经系统和外周β3受体有关。
5 总结与展望冬眠状态是动物为了应对寒冷天气所采取的一种自我保护机制。人类没有冬眠习性, 但是在很多特殊情况下, 如果能人为诱导出类冬眠特性的torpor状态, 比如航天员在太空工作时, 能量供给极度有限, 诱导航天人员进入torpor状态可极大地减少能量消耗[25]; 患者危重状态下, 诱导患者进入torpor状态可使患者维持现有状态不至恶化, 为后续救治赢得宝贵时间[26]。到目前为止, 针对不具有冬眠习性的啮齿类动物torpor发生机制的研究已取得一定进展, 但由于安全性及苏醒后的器官保护等问题, 诱导人类出现torpor状态尚未成功[27], 因此对于torpor状态发生机制的探索具有重要意义。Torpor状态的发生是由许多因素共同调节的结果, 与昼夜节律、中枢体温调节交感神经信号阻断、外周交感神经β3受体激活以及瘦素缺乏都有关系, 尤其是最近的两项研究结果, 下丘脑区域QRFP神经元和avMLPA区adcyap1神经元可在无需限制能量供给的情况下直接介导torpor状态的发生。本文对torpor发生机制进行总结, 为其进一步研究及人工诱导torpor状态的实际应用提供思路。
作者贡献: 朱子玉参与文章撰写和修订; 姜剑伟及张建军负责文章修改。
利益冲突: 无利益冲突。
| [1] |
Saper CB, Machado NLS. Flipping the switch on the thermoregulatory system[J]. Nature, 2020, 583: 34-35. DOI:10.1038/d41586-020-01600-5 |
| [2] |
Tarahovsky YS, Fadeeva IS, Komelina NP, et al. Antipsychotic inductors of brain hypothermia and torpor-like states: perspectives of application[J]. Psychopharmacology, 2017, 234: 173-184. DOI:10.1007/s00213-016-4496-2 |
| [3] |
Van der Vinne V, Bingaman MJ, Weaver DR, et al. Clocks and meals keep mice from being cool[J]. J Exp Biol, 2018, 221: eb179812. |
| [4] |
Hrvatin S, Sun S, Wilcox OF, et al. Neurons that regulate mouse torpor[J]. Nature, 2020, 583: 115-121. DOI:10.1038/s41586-020-2387-5 |
| [5] |
Yan QX, Ma Y, Hong A. Research progress of pituitary adenylate cyclase-activating polypeptide (PACAP) as a new potential therapeutic peptide in diabetes and its complications[J]. China Biotechnol (中国生物工程杂志), 2018, 38: 62-68. |
| [6] |
Guenthner CJ, Miyamichi K, Yang HH, et al. Permanent genetic access to transiently active neurons via TRAP: targeted recombination in active populations[J]. Neuron, 2013, 78: 773-784. DOI:10.1016/j.neuron.2013.03.025 |
| [7] |
Zhang Y, Proenca R, Maffei M, et al. Positional cloning of the mouse obese gene and its human homologue[J]. Nature, 1994, 372: 425-432. DOI:10.1038/372425a0 |
| [8] |
Park S, Aintablian A, Coupe B, et al. The endoplasmic reticulum stress-autophagy pathway controls hypothalamic development and energy balance regulation in leptin-deficient neonates[J]. Nat Commun, 2020, 11: 1914. DOI:10.1038/s41467-020-15624-y |
| [9] |
Caron A, Lee S, Elmquist JK, et al. Leptin and brain-adipose crosstalks[J]. Nat Rev Neurosci, 2018, 19: 153-165. DOI:10.1038/nrn.2018.7 |
| [10] |
Fischer AW, Cannon B, Nedergaard J. Leptin: is it thermogenic?[J]. Endocr Rev, 2020, 41: 232-260. DOI:10.1210/endrev/bnz016 |
| [11] |
Swoap SJ, Bingaman MJ, Hult EM, et al. Alternate-day feeding leads to improved glucose regulation on fasting days without significant weight loss in genetically obese mice[J]. Am J Physiol Regul Integr Comp Physiol, 2019, 317: R461-R469. DOI:10.1152/ajpregu.00140.2019 |
| [12] |
Gavrilova O, Leon LR, Marcus-Samuels B, et al. Torpor in mice is induced by both leptin-dependent and -independent mechanisms[J]. Proc Natl Acad Sci U S A, 1999, 96: 14623-14628. DOI:10.1073/pnas.96.25.14623 |
| [13] |
Bolze F, Morath V, Bast A, et al. Long-acting PASylated leptin ameliorates obesity by promoting satiety and preventing hypometabolism in leptin-deficient Lep (ob/ob) mice[J]. Endocrinology, 2016, 157: 233-244. DOI:10.1210/en.2015-1519 |
| [14] |
Mistry AM, Swick AG, Romsos DR. Leptin rapidly lowers food intake and elevates metabolic rates in lean and ob/ob mice[J]. J Nutr, 1997, 127: 2065-2072. DOI:10.1093/jn/127.10.2065 |
| [15] |
Zagorácz O, Ollmann T, Péczely L, et al. QRFP administration into the medial hypothalamic nuclei improves memory in rats[J]. Brain Res, 2020, 1727: 146563. DOI:10.1016/j.brainres.2019.146563 |
| [16] |
Leprince J, Bagnol D, Bureau R, et al. The Arg-Phe-amide peptide 26RFa/glutamine RF-amide peptide and its receptor: IUPHAR Review 24[J]. Br J Pharmacol, 2017, 174: 3573-3607. DOI:10.1111/bph.13907 |
| [17] |
Okamoto K, Yamasaki M, Takao K, et al. QRFP-deficient mice are hypophagic, lean, hypoactive and exhibit increased anxiety-like behavior[J]. PLoS One, 2016, 11: e0164716. DOI:10.1371/journal.pone.0164716 |
| [18] |
Takahashi TM, Sunagawa GA, Soya S, et al. A discrete neuronal circuit induces a hibernation-like state in rodents[J]. Nature, 2020, 583: 109-114. DOI:10.1038/s41586-020-2163-6 |
| [19] |
Paxinos G, Franklin KBJ. The Mouse Brain in Stereotaxic Coordinates[M]. 2nd ed. San Diego: Academic Press, 2001: 5.
|
| [20] |
Tan CL, Knight ZA. Regulation of body temperature by the nervous system[J]. Neuron, 2018, 98: 31-48. DOI:10.1016/j.neuron.2018.02.022 |
| [21] |
Wei D, Xu ZP, Xue YM. The distribution, influencing factors and physiological functions of human brown fat[J]. J Pract Med (实用医学杂志), 2013, 29: 2918-2920. |
| [22] |
Hitrec T, Luppi M, Bastianini S, et al. Neural control of fasting-induced torpor in mice[J]. Sci Rep, 2019, 9: 15462. DOI:10.1038/s41598-019-51841-2 |
| [23] |
Jeong JH, Lee DK, Blouet C, et al. Cholinergic neurons in the dorsomedial hypothalamus regulate mouse brown adipose tissue metabolism[J]. Mol Metab, 2015, 4: 483-492. DOI:10.1016/j.molmet.2015.03.006 |
| [24] |
Swoap SJ, Gutilla MJ, Liles LC, et al. The full expression of fasting-induced torpor requires beta 3-adrenergic receptor signaling[J]. J Neurosci, 2006, 26: 241-245. DOI:10.1523/JNEUROSCI.3721-05.2006 |
| [25] |
Jastroch M, Giroud S, Barrett P, et al. Seasonal control of mammalian energy balance: recent advances in the understanding of daily torpor and hibernation[J]. Neuroendocrinol, 2016. DOI:10.1111/jne.12437 |
| [26] |
Zakharova NM, Tarahovsky YS, Komelina N, et al. Long-term pharmacological torpor of rats with feedback-controlled drug administration[J]. Life Sci Space Res, 2021, 28: 18-21. DOI:10.1016/j.lssr.2020.11.002 |
| [27] |
Shi Z, Qin M, Huang L, et al. Human torpor: translating insights from nature into manned deep space expedition[J]. Biol Rev Camb Philos Soc, 2020. DOI:10.1111/brv.12671 |
 2021, Vol. 56
2021, Vol. 56


