2. 北京市药品检验研究所, 国家药品监督管理局中成药质量评价重点实验室, 中药成分分析与生物评价北京市重点实验室, 北京 102206;
3. 西南交通大学生命科学与工程学院, 四川 成都 610031;
4. 中国中医科学院中药研究所, 北京 100700;
5. 中药资源教育部工程研究中心, 北京 100193
2. Beijing Institute for Drug Control, NMPA Key Laboratory for Quality Evaluation of Traditional Chinese Medicine(Traditional Chinese Patent Medicine), Beijing Key Laboratory of Analysis and Evaluation on Chinese Medicine, Beijing 102206, China;
3. School of Life and Science, Southwest Jiaotong University, Chengdu 610031, China;
4. Institute of Chinese Materia Medica, China Academy of Chinese Medical Sciences, Beijing 100700, China;
5. Engineering Research Center of Chinese Medicine Resource, Ministry of Education, Beijing 100193, China
《中华人民共和国药品管理法》明确规定“药品监督管理部门根据监督检查的需要, 可以对药品质量进行抽查检验”, 《药品质量抽查检验管理规定》指出“国家依法对生产、经营和使用的药品质量进行抽查检验”。根据任务来源不同, 药品抽验可分为国家级药品抽验和省(自治区) 级药品抽验, 根据目的不同分为评价性抽验、监督抽验及监测抽验等, 其中国家药品抽验以评价性抽验为主。根据国家药品抽验的要求, 2019年和2020年北京市药品检验所分别承担中成药红金消结胶囊、红金消结片(处方组成: 三七、香附、八角莲、鼠妇虫、黑蚂蚁、五香血藤、鸡矢藤、金荞麦、大红袍、柴胡) 和柴黄颗粒(处方组成: 柴胡、黄芩) 的国家药品抽验任务, 并同时对处方中大宗常用中药材柴胡、有毒药材八角莲、动物类药材黑蚂蚁和鼠妇虫原料基原物种进行探索性研究, 自全国各地药材市场、药店及中成药生产企业广泛收集上述四味中药饮片及相关药材, 按现行标准完成常规检验, 发现部分市售样本中存在掺伪、混伪现象, 但不能确定混伪品基原物种。
鉴于八角莲及黑蚂蚁均未被《中国药典》收录, 参考各地方标准, 发现八角莲及黑蚂蚁药材基原物种在不同标准中存在差异, 如八角莲药材基原物种包括八角莲Dysosma pleiantha (该拉丁名在《中国植物志》中对应的物种中文名为六角莲)、八角莲Dysosma versipellis、川八角莲Dysosma delavayi等; 黑蚂蚁药材基原物种包括双齿多刺蚁Polyrhachis dives、拟黑多刺蚁Polyrhachis vicina、鼎突多刺蚁Polyrhachis vicina等[1], 而根据中国蚁学泰斗王常禄和吴坚教授的文献, 上述名称实际均为同种蚂蚁, 即双齿多刺蚁Polyrhachis dives[2], 且在蚁学专业网站AntWiki (https://www.antwiki.org/wiki/Welcome_to_AntWiki) 上亦记录Polyrhachis vicina为Polyrhachis dives的次异名。此外, 《中国药典》 (2020年版·四部)“成方制剂中本版药典未收载的药材和饮片”中收录鼠妇虫来源于潮虫科(Armadillidiidae) 动物平甲虫Armadillidium vulgare[3]。由于早期对该类动物的研究不够深入, 分类方法不完善, 故在不同文献或标准中记载较为混乱, 涉及平甲虫科、卷甲虫科、潮虫科和鼠妇科等不同名称, 包含平甲虫Armadillidium vulgare、鼠妇Porcellio sp.、粗糙鼠妇Porcellio scaber等物种[4, 5]。根据现代分类学方法[6], 《中国药典》收载的鼠妇虫基原物种应当归为卷甲虫科(Armadillidiidae) 卷甲虫属寻常卷甲虫(Armadillidium vulgare)。综上, 地方标准收载物种不一致, 也是造成市售药材品种不一致的潜在原因之一。
中药材DNA条形码分子鉴定技术被誉为中药鉴定学的“文艺复兴”[7], 经过大量实践证实, 该技术能有效实现对中药种子种苗[8]、基原物种[9]、药材[10]、饮片[11, 12]及中成药[13, 14]等的基原鉴定, 结合二维码技术[15], 可对种植、加工、流通和使用进行全流程追溯[16]。随着该技术的不断推广, 越来越多的中药生产加工企业开始选择采用该技术来监控其原料药基原。“中药材DNA条形码分子鉴定法指导原则”纳入《中国药典》[17], 也使其逐渐成为药检机构的检测项目。综上, 为保证临床用药安全, 本研究拟采用中药材DNA条形码分子鉴定技术对上述样本进行检测。
材料与方法材料 本研究共涉及212份实验样本, 包括3种国家药品抽验中成药(红金消结胶囊、红金消结片和柴黄颗粒) 处方中部分饮片及相关药材样品184份, 其中市售柴胡类药材及饮片样本115份, 编号NDECH001~NDECH115; 市售八角莲药材样本22份, 编号NDEBJL01~NDEBJL22; 市售黑蚂蚁饮片样本9份, 编号NDEHMY01~NDEHMY09, 市售鼠妇虫饮片样本38份, 编号NDESFC01~NDESFC38; 另有窄竹叶柴胡(Bupleurum marginatum var. stenophyllum) 标本4份(采自西藏自治区拉萨市), 经中国医学科学院药用植物研究所标本馆林余霖研究员鉴定, 编号PS4260MT01~PS4260MT04; 黑蚂蚁对照药材样本1份(中国食品药品检定研究院), 编号FDCHMY01; 黑蚂蚁新鲜冷冻样本20份(自云南文山捕捉, 人工养殖), 经中国科学院动物研究所生物多样性基因组研究学科组客座顾问冉浩鉴定为双齿多刺蚁Polyrhachis dives, 编号AS2019MT01~20; 鼠妇虫75%乙醇浸泡新鲜样本3份, 编号NDESFC39~NDESFC41。此外, 自GenBank下载寻常卷甲虫Armadillidium vulgare、中华蒙潮虫Mongoloniscus sinensis、光滑鼠妇Porcellio laevis和粗糙鼠妇Por. scaber等物种COI序列11条。上述样品信息详见表 1。
| Table 1 Sample list and DNA barcoding identification results. "/" referred to genomic DNA degradation and no PCR product |
DNA提取 窄竹叶柴胡标本取叶片约20 mg置于2.0 mL EP管; 柴胡、八角莲药材及饮片样本用75%乙醇擦拭表面后晾干, 刮去外部栓皮, 取内部样本切成约2 mm3的小块, 取约50 mg置于2.0 mL EP管; 向上述管中各加入2颗钢珠, 用MM400型组织研磨仪(Retsch GmbH, Germany) 研磨2 min (每秒30次); 依照《中国药典》 (2020年版四部) 收载“中药材DNA条形码分子鉴定法指导原则”标准操作流程[17], 采用植物基因组DNA提取试剂盒(DP305, 天根生化科技(北京) 有限公司) 进行实验, 提取各样本基因组DNA。
黑蚂蚁、鼠妇虫干燥饮片样本各取较为完整的单只个体, 置于2.0 mL EP管; 黑蚂蚁、鼠妇虫新鲜样本各取单只个体, 置于2.0 mL EP管, 加入液氮冷冻; 向上述管中各加入2颗钢珠, 用MM400型组织研磨仪(Retsch GmbH, Germany) 研磨2 min (每秒30次); 依照《中国药典》 (2020年版四部) 收载“中药材DNA条形码分子鉴定法指导原则”标准操作流程[17], 采用血液/细胞/组织基因组DNA提取试剂盒(DP304, 天根生化科技(北京) 有限公司) 进行实验, 提取各样本基因组DNA。
DNA条形码序列扩增及测序 依照“中药材DNA条形码分子鉴定法”标准操作流程(DNA barcoding SOP) 进行PCR扩增实验[17], 其中柴胡和八角莲扩增ITS2序列, 黑蚂蚁和鼠妇虫扩增COI序列, 各序列通用引物及反应程序见表 2。PCR扩增产物纯化后采用ABI 3730 XL测序仪进行双向测序。
| Table 2 Primers and PCR conditions used in the experiment[17] |
数据分析 测序结果经校对、拼接后, 去除低质量区及引物区, 此外, ITS2序列在ITS2 database (http://its2.bioapps.biozentrum.uni-wuerzburg.de/) 中注释, 去除两端5.8S和28S区, 最终获得各样本DNA条形码序列。参照前期文献报道[7, 17], 在“中药材DNA条形码鉴定系统(http://www.tcmbarcode.cn)”中进行结果判定。采用MEGA6.06 (molecular evolutionary genetics analysis) 软件, 基于ClustalW算法进行多序列比对, 采用邻接法(NJ) 构建系统发育树。
结果 1 DNA条形码序列获取结果本研究共涉及212份样本, 经DNA提取、PCR扩增、测序及拼接后, 共有183份样本获得DNA条形码序列(表 3), 其中市售柴胡类药材及饮片获得111条ITS2序列, 窄竹叶柴胡标本获得4条ITS2序列, 市售八角莲药材样本获得21条ITS2序列, 黑蚂蚁新鲜冷冻样本获得20条COI序列, 市售鼠妇虫饮片及乙醇浸泡新鲜样本获得27条COI序列。其余29份样本基因组DNA降解严重, 未获得PCR扩增产物。
| 表 3 DNA barcode sequences gained in this study |
115份市售柴胡类药材及饮片样本共获得ITS2序列111条, 序列长度为218~233 bp, 比对后长度为239 bp, 存在153个变异位点, 共分为18个单倍型。4份窄竹叶柴胡标本均成功获得ITS2序列, 长度为229 bp, 比对后无变异位点, 序列特征见图 1。在“中药材DNA条形码鉴定系统(http://www.tcmbarcode.cn)”中进行结果判定, 获得与待检样本ITS2序列相似度最高的物种。其中, 71份样本比对为伞形科(Apiaceae) 柴胡属植物柴胡Bupleurum chinense, 分为9个单倍型; 15份样本比对为窄竹叶柴胡Bupleurum marginatum var. stenophyllum/柴首Bupleurum chaishoui; 13份样本比对为锥叶柴胡Bupleurum bicaule; 3份样本比对为狭叶柴胡Bupleurum scorzonerifolium, 分为2个单倍型; 1份样本比对为大叶柴胡Bupleurum longiradiatum; 1份样本比对为黑柴胡Bupleurum smithii; 1份样本比对为银州柴胡Bupleurum yinchowense; 1份样本比对为苦木科(Simaroubaceae) 臭椿属植物臭椿Ailanthus altissima; 2份样本比对为伞形科防风属植物防风Saposhnikovia divaricata; 3份样本比对为菊科(Asteraceae) 一枝黄花属植物一枝黄花Solidago decurrens (图 2), 详细信息见表 1。

|
Figure 1 Standard DNA barcode of Bupleurum marginatum var. stenophyllum |

|
Figure 2 Adulterants detected in the commercial samples of Bupleuri Radix. A: Saposhnikovia divaricate, B: Solidago decurrens |
22份市售八角莲药材样本共获得ITS2序列21条, 序列长度为242~246 bp, 比对后长度为246 bp, 存在32个变异位点(图 3), 共分为8个单倍型。在“中药材DNA条形码鉴定系统(http://www.tcmbarcode.cn)”中进行结果判定, 获得与待检样本ITS2序列相似度最高的物种。其中, 15份样本比对为小檗科(Berberidaceae) 山荷叶属植物南方山荷叶Diphylleia sinensis, 分为3个单倍型; 2份样本比对为小檗科鬼臼属植物云南八角莲Dysosma aurantiocaulis; 1份样本比对为西藏八角莲Dysosma tsayuensis; 1份样本比对为八角莲Dysosma versipellis; 2份样本比对为八角莲Dysosma versipellis/贵州八角莲Dysosma majorensis/小八角莲Dysosma difformis, 分为2个单倍型; 详细结果见表 1。
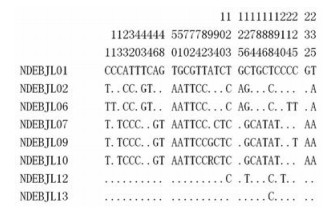
|
Figure 3 Variables sites in the ITS2 region of the commercial Bajiaolian samples |
本研究涉及市售黑蚂蚁饮片样本22份, 黑蚂蚁对照药材样本1份, 均未获得PCR扩增产物。自云南文山捕捉人工养殖黑蚂蚁(双齿多刺蚁Polyrhachis dives) 样本20份, 直接冷冻后带回实验室进行DNA提取及PCR扩增实验, 成功获得COI序列扩增产物。测序结果经处理后, 获得黑蚂蚁COI序列, 序列长度为657~658 bp, 比对后长度为658 bp, 存在1 bp插入/缺失, 为35位点, 主导单倍型序列特征见图 4。在“中药材DNA条形码鉴定系统(http://www.tcmbarcode.cn)”中比对结果显示与蚁科(Formicidae) 多刺蚁属动物双齿多刺蚁Polyrhachis dives具有最大相似性, 相似度为100%。
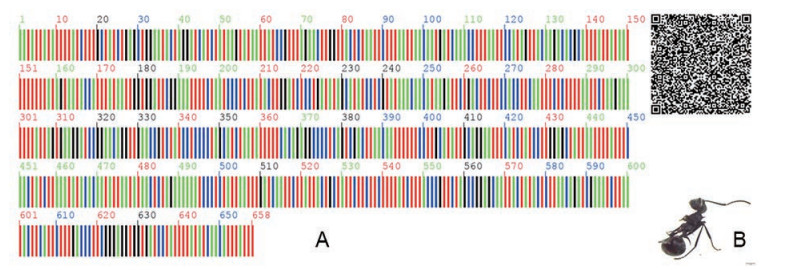
|
Figure 4 Standard DNA barcode and figure of Polyrhachis dives. A: DNA barcode of the COI region of Pol. Dives; B: Figure of Pol. dives |
38份市售鼠妇虫饮片样本共获得COI序列24条, 序列比对前后长度均为658 bp, 存在215个变异位点, 共分为6个单倍型。在“中药材DNA条形码鉴定系统(http://www.tcmbarcode.cn)”中进行结果判定, 获得与待检样本COI序列相似度最高的物种。其中11份样本比对为鼠妇科(Porcellionidae) 鼠妇属动物光滑鼠妇Porcellio laevis; 9份样本比对为卷甲虫科(Armadillidiidae) 卷甲虫属动物寻常卷甲虫Armadillidium vulgare, 分为2个单倍型; 2份样本比对为气肢虫科(Trachelipodidae) 蒙潮虫属动物中华蒙潮虫Mongoloniscus sinensis, 另有2份样本与数据库中序列相似度低于90%, 尚不能判断其物种, 基于COI序列构建NJ树显示这两份样本与Porcellio laevis亲缘关系更近(图 5)。3份75%乙醇浸泡新鲜样本均获得COI序列, 序列比对前后长度均为658 bp, 存在126个变异位点, 共分为2个单倍型, 其中2份样本比对为寻常卷甲虫, 1份样本比对为光滑鼠妇。详细结果见表 1。

|
Figure 5 Phylogenetic tree of Shufuchong and its adulterants constructed with COI sequences using NJ method. The bootstrap scores (1 000 replicates) are shown (≥50%) for each branch |
中成药质量关乎患者生命健康, 国家药品监督管理局2020年共发布5次“关于药品不符合规定的通告”, 总计通报98批次药品不符合规定, 包含中成药28批次, 占比28.6%, 例如12批次石斛夜光丸薄层色谱鉴别不符合规定, 1批次元胡止痛片含量测定不符合规定, 2批次元胡止痛片检出染色剂“金胺O”, 3批次柴黄颗粒需氧菌总数不符合规定等, 上述存在质量问题的药品均为临床用药安全带来隐患。中成药在生产加工过程中, 投料饮片如存在掺伪、掺杂、染色、虫蛀霉变等现象, 均会影响中成药质量, 进而导致在抽检过程中出现各检测项“不符合规定”的结果。现行版《中国药典》中成药检测方法多为显微、薄层色谱鉴别或含量测定等, 难以区分显微特征或化学成分相似的物种, 因此, 本研究采用DNA条形码技术对柴胡、八角莲、黑蚂蚁和鼠妇虫市售饮片及相关药材进行基原物种鉴定。
柴胡作为大宗常用中药材, 其市场需求量一直较高, 据中药材天地网(https://www.zyctd.com/jiage) 数据统计, 柴胡价格自2015年以来逐年攀升, 目前药材市场价格在每公斤60~75元, 而“藏柴胡”价格仅为每公斤15~25元, 因此常有以“藏柴胡”充当“柴胡”出售的现象。2017年, Wang等[18]对市售柴胡药材进行DNA条形码鉴定, 发现市售柴胡药材正品率为64.7%。而本研究收集到标签名为“柴胡/北柴胡/南柴胡”的91份样本中, 共71份样本比对为柴胡药材基原物种柴胡, 3份药材比对为柴胡药材另一基原物种狭叶柴胡, 正品率81.3%; 1份样本中检出有毒物种大叶柴胡, 需要特别引起中药生产加工企业重视, 如误以掺有该物种的原料作为“柴胡”药材投料, 存在发生毒副作用的可能性, 潜在危害临床用药安全[19]; 另有样本中检出窄竹叶柴胡、银州柴胡、黑柴胡等同属近缘物种及一枝黄花、臭椿两种前期文献未见报道过的伪品。上述结果表明随着国家监管力度的加大, 中药材市场状况有所好转, 但仍然存在小部分掺伪混伪现象, 需要进一步加强管理, 以规范药材市场秩序。此外, 本研究还收集到标签名称为“藏柴胡”的样本, 其ITS2序列经比对后与窄竹叶柴胡序列一致, 另有标签名为“海拉尔柴胡/海拉尔竹叶柴胡”的样本, 其ITS2序列经比对后与锥叶柴胡一致, 均与文献报道的地方习用品“藏柴胡”、“海拉尔柴胡”基原物种一致。此外, 1份标签名为“海拉尔柴胡”及1份标签名为“锥叶柴胡”的样本中, 检出非同属物种防风。综上, DNA条形码技术能够有效确定中药材及饮片的基原物种, 建议药品监督管理机构从源头抓起, 跟踪种植、采收、加工、储藏、运输直至投料、成药等中药生产全流程, 切实达到“追溯”目的。
濒危药材八角莲市场需求量有限, 经营商家较少, 目前市场价格稳定在每公斤65元。《中国生物多样性红色名录-高等植物卷》 (http://www.iplant.cn/rep/protlist/4) 将鬼臼属八角莲、贵州八角莲、西藏八角莲、川八角莲Dysosma veitchii、小八角莲和云南八角莲6个物种均列为濒危物种, 其中前4个物种为中国特有种, 除云南八角莲为“濒危”外, 其余5种均为“易危”, 致危原因为生境破坏、人为采挖等。本研究发现22份八角莲药材样本中有15份样本比对为南方山荷叶而非鬼臼属植物, 占获得序列样本量的71.4%, 极大可能是受限于野生资源量, 采挖者不能有效区分南方山荷叶与鬼臼属物种, 便将外观形态相似的物种均作“八角莲”采挖, 鉴于此类药材均含鬼臼毒素且毒性较强, 应当加强监管。此外, 因功效及化学成分相似, 神农架地区常将小檗科桃儿七属、山荷叶属、鬼臼属共计9个物种混用为民间药“江边一碗水”[20], 亦是造成市售八角莲药材来源混乱的原因之一, 其中桃儿七属植物桃儿七Sinopodophyllum hexandrum被收录于“濒危动植物种国际贸易公约(CITES)”附录II (http://www.cites.org.cn/citesgy/fl/201911/t20191111_524091.html)。由此可见, 对上述野生药用植物应当加大保护力度, 减少或避免因追求其药用价值而无序采挖野生资源等行为, 并选用物种鉴定准确的种质资源建立规范化种植基地, 将野生药材变家种, 以保证药材来源稳定、可靠。
黑蚂蚁饮片采用的“烧烫的铁锅内小火焙干”加工方式会导致其基因组DNA降解, 且黑蚂蚁样本个体较小, 单只重仅8 mg左右, 故本研究未能获得黑蚂蚁饮片的COI序列扩增产物, 对于该饮片的基原物种鉴定, 需在源头进行控制。鉴于目前市售黑蚂蚁大多为人工养殖, 可在养殖基地进行活体取样, 经DNA条形码鉴定后, 获得其二维码, 即可用于黑蚂蚁药材、饮片及相关中成药、保健食品等的全产业链监控。
鼠妇虫价格自2016年底由每公斤90元飙高至230元, 之后逐渐回落, 目前市场价为每公斤100~155元。现有多种中成药, 如红金消结胶囊、红金消结片、鳖甲煎丸和人参鳖甲煎丸等的组方中均包含鼠妇虫, 其来源混乱将严重影响中成药质量。而本次抽检结果显示, 基于COI序列可鉴定出市售鼠妇虫饮片至少来源于3个不同科的3个物种, 正品率仅为37.5%。鉴于多数鼠妇虫养殖户均对动物分类学专业知识了解不足, 并不能明确其所养殖的物种是否为各省(自治区、直辖市) 相关标准及《中国药典》附录所收载的正品药材, 建议中药饮片或中成药生产加工企业对养殖户进行科普培训, 协助其辨识中药生产所需的准确物种, 或者由中药饮片或中成药生产加工企业向养殖户配发基原物种鉴定准确的种虫, 用以扩大养殖, 再收购成虫, 既能够保证中药饮片和中成药质量, 同时又能够避免养殖户的损失, 进而能够规范鼠妇虫药材及饮片市场, 降低监管难度。
为保障中药质量, 我国持续加大对中药材及饮片的监督检查和抽验力度, 2018年国家药品监督管理局发布《中药饮片质量集中整治工作方案》, 决定在全国范围内开展中药饮片质量集中整治。统计数据表明, 该工作实施效果良好, 2019年全国中药材及饮片抽验平均合格率为91%, 较2018年提高3%[21]。研究结果显示仍有少数市售饮片存在掺伪、混伪现象, 如以“广金钱草”作“金钱草”、“珠芽蓼”作“拳参”、“条叶旋覆花”作“旋覆花”出售[11]。亦有国家药品评价性抽验研究报告显示, 对118批通草饮片样本进行性状鉴别, 结果发现24批通草性状与《中国药典》不一致, 分别为12批喜马山旌节花Stachyurus himalaicus (小通草) 和12批西南绣球Hydrangea davidii, 此外还存在非法增重现象[22]; 基于DNA条形码技术对126批鹅不食草样品进行鉴定, 检出掺杂物种莎草科白鳞莎草Cyperus nipponicus和玄参科阿拉伯婆婆纳Veronica persica[23]; 基于薄层色谱法对55批次重楼饮片样本进行鉴别, 发现部分批次样品存在薄层色谱鉴别不合格现象, 但未能判定混伪品基原物种[24]。上述研究均表明, 对于中药材及饮片的监管仍然不能松懈, 此外, 基于DNA条形码分子鉴定技术, 能有效检出中药材及饮片中性状鉴别特征不明显的混伪品, 有助于规范药材市场, 对于诸如八角莲、黑蚂蚁等未收载于《中国药典》的中药材而言, 有助于了解市售药材基原物种, 并可根据实际情况对药品质量标准进行修订, 促进药品标准提升。总之, 国家药品抽验有助于建立中药材、中药饮片、中成药生产流通使用全过程追溯体系, 维护临床用药安全。
作者贡献: 辛天怡负责实验设计、数据分析及文章撰写; 闫海霞负责样本收集、文章修改; 李冉郡、娄千、郝利军参与实验工作; 廖保生参与生信分析工作; 刘颖、陈晶、陈有根、杜小伟负责样本收集等工作; 郭洪祝、傅欣彤、宋经元负责实验设计、总体把关和稿件修改等工作。
利益冲突: 本文的研究内容无任何利益冲突。
| [1] |
Lin R. Standard Directory of Chinese Medicinal Materials (中国药材标准名录)[M]. Beijing: Science Press, 2011: 502.
|
| [2] |
Wang C, Wu J. Taxonomic studies on the genus Polyrhachis Mayr of China (Hymenoptcra: Formicidae)[J]. Forest Res (林业科学研究), 1991, 4: 596-601. |
| [3] |
State Pharmacopoeia Committee. Pharmacopoeia of the People's Republic of China (中华人民共和国药典)[S]. Part 4. 2020 Ed. Beijing: China Medical Science Press, 2020: 558
|
| [4] |
Lin R. Standard Directory of Chinese Medicinal Materials (中国药材标准名录)[M]. Beijing: Science Press, 2011: 527.
|
| [5] |
Kang S, Yue J, Jiang Z, et al. Varieties textual research and species identification of Chinese medicine Armadillidium[J]. J Chin Med Mater (中药材), 2019, 42: 1761-1765. |
| [6] |
Chen G. Terrestrial Isopoda fauna of typical zones in China[J]. Acta Zool Sin (动物学报), 2000, 46: 255-264. |
| [7] |
Chen S, Pang X, Song J, et al. A renaissance in herbal medicine identification: from morphology to DNA[J]. Biotechnol Adv, 2014, 32: 1237-1244. DOI:10.1016/j.biotechadv.2014.07.004 |
| [8] |
Zhang N, Xin T, Jin Y, et al. Identification of Alisma plantago-aquatica seeds based on traditional Chinese medicine DNA barcoding system[J]. World Sci Technol Mod Tradit Chin Med (世界科学技术-中医药现代化), 2016, 18: 18-23. |
| [9] |
Lv R, Feng Z, Ma T, et al. Use of ITS2 and psbA-trnH DNA barcode sequences of wild Phytolacca resources in Guanzhong area of Shaanxi Province[J]. Acta Pharm Sin (药学学报), 2020, 55: 1951-1956. |
| [10] |
Li J, Zhang R, Yu S, et al. Identification of Chinese medicinal materials Stellariae Radix and its adulterants using DNA barcoding[J]. Acta Pharm Sin (药学学报), 2019, 54: 937-943. |
| [11] |
Xin T, Lou Q, Hao L, et al. DNA barcoding identification of the commercial decoction pieces of traditional Chinese medicine[J]. Acta Pharm Sin (药学学报), 2021, 56: 879-889. |
| [12] |
Xin T, Li X, Yao H, et al. Survey of commercial Rhodiola products revealed species diversity and potential safety issues[J]. Sci Rep, 2015, 5: 8337. DOI:10.1038/srep08337 |
| [13] |
Xin T, Su C, Lin Y, et al. Precise species detection of traditional Chinese patent medicine by shotgun metagenomic sequencing[J]. Phytomedicine, 2018, 47: 40-47. DOI:10.1016/j.phymed.2018.04.048 |
| [14] |
Xin T, Xu Z, Jia J, et al. Biomonitoring for traditional herbal medicinal products using DNA metabarcoding and single molecule, real-time sequencing[J]. Acta Pharm Sin B, 2018, 8: 488-497. DOI:10.1016/j.apsb.2017.10.001 |
| [15] |
Xin T, Li X, Yao H, et al. A two-dimensional DNA barcode system for circulation regulation of traditional Chinese medicine[J]. Sci Sin Vit (中国科学: 生命科学), 2015, 45: 695-702. DOI:10.1360/N052015-00082 |
| [16] |
Lou Q, Xin T, Song J. Application of DNA barcoding technology in the whole industrial chain of traditional Chinese medicine[J]. Acta Pharm Sin (药学学报), 2020, 55: 1784-1791. |
| [17] |
State Pharmacopoeia Committee. Pharmacopoeia of the People's Republic of China (中华人民共和国药典)[S]. Part 4. 2020 Ed. Beijing: China Medical Science Press, 2020: 490-492.
|
| [18] |
Wang Y, Han X, Zhao Y, et al. Identification of commercial Bupleuri Radix and its adulterants based on ITS2 barcode[J]. Chin Tradit Herb Drugs (中草药), 2017, 48: 3590-3596. |
| [19] |
Yu J, Zhao S, Ren M, et al. Identification of Bupleurum chinense and B. longiradiatum based on ITS2 barcode[J]. China J Chin Mater Med (中国中药杂志), 2014, 39: 2160-2163. |
| [20] |
Han P, Dong H, Cheng L, et al. Study on the medicinal properties of "Jiangbianyiwanshui"[J]. Chin Tradit Pat Med (中成药), 2012, 34: 1151-1154. |
| [21] |
Zhang P, Li N, Li M, et al. Report of supervision and quality of Chinese materia medica and decoction pieces in 2019[J]. Mod Chin Med (中国现代中药), 2020, 22: 663-671. |
| [22] |
Lin Q, Huang Q, Teng A, et al. On quality and regulatory countermeasures of Tetrapanacis Medulla based on national drug sampling inspection[J]. China Pharm Aff (中国药事), 2019, 33: 1419-1423. |
| [23] |
Liu J, Guo L, Ma S, et al. Analysis of quality problems of Centipeda minima based on national drug evaluation surveillance[J]. China Pharm Aff (中国药事), 2020, 34: 325-329. |
| [24] |
Gao Y, Li D, Guo L, et al. Quality analysis and study on Paridis Rhizoma pieces based on national drug evaluation sampling inspection[J]. China Pharm Aff (中国药事), 2019, 33: 754-759. |
 2021, Vol. 56
2021, Vol. 56


