2. 沈阳药科大学药学院, 辽宁 沈阳 110016
2. School of Pharmacy, Shenyang Pharmaceutical University, Shenyang 110016, China
分子印迹聚合物(molecularly imprinted polymer, MIP) 是通过“锁-钥匙”机制选择性靶向结合分子受体, 这些分子受体在形状、大小和功能基团上与模板分子一致, 即在聚合物材料上留下与模板分子互补的孔穴结构[1, 2]。目前MIP在许多领域已受到广泛关注, 例如纯化和分离、化学/生物传感、人工抗体、药物递送、催化和降解、生物受体的替代品以及分子印迹固相萃取即分析化学中的提取和样品制备[3-8]。传统制备分子印迹聚合物的有机基质印迹聚合物理化性质较差, 例如刚性和稳定性差, 浸渍溶剂中易发生溶胀。然而具有网络状的二氧化硅溶胶-凝胶基质可解决克服以上问题, 即良好的热稳定性和水相容性[9]。溶胶-凝胶反应中产生的水和醇是致孔剂, 干燥后所得高分子聚合物为分子印迹干凝胶(molecularly imprinted xerogel polymers, MIXPs)[10]。
可卡因、偏苯丙胺和3, 4-亚甲基二氧基甲基苯丙胺会导致过量的多巴胺(dopamine, DA) 产生[11]。多巴胺可导致细胞死亡[11]、神经毒性[12]和心脏毒性[13]。据文献[14]报道, 单壁碳纳米管(aggregated single-walled carbon nanotubes, aSWNTs) 对纹状体中的细胞外DA有治疗作用。然而, aSWNTs的选择性很小, 除了可吸附DA外, 还会吸附其他儿茶酚胺神经递质, 如去甲肾上腺素(norepinephrine, NA) 和肾上腺素[15]。另外, aSWNTs还有许多缺点, 包括聚集性强、溶解性低、生物相容性低和遗传毒性[16-19]。因此, 采用MIXPs克服上述关于aSWNTs的问题, 以改善大脑中过量DA的选择性吸附。此外, 单胺氧化酶对儿茶酚胺代谢有重大意义[20], 单胺氧化酶A (monoamine oxidase A, MAO-A) 是DA代谢中的关键酶之一[21], 研究表明DA可被线粒体酶复合物MAO消除[22]。将酶固定化技术与分子印迹干凝胶的溶胶-凝胶方法相结合, 使降解酶MAO固定化在分子印迹干凝胶(monoamine oxidase immobilized MIXPs, MAO-MIXPs) 上, 通过高选择性识别、吸附和降解作用, 降低表达DA的量。
在本研究中, 聚乙烯亚胺(polyethyleneimine, PEI) 首先与DA结合形成胶体溶液(溶胶), 然后与四甲氧基硅烷(tetramethoxysilane, TMOS) 缩聚体混合形成高度交联的二氧化硅材料(或凝胶)-MIXPs, 将降解酶MAO固定化到MIXPs上。此外, 制备人工脑脊髓液以模拟多巴胺在脑环境条件下的体外吸收过程。根据合成优化和表征的结果, 经聚合反应相结合形成了一种新型的共聚物, 且不同掺入量可显著并有规律地吸附与降解, 通过生物方法和技术使MAO-MIXPs可高选择性识别、吸附并降解多巴胺, 有望用于多巴胺的表达调节。
材料与方法材料 DA (99.9%, Meilunbio制药公司); PEI (99.9%, 相对分子质量为600)、四甲氧基硅烷[TMOS, Si(OCH3)4, Macklin公司]; 3, 4-二羟基苯乙酸ELISA试剂盒(北京冬歌博业生物科技有限公司); MAO-A (每小瓶2.5 mg, Sigma-Aldrich公司); 去离子水(沈阳药科大学实验中心)。
仿生溶胶-凝胶法合成MIXPs 将PEI 0.2 mL与水20.4 mL混合并静置24 h以上制备PEI水溶液[23], 然后将DA 40 mg溶于1 mL PEI水溶液中, 并向混合溶液中加入TMOS 1 mL (PEI水溶液∶TMOS = 1∶1, v/v)[23], 涡旋。最后, 将该体系静置下形成象牙白色湿凝胶, 并在40 ℃真空干燥箱中干燥直至形成干凝胶状态。由于DA是水溶性药物, 因此通过用水洗涤数次除去DA, 离心(13 000 r·min-1), 通过紫外可见分光光度计(UV-vis, UV5100, 上海元析仪器有限公司) 测定离心后的上清液中DA浓度, 检测波长为280 nm。直到紫外可见分光光度计检测不到上清液的吸光度为止。如上所述使用仿生方法在未添加DA模板情况下合成空白的非印迹干凝胶聚合物(nonimprinted xerogel polymers, NIXPs)。
降解酶固定化MIXPs 在-80 ℃的冰箱中取出适量的单胺氧化酶(monoamine oxidase, MAO)。稀释后, 将MIXPs和NIXPs加入到MAO溶液中, 180 r·min-1振荡8 h, 并在37 ℃的干燥箱中干燥, 将MAO分别固化在MIXPs上, 使其含量为0.5、1、1.5、2、2.5、3和3.5 mg·g-1。在吸附实验中分别称取36 mg的MIXPs、MAO-MIXPs和MAO固定化NIXPs (monoamine oxidase immobilized NIXPs, MAO-NIXPs), 体外吸附实验时使MAO的质量浓度达到0.015 mg·mL-1, 分别在15、25、35、45、55和75 min时离心(13 000 r·min-1), 取上清并测量DA与其主要降解产物3, 4-二羟基苯乙酸。
体外制备人工脑脊液 脑脊液中神经递质的浓度是脑功能和相关疾病的直接指标。脑脊液是血浆的超滤液, 血浆和肽类蛋白从血液中主动转移到脑脊液中或在脉络丛中, 其中含有一定量的维生素、胆固醇和蛋白质, 但糖和钙的含量极低, 没有胆红素和非蛋白质氮, 更多的是碳酸氢盐和氯化物, 其主要由Na+、Cl-和HCO3-组成, 而K+、Mg2+和Ca2+较少[24]。在目前研究中, 人工脑脊液(aCSF) 是将10 mmol·L-1葡萄糖、4 mmol·L-1蔗糖、2.5 mmol·L-1 CaCl2、26 mmol·L-1 NaHCO3、2 mmol·L-1 MgSO4、2.5 mmol·L-1 KCl和124 mmol·L-1 NaCl混合制备而成[25]。
处方的优化 进行处方单因素考察分别将PEI 0.2、0.3、0.4、0.6和0.8 mL与水20.4 mL混合并静置24 h以上制备PEI水溶液[23]。考察DA对吸附效果的影响, 分别将DA 20、40、60、80、100和140 mg溶于1 mL PEI水溶液中, 并向混合溶液中加入TMOS 1 mL (PEI水溶液∶TMOS = 1∶1, v/v)[23], 然后涡旋。最后, 将该体系静置形成象牙白色湿凝胶, 并在40 ℃的真空干燥箱中干燥直至形成干凝胶状态。MIXPs筛分后粒径范围为d ≤ 250 μm、250 μm < d ≤ 380 μm和380 μm < d ≤ 1 000 μm, 分别称取60 mg放入5 mL去离子水中超声4 h。aCSF溶液中加入4 mg·mL-1 DA 5 mL, 使其在aCSF溶液中的质量浓度达到2 mg·mL-1, 最后在37 ℃的振荡器中振荡20 h进行吸附实验。
扫描电子显微镜(scanning electron microscopy, SEM) 表征 使用双面胶带将样品安装到金属桩上, 并在真空下喷涂一层薄薄的金。镀金后, 通过SURA 35场发射后用扫描电子显微镜(S-3400N, 日本日立公司) 分别表征MIXPs、NIXPs和不同粒径的MIXPs的微观形貌。
傅立叶变换红外光谱(Fourier transform infrared spectroscopy, FTIR) 表征 通过傅立叶变换红外光谱(EQUINOX55) 在400~4 000 cm-1内测定DA、MIXPs和MIXPs吸附DA (MIXPs adsorption DA, DA-MIXPs) 的光谱并鉴定官能团, 使用KBr制备DA、MIXPs和DA-MIXPs样品。
差示热量扫描仪(differential scanning calorimeter, DSC) 表征 采用差示热量扫描仪(瑞士梅特勒托利多仪器有限公司) 检测DA、MIXPs和DA-MIXPs的结晶状态。将样品约5 mg密封在铝盘中进行测量。在40 mL·min-1的氮气吹扫下, 以10 ℃·min-1的速率将样品从30 ℃加热到300 ℃。
吸附实验 用UV-vis检测离心后获得上清液的吸光度值, 并根据吸光度值计算平衡浓度, 通过以下吸附方程式(1) 来计算吸附量:
| $ Q_{e}=\left(C_{0}-C_{e}\right) \times V / m $ | (1) |
其中, C0和Ce (mg·mL-1) 分别为初始浓度和平衡浓度; Qe (mg·g-1)、V (L) 和m (g) 分别代表MAO-MIXPs、MAO-NIXPs、MIXPs、NIXPs的吸附量、溶液体积和重量。
选择性重吸附实验 分别称取MIXPs 60 mg (DA 40 mg和PEI 0.2 mL, 380 μm < d ≤ 1 000 μm) 并加入5 mL去离子水中超声4 h。在aCSF中分别加入5 mL 4 mg·mL-1 DA和NA, 使DA和NA的质量浓度达到2 mg·mL-1。最后将其在振荡箱中于37 ℃振荡20 h, 离心并测量样品上清液。
统计学方法 所得数据用均数±标准差(x± s) 表示, 用Excel和Origin统计软件进行数据统计和分析, 进行ANOVA方差分析, 并用Excel和Origin对数据进行分析作图。
结果 1 以DA为模板的MIXPs合成DA与PEI、TMOS结合并水解形成胶体溶液(溶胶), 然后缩聚形成高度交联的二氧化硅材料(或凝胶), 其表面含有许多硅烷醇基团, 有较高的孔隙容积和安全性[26], TMOS水解过程如下[10]:
nSi(OCH3)4 + 2nH2O → nSiO2 + 4nCH3OH
MIXPs制备方法如图 1, MIXPs通过仿生溶胶-凝胶两步法合成, 首先由DA和PEI聚合, 然后聚合物与TMOS以非共价氢键形式自组装成湿凝胶, 其中溶胶-凝胶反应中产生的水和醇是致孔剂, 洗脱模板分子干燥后所得高分子聚合物为MIXPs, 对DA有选择性吸附作用。甲基苯丙胺是诱导中枢神经系统兴奋状态最有效的拟交感神经胺之一, 通过中枢神经系统释放DA和其他生物胺, 并抑制神经元、囊泡单胺转运蛋白和MAO。使用制备的MAO-MIXPs可降解DA并特异性识别吸附DA, 以治疗由于DA过量产生而引起的成瘾性。MAO-MIXPs是以DA分子为模板、PEI为功能性单体、TMOS为交联剂的一种创新的印迹方法, 并将降解酶MAO固定化在分子印迹干凝胶上。
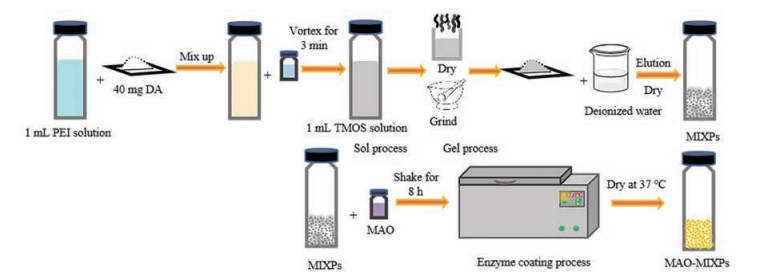
|
Figure 1 Schematic diagram for the synthesis process of monoamine oxidase immobilized MIXPs (MAO-MIXPs). MAO: Monoamine oxidase; MIXPs: Molecularly imprinted xerogel polymers; DA: Dopamine; TMOS: Tetramethoxysilane; PEI: Polyethyleneimine |
由SEM结果可见, 在MIXPs中有许多明显的孔(图 2a), 表明已经形成了DA的印迹“记忆腔”, 而在图 2b中空白组表面是光滑的, 没有发现孔隙。由于空白的NIXPs不存在DA模板分子从而不会形成“记忆腔”。在图 2c、d中, MAO固定化在NIXPs上后, 表面光滑并附着有蛋白质, 表明MAO被包裹在NIXPs上, 同时MAO也可固定化在MIXPs的表面。在进行24 h吸附实验后, MAO-MIXPs、MAO-NIXPs、MIXPs和NIXPs降低DA表达量的比较结果进一步证明MAO-MIXPs对DA可特异性识别(表 1)。而MAO-MIXPs降低DA表达量的效果明显高于MIXPs, 这是因为印迹“记忆腔”的形成可增加对DA的吸附量。与此同时, 由于降解酶的存在, MAO-MIXPs会对DA降解, 从而增强了降低DA表达量的效果。随着MIXPs粒径的增大、孔隙更多, 对DA的吸附量将会更多(图 3)。

|
Figure 2 Scanning electron microscopy (SEM) top images of the molecularly imprinted xerogel polymers (MIXPs) (a), nonimprinted xerogel polymers (NIXPs) (b), monoamine oxidase immobilized MIXPs (MAO-MIXPs) (c) and monoamine immobilized NIXPs (MAO-NIXPs) (d). Magnification: ×7 000 |
| Table 1 Comparison of adsorption amounts (Qe) of MAO-MIXPs, MAO-NIXPs, MIXPs and NIXPs |
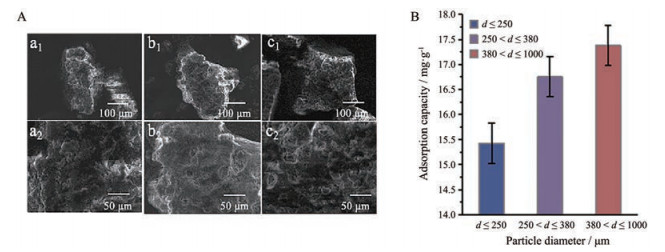
|
Figure 3 SEM top images of the MIXPs. a: d ≤ 250 μm; b: 250 μm < d ≤ 380 μm; c: 380 μm < d ≤ 1 000 μm (A), and comparison of adsorption effects of different diameters (B) |
DA、MIXPs、DA-MIXPs和MAO-MIXPs的DSC图谱见图 4。DA在248.41 ℃显示出强吸热峰, MIXPs和MAO-MIXPs为宽而钝的吸热峰, 这是无定形多胺的PEI被结合在二氧化硅上, 合成后的MIXPs也是无定形的。DA-MIXPs没有出现明显的吸热峰, 而DA-MIXPs的模板分子DA和记忆腔通过氢键结合在一起。
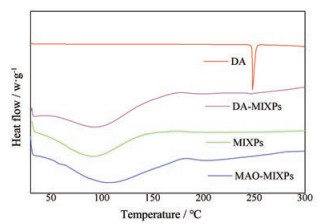
|
Figure 4 Differential scanning calorimeter (DSC) spectra of DA, MIXPs, MAO-MIXPs and MIXPs adsorption DA (DA-MIXPs) |
DA、MIXPs、DA-MIXPs和MAO-MIXPs的红外光谱图见图 5。MAO-MIXPs、MIXPs和DA-MIXPs主要谱带有着相似的位置, 在1 087.5和954.8 cm-1观察到的MIXPs的特征峰分别表明Si-O-Si和Si-OH拉伸振动。在1 630.5 cm-1处出现的OH特征峰是由于TMOS水解产生的。799.1和465.5 cm-1是Si-O特征峰。N-H键的弯曲振动出现在3 411.6和1 630.5 cm-1处, 而C-N键的弯曲振动是在1 400和1 440 cm-1处。这些吸收峰的出现表明PEI大分子已被接枝到硅胶表面, 并以偶联的方式形成MIXPs。据文献[27]报道, 未吸附DA的MIXPs存在N=O, 即MIXPs和DA之间没有氢键相互作用。当使用去离子水作为洗脱液时, DA和PEI之间的氢键相互作用被破坏, 随后DA被释放。因此, 由于氢键作用, DA-MIXPs的官能团Si-OH和C-N特征峰与MIXPs的相应特征峰相比更宽、更钝。DA苯基特征峰(2 958.8、1 470.6、876.8、831.0 cm-1) 在DA-MIXPs的FTIR谱图上证明DA被氢键键合在MIXPs的空腔中。通过PEI和DA之间非常强的氢键相互作用, MAO-MIXPs特异性识别吸附DA。
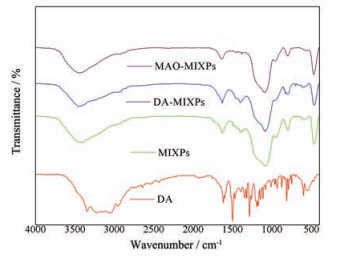
|
Figure 5 Fourier transform infrared spectroscopy (FTIR) spectra of DA, MIXPs and DA-MIXPs |
由图 6A可以看出, 随着DA量的增加, MIXPs的吸附能力越强, 这表明模板上的靶位越来越多。当多巴胺达到一定量(40 mg) 时, 出现最大吸附量, 然后随着多巴胺的增加吸附容量下降。聚集的DA竞争性位点导致吸附位点的减少, 或聚合物和交联剂的量有限, 承载不了过多的DA。同时DA洗脱不彻底, 以至于孔隙的数量减少。当PEI的体积为0.6 mL, MAO为2.5 mg·g-1时, 对DA吸附量最佳(图 6B、C)。制备3种不同的MIXPs, 分别是PEI 0.6 mL + DA 60 mg、PEI 0.2 mL + DA 40 mg和PEI 0.6 mL + DA 40 mg进行比较, PEI 0.6 mL + DA 40 mg制备得到的MIXPs吸附量最大(图 7A)。
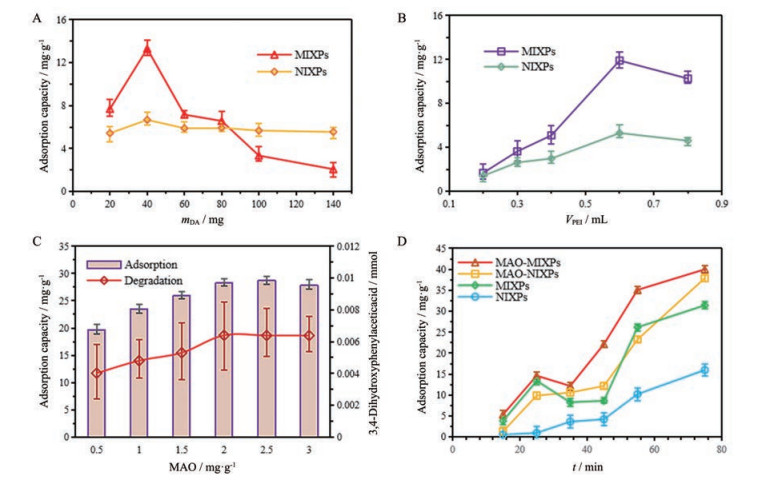
|
Figure 6 The influence of the different amount of DA template molecule on the adsorption efficiency (A). The influence of the different amount of PEI on the adsorption efficiency (B). The influence of the different amount of MAO on the adsorption efficiency (C). Comparison of adsorption amounts of MAO-MIXPs, MAO-NIXPs, MIXPs and NIXPs at different time (D) |
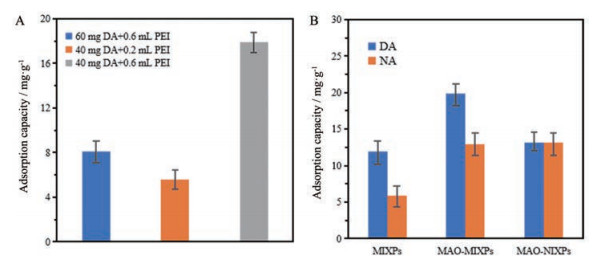
|
Figure 7 Optimized ratio of DA and PEI for synthesizing MIXPs (A). The influence of the analog on the adsorption efficiency (B). NA: Norepinephrine |
由图 6D和表 1可以看出, MAO-MIXPs对降低DA表达量的效果明显高于MAO-NIXPs和MIXPs, 与未用降解酶固定化的MIXPs相比, 当MAO固定在MIXPs上时, 对DA降解大大增加。此外, MAO-NIXPs由于缺乏模板分子DA印迹形成的孔, 对DA的吸附量比MAO-MIXPs少, 导致对降低DA表达量的效果不如MAO-MIXPs。
6 MAO-MIXPs选择性吸附分析为了验证MAO-MIXPs对DA的选择性, 使用MAO-MIXPs吸附与DA结构相似的分子如NA并比较MAO-MIXPs与DA和NA的吸附特异性。DA和NA的吸附质量浓度均为2 mg·mL-1。如图 7B所示, MAO-MIXPs对DA的最大吸附量达到23.29 mg·g-1, 远高于对NA的吸附量9.37 mg·g-1。MAO-MIXPs对DA表达量的降低效果也高于没有MAO固定化的MIXPs。这表明所制备的MAO-MIXPs因增加了DA降解酶MAO从而显著降低了DA表达量。
7 MAO-MIXPs的吸附机制经过MAO-MIXPs的静态重吸附实验, 使用兰格缪尔吸附公式(Langmuir) 和Brunner-Emmet-Teller多分子层吸附公式(BET) 模拟计算平衡吸附过程和线性回归值, 进行ANOVA方差分析。DA的吸附质量浓度为1~6 mg·mL-1时MAO-MIXPs的吸附等温线见图 8。当DA浓度增加时, MIXPs的平衡吸附能力也随之增加。Langmuir模型假定了均等的吸附位点分布具有相等的能量[28]。Langmuir模型方程如下:
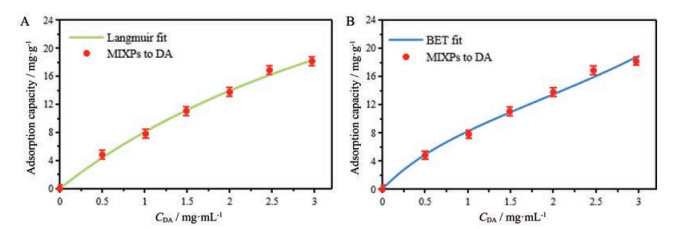
|
Figure 8 Langmuir model and Brunner-Emmet-Teller (BET) model were fitted by origin software |
| $ Q_{e}=\mathrm{K} Q C_{e} /\left(1+\mathrm{K} C_{e}\right) $ | (2) |
BET模型方程如下:
| $ Q_{e}=\mathrm{B} C_{e} Q /\left(C_{s}-C_{e}\right) /\left[1+(\mathrm{B}-1) C_{e} / C_{s}\right] $ | (3) |
其中, Qe (mg·g-1) 和Q (mg·g-1) 分别为DA的平衡和饱和吸附量, Ce (mg·mL-1) 为DA的平衡浓度, K (mL·mg-1) 是Langmuir常数。Cs (mg·mL-1) 为DA饱和浓度, B为与吸附热有关的常数。
如图 8和表 2所示, 与BET模型相比, Langmuir模型R2值更接近1。Langmuir模型表明为单层吸附[29]。这说明在MAO-MIXPs上具有均匀分布的降解酶及印迹层且更倾向于单层吸附机制, 并且最可能的吸附方式是通过存在于表面的经降解酶修饰的选择性分子印迹腔。
| Table 2 Langmuir and BET data for the adsorption of DA onto MAO-MIXPs. K: Langmuir constant; Q: Adsorption capacity; B: BET constant |
本文首次利用仿生溶胶-凝胶法和降解酶固定化技术制备了MAO-MIXPs。MAO-MIXPs可高选择性识别、吸附并降解DA, 有望用于DA表达调节。仿生溶胶-凝胶法首先将DA和PEI聚合, 再通过非共价键氢键的结合, 与TMOS自组装偶联, 经洗脱模板分子留下“记忆腔”, 然后将DA降解酶MAO固定在MIXPs。MAO-MIXPs因洗脱模板分子后留下DA印迹位点以及MAO可对DA降解, 降低了DA的表达。DA吸附实验是在人工脑脊液下进行的, 即通过模拟脑中DA过表达环境并为体内研究提供了理论基础。吸附机制实验研究验证了该聚合物更倾向于均一单层吸附, 为今后MAO-MIXPs剂型的制备提供了理论基础。此项研究尚未在动物实验中探索, 未来期待进一步在体内探究吸附效果。
综上所述, 通过仿生溶胶-凝胶法和酶固定化技术制备了MAO-MIXPs, 创新地提出了新型吸附分子体系。此项研究为对特定化合物的快速识别吸附及降解提供了一个新的方向, 有望使其能够高度选择性地吸附并降解, 降低因甲基苯丙胺成瘾机制产生的超过阈值的DA水平, 同时不吸附其他类似结构的儿茶酚胺神经递质。
作者贡献: 李小畅负责实验设计、MAO-MIXPs的处方优化、FTIR等表征图谱解析、吸附模型的模拟实验; 陈焘熙负责MAO-MIXPs实验材料的准备与制备; 李清晨负责MAO-MIXPs的吸附实验; 刘杨佳负责MAO-MIXPs的相关表征; 叶田田和王淑君负责实验设计指导、论文写作指导与把关。
利益冲突: 本文的研究内容无任何利益冲突。
| [1] |
Wu ZH, Chai ML, Hou JP, et al. Recent advances and perspective in the study of the nano-reinforcing materials for molecular imprinting of proteins[J]. Acta Pharm Sin (药学学报), 2015, 50: 15-20. |
| [2] |
Wang X, Wang YH, Liu S, et al. Construction of the brain-targeting drug carrier through imprinting of nicotinic acetylcholine receptor α7[J]. Acta Pharm Sin (药学学报), 2017, 52: 488-493. |
| [3] |
BelBruno JJ. Molecularly imprinted polymers[J]. Chem Rev, 2018, 119: 94-119. |
| [4] |
Chen LX, Wang XY, Lu WH. Molecular imprinting: perspectives and applications[J]. Chem Soc Rev, 2016, 45: 2137-2211. DOI:10.1039/C6CS00061D |
| [5] |
Zhang HQ. Water-compatible molecularly imprinted polymers: promising synthetic substitutes for biological receptors[J]. Polymer, 2014, 55: 699-714. DOI:10.1016/j.polymer.2013.12.064 |
| [6] |
Hu YL, Pan JL, Zhang KG, et al. Novel applications of molecularly imprinted polymers in sample preparation[J]. Trend Analyt Chem, 2013, 43: 37-52. DOI:10.1016/j.trac.2012.08.014 |
| [7] |
Peng J, Tang F, Zhou R. New techniques of on-line biological sample processing and their application in the field of biopharmaceutical analysis[J]. Acta Pharm Sin B, 2016, 6: 540-551. DOI:10.1016/j.apsb.2016.05.016 |
| [8] |
Gao BJ, An FQ, Zhu Y. Novel surface ionic imprinting materials prepared via couple grafting of polymer and ionic imprinting on surfaces of silica gel particles[J]. Polymer, 2007, 48: 2288-2297. DOI:10.1016/j.polymer.2006.12.041 |
| [9] |
Kadhirvel P, Azenha M, Silva AF, et al. Chromatographycally efficient microspherical composites of molecularly imprinted xerogels deposited inside mesoporous silica[J]. J Chromatog A, 2014, 1355: 158-163. DOI:10.1016/j.chroma.2014.06.013 |
| [10] |
Lofgreen JE, Ozin GA. Controlling morphology and porosity to improve performance of molecularly imprinted sol-gel silica[J]. Chem Soc Rev, 2014, 43: 911-933. DOI:10.1039/C3CS60276A |
| [11] |
Shaerzadeh F, Streit WJ, Heysieattalab S, et al. Methamphetamine neurotoxicity, microglia, and neuroinflammation[J]. J Neuroinflammation, 2018, 15: 341. DOI:10.1186/s12974-018-1385-0 |
| [12] |
Park EJ, Min YG, Kim GW, et al. Pathophysiology of brain injuries in acute carbon monoxide poisoning: a novel hypothesis[J]. Med Hypoth, 2014, 83: 186-189. DOI:10.1016/j.mehy.2014.04.032 |
| [13] |
Begieneman M, Horst ET, Rijvers L, et al. Dopamine induces lipid accumulation, NADPH oxidase-related oxidative stress and a pro-inflammatory status of the plasma membrane in H9C2 cells[J]. Am J Physiol Heart C, 2016, 311: 1097-1107. DOI:10.1152/ajpheart.00633.2015 |
| [14] |
Xue X, Yang JY, He Y, et al. Aggregated single-walled carbon nanotubes attenuate the behavioural and neurochemical effects of methamphetamine in mice[J]. Nat Nanotechnol, 2016, 11: 613-620. DOI:10.1038/nnano.2016.23 |
| [15] |
Ribeiro JA, Fernandes P, Pereira CM, et al. Electrochemical sensors and biosensors for determination of catecholamine neurotransmitters: a review[J]. Talanta, 2016, 160: 653-679. DOI:10.1016/j.talanta.2016.06.066 |
| [16] |
Nagai Y, Yudasaka M, Kataura H, et al. Brighter near-IR emission of single-walled carbon nanotubes modified with a cross-linked polymer coating[J]. Chem Commun, 2019, 55: 6854-6857. DOI:10.1039/C9CC02712B |
| [17] |
Meran M, Akkus PD, Kurkcuoglu O, et al. Noncovalent pyrene-polyethylene glycol coatings of carbon nanotubes achieve in vitro biocompatibility[J]. Langmuir, 2018, 34: 12071-12082. DOI:10.1021/acs.langmuir.8b00971 |
| [18] |
Movia D, Canto ED, Giordani S. Purified and oxidized single-walled carbon nanotubes as robust near-IR fluorescent probes for molecular imaging[J]. J Phys Chem C, 2010, 114: 18407-18413. DOI:10.1021/jp1067318 |
| [19] |
Cicchetti R, Divizia M, Valentini F, et al. Effects of single-wall carbon nanotubes in human cells of the oral cavity: geno-cytotoxic risk[J]. Toxicol In Vitro, 2011, 25: 1811-1819. DOI:10.1016/j.tiv.2011.09.017 |
| [20] |
Pei MY. The influence of ephedrine on the activity of amineoxidase[J]. Acta Pharm Sin (药学学报), 1964, 834-836. |
| [21] |
Yang Z, Wang X, Yang J, et al. Aberrant CpG methylation mediates abnormal transcription of MAO-A induced by acute and chronic L-3, 4-dihydroxyphenylalanine administration in SH-SY5Y neuronal cells[J]. Neurotox Res, 2017, 31: 334-347. DOI:10.1007/s12640-016-9686-5 |
| [22] |
Aguirre-Martinez GV, Andre C, Gagne F, et al. The effects of human drugs in Corbicula fluminea. Assessment of neurotoxicity, inflammation, gametogenic activity, and energy status[J]. Ecotoxicol Environ Safe, 2017, 148: 652-663. |
| [23] |
Li J, Xu L, Wang HY, et al. Comparison of bare and amino modified mesoporous silica@poly(ethyleneimine)s xerogel as indomethacin carrier: superiority of amino modification[J]. Mat Sci Eng C Mater, 2016, 59: 710-716. DOI:10.1016/j.msec.2015.10.072 |
| [24] |
Spector R, Snodgrass SR, Johanson CE. A balanced view of the cerebrospinal fluid composition and functions: focus on adult humans[J]. Exp Neurol, 2015, 273: 57-68. DOI:10.1016/j.expneurol.2015.07.027 |
| [25] |
Pathak A, Gupta BD. Ultra-selective fiber optic SPR platform for the sensing of dopamine in synthetic cerebrospinal fluid incorporating permselective nafion membrane and surface imprinted MWCNTs-PPy matrix[J]. Biosens Bioelectron, 2019, 133: 205-214. DOI:10.1016/j.bios.2019.03.023 |
| [26] |
Tian JJ, Yu YT, Zhao LJ, et al. Mesoporous silica solidifying volatile oil from Bupleuri radix and forsythiae fructus and its micromeritic properties[J]. Acta Pharm Sin (药学学报), 2019, 54: 1493-1501. |
| [27] |
An FQ, Gao BJ, Feng XQ. Adsorption and recognizing ability of molecular imprinted polymer MIP-PEI/SiO2 towards phenol[J]. J Hazard Mater, 2008, 157: 286-292. DOI:10.1016/j.jhazmat.2007.12.095 |
| [28] |
Langmuir I. The adsorption of gases on plane surfaces of glass, mica and platinum[J]. J Am Chem Soc, 1918, 40: 1361-1403. DOI:10.1021/ja02242a004 |
| [29] |
Anirudhan TS, Christa J, Deepa JR. Extraction of melamine from milk using a magnetic molecularly imprinted polymer[J]. Food Chem, 2017, 227: 85-92. DOI:10.1016/j.foodchem.2016.12.090 |
 2021, Vol. 56
2021, Vol. 56


