2. 中国科学院上海药物研究所新药研究国家重点实验室, 上海 201203
2. State Key Laboratory of Drug Research, Shanghai Institute of Materia Medica, Chinese Academy of Sciences, Shanghai 201203, China
甘草为豆科植物甘草(Glycyrrhiza uralensis Fisch.)、胀果甘草(Glycyrrhiza inflata Bat.) 或光果甘草(Glycyrrhiza glabra L.) 的干燥根和根茎, 其味甘、性平, 具有补脾益气、清热解毒、祛痰止咳、缓急止痛、调和诸药的功效[1]。近年来化学研究表明, 黄酮类、萜类等是甘草的主要化学成分[2]。甘草为中医临床常用的大宗中药品种, 在我国药用历史悠久, 入药多采用其炮制品炙甘草, 其中甘草经蜜炙后可增强其补脾益气的作用。唐代孙思邈在《千金翼方》中多用炙甘草, 生甘草仅见于咽痛、小儿灼疮等清热解毒方。明代杜文燮著《药鉴》提出甘草“气平味甘, 阳也。入足厥阴太阴二经。生用则寒, 炙之则温[3]。”现代临床已经证实[4], 蜜炙甘草可最大限度发挥甘草的药用价值, 可能是由于炮制引起的药用化学成分变化引起的。已有文献报道, 炮制可显著提高药材中甘草酸与甘草苷含量[5]。但是, 甘草在炮制过程中的化学成分整体性差异尚不明确, 因此, 揭示炮制过程中主要的差异性化学成分, 并发现其与不同炮制程度之间的联系, 可以为炮制工艺的控制提供重要的科学依据。
植物次生代谢产物种类繁多、结构迥异, 传统的分析手段难以满足对某一植物中不同类型化学成分同时进行分析的要求。代谢组学技术的出现为这一问题的解决提供了新的方法和思路[6], 它通过高通量化学分析对生物体内的代谢物进行定性和定量分析[7], 从中检测并筛查出具有显著差异的代谢产物, 并以此为基础研究生物体的代谢过程和变化机制[8]。代谢组学技术能够从整体上对中药所含的化学成分进行全面分析, 获得中药的次生代谢物指纹图谱, 通过多元统计分析明确不同样本的分组聚类情况, 在药用植物基源鉴定、与环境胁迫关系、药材道地性及质量控制、中药炮制、中药复方配伍、中药药效及药理评价、中药代谢及毒理评价、中药方证等领域应用广泛[9-11]。例如, Wang等[12]采用1H NMR代谢组学技术评价何首乌炮制品中的差异代谢物, 找出了15种差异化学成分, 可以较好地评价何首乌的不同炮制工艺。Zhang等[13]开发了一种基于UPLC-QTOF-MS/MS的代谢组学方法, 以快速评估红参和人参炮制前后的不同特征成分, 发现炮制对人参的质量产生了影响。Wang等[14]基于UPLC-Q-TOF-HDMS的代谢组学研究方法, 结合模式识别分析, 研究了川乌、附子及其炮制品对大鼠血浆综合代谢特征和生物标志物的影响, 发现炮制可以降低毒性, 并分别找到了10个和8个重要的生物标志物。Zhang等[15]采用UPLC-Q-TOF-MSE技术结合外源性代谢组学方法, 对肝豆汤给药后正常和铜负荷模型大鼠尿液中的原形成分及代谢产物进行定性分析, 共检测到77个外源性成分, 并提出UPLC-Q-TOF-MSE结合外源性代谢组学方法能去除内源性干扰离子, 使数据分析过程更加准确便捷, 简化了化合物解析过程, 可作为筛选鉴定代谢成分的有效工具。
本文将超高效液相色谱耦联四级杆-高分辨飞行时间质谱(UPLC-Q-TOF/MS) 技术和代谢组学分析方法应用到对中药饮片甘草的研究中, 以山西、内蒙古、河北张家口产地生药及其炮制不及、炮制适度和炮制太过的蜜炙甘草为研究对象, 筛查其中差异显著的次生代谢化合物来指导蜜炙甘草炮制工艺的过程, 为蜜炙甘草炮制工艺优化提供科学依据。
材料与方法实验材料与试剂 本实验共收集了21批次不同产地的生药(raw, R)、炮制不及(less processing, LP)、炮制适度(moderate processing, MP) 和炮制太过(excessive processing, EP) 的中药甘草(Glycyrrhiza uralensis Fisch.) 饮片, 详细信息见表 1, 甘草生药以及其炮制品由国药集团北京华邈药业有限公司提供(收样日期: 2019.10.18, 炮制标准: 中国药典2015年版); 甘草(G. uralensis Fisch.) 对照药材由上海中药现代化研究中心提供。对照品芹糖甘草苷(含量≥ 98%, 批号ST04390120)、甘草苷(含量≥ 98%, 批号ST07010120)、芹糖异甘草苷(含量≥ 98%, 批号ST18930105)、异甘草苷(含量≥ 98%, 批号ST04480120)、甘草素(含量≥ 98%, 批号ST07000120)、甘草酸(含量≥ 98%, 批号ST00660120)、甘草次酸(含量≥ 98%, 批号ST00710120) 购自上海诗丹德标准技术服务有限公司。HPLC级甲醇和乙腈购自Merck (Darmstadt, 德国); 甲酸和亮氨酸脑啡肽购自Sigma-Aldrich (St Louis, MO, 美国); 超纯水由Millipore纯水机制备; 其他试剂均为分析纯。
| Table 1 The information of the prepared slices of G. uralensis. R: Raw; LP: Less processing; MP: Moderate processing; EP: Excessive processing; WGR: Weight gain rate |
仪器 Waters Acquity UPLC超高效液相色谱系统(Waters, 美国), Waters SYNAPT G2-Si Q-TOF高分辨率飞行时间质谱仪(Waters, 美国), Millipore Simplicity纯水仪(Millipore, Molsheim, 法国), 粉碎机(DJ-02, 上海淀久中药机械制造有限公司), 电子分析天平(MSE 125P-100DA, Sartorius, 德国), 超声仪(KQ-500VDE, 昆山超声仪器有限公司), 高速台式冷冻离心机(Eppendorf, 德国)。
蜜炙甘草的制备 照蜜炙法(通则0213) 进行炮制: 取甘草片, 将炼蜜加适量沸水稀释后, 加入甘草片中拌匀, 闷透, 置炒制容器内, 炒至黄色至深黄色, 不粘手时取出, 晾凉[16]。炮制不及和炮制太过组在此时间基础上上下浮动50%。每100 kg甘草片, 用炼蜜25 kg。
供试样品的制备 分别平行称取3次甘草生药100.0 mg以及相当于100.0 mg生药的炮制品, 加入80%甲醇溶液20 mL, 称重, 超声2 h, 用相同的溶剂补足减失的重量, 摇匀。取溶液1 mL, 经15 000 r‧min-1离心10 min, 取上清, 用50%乙腈溶液稀释10倍, 用于UPLC-Q-TOF/MS检测。
对照品的制备 精密称取对照品1.00 mg, 用50%乙腈溶液配制成1 μg‧mL-1的溶液, 作为对照品试液。
超高效液相色谱条件 色谱柱Acquity UPLC HSS T3 (100 mm×2.1 mm, 1.8 μm); 柱温40 ℃; 流动相: 0.1%甲酸/水(A)-0.1%甲酸/乙腈(B); 梯度洗脱: 0~3 min, 17% B; 3~10 min, 17%~32% B; 10~30 min, 32%~82% B。流速0.4 mL‧min-1, 进样体积1 μL, 自动进样器温度保持在10 ℃。
UPLC-Q-TOF/MS质谱条件 数据采集模式设置为MSE, 电离模式设置为, 正离子电喷雾(ESI+)、负离子电喷雾(ESI-)。雾化气为高纯度氮气, 碰撞气为高纯度氦气, 质量扫描范围: m/z 50~1 200; 锥孔电压为40 V, 正离子模式毛细管电压为3.0 kV, 负离子模式毛细管电压为2.5 kV, 离子源温度120 ℃, 脱溶剂气温度350 ℃, 脱溶剂气流速750 L‧h-1, 锥孔气流速50 L‧h-1, 低能量通道扫描的碰撞能量为2 eV, 高能量通道扫描的碰撞能量为15~50 eV。LockMass: 亮氨酸脑啡肽(ESI+: m/z 556.277 1, ESI-: m/z 554.261 5)。LC-MS数据采集由MassLynx 4.1质谱工作站(Waters, 美国) 进行。对于UNIFI的代谢物表征, MSE数据以Continnum格式获得, 未采用实时校正。采集的负离子模式下的MSE数据用于Progenesis QI 3.0 (Waters, 美国) 分析。
数据处理与统计学分析 通过UNIFI 1.8 (Waters, 美国) 实现了代谢物的自动表征。利用UNIFI在线软件进行化学成分鉴定与匹配, 具体参数设置如下: 分析类型设置为MSE数据的精确质量数进行筛查; 峰值检测时间, 1~25 min; 质量准确度, ± 10 ppm; 保留时间容差, ± 0.2 min, 碎片数≥ 1, 峰强度 > 2 000。通过人工校验和核实各化合物的精确相对分子质量, 筛查甘草的化学成分。利用Progenesis QI 3.0进行数据预处理和多元统计学分析, 通过峰对齐、峰提取、去卷积化、归一化等过程获得包括保留时间、质荷比和峰面积在内的数据矩阵。将数据矩阵导入MetaboAnalyst以及SIMCA-P 14.0软件(Umetrics, Umea, 瑞典) 进行分析, 包括主成分分析(PCA)、正交偏最小二乘判别分析(OPLS-DA) 以及偏最小二乘判别分析(PLS-DA)、t检验以及单因素方差分析等; 差异化合物筛选标准为变量投影重要度(VIP) 大于1以及t检验P < 0.05。
结果 1 UNIFI信息软件管理平台对甘草生药次生代谢化合物的自动表征通过查阅文献[2, 17-19]搜集甘草中已报道的化学成分信息, 基于UNIFI信息管理软件建立了中药甘草中已报道化合物的理论数据库, 记录了每一个化学成分的相对分子质量、分子式、CAS号、结构式的mol文件等基本信息。同时, 还建立了甘草中化合物对照品的实物数据库, 除了录入和理论数据库相同的信息外, 还录入了保留时间、碎片质荷比(m/z) 等信息。
甘草对照药材以及对照品溶液的正、负离子模式基峰色谱图(BPI图) 如图 1所示。将采集的MSE数据导入到UNIFI信息管理平台中进行快速匹配筛查。有文献报道甘草的主要药效活性可能是由其中的主要成分产生的[20], 因此人工筛查了在质谱中峰强度大于2 000的化合物。据此共鉴定甘草中的57个化学成分, 其中正离子采集模式鉴定了37个化合物, 负离子采集模式鉴定了56个化合物。表 2、3分别为正、负离子模式下鉴定出的化合物列表。
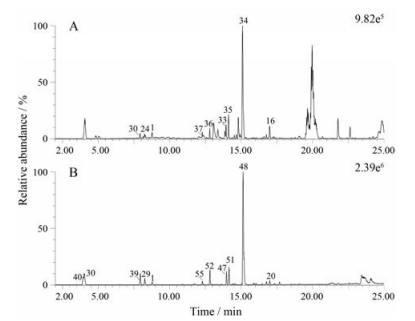
|
Figure 1 Base peak intensity (BPI) chromatograms of G. uralensis in positive ion mode (A) and negative ion mode (B) |
| Table 2 Identification of compounds in G. uralensis in positive ion mode. aCompounds confirmed by comparison with reference compounds |
| Table 3 Identification of compounds in G. uralensis in negative ion mode. aCompounds confirmed by comparison with reference compounds |
利用Progenesis QI 3.0软件对在负离子模式下采集的不同产地甘草(山西、河北张家口、内蒙古) 生药及其不同炮制程度(炮制不及、炮制适度和炮制太过) 的蜜炙甘草饮片的MSE数据进行了合适的预处理, 将前期利用UNIFI信息管理软件建立的甘草化学成分的理论数据库导入QI软件进行筛查匹配, 分别从山西、河北张家口和内蒙古产地的甘草样品中匹配出55个、47个和63个化合物的数据矩阵。采用非监督的PCA模型对数据集进行相似性和差异性分析, 结果如图 2所示。不同产地的生药、炮制不及、炮制适度和炮制太过组甘草各自能较好地聚为一类, 表明四组在化学成分上有一定的差异。
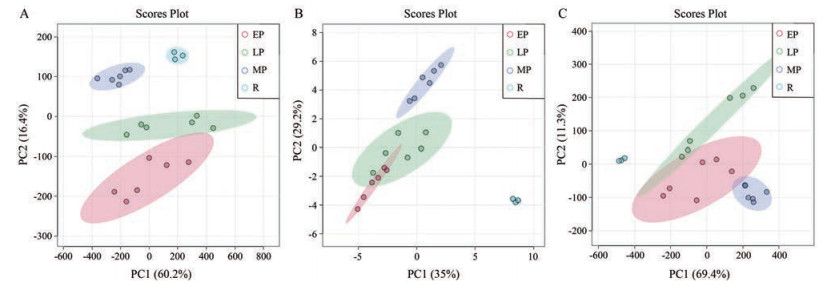
|
Figure 2 The PCA scores plot for R group versus LP group versus MP group versus EP group in Shanxi (A), Hebei Zhangjiakou (B) and Inner Mongolia (C) |
PCA模型可以根据样本间次生代谢化合物丰度的不同来对样本进行聚类[21], 同时反映了组内和组间的差异。为了突出组间差异, 便于寻找差异性的特征成分, 采用有监督的OPLS-DA模型和PLS-DA模型对数据进行分析, 前者通常适用于两组间的对比, 而后者可以用于两组及以上组别的分类比较[22]。因此, OPLS-DA模型用于生药组和炮制适度组的分析, PLS-DA模型用于炮制不及组、炮制适度组和炮制太过组的分析, 得到的得分图由交叉验证参数R2X、R2Y和Q2描述。R2X、R2Y代表模型的可解释变量, Q2代表模型的可预测变量。两种模型的R2X、R2Y和Q2值如表 4所示, 数值均接近1, 远大于0.5, 提示模型具有很好的稳定性和预测能力。图 3 (VIP > 1) 和图 4 (VIP > 1) 分别为不同产地甘草的OPLS-DA模型的S-plot载荷图和PLS-DA模型的Loading载荷图。这两种载荷图中, 每个点代表一个化学成分(变量), 并且每个变量离被分析化学物质的主类越远, 该成分就越有可能对组间差异做出重要贡献。这些差异较大的变量可被认为是甘草生药与不同炮制程度甘草的潜在差异性化合物。
| Table 4 The R2X, R2Y, and Q2 value of OPLS-DA scores plot and PLS-DA scores plot of G. uralensis in the three locations |
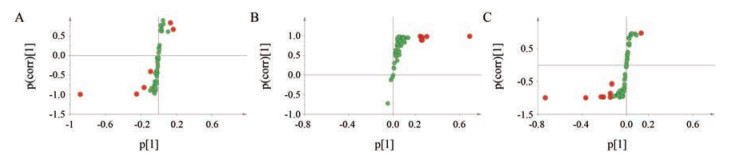
|
Figure 3 S-plots of OPLS-DA for R group versus MP group in Shanxi (A), Hebei Zhangjiakou (B) and Inner Mongolia (C) |
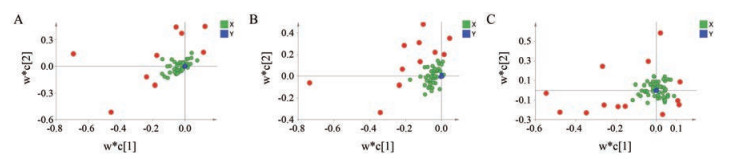
|
图 4 Loading plots of PLS-DA for LP group versus MP group versus EP group in Shanxi (A), Hebei Zhangjiakou (B) and Inner Mongolia (C) |
差异化合物以两个模型的VIP > 1、t检验的P < 0.05以及同时存在于不同产地的甘草样品中并且其含量具有明显差异性为标准进行筛查, 差异化合物的含量由利用QI软件匹配得到的数据矩阵中的化合物的峰面积表示。炮制适度组和生药组的比较发现, 不同产地甘草中的芹糖甘草苷(liquirtin apioside)、芹糖异甘草苷(isoliquirtin apioside)、甘草酸(glycyrrhizic acid)、甘草皂苷G2 (licoricesaponin G2)[23]和甘草皂苷E2 (licoricesaponin E2)[23]的含量均有明显差异。不同炮制程度组的比较发现, 甘草酸、甘草皂苷G2和甘草皂苷E2 (结构如图 5所示) 存在较为显著的差异, 可用作区分生药和不同炮制程度组的差异化合物。进一步发现, 这三个化合物在炮制后, 其相对含量增加, 且在炮制适度时, 含量最高, 随着炮制时间增加, 含量减少, 可能可以用作蜜炙甘草饮片炮制程度过程控制的评价指标。
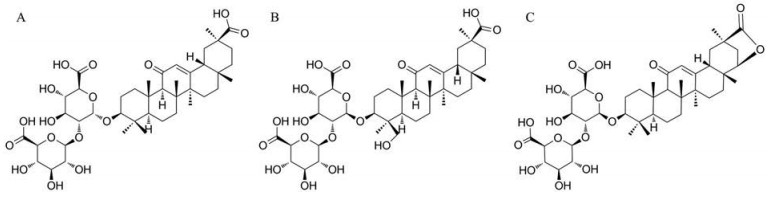
|
Figure 5 The structures of glycyrrhizic acid (A), licoricesaponin G2 (B) and licoricesaponin E2 (C) |
明代陈嘉谟[24]在《本草蒙筌》中提出“凡药制造, 贵在适中, 不及则功效难求, 太过则气味反失”, 这里提到的就是炮制对药材功效的影响, 其中适中即是对“度”的准确把握, 因此控制中药材的炮制加工对其药效有着重要影响。生甘草能清热解毒, 润肺止咳, 调和诸药; 蜜炙甘草能补脾和胃、益气复脉。已有文献报道, 甘草饮片炮制时间过长, 会显著降低主要化学成分的含量[25]。这说明炮制影响药材的功效很可能是由于炮制过程使二者化学成分发生变化所导致的。
本研究基于UPLC-Q-TOF/MS技术, 将代谢组学分析方法应用到对不同产地甘草中药饮片以及炮制品蜜炙甘草的研究中, 结果表明, 炮制程度不同的甘草饮片中的化学成分类型没有发生明显变化, 但是其中主要化学成分的含量发生了变化, 其中炮制适度的蜜炙甘草饮片中甘草酸、甘草皂苷G2、甘草皂苷E2相对含量高于生药、炮制不及和炮制太过组。上述三个化学成分的含量的变化可以反映炮制程度的不同, 因此对它们的监测可以用来控制炮制工艺的过程。
蜜炙伴随着加热, 在蜜炙过程中, 甘草中的一系列结构类似物经过加热发生了复杂的化学转化, 推测甘草酸、甘草皂苷G2、甘草皂苷E2的含量发生变化可能是由此原因造成的。Ota等[26]在对甘草、烤甘草和蜜炙甘草的化学成分差异的研究中发现甘草酸经过长时间的加热, 其含量降低, 而甘草次酸3-O-葡萄糖醛酸苷和甘草次酸的含量明显升高, 提出甘草酸在加热条件下, 发生醚苷键断裂, 依次脱葡萄糖醛酸生成甘草次酸3-O-葡萄糖醛酸苷和甘草次酸的反应。
从化学角度来说, 皂苷的酯苷键的热稳定性不如醚苷键, 因此认为甘草酸、甘草皂苷G2和甘草皂苷E2的含量先升高后降低可能是因为与它们对应的皂苷化合物的酯苷键在蜜炙过程中首先发生裂解反应, 然后随着蜜炙加热时间的增加其本身再发生醚苷键的裂解。
以甘草酸和甘草皂苷G2为例, 甘草中存在着一系列这两个化合物的类似物, 如甘草皂苷A3 (licoricesaponin A3)和24-羟基-甘草皂苷A3 (24-hydroxy-licoricesaponin A3), 它们分别是在甘草酸和甘草皂苷G2结构上的C-20位有酯苷键取代的化合物。根据在实验过程中监测到的相关化合物的峰面积, 发现甘草皂苷A3和24-羟基-甘草皂苷A3随着炮制时间的增加, 其含量减少, 可能是因为结构上C-20位的酯苷键首先发生了断裂, 分别转化为甘草酸和甘草皂苷G2, 从而使甘草酸和甘草皂苷G2含量增加。随着炮制时间继续增加, 甘草酸和甘草皂苷G2的含量不断降低, 可能是因为其结构上的醚苷键进一步发生断裂, 依次脱葡萄糖醛酸生成其他化合物。
对于皂苷化合物的类似变化, Li等[27]在对芍药苷的研究中也有发现。芍药苷类似物在浸润过程中酯苷键首先裂解转变为芍药苷, 从而导致白芍浸润过程中芍药苷含量的升高, 并且随着时间的延长, 芍药苷中的醚苷键发生变化转变为其他成分, 使芍药苷含量降低。
据相关文献报道甘草中的三萜皂苷类成分具有抗病毒作用[28]、抗炎保肝作用[29, 30]、抗肿瘤作用[31]、解毒作用[32]、抗痉挛作用[33]、与其他药物协同抗哮喘作用[34]及神经保护作用[35]等。这些三萜皂苷类化合物可以视为中药甘草饮片中的主要活性成分, 与中药甘草饮片的质量息息相关。
因此, 从化学成分的角度来说, 蜜炙甘草饮片的质量与活性化合物的含量有密切的联系, 而化合物含量受到多方面因素的影响, 除炮制工艺外, 药材产地对其也有重要影响。在研究过程中, 通过对化学成分含量的监测, 发现内蒙古产地甘草中的皂苷含量明显比山西或河北张家口产地甘草中的含量高, 经炮制后, 其皂苷含量仍然远高于其他地区。因此, 产地对甘草炮制饮片质量的影响远大于炮制工艺的影响, 内蒙古产地的炮制适度的炙甘草质量应该是最优的结果。本研究结果提示, 蜜炙甘草饮片的质量保证首先要规范原料药材产地, 其次才是规范炮制工艺。
作者贡献: 姚玲玲负责查阅文献、设计实验方案、实验操作、数据分析以及文章撰写; 柯昌强负责指导实验方案设计、实验操作和数据分析; 刘佳负责指导实验方案设计及核实实验数据和数据分析结果; 唐春萍和叶阳负责指导论文写作及修改。
利益冲突: 本文中所有作者声明无任何利益冲突。
| [1] |
Chinese Pharmacopoeia Commission. Pharmacopoeia of the People's Republic of China (中华人民共和国药典)[S]. 2020 Ed. Vol Ⅰ. Beijing: China Medical Science Press, 2020: 88.
|
| [2] |
Sun C. Research progress on chemical constituents of Glycyrrhiza uralensis Fisch[J]. Sci Technol Inf (科技资讯), 2020, 575: 70-71. |
| [3] |
Du WX. Yao Jian (药鉴)[M]. Shanghai: Shanghai People's Publishing House, 1975: 50.
|
| [4] |
Ye H, Wang JC, Liu P, et al. Study on glycyrrhizic acid content in Glycyrrhiza Uralensis before and after processing in different compatibility[J]. Guangzhou Chem Ind (广州化工), 2018, 46: 61-65. |
| [5] |
Li HB. Effect of processing factors on glycyrrhizin and glycyrrhizic acid in Glycyrrhiza uralensis Fisch[J]. Guide China Med (中国医药指南), 2020, 18: 177. |
| [6] |
Fiehn O, Kopka J, Dörmann P, et al. Metabolite profiling for plant functional genomics[J]. Nat Biotechnol, 2000, 18: 1157-1161. DOI:10.1038/81137 |
| [7] |
Nicholson JK, Lindon JC, Holmes E. 'Metabonomics': understanding the metabolic responses of living systems to pathophysiological stimuli via multivariate statistical analysis of biological NMR spectroscopic data[J]. Xenobiotica, 1999, 29: 1181-1189. DOI:10.1080/004982599238047 |
| [8] |
Qiu Y, Reed D. Gas Chromatography in metabolomics study[M]//Guo XH. Advances in Gas Chromatography. London: Intech Open, 2014, 4: 83-101.
|
| [9] |
Duan LX, Dai YT, Sun C, et al. Metabolomics research of medicinal plants[J]. China J Chin Mater Med (中国中药杂志), 2016, 41: 4090-4095. |
| [10] |
Miao X, Xiao B, Shui S, et al. Metabolomics analysis of serum reveals the effect of Danggui Buxue Tang on fatigued mice induced by exhausting physical exercise[J]. J Pharm Biomed Anal, 2018, 151: 301-309. DOI:10.1016/j.jpba.2018.01.028 |
| [11] |
Wang XJ, Zhang AH, Sun H, et al. Precision diagnosis of Chinese medicine syndrome and evaluation of prescription efficacy based on chinmedomics[J]. World Sci Technol Mod Tradit Chin Med (世界科学技术-中医药现代化), 2017, 19: 30-34. |
| [12] |
Wang J, Sun Y, Chen LL, et al. Significant changed metabolites in processed products of Polygoni Multiflori Radix based on fingerprint of 1H-NMR[J]. Drugs Clin (现代药物与临床), 2020, 35: 1537-1543. |
| [13] |
Zhang HM, Li SL, Zhang H, et al. Holistic quality evaluation of commercial white and red ginseng using a UPLC-QTOF-MS/MS-based metabolomics approach[J]. J Pharm Biomed Anal, 2012, 62: 258-273. DOI:10.1016/j.jpba.2012.01.010 |
| [14] |
Wang X, Wang H, Zhang A, et al. Metabolomics study on the toxicity of aconite root and its processed products using ultraperformance liquid-chromatography/electrospray-ionization synapt high-definition mass spectrometry coupled with pattern recognition approach and ingenuity pathways analysis[J]. J Proteome Res, 2012, 11: 1284-1301. DOI:10.1021/pr200963e |
| [15] |
Zhang XY, Liu Y, Wu H, et al. Identification of major bioactive components and metabolites of Gandou decoction in rat urine by an integrative approach based on UPLC-Q-TOF-MSE coupled with xenometabolomics analytical platform[J]. Acta Pharm Sin (药学学报), 2020, 55: 217-224. |
| [16] |
Chinese Pharmacopoeia Commission. Pharmacopoeia of the People's Republic of China (中华人民共和国药典)[S]. 2015 Ed. Vol Ⅰ. Beijing: China Medical Science Press, 2015: 87.
|
| [17] |
Bao F, Bai HY, Wu ZR, et al. Phenolic compounds from cultivated Glycyrrhiza uralensis and their PD-1/PD-L1 inhibitory activities[J]. Nat Prod Res, 2021, 35: 562-569. DOI:10.1080/14786419.2019.1586698 |
| [18] |
Kitagawa I, Chen WZ, Hori K, et al. Chemical studies of Chinese licorice-roots. II. Five new flavonoid constituents from the roots of Glycyrrhiza aspera Pall. collected in Xinjiang[J]. Chem Pharm Bull, 1998, 46: 1511-1517. DOI:10.1248/cpb.46.1511 |
| [19] |
Ji S, Li ZW, Song W, et al. Bioactive constituents of Glycyrrhiza uralensis (licorice): discovery of the effective components of a traditional herbal medicine[J]. J Nat Prod, 2016, 79: 281-292. DOI:10.1021/acs.jnatprod.5b00877 |
| [20] |
Li Q, Gao HR, Guo JF. Research progress on main chemical composition and pharmacodynamic activity of Glycyrrhiza uralensis and relationship with environment[J]. Heilongjiang Agric Sci (黑龙江农业科学), 2019(09): 150-154. |
| [21] |
Heinemann J. Cluster analysis of untargeted metabolomic experiments[J]. Methods Mol Biol, 2019, 1859: 275-285. |
| [22] |
Blasco H, Błaszczyński J, Billaut JC, et al. Comparative analysis of targeted metabolomics: dominance-based rough set approach versus orthogonal partial least square-discriminant analysis[J]. J Biomed Inf, 2015, 53: 291-299. DOI:10.1016/j.jbi.2014.12.001 |
| [23] |
Kitagawa I, Hori K, Sakagami M, et al. Saponin and sapogenol. XLVIII. On the constituents of the roots of Glycyrrhiza uralensis Fischer from Northeastern China. (2). Licoricesaponins D3, E2, F3, G2, H2, J2, and K2[J]. Chem Pharm Bull, 1993, 41: 1337-1345. DOI:10.1248/cpb.41.1337 |
| [24] |
Chen JM. Ben Cao Meng Quan (本草蒙筌)[M]. Beijing: Ancient Chinese Medical Book Press, 2009.
|
| [25] |
Zhang RH. Effect of different processing conditions on content and variation of epimer and impurities of main components in Glycyrrhiza uralensis[J]. J Sichuan Tradit Chin Med (四川中医), 2019, 37: 64-68. |
| [26] |
Ota M, Xu F, Li YL, et al. Comparison of chemical constituents among licorice, roasted licorice, and roasted licorice with honey[J]. J Nat Med, 2018, 72: 80-95. DOI:10.1007/s11418-017-1115-4 |
| [27] |
Li W, Liu P, Yan X. The influence of soaking time on the content of paeoniflorin[J]. Lishizhen Med Mater Med Res (时珍国医国药), 2006, 17: 775-776. |
| [28] |
Sui X, Yin J, Ren X. Antiviral effect of diammonium glycyrrhizinate and lithium chloride on cell infection by pseudorabies herpesvirus[J]. Antiviral Res, 2010, 85: 346-353. DOI:10.1016/j.antiviral.2009.10.014 |
| [29] |
Li XH, Qi Y, Cai RL, et al. Studies on the anti-inflammatory mechanism of total saponins of Radix Glycyrrhiza in vitro[J]. Chin J Exp Tradit Med Form (中国实验方剂学杂志), 2010, 16: 110-113. |
| [30] |
Abe K, Ikeda T, Wake K, et al. Glycyrrhizin prevents of lipopolysaccharide/D-galactosamine-induced liver injury through down-regulation of matrix metalloproteinase-9 in mice[J]. J Pharm Pharmacol, 2010, 60: 91-97. DOI:10.1211/jpp.60.1.0012 |
| [31] |
Hibasami H, Iwase H, Yoshioka K, et al. Glycyrrhizin induces apoptosis in human stomach cancer KATO III and human promyelotic leukemia HL-60 cells[J]. Int J Mol Med, 2005, 16: 233-236. |
| [32] |
Rahman S, Sultana S. Glycyrrhizin exhibits potential chemopreventive activity on 12-O-tetradecanoyl phorbol-13-acetate-induced cutaneous oxidative stress and tumor promotion in Swiss albino mice[J]. J Enzyme Inhib Med Chem, 2007, 22: 363. DOI:10.1080/14756360601074094 |
| [33] |
Bhangale JO, Chaudhari SR, Shete RV, et al. Antinociceptive and antinflammatory effects of Tectona grandis (L.) bark[J]. Pharmacologyonline, 2010, 2: 856-864. |
| [34] |
Yang Y, Shi Q, Liu Z, et al. The synergistic anti-asthmatic effects of glycyrrhizin and salbutamol[J]. Acta Pharmacol Sin, 2010, 31: 443-449. DOI:10.1038/aps.2009.207 |
| [35] |
Kao TC, Wu CH, Yen GC. Glycyrrhizic acid and 18β-glycyrrhetinic acid recover glucocorticoid resistance via PI3K-induced AP1, CRE and NFAT activation[J]. Phytomedicine, 2013, 20: 295-302. DOI:10.1016/j.phymed.2012.10.013 |
 2021, Vol. 56
2021, Vol. 56


