2. 中国食品药品检定研究院, 化学药品质量研究与评价重点实验室, 北京 100050
2. NMPA Key Laboratory for Quality Research and Evaluation of Chemical Drugs, National Institutes for Food and Drug Control, Beijing 100050, China
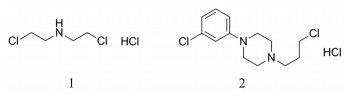
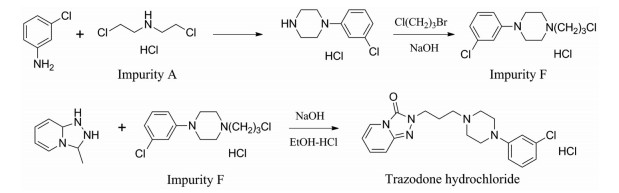
盐酸曲唑酮是一种非典型的四环类抗抑郁药物, 通过选择性地抑制5-羟色胺的重吸收发挥有效的抗抑郁及抗焦虑作用, 其优点在于毒性较传统抗抑郁药低, 起效快, 抗胆碱和心血管作用的发生率低。除此之外, 盐酸曲唑酮还具有镇静作用和轻微的肌肉松弛作用[1]。盐酸曲唑酮原料药合成工艺通常采用双(2-氯乙基) 胺(杂质A) 来合成中间体1-(3-氯苯基)-4-(3-氯丙基) 哌嗪(杂质F), 再与l, 2, 4三唑并[4, 3-a]吡啶-3(2H)-酮在碱性条件下反应制得成品[2], 盐酸曲唑酮杂质A和杂质F的结构式见图 1, 合成路径见图 2。已有实验证明双(2-氯乙基) 胺为具有体外致突变性的第二类遗传毒性杂质[3]。1-(3-氯苯基)-4-(3-氯丙基) 哌嗪具有与双(2-氯乙基) 胺相似的卤代烷烃取代基警戒结构, 经定量构效关系评估及体外Ames致突变实验证实其具有体外致突变性, 同样为第二类遗传毒性杂质。人用药品注册技术要求国际协调会(ICH) 于2017年出版的最新版评估和控制药物中DNA反应性(致突变) 杂质以限制潜在致癌风险指南M7 (R1) 中根据药物暴露周期科学地控制遗传毒性杂质含量而提出的可接受摄入量及限度的计算方法, 采用毒理学关注阈值(threshold of toxicological concern, TTC) 1.5 μg·d-1作为每日可接受摄入量[4], 盐酸曲唑酮每日最高服用剂量应不大于600 mg, 计算得1-(3-氯苯基)-4-(3-氯丙基) 哌嗪盐酸盐及双(2-氯乙基) 胺盐酸盐的限值均为2.5 μg·g-1。
|
图 1 The chemical structures of trazodone hydrochloride impurity A (1) and impurity F (2) |
|
图 2 The synthetic scheme of trazodone hydrochloride |
目前盐酸曲唑酮原料药及其制剂国外仅有美国药典(USP) 和英国药典(BP) 收载, 其中BP仅提及需建立合适的方法控制杂质F, 但并未提供具体方法; USP仅在原料药标准中建立了杂质A和杂质F相应的检测方法并规定了限度; 国内原料药及片剂标准中则并未将杂质F和杂质A作为特殊杂质进行控制。在确证了杂质A和杂质F的体外致突变风险后, 作者认为有必要建立一种检测盐酸曲唑酮片剂中两种痕量遗传毒性杂质的高灵敏度分析方法, 以保证盐酸曲唑酮制剂中遗传毒性风险杂质的可控性[5]。
液相联用质谱检测器是一种普适性分析方法, 因其具有较其他检测器更高的灵敏度和特异性的特点, 常用于各类痕量杂质的痕量检测。本文建立了UPLC-MS/MS法用于测定盐酸曲唑酮制剂中2种遗传毒性杂质, 进行了相应的方法学验证, 并对部分企业的盐酸曲唑酮原料药及片剂进行检测, 为盐酸曲唑酮的质量控制和生产工艺改进提供参考依据。
材料与方法仪器与试药 Waters I Class/XEVO TQ-S UPLC-MS/MS (UPLC: 美国Waters公司, 型号: ACQUITY I Class; 质谱软件: 美国Waters公司, 型号: MassyLynx); 百万分之一电子天平(瑞士METTLER TOLEDO公司, 型号: XPE26); 超纯水仪(美国Millipore公司, 型号: Milli-Q)。乙腈(LC-MS级, 美国Fluka公司, 批号: SHBG1053V); 甲酸(LC-MS级, 美国Fluka公司, 批号: 186260); 碳酸氢铵(LC-MS级, 美国Merck公司, 批号: K51759005016); 去离子水(MILLI-Q纯水仪, 当天制备); 盐酸曲唑酮杂质A (美国SIGMA-ALORICH公司, 批号: BCBT3901; 纯度: 98%); 盐酸曲唑酮杂质F (日本东京化成工业株式会社, 批号: FHN01; 纯度: 97%); 盐酸曲唑酮原料药(中国台湾美时化学制药股份有限公司; 批号97-03671); 盐酸曲唑酮缓释片(意大利AZ.CHIM.RIUN.ANGELINI FRANCESCO ACRAF S.P.A公司; 批号: 1618、1621、1622、3177、3189、3190; 规格: 75 mg、150 mg)。
色谱条件 液相色谱柱: Waters ACQUITY UPLC BEH C18 (2.1 mm×100 mm, 1.7 μm); 流动相为5 mmol·L-1碳酸氢铵水溶液(A)-乙腈(B), 流速为0.3 mL·min-1, 梯度洗脱, 洗脱程序: 0~2 min, 55% B; 2~3 min, 90% B; 3~4 min, 55% B。稀释剂: 乙腈-水-甲酸(100∶900∶1); 柱温20 ℃; 进样盘温度10 ℃; 进样量2 μL。
质谱条件 采用电喷雾正离子化(ESI+) 测定2个遗传毒性杂质。优化后的参数如下: 毛细管电压: 3.20 kV; 电喷雾离子源温度: 150 ℃; 去溶剂温度: 350 ℃; 去溶剂气流速: 420 L·h-1, 锥孔气流速: 150 L·h-1; 萃取电压5.0 V。采用多反应监测(MRM) 模式检测, 其实验参数见表 1。
| 表 1 MS/MS acquisition parameters for genotoxic impurities of trazodone hydrochloride. aRepresent quantitative ion |
溶液制备
供试品溶液取盐酸曲唑酮原料药适量, 用稀释剂溶解并稀释制成每1 mL中含盐酸曲唑酮约1 mg的溶液, 作为原料药供试品溶液; 取盐酸曲唑酮片20片, 研细, 取细粉适量, 加稀释剂超声使充分溶解后, 稀释制成每1 mL中含盐酸曲唑酮约1 mg的溶液, 作为片剂供试品溶液。
对照品溶液精密称取盐酸曲唑酮杂质A和盐酸曲唑酮杂质F适量, 加稀释剂溶解并稀释, 制成每1 mL中含2.5 μg杂质A和2.5 μg杂质F的溶液, 作为杂质对照品储备液; 精密量取杂质对照品储备液适量, 加稀释剂溶解制成每1 mL中含2.5 ng杂质A和2.5 ng杂质F的溶液, 作为杂质对照溶液。
系统适用性溶液取盐酸曲唑酮缓释片20片, 研细, 取细粉适量(约相当于盐酸曲唑酮100 mg) 置于1个100 mL量瓶中, 加入杂质对照品储备液100 μL, 超声完全溶解后稀释剂定容至刻度, 摇匀, 即得系统适用性溶液。
线性系列对照品溶液精密量取杂质对照品储备液适量, 用稀释剂制成杂质A和杂质F质量浓度分别为10、8、5、3、1、0.8、0.5、0.3和0.1 ng·mL-1的溶液, 即得。
回收率加标溶液取盐酸曲唑酮缓释片20片, 研细, 取细粉适量(约相当于盐酸曲唑酮10 mg) 置于6个10 mL量瓶中, 分别加入5 ng·mL-1浓度线性系列对照品溶液5 mL, 超声完全溶解后稀释剂定容至刻度, 摇匀, 即得100%回收率测定溶液共6份。
稳定性溶液精密量取杂质对照品储备液适量, 用稀释剂制成每1 mL中含10 ng杂质A和10 ng杂质F的溶液, 精密量取5 mL共2份, 分别置于25 mL量瓶中, 加入供试品溶液5 mL, 用稀释剂稀释至刻度, 摇匀, 即得两份稳定性考察溶液, 其中一份置于10 ℃冰箱保存, 另一份置于常温保存, 即得。
方法学验证
专属性 分别取稀释剂、对照溶液、系统适用性溶液和供试品溶液在建立的UPLC-MS/MS方法下进样测定, 考察方法的专属性。
线性、定量限及检出限 精密量取线性系列对照品溶液在建立的UPLC-MS/MS方法下进样测定, 以MRM离子流峰面积为纵坐标, 以杂质A和杂质F的质量浓度为横坐标, 计算线性回归方程、定量限(limit of quantitation, LOQ) 和检出限(limit of detection, LOD)。
重复性 平行制备6份片剂供试品溶液, 在建立的UPLC-MS/MS方法下进样测定, 并计算色谱峰面积的相对标准偏差(RSD) 考察其重复性。
回收率 取回收率加标溶液在建立的UPLC-MS/MS方法下进样测定并计算其回收率, 计算公式为: 回收率(%) = (回收率加标溶液测得量- 本底原有量) / 对照品加入量× 100%。
样品稳定性 取10 ℃和室温保存的稳定性溶液制备分别于0、3、6、12和24 h在建立的UPLC-MS/MS方法下进行测定, 计算杂质A和杂质F色谱峰面积的RSD。
耐用性 取稀释剂、对照溶液、系统适用性溶液和供试品溶液, 分别改变液相色谱柱[改用CORTECS UPLC C18 (100 mm×2.1 mm, 1.6 μm) 柱]、改变流速(流速变化± 0.01 mL·min-1), 在建立的UPLC-MS/MS方法下进行测定, 考察方法的耐用性。
样品测定 取1批盐酸曲唑酮原料药(中国台湾美时化学制药股份有限公司; 批号97-03671) 和6批盐酸曲唑酮片(意大利AZ.CHIM.RIUN.ANGELINI FRANCESCO ACRAF S.P.A公司; 批号: 1618、1621、1622、3177、3189、3190; 规格: 75 mg、150 mg) 制备供试品溶液并进行测定, 采用外标法计算盐酸曲唑酮杂质A及盐酸曲唑酮杂质F含量。
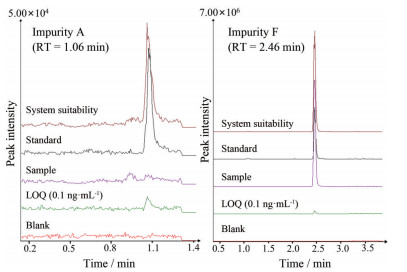
结果 1 专属性在所建立的色谱-质谱条件下, 杂质A和杂质F完全分离, 峰形良好, 空白稀释剂、供试品溶液对杂质对照溶液中各杂质的检查无干扰(图 3), 且满足系统适用性要求(表 2)。
|
Figure 3 MRM chromatograms of blank solvent, limit of quantitation (LOQ), sample, standard and system suitability |
| Table 2 System suitability requirements of analytical method for genotoxic impurities of trazodone hydrochloride |
线性回归方程、定量限和检出限结果如表 3所示。
| Table 3 Linear regression equation, limit of detection (LOD) and LOQ of impurity A and impurity F |
结果表明, 盐酸曲唑酮杂质A和盐酸曲唑酮杂质F在0.1~10 ng·mL-1内浓度与峰面积呈良好的线性关系, 且杂质A和杂质F的LOQ和LOD均远低于其限度, 可见该方法的灵敏度满足检测要求。
3 重复性6份片剂供试品溶液中检出杂质F的RSD为2.09%, 方法重复性良好, 未检出杂质A。
4 回收率杂质A平均回收率(n = 6) 为101.53%, RSD为4.06%; 杂质F平均回收率(n =6) 为97.95%, RSD为1.27%, 方法回收率良好。
5 样品稳定性杂质A在10 ℃保存条件下RSD为2.26%, 在室温保存条件下的RSD为2.00%; 杂质F在10 ℃保存条件下RSD为1.11%, 在室温保存条件下为1.71%, 说明样品在10 ℃/室温条件保存下24 h稳定。
6 耐用性耐用性结果表明改变流速和色谱柱后各项参数均可达到系统适用性以及分离度要求, 说明该方法对C18色谱柱型号及流速改变的耐用性良好。
7 样品测定样品测定结果如表 4所示, 杂质A均未检出, 杂质F检出量均未超限。
| Table 4 The result of residue determination about genotoxic impurity A and impurity F in trazodone hydrochloride |
遗传毒性杂质是指药物中能直接或间接导致DNA受损引起基因突变, 并具有致癌性或者潜在致癌可能性的一类杂质[6]。由于其较一般杂质具有微量水平就存在潜在致突变性和致癌性风险的特点, 遗传毒性杂质是受到药品监管机构和制药企业重点关注和控制的对象, 需要严格控制其在药物中的含量以保证药物质量与临床应用的安全性。双(2-氯乙基) 胺和1-(3-氯苯基)-4-(3-氯丙基) 哌嗪已被证实是一类具有卤代烷烃取代基结构的遗传毒性杂质, 进入体内后可能通过形成具有活泼的亲电性基团的化合物进而与DNA中碱基对发生共价结合导致其断裂。
目前国内盐酸曲唑酮药品标准及进口注册标准中均未对盐酸曲唑酮原料药及制剂中可能存在的这两种遗传毒性杂质进行控制。本文分别考察了不同浓度的乙酸铵水溶液和碳酸氢铵水溶液作为流动相水相对目标化合物分离效果的影响, 最终选择5 mmol·L-1碳酸氢铵水溶液(A)-乙腈(B) 作为流动相体系; 本实验优化了流动相梯度程序, 在满足两种杂质和主成分的分离度的情况下将检测一针的时间从6.5 min缩短到4 min, 提高了检测效率。除此之外还将六通阀设置为将1.3~2.0 min时间段内的流出物切换到废液通道, 从而避免主成分的干扰和污染。本实验建立的LC-MS/MS法可以同时用于检测盐酸曲唑酮原料药及其制剂中的两种遗传毒性杂质含量, 说明该方法适用范围广, 可为盐酸曲唑酮原料药及制剂的质量控制方法的优化提供参考。
作者贡献: 万君玥为本实验的主要操作者及撰写者; 陈华和尹婕为本试验设备以及材料的提供者, 并负责具体试验的指导与本文的修改。
利益冲突: 本文与任何组织或个人无任何利益冲突。
| [1] |
Haria M, Fitton A, McTavish D. Trazodone. A review of its pharmacology, therapeutic use in depression and therapeutic potential in other disorders[J]. Drugs Aging, 1994, 4: 331-355.
|
| [2] |
Jaśkowska J, Zaręba P, Śliwa P, et al. Microwave-assisted synthesis of trazodone and its derivatives as new 5-HT1A ligands: binding and docking studies[J]. Molecules, 2019, 24: 1609. DOI:10.3390/molecules24081609 |
| [3] |
Kazius J, McGuire R, Bursi R. Derivation and validation of toxicophores for mutagenicity prediction[J]. J Med Chem, 2005, 48: 312-320. DOI:10.1021/jm040835a |
| [4] |
European Medicines Agency. Guideline on the limits of genotoxic impurities[EB/OL]. (2006-06-28)[2020-10-13]. http:www.emea.europa.eu/docs/en_GB/document_library/Scientific_guideline/2009/09/WC500002903.pdf.
|
| [5] |
The United States Pharmacopeia Convention. The United States Pharmacopiea USP 42[S]. Trazodone: Official Monographs, 2019: 4434-4435.
|
| [6] |
Szekely G, Amores de Sousa MC, Gil M, et al. Genotoxic impurities in pharmaceutical manufacturing: sources, regulations, and mitigation[J]. Chem Rev, 2015, 115: 8182-8229. DOI:10.1021/cr300095f |
 2021, Vol. 56
2021, Vol. 56


