2. 湖南科技学院, 湖南 永州 425199;
3. 广东药科大学, 广东 广州 510006
2. Hunan University of Science and Engineering, Yongzhou 425199, China;
3. Guangdong Pharmaceutical University, Guangzhou 510006, China
甘青乌头[Aconitum tanguticum (Maxim.) Stapf] 主产于青海、甘肃、四川、云南和西藏, 为常用藏药榜嘎的基源植物之一, 具有清热解毒功效, 临床上用其全草治疗传染病发热, 肝、胆热病, 流行性感冒以及食物中毒等[1]。甘青乌头中的化学成分主要是二萜生物碱, 此外还含有黄酮、酚酸和苯乙醇苷类成分[2]。本课题组前期对甘青乌头的化学成分进行了系统研究, 从中分离得到多个结构新颖的二萜生物碱类成分[3]。近期, 又从中分离得到两个双二萜生物碱, 其中1个为新化合物, 命名为tanguticurine A (1, 图 1), 另1个为已知化合物anthoroidine B (2), 二者均为首次从甘青乌头中分离得到。体外实验结果显示, tanguticurine A (1) 具有较好的抗HCV和EV71活性, 其半数有效浓度(EC50) 分别为15.5和9.7 μmol·L-1, 是一个较好的抗病毒先导化合物, 值得深入研究。
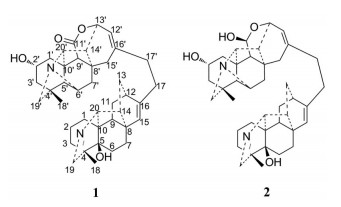
|
Figure 1 Structures of compounds 1 and 2 |
Tanguticurine A (1) 白色无定形粉末, 改良碘化铋钾反应呈阳性。HR-ESI-MS推断其分子式为C40H50N2O4 (m/z 623.384 0 [M+H]+)。13C NMR和DEPT谱显示, 该化合物结构中含有10个C、14个CH、14个CH2和2个CH3。分析其NMR数据可知, 化合物1中存在着一组典型的C20海替定型二萜生物碱的信号, 包括1个亚胺(δH 7.40, d, J = 2.4 Hz; δC 169.5 d)、1个角甲基(δH 1.05, 3H, s; δC 19.0 q)、1个环内双键(δH 5.24, brs; δC 127.4 d, 149.7 s)、以及1个20位的碳氢信号(δH 3.52, brs; δC 80.4 d)。结合分子式C40H50N2O4, 推断该化合物是由2个C20的生物碱连接而成的双二萜生物碱。与已知双二萜生物碱trichocarpinine A[4]的核磁数据比对, 发现化合物1中C20海替定型二萜生物碱片段与trichocarpinine A结构中海替定型生物碱片段结构一致, 该片段可由2D-NMR验证。除去该生物碱片段, 还剩余1个C20的生物碱片段。剩余信号包含了1组C20海替生型二萜生物碱的特征信号, 分别是1个连氮的CH2信号(δH 2.55, 1H, d, J = 11.4 Hz; δH 3.35, 1H, brs; δC 63.5 t)、1个角甲基(δH 1.03, 3H, s; δC 29.2 q) 和两个连氮的CH信号(δH 3.75, brs; δC 69.6; δH 3.49, brs; δC 65.0)。除此之外, 该结构片段还剩余1个酯羰基(δC 174.2 s)、1个环内双键(δH 5.88, 1H, d, J = 6.0 Hz; δC 121.7 d, 142.4 s) 和1个连氧碳(δH 4.69, 1H, d, J = 6.6 Hz; δC 74.7)。与文献数据[5]比较可知, 该片段中A环和B环与C20海替生型二萜生物碱hetisine基本一致, 但C环不同。受化合物anthriscifolsine A[6]结构形成的启发, 推测该C20生物碱的母核的C环与已知化合物anthriscifolsine A母核的C环的形成有类似处, 即C11-C12键断裂, C13位羟基与C11位醛基通过羟醛缩合反应形成半缩醛, 半缩醛结构再失去一分子氢形成一个含有酯键的八元环。该推测可在HMBC (图 2) 上得到验证: H-13'与C-8', C-11', C-12', C-14', C-16', C-20'有相关、环内双键氢质子H-12'与C-13', C-14', C-15', C-17'相关、H-15'与C-8', C-9', C-12', C-14', C-16', C-17'相关、H-17'与C-12', C-15', C-16'相关。该片段中还含有1个羟基, 连接在母核2'位, 可由1H-1H COSY和HMBC验证。此外, 两个二萜生物碱通过17位与17'位的亚甲基连接, 可由HMBC中H-17与C-16', C-17'相关、H-17'与C-16, C-17相关以及关键1H-1H COSY验证。该化合物的立体化学通过偶合常数和NOESY确认, NOESY图谱中, H-2'与H-5'有相关, 推测H-2'是β构型。通过进一步分析2D-NMR (1H-1H COSY、DEPT、HMBC) (表 1), 化合物1鉴定为tanguticurine A。
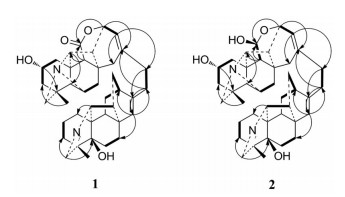
|
Figure 2 Key HMBC (H |
| 表 1 NMR data assignment of compounds 1 and 2 (600 MHz for 1H NMR, 150 MHz for 13C NMR, 1 in CDCl3, 2 in CD3OD, J in Hz). *Overlapping |
Anthoroidine B (2) 白色针状结晶(甲醇), 改良碘化铋钾反应呈阳性。由HR-ESI-MS推断其分子式为C40H52N2O4 (m/z 625.402 2 [M+H]+)。13C NMR和DEPT谱显示, 该化合物结构中含有9个C、15个CH、14个CH2和2个CH3。与化合物1核磁数据比较可发现, 化合物2同样是由2个C20生物碱连接而成的双二萜生物碱, 其中之一为1个C20海替定型二萜生物碱(δH 7.33, d, J = 2.4 Hz; δC 172.8 d; δH 1.00, 3H, s; δC 19.3 q; δH 3.44, 1H, brs; δC 81.4 d; δH 5.24, 1H, brs; δC 128.4 d; 151.6 s), 另一个为1个类海替生型的二萜生物碱(δH 2.44, 1H, d, J = 11.4 Hz; δH 3.33, 1H, brs; δC 64.2; δH 0.95, 3H, s; δC 30.0 q; δH 3.59, 1H, brs; δC 70.8; δH 3.29, 1H, brs; δC 66.5)。与化合物1的最大区别在于, 化合物2少了化合物1的酯羰基信号(δC 174.2 s), 而多了1个独特的半缩醛信号(δH 4.94, 1H, s; δC 93.0), 提示化合物2中类海替生型二萜生物碱片段上的八元环组成与化合物1不同。同样受化合物anthriscifolsine A结构的启发, 再结合化合物2比1分子量仅仅多2, 可推测化合物2中的八元环形成如下: 由C11-C12键断裂, C13位羟基与C11位醛基通过羟醛缩合反应而形成1个八元环。该推测也在HMBC (图 2) 上得到了验证。与文献值[7]比较, 化合物2的NMR数据(表 1) 与anthoroidine B基本一致, 因此鉴定其结构为anthoroidine B。
2 化合物活性检测采用荧光素酶报告基因法测定了两个化合物的抗病毒活性, 结果显示: tanguticurine A (1) 抗HCV的EC50为15.5 μmol·L-1, 抗EV71的EC50为9.7 μmol·L-1; 阳性药sobosbuvir抗HCV的EC50为1.2 μmol·L-1, 阳性药NITD008抗EV71的EC50为0.78 μmol·L-1。上述结果提示tanguticurine A对HCV和EV71均有较好的抑制作用, 是一个较好的抗病毒先导化合物, 具有进行结构改造的价值和潜力。Anthoroidine B (2) 对两种病毒均无抑制作用(对HCV的最大给药浓度为50 μmol·L-1, 对EV71的最大给药浓度为100 μmol·L-1)。
实验部分Waters Acquity UPLC/Xevo G2 QTOF系统(包括Waters Xevo G2 QTOF质谱仪和Waters Acquity超高效液相色谱系统) (美国Waters公司); LTQ Orbitray Velos pro质谱仪(高分辨静电场轨道阱质谱, ESI源) 和Ultimate 3000超高效液相色谱仪(美国Thermo Fisher公司); Bruker Avance III 600-NMR spectrometer (内标为TMS, 德国Bruker公司); RE-52A旋转蒸发仪(上海亚荣生化仪器厂)。柱色谱硅胶(160~200目, 200~300目, 青岛海洋化工厂); 碱性氧化铝(100~200目, 上海沪震实业有限公司), 高效薄层板GF254 (德国Merck公司)。PURELAB Plus超纯水仪(美国波尔公司); 电热培养箱(上海浦东跃欣科学仪器厂); 5418型离心机(Eppendorf公司); 5417R型冷冻离心机(Eppendorf公司), -80 ℃冰箱(日本三洋公司); HW-8B型超级微量恒温器(上海浦江分析仪器厂); 涡旋振荡器(北京卓信伟业科技有限公司); 细胞培养皿(Thermo Scientific); 96孔板(NUNC); 移液器(Thermo Scientific); 载玻片, 盖玻片, DMEM (Gibco); 胎牛血清FBS (Gibco); 胰酶(Gibco); DMSO (Vetec); Renilia-Glo Luciferase Assay System (Promega); Pen Strep (缩写PS, Gibco)。
人肝癌细胞系Huh7.5.1和人横纹肌肉瘤RD细胞为清华大学提供。丙型肝炎病毒(HCV) 和肠道病毒EV71也均由清华大学提供。
1 提取分离甘青乌头干燥全草(10 kg), 粗粉碎, 分别加8、6、6倍量70%乙醇回流提取3次, 每次2 h, 合并提取液, 提取液减压浓缩成浸膏。浸膏加水稀释到25 L, 加盐酸调节pH值至2.5, 用二氯甲烷萃取, 合并二氯甲烷溶液回收溶剂得到甘青乌头酸性部位; 剩余水溶液加氨水调节pH值至10, 用二氯甲烷萃取, 合并二氯甲烷萃取液减压回收溶剂后得总生物碱47 g。取甘青乌头总生物碱47 g, 经碱性氧化铝柱色谱, 氯仿-甲醇(1∶0~7∶3) 梯度洗脱, 得到7个流分S1~S7。S4经硅胶柱色谱, 石油醚-丙酮(3∶1~0∶1) 梯度洗脱, 得到S4-1~S4-4共4个流分。S4-4再经硅胶柱色谱, 以石油醚-丙酮(5∶1~2∶1) 梯度洗脱, 得到化合物1 (7 mg)。
甘青乌头干燥全草(25 kg), 粗粉碎, 加8倍量95%乙醇超声提取3次, 每次40 min, 合并提取液, 提取液经减压浓缩成浸膏, 浸膏加水稀释到10 L, 加盐酸调节pH值到2.5, 用二氯甲烷萃取, 合并二氯甲烷溶液回收溶剂得到甘青乌头酸性部位; 剩余水溶液加氨水调节pH值至10.0, 用二氯甲烷萃取, 合并二氯甲烷萃取液回收溶剂得总生物碱11.3 g。取甘青乌头总生物碱10 g, 经硅胶柱色谱, 氯仿-甲醇-氨水(50∶1∶1~8∶2∶0.2) 梯度洗脱, 得到4个流分S1~S4。S3反复甲醇重结晶得到化合物2 (10 mg)。
2 结构鉴定Tanguticurine A (1) [α]D20 +28.38 (c 0.21, MeOH); UV (MeOH) λmax/nm 191.2; CD谱: 210 nm处观察到一个负的Cotton效应(Δε = -4.737 14), 234 nm处观察到一个正的Cotton效应(Δε = +3.733 33); (-) ESI-MS m/z: 657 [M+Cl]-; (+) HR-ESI-MS m/z: 623.384 0 [M+H]+ (Calcd. for C40H51O4N2+ 623.384 3), 312.197 0 [M-C21H28NO]+ (基峰), 328.191 1 [M+2H-C20H26NO]+; 1H NMR和13C NMR数据见表 1。
Anthoroidine B (2) [α]D20 +31.69 (c 0.183, MeOH); UV (MeOH) λmax/nm: 193.6; (-) ESI-MS m/z: 659 [M+Cl]-; (+) HR-ESI-MS m/z: 625.402 2 [M+H]+ (Calcd. for C40H53O4N2+ 625.400 0), 313.205 1 [M-H-C21H28NO]+ (基峰), 304.200 2; 1H NMR和13C NMR数据见表 1。
3 抗病毒活性测定 3.1 各化合物细胞毒性测定参考文献方法[8], 将Huh 7.5.1细胞和RD细胞分别加入含有10%胎牛血清的DMEM培养基中, 置于37 ℃、5% CO2培养箱中培养, 取对数生长期细胞进行实验。将培养好的Huh 7.5.1细胞(EV71测活使用RD细胞) 以每孔3 000个细胞铺96孔板, 置于37 ℃、5% CO2培养箱中培养过夜。用含有5% DMSO的培养基稀释化合物。向实验组中, 每孔加入各化合物50 μL, DMEM 50 μL。另取一列加入100 μL DMEM作为细胞对照组。平行重复3次实验。将96孔板放入37 ℃、5% CO2培养箱中培养24 h。取出96孔板, 置于显微镜下观察细胞生长状态并且记录结果。
结果显示, tanguticurine A (1) 浓度为50 μmol·L-1时对Huh 7.5.1细胞无毒性反应, 100 μmol·L-1对RD细胞的毒性为100%; anthoroidine B (2) 浓度为50 μmol·L-1时对Huh 7.5.1细胞的毒性为30%, 100 μmol·L-1对RD细胞无毒性反应。
3.2 各化合物EC50测定将培养好的Huh 7.5.1细胞(EV71测活使用RD细胞) 以每孔3 000个细胞铺96孔板。用含有5% DMSO和10% FBS的培养基稀释各化合物。用移液器吸弃96孔板中实验组每孔内的培养基, 再向96孔板中分别加入不同浓度的化合物50 μL, 每个浓度重复三孔。另外取三孔作为病毒对照组(不加化合物)。将96孔板放入37 ℃、5% CO2培养箱中培养6~8 h。向每孔中加入浓度为100 TCID50 JFH-1 HCV病毒(含荧光素酶报告基因) 50 μL (EV71测活使用含荧光素酶报告基因的EV71假病毒50 μL), 小心混匀。于37 ℃、5% CO2培养箱中培养48 h (EV71测活时间为24 h)。48 h (24 h) 后, 取出96孔板, 吸弃上清液, 向每孔中加入100 μL Renilla-GloTM Luciferase reagent, 室温避光孵育3~5 min, 将每孔中的液体吸入到96孔白板中, 使用Glomax plate reader读数, 计算EC50。
结果显示: tanguticurine A (1) 抗HCV的EC50为15.5 μmol·L-1, 抗EV71的EC50为9.7 μmol·L-1; 阳性药sobosbuvir抗HCV的EC50为1.2 μmol·L-1, 阳性药NITD008抗EV71的EC50为0.78 μmol·L-1; anthoroidine B (2) 即使在最大给药浓度时也均显示无效(对HCV的最大浓度为50 μmol·L-1, 对EV71的最大浓度为100 μmol·L-1)。
致谢: 感谢清华大学娄智勇教授测定两个化合物的抗病毒活性。
作者贡献: 李春设计和组织了整个研究; 杨丽华负责成分分离、结构鉴定和论文撰写; 王月协助提取分离工作; 刘晓谦和梁曜华对论文进行了润色; 王智民指导了化合物结构鉴定。
利益冲突: 所有作者声明不存在任何利益冲突。
| [1] |
Liu ZM, Zhao JF, Qin SY, et al. Resources and usage status of Tibetan medicinal plant "Bangga"[J]. China J Chin Mater Med (中国中药杂志), 2017, 42: 4898-4904. |
| [2] |
Yang LH, Lin LM, Wang ZM, et al. Research progress on Aconitum tanguticum[J]. Chin J Exp Tradit Med Form (中国实验方剂学杂志), 2016, 22: 43-49. |
| [3] |
Fan XR, Yang LH, Liu ZH, et al. Diterpenoid alkaloids from the whole plant of Aconitum tanguticum (Maxim.) Stapf[J]. Photochemistry, 2019, 160: 71-77. DOI:10.1016/j.phytochem.2018.11.008 |
| [4] |
Zhang ZT, Chen DL, Chen QH, et al. Bis-diterpenoid alkaloids from Aconitum tanguticum var. trichocarpum[J]. Helv Chim Acta, 2013, 96: 710-718. DOI:10.1002/hlca.201200256 |
| [5] |
Bessonova IA, Saidkhodzhaeva SA. Hetisane-type diterpenoid alkaloids[J]. Chem Nat Compounds, 2000, 36: 419-477. DOI:10.1023/A:1002808721838 |
| [6] |
Shan LH. Studies on Diterpenoid Alkaloids Constituent of Four Herb Aconitum (四种国产草乌大花还亮草、毛果船苞翠雀花、多根乌头、林地乌头生物喊成分研究)[D]. Chengdu: Southwest Jiaotong University, 2017.
|
| [7] |
Zhang JF. Studies on Diterpenoid Alkaloids and Biological Activity of Five Specific Traditional Chinese Medicines "Cao Wu" in Xinjiang (五种新疆特有药用草乌生物碱成分及生物活性研究)[D]. Chengdu: Southwest Jiaotong University, 2018.
|
| [8] |
Fu ZX, Li S, Xiang T, et al. Differential expression of long non-coding RNAs of Huh.7.5.1 cells after infection with the hepatitis C virus and their effects on cell proliferation[J]. Chin J Virol (病毒学报), 2017, 33: 192-199. |
 2021, Vol. 56
2021, Vol. 56


