细菌耐药成为全球严重的公共卫生问题, 其中最严重的是“ESKAPE”, 即屎肠球菌(Enterococcus faecium)、金葡菌(Staphylococcus aureus)、肺炎克雷伯菌(Klebsiella pneumoniae)、鲍曼不动杆菌(Acinetobacter baumanni)、铜绿假单胞菌(Pseudomonas aeruginosa) 和肠杆菌属(Enterobacter species)。这些细菌不仅作为院内感染的主要致病菌, 还因其耐药性突出而受到关注[1-4]。2017年2月, 世界卫生组织(WHO) 发布首份急需研发新型抗生素的重点病原体清单, 其中万古霉素耐药屎肠球菌(VRE) 和甲氧西林耐药金葡菌(MRSA) 被列为第二类重点(高迫切度)。因此, 急需研发新型抗菌药物来应对这些耐药菌[5]。
抗菌肽的抗菌谱广, 通常作用于细胞膜表现为杀菌作用, 且不易产生耐药性, 因此受到广泛关注[6-10]。蜂毒肽(melittin) 是一种线性阳离子抗菌肽(图 1), 它有26个氨基酸组成(GIGAVLKVLTTGLPALISWIKR KRQQ-CONH2), 在生理pH条件下带有6个正电荷。蜂毒肽N端(1~20位氨基酸) 主要为疏水区域, C端(21~26位氨基酸) 主要为亲水区域, 能够形成两亲性的α-螺旋结构, 破坏微生物细胞膜, 造成胞内容物泄露进而杀死细菌[11-15]。同时, 蜂毒肽还可以结合在红细胞膜表面, 损伤红细胞膜结构, 导致红细胞溶血, 限制了其临床应用[16, 17]。研究表明, 蜂毒肽的溶血作用与疏水性、正电荷数(碱性氨基酸数) 和α-螺旋结构等相关[17]。根据蜂毒肽二级结构显示出的α-螺旋结构[15], 本研究主要通过改变蜂毒肽N端疏水区域的氨基酸疏水性、极性和C端亲水区域的碱性氨基酸数量, 研究蜂毒肽N端疏水区域氨基酸疏水性、极性和C端亲水区域正电荷数改变对抗菌活性和溶血作用的影响。
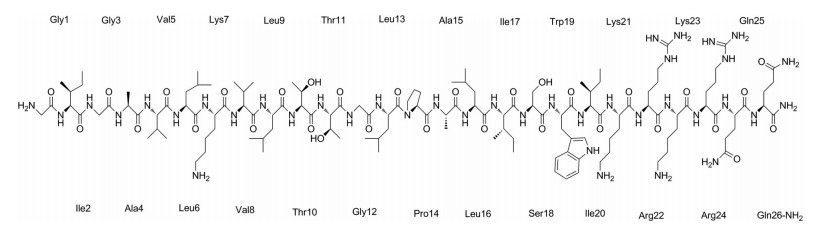
|
Figure 1 Chemical structure of melittin |
本研究设计合成极性增加、疏水性降低的新衍生物13个(化合物1~13); 疏水性增加的新衍生物2个(化合物14、15); 电荷数降低的新衍生物5个(化合物16~20); 然后评价衍生物的抗菌活性和溶血作用。结果表明, 部分化合物对阳性菌的抗菌活性保持或提高, 并且大部分化合物的溶血作用明显降低。其中, 新衍生物13对耐药或敏感的屎肠球菌(MIC: 2 μg·mL-1) 的抗菌活性是蜂毒肽的2倍, 对红细胞的溶血作用(HC50: 24.0 ± 4.3 μg·mL-1) 与蜂毒肽相比降低4倍, 衍生物13值得进一步研究。
结果与讨论本文共设计合成蜂毒肽及新衍生物20个, 化合物结构和纯度经高分辨质谱(HR-MS) 和高效液相色谱(HPLC) 确证(表 1)。体外抗菌实验表明(表 2), 蜂毒肽对测定的耐药或敏感的金葡菌、屎肠球菌、大肠埃希菌和鲍曼不动杆菌显示出较强的抗菌活性(MIC: 4~8 μg·mL-1), 对测定的肺炎克雷伯菌和铜绿假单胞菌抗菌活性较弱(MIC: 16~32 μg·mL-1)。衍生物1~3、8 (MIC: 4 μg·mL-1) 对测定的耐药或敏感的屎肠球菌的抗菌活性与蜂毒肽(MIC: 4 μg·mL-1) 相当, 对其他菌株的抗菌活性降低; 衍生物4 (MIC: 4~8 μg·mL-1) 对测定的耐药或敏感的屎肠球菌、大肠埃希菌和鲍曼不动杆菌的抗菌活性与蜂毒肽(MIC: 4~8 μg·mL-1) 相当, 对其他菌株的抗菌活性降低; 衍生物5~7、9 (MIC ≥ 8 μg·mL-1) 对测定的耐药或敏感菌株的抗菌活性均降低; 衍生物10 (MIC: 4 μg·mL-1) 对测定的耐药或敏感的金葡菌和屎肠球菌的抗菌活性与蜂毒肽(MIC: 4 μg·mL-1) 相当, 对其他菌株的抗菌活性降低; 这些结果表明用极性氨基酸Thr替换蜂毒肽N端疏水区域的疏水氨基酸(Ile2、Val5、Leu6、Val8、Leu9、Leu13、Leu16、Ile17、Trp19或Ile20) 降低衍生物的疏水性, 不能提高衍生物的抗菌活性, 甚至会降低抗菌活性。衍生物11对测定的耐药或敏感的金葡菌(MIC: 4 μg·mL-1)、屎肠球菌(MIC: 2~4 μg·mL-1)、大肠埃希菌(MIC: 8 μg·mL-1) 和肺炎克雷伯菌(MIC: 32 μg·mL-1) 的抗菌活性与蜂毒肽相当, 对其他菌株的抗菌活性降低; 衍生物12对测定的耐药或敏感的屎肠球菌(MIC: 4 μg·mL-1)、大肠埃希菌(MIC: 8 μg·mL-1) 和肺炎克雷伯菌(MIC: 32 μg·mL-1) 的抗菌活性与蜂毒肽相当, 对其他菌株的抗菌活性降低; 这些结果表明用极性氨基酸Ser替换蜂毒肽N端疏水区域的Thr10或Thr11增加衍生物的极性, 同样不能提高抗菌活性。衍生物13对测定的耐药或敏感的屎肠球菌(MIC: 2 μg·mL-1) 的抗菌活性是蜂毒肽的2倍, 对测定的耐药的金葡菌(MIC: 4 μg·mL-1)、大肠埃希菌(MIC: 8 μg·mL-1)、肺炎克雷伯菌(MIC: 32 μg·mL-1) 和鲍曼不动杆菌(MIC: 4 μg·mL-1) 的抗菌活性与蜂毒肽相当, 对铜绿假单胞菌的抗菌活性降低; 这些结果表明用疏水氨基酸Val替换蜂毒肽N端疏水区域的疏水氨基酸Leu13降低衍生物的疏水性, 可以提高衍生物对屎肠球菌的抗菌活性。溶血实验表明(表 2), 衍生物1~13的溶血作用(HC50 ≥ 11.9 μg·mL-1) 与蜂毒肽(HC50: 5.3 ± 0.4 μg·mL-1) 相比降低, 表明降低蜂毒肽N端疏水区域的疏水性、增加极性可以降低溶血作用。衍生物14对测定的耐药肺炎克雷伯菌(MIC: 16 μg·mL-1) 的抗菌活性是蜂毒肽的2倍, 对其他菌株的抗菌活性保持; 衍生物15对测定的金葡菌(MIC: 1 μg·mL-1) 和屎肠球菌(MIC: 2 μg·mL-1) 的抗菌活性是蜂毒肽的2~4倍, 对测定的耐药的大肠埃希菌(MIC: 8 μg·mL-1)、肺炎克雷伯菌(MIC: 32 μg·mL-1) 和鲍曼不动杆菌(MIC: 4 μg·mL-1) 的抗菌活性与蜂毒肽相当, 对铜绿假单胞菌的抗菌活性降低; 这些结果表明用疏水氨基酸Leu替换蜂毒肽N端疏水区域的疏水氨基酸Val8提高衍生物的疏水性抗菌活性基本不变, 而用疏水氨基酸Ala替换疏水氨基酸Gly12提高衍生物的疏水性对阳性菌的活性是蜂毒肽的2~4倍。衍生物14 (HC50: 2.1 ± 0.1 μg·mL-1) 和15 (HC50: 2.3 ± 0.4 μg·mL-1) 的溶血作用是蜂毒肽(HC50: 5.3 ± 0.4 μg·mL-1) 的2倍, 表明提高蜂毒肽N端疏水区域的疏水性会增大溶血作用。衍生物16、17、19、20 (MIC: 4~8 μg·mL-1) 对测定的耐药或敏感的金葡菌和屎肠球菌的抗菌活性与蜂毒肽相当(MIC: 4 μg·mL-1), 对其他菌株的抗菌活性降低, 这些结果表明用极性氨基酸Thr替换蜂毒肽的碱性氨基酸(Lys7、Lys21、Lys23或Arg24) 降低衍生物的正电荷数, 可保持衍生物对阳性菌的抗菌活性; 衍生物18对测定的菌株的抗菌活性均降低; 这些结果表明用极性氨基酸Thr替换蜂毒肽C端亲水区域的碱性氨基酸Arg22减少衍生物的正电荷数, 会降低衍生物的抗菌活性。与蜂毒肽相比, 衍生物16、18和19的溶血作用(HC50 ≥ 19.2 μg·mL-1) 降低3倍, 表明减少蜂毒肽的7、22或23位的一个正电荷可以降低溶血作用。降低蜂毒肽N端疏水区域部分氨基酸的疏水性、增大部分氨基酸的极性对阳性菌的抗菌活性保持或提高, 并且溶血作用明显降低; 增加蜂毒肽N端疏水区域的部分氨基酸的疏水性可提高对阳性菌或阴性菌的活性, 但溶血作用也明显增大; 减少蜂毒肽C端亲水区域的正电荷对阳性菌的抗菌活性保持或降低, 但减少蜂毒肽7、22或23位的一个正电荷可以降低溶血作用。总体结果表明, 适当降低N端疏水区域疏水氨基酸的疏水性可保持甚至提高抗菌活性, 并且降低溶血作用。
| Table 1 Chemical structures of novel melittin analogues. aPurity was measured by reverse-phase HPLC |
| Table 2 Minimum inhibitory concentration (MIC: μg·mL-1) and hemolysis (HC50: μg·mL-1) of melittin analogues. aATCC (American Type Culture Collection). bClinical isolate. cNCTC (National Collection of Type Cultures). d50% Hemolytic concentration. MRSA (Methicillin-resistant Staphylococcus aureus). VRE (Vancomycin resistance Enterococcus). KPC (Klebsiella pneumoniae carbapenemase). OXA (Oxacilllinase) |
本文通过固相合成方法, 设计合成蜂毒肽及其衍生物20个, 所合成衍生物结构经高分辨质谱确证。在极性增加、疏水性降低的衍生物1~13中, 衍生物13对屎肠球菌的抗菌活性(MIC: 2 μg·mL-1) 是蜂毒肽的2倍, 其余衍生物的抗菌活性保持或降低; 并且衍生物1~13的溶血作用均降低。在疏水性增加的衍生物14和15中, 衍生物14对肺炎克雷伯菌(MIC: 16 μg·mL-1) 的抗菌活性是蜂毒肽的2倍, 衍生物15对金葡菌(MIC: 1 μg·mL-1) 和屎肠球菌(MIC: 2 μg·mL-1) 的抗菌活性是蜂毒肽的2~4倍, 但衍生物14和15的溶血作用均增大。在正电荷减少的衍生物16~20中, 所有化合物的抗菌活性均未提高, 但衍生物16、18和19的溶血作用降低3倍。分析构效关系、构毒关系表明, 降低蜂毒肽部分氨基酸的疏水性或增大部分氨基酸的极性对阳性菌的抗菌活性保持或提高, 并且溶血作用明显降低; 增加蜂毒肽部分氨基酸的疏水性可提高对阳性菌或阴性菌的活性, 但溶血作用也明显增大; 减少蜂毒肽的正电荷对阳性菌的抗菌活性保持或降低, 但减少蜂毒肽7、22或23位的一个正电荷可以降低溶血作用。研究结果表明通过对蜂毒肽进行结构改造, 有可能获得高抗菌活性、低溶血作用的蜂毒肽衍生物。
实验部分高效液相为岛津LC-20A分析型高效液相色谱系统, 分析柱为RD-C18 (4.6 mm×150 mm, 5 μm); 分离纯化为LC3050N半制备型高效液相色谱系统, 半制备柱GS-120-10-C18 (20 mm×250 mm, 10 μm); 高分辨质谱为AB SCIEX Triple TOF 5600测定。
Rink Amide MBHA树脂(0.32 mmol·g-1)、Fmoc-氨基酸、O-苯并三氮唑-N, N, N', N'-四甲基脲四氟硼酸酯(TBTU) 由吉尔生化(上海) 有限公司提供; N, N-二异丙基乙胺(DIEA)、三氟乙酸(TFA)、三异丙基硅烷(TIS)、乙二硫醇(EDT)、色谱纯乙腈由J & K百灵威科技有限公司提供; 哌啶(PIP)、无水乙醚、二氯甲烷(DCM) 由北京化工厂提供; N, N-二甲基甲酰胺(DMF) 由北京博迈杰科技有限公司提供。
1 蜂毒肽及其衍生物的合成根据文献[18-20]报道, 采用Fmoc保护的氨基酸固相合成法, 以Rink Amide MBHA树脂作载体; 脱保护试剂为20% PIP/DMF溶液, 脱保护时间为5 min和10 min; 缩合剂为TBTU, 催化剂为DIEA, 缩合时间为1 h; 切肽试剂为TFA∶EDT∶TIS∶H2O = 95∶2∶2∶1, 切肽时间为2.5 h。向切割试剂中加入5倍体积的冷乙醚得絮状沉淀, 离心得粗肽, 用半制备型高效液相色谱仪进行纯化, 以乙腈-水(水和乙腈中各含0.1%三氟乙酸) 为洗脱液梯度洗脱, 收集产物峰, 冻干得目标产物, 产物的纯度通过高效液相色谱法测定, 采用面积归一化法计算化合物纯度。
2 体外抗菌活性实验采用美国临床和实验室标准协会(CLSI) 抗菌药物敏感性实验操作规程推荐的微量肉汤稀释法测定衍生物的MIC值。称取适量的受试样品粉末, 用无菌纯水溶解样品, 使加样槽内的药物浓度依次为128、64、32、16、8、4、2、1、0.5、0.25、0.125、0.06 μg·mL-1。从18~24 h培养的琼脂平皿中挑选几个菌落直接在无菌生理盐水中制成菌悬液, 调整菌悬液的浓度为0.5麦氏单位。将校正后的菌液用MH肉汤稀释至4×105~8×105 CFU·mL-1。分别吸取100 μL上述不同浓度的受试样品溶液到无菌的96孔聚苯乙烯板中的第1至第12孔内, 另取上述接种物100 μL加入各孔。孔内受试样品终浓度分别为64、32、16、8、4、2、1、0.5、0.25、0.125、0.06、0.03 μg·mL-1, 最终接种物浓度均为2×105~4×105 CFU·mL-1。另设生长对照孔, 将加样接种后的96孔板置于35~37 ℃培养箱内培养16~20 h。培养结束后, 观察各孔内细菌的生长情况, 以在小孔内完全抑制细菌生长的最低药物浓度为其最低抑菌浓度(MIC)。
3 红细胞溶血通过玻璃棒搅拌, 将烧杯中的新鲜兔血除去纤维蛋白原。将不含纤维蛋白原的兔血置于50 mL离心管中, 以3 000 ×g离心5 min, 弃去上清, 将沉淀的红细胞重悬于50 mL 0.9% NaCl溶液中, 如上离心。最后, 将红细胞重悬于含50 mL 0.9% NaCl溶液的无菌试管中, 将所得红细胞配制成2% (v/v) 的混悬液。将不同浓度的药物配制成0.9% NaCl溶液, 取每种药物浓度0.4 mL加入到3.6 mL红细胞悬液中, 使药物终质量浓度为0.1、0.3、1、3、10、33、100、333、1 000 μg·mL-1。10 μL Triton X-100加入4 mL红细胞悬液中作为阳性对照, 4 mL红细胞悬液作为阴性对照, 悬浮液与药物37 ℃共同孵化180 min。孵化后轻轻涡旋, 每个样本取1 mL以3 000 ×g离心5 min, 每个上层清液取200 μL, 使用BioTek Synergy 2酶标仪在λ = 550 nm处测定吸光度。根据公式: (A - A0) / (AX - A0) × 100%计算溶血百分比, 式中A为样品吸光度, A0为阴性对照吸光度, AX为阳性对照吸光度。
作者贡献: 崔阿龙负责化合物的设计、制备和HPLC分析, 杨鹤显、薛司徒和孙连奇参与了部分体外活性实验, 金洁和易红参与了数据分析及文献整理, 李卓荣是文章整体研究方案的构思者与负责人。
利益冲突: 所有作者均不存在利益冲突。
| [1] |
Rice LB. Federal funding for the study of antimicrobial resistance in nosocomial pathogens: no ESKAPE[J]. J Infect Dis, 2008, 197: 1079-1081. DOI:10.1086/533452 |
| [2] |
Boucher HW, Talbot GH, Bradley JS, et al. Bad bugs, no drugs: no ESKAPE! An update from the Infectious Diseases Society of America[J]. Clin Infect Dis, 2009, 48: 1-12. DOI:10.1086/595011 |
| [3] |
Pendleton JN, Gorman SP, Gilmore BF. Clinical relevance of the ESKAPE pathogens[J]. Expert Rev Anti Infect Ther, 2013, 11: 297-308. DOI:10.1586/eri.13.12 |
| [4] |
De Oliveira DMP, Forde BM, Kidd TJ, et al. Antimicrobial resistance in ESKAPE pathogens[J]. Clin Microbiol Rev, 2020, 33: e00181-19. |
| [5] |
Fan TY, Yang YS, Hu XX, et al. Anti-MRSA activities of cycloberberine derivatives with a novel chemical scaffold[J]. Acta Pharm Sin (药学学报), 2019, 54: 1627-1635. |
| [6] |
Boparai JK, Sharma PK. Mini review on antimicrobial peptides, sources, mechanism and recent applications[J]. Protein Pept Lett, 2020, 27: 4-16. |
| [7] |
Moravej H, Moravej Z, Yazdanparast M, et al. Antimicrobial peptides: features, action, and their resistance mechanisms in bacteria[J]. Microb Drug Resist, 2018, 24: 747-767. DOI:10.1089/mdr.2017.0392 |
| [8] |
Sharma K, Aaghaz S, Shenmar K, et al. Short antimicrobial peptides[J]. Recent Pat Antiinfect Drug Discov, 2018, 13: 12-52. DOI:10.2174/1574891X13666180628105928 |
| [9] |
Andersson DI, Hughes D, Kubicek-Sutherland JZ. Mechanisms and consequences of bacterial resistance to antimicrobial peptides[J]. Drug Resist Updat, 2016, 26: 43-57. DOI:10.1016/j.drup.2016.04.002 |
| [10] |
Magana M, Pushpanathan M, Santos AL, et al. The value of antimicrobial peptides in the age of resistance[J]. Lancet Infect Dis, 2020, 20: e216-e230. DOI:10.1016/S1473-3099(20)30327-3 |
| [11] |
Terwilliger TC, Weissman L, Eisenberg D. The structure of melittin in the form I crystals and its implication for melittin's lytic and surface activities[J]. Biophys J, 1982, 37: 353-361. DOI:10.1016/S0006-3495(82)84683-3 |
| [12] |
Raghuraman H, Chattopadhyay A. Melittin: a membrane-active peptide with diverse functions[J]. Biosci Rep, 2007, 27: 189-223. DOI:10.1007/s10540-006-9030-z |
| [13] |
Therrien A, Fournier A, Lafleur M. Role of the cationic C-terminal segment of melittin on membrane fragmentation[J]. J Phys Chem B, 2016, 120: 3993-4002. DOI:10.1021/acs.jpcb.5b11705 |
| [14] |
Asthana N, Yadav SP, Ghosh JK. Dissection of antibacterial and toxic activity of melittin: a leucine zipper motif plays a crucial role in determining its hemolytic activity but not antibacterial activity[J]. J Biol Chem, 2004, 279: 55042-55050. DOI:10.1074/jbc.M408881200 |
| [15] |
Hong J, Lu X, Deng Z, et al. How melittin inserts into cell membrane: conformational changes, inter-peptide cooperation, and disturbance on the membrane[J]. Molecules, 2019, 24: 1775. DOI:10.3390/molecules24091775 |
| [16] |
Hu HY, Chen DW, Liu YF, et al. Preparation and in vitro tumor cells selectivity of sterically stabilized immunoliposomal peptides in bee venom[J]. Acta Pharm Sin (药学学报), 2007, 42: 1201-1205. |
| [17] |
Zhang SK, Ma Q, Li SB, et al. RV-23, a melittin-related peptide with cell-selective antibacterial activity and high hemocompatibility[J]. J Microbiol Biotechnol, 2016, 26: 1046-1056. DOI:10.4014/jmb.1510.10074 |
| [18] |
Hewish DR, Barnham KJ, Werkmeister JA, et al. Structure and activity of D-Pro14 melittin[J]. J Protein Chem, 2002, 21: 243-253. DOI:10.1023/A:1019741202601 |
| [19] |
Pandey BK, Ahmad A, Asthana N, et al. Cell-selective lysis by novel analogues of melittin against human red blood cells and Escherichia coli[J]. Biochemistry, 2010, 49: 7920-7929. DOI:10.1021/bi100729m |
| [20] |
Tang HQ, Li YC, Dong YZ, et al. Synthesis as well as determination of the antimicrobial activities and haemolytic activities of halogen-contained cationic antimicrobial peptides[J]. Chin J Pharm (中国医药工业杂志), 2016, 47: 1513-1518. |
 2021, Vol. 56
2021, Vol. 56


