2. 贵州医科大学实验动物中心, 贵州 贵阳 550025;
3. 贵州医科大学微生物与生化药学工程中心, 贵州 贵阳 550025
2. Experimental Animal Center of Guizhou Medical University, Guiyang 550025, China;
3. Center of Microbiology and Biochemical Pharmaceutical Engineering, Guizhou Medical University, Guiyang 550025, China
黄芩苷为典型的黄酮类化合物, 是中药黄芩的主要活性成分, 同时也是其主要的质量控制标志物。黄芩苷药用价值丰富, 具有保肝、利胆、抗菌、抗炎、抗肿瘤、抗病毒、抗氧化、保护神经元及抗糖尿病肾病等药理作用[1-5]。口服吸收研究[6-8]表明, 黄芩苷能在肠道细菌β-葡萄糖醛酸苷酶(GUS) 的作用下水解生成黄芩素, 而黄芩素能够在肝脏中尿苷二磷酸葡萄糖醛酸转移酶1A8 (uridine diphosphate glucuronosyl-transferases 1A8, UGT1A8) 和尿苷二磷酸葡萄糖醛酸转移酶1A9(UGT1A9) 的作用下分别生成黄芩苷和黄芩素6-O-β-D-葡萄糖醛酸苷(baicalein 6-O-β-D-glucuronide, B6G), 并以这两种糖苷的形式吸收入血并分布, 同时经过肝肠循环, 使得血药浓度长时间保持, 药物半衰期得以延长。
聚乙二醇(PEGs) 是一种常见的多分散分子, 分子质量因聚合度不同而异, 通常在200~35 000之间, 其物理性质与相对分子质量的大小相关。一般来说, PEGs是安全无毒且惰性的, 因此在临床治疗中, 都将其当作不影响药物药效的成分(通常被忽略)。但是越来越多的证据表明, PEGs能够影响药物的稳定性及释药速率, 甚至影响药物外排泵(P-gp) 的功能, 从而改变药物在体内的吸收、分布、代谢和排泄[9, 10]。Ashiru-Oredope等[11]报道聚乙二醇400可以提高男性体内雷尼替丁的口服生物利用度; 此外, 聚乙二醇还对体内的CYP3A4酶有影响, 可能会提高或降低药物的生物利用度, 影响药物的临床效应[12]。
PEGs作为两亲性新型药用辅料, 广泛地应用于含有活性成分黄芩苷的中药复方制剂中, 例如PEG400应用于中药软胶囊及中药注射剂的处方中(如茵栀黄软胶囊及清开灵注射剂), PEG1000应用于中药滴丸(银黄含化滴丸) 中等。前期研究表明, PEG400能够影响菌群失调大鼠对黄芩苷的吸收[13], 那么不同浓度的PEGs对黄芩苷在大鼠体内的吸收情况未见报道, 其影响药物吸收的机制也尚不明确。本研究拟采用UPLC-MS/MS考察不同浓度的3种相对分子质量的PEGs对黄芩苷及其主要代谢物B6G药代动力学的影响, 并基于体外孵育的方法研究不同相对分子质量的PEGs对重组酶UGT1A8及UGT1A9活性的影响, 初步揭示大鼠体内PEGs与黄芩苷的相互作用以及PEGs对药物代谢酶(UGT1A8/UGT1A9) 的干预能力, 以期提高PEGs参与的黄酮类药物(黄芩苷等) 的新剂型设计及临床安全用药提供参考。
材料与方法仪器 UltiMate 3000型超高效液相色谱-TSQ Quantum型三重四极杆串联质谱(Thermo, 美国), Vibrax VXR basic型自动漩涡振荡仪(IKA, 德国), AB104-N型电子天平(梅特勒-托利多仪器有限公司, 瑞士), Polytron 1200E手持组织匀浆机(Kinematica, 瑞士), Allegra BHR型超高速冷冻离心机(Beckman, 美国), D101型氮吹仪(杭州蓝焰科技有限公司), 2XZ-1型旋片式真空泵(浙江黄岩黎明实业有限公司), DNP-9052电热恒温培养箱, DK-98-ⅡA型电热水浴锅(天津市泰斯特仪器有限公司), BBS-V800型超净工作台(苏州净化设备总厂)。
试药 黄芩苷原料药(批号HQ190916, 纯度≥90%, 陕西昊辰生物科技有限公司); 黄芩苷、黄芩素、染料木素对照品(批号分别为110715-201312, 110715-201214, 110714-201216, 纯度均≥98%, 中国食品药品检定研究院); B6G对照品(纯度≥98%, 大连医科大学); 三羟甲基氨基甲烷盐酸盐(Tris-HCl) 缓冲液(批号20180912, 北京索莱宝生物技术有限公司); 聚乙二醇400 (西陇化工股份限公司); 聚乙二醇1 000、4 000 (上海源叶生物科技有限公司); 重组酶UGT1A8、UGT1A9 (上海全洋生物科技有限公司); 尿苷二磷酸葡萄糖醛酸(UDPGA, 批号63700-19-6, 上海源叶生物科技有限公司); 氯化镁(MgCl2, 分析纯, 天津市科密欧化学试剂有限公司); 甲醇、乙腈为色谱纯(Merck公司, 德国), 甲酸为色谱纯(CNW公司, 德国), 其他试剂均为分析纯。
动物 SPF级雄性SD大鼠, 体质量(230 ± 20) g, 由贵州医科大学实验动物中心提供, 许可证号SYXK (黔) 2018-0001。大鼠严格按照实验动物护理和使用指南饲养。将大鼠饲养在室温(23 ± 2) ℃和相对湿度55% ± 5%的环境中, 光照12 h循环, 自由饮水。本实验所涉及动物的相关操作均在贵州医科大学实验动物伦理委员会的批准下进行(批准号: 1901090), 并严格遵循相关准则。
色谱条件 Thermo Hypersil GOLD C18色谱柱(100 mm×2.1 mm, 1.9 μm), 带有Hypersil GOLD C18预柱(10 mm×2.1 mm, 1.9 μm), 流动相乙腈(A)-0.1%甲酸水溶液(B) 梯度洗脱(0~9 min, 90%~27% B; 9~9.1 min, 27%~90% B; 9.1~12 min, 90% B), 流速0.3 mL·min-1, 柱温30 ℃, 进样量5 μL。
质谱条件 电喷雾离子源(ESI), 检测方式为正离子模式, 碰撞气为氩气(Ar), 辅助气为氮气(N2), 离子源电压3.5 kV, 毛细管电压2.5 kV, 离子传输管温度375 ℃, 雾化器温度275 ℃; 黄芩苷、B6G和染料木素的碰撞能量(CE) 分别为20、20和25 eV; 透镜电压分别为151、151、180 V; 采用选择反应监测(SRM) 模式进行测定; 黄芩苷和B6G用于定量分析的离子对均为m/z 447~271; 染料木素(IS) 为m/z 271~215。
溶液的配制 精密称取适量的黄芩苷及B6G对照品, 用甲醇超声溶解并定容, 分别得到含有7 000 ng·mL-1黄芩苷和9 000 ng·mL-1 B6G的混合对照品储备液。梯度稀释得到黄芩苷系列工作溶液(质量浓度为27.35、54.69、109.38、218.75、437.5、875、1 750和3 500 ng·mL-1) 和B6G的系列工作溶液(质量浓度为35.15、70.31、140.63、281.25、562.5、1 125、2 250和4 500 ng·mL-1)。以染料木素对照品溶液为内标溶液(质量浓度为10 μg·mL-1)。100 μL空白血浆中分别加入工作溶液和内标溶液10 μL以得到黄芩苷及B6G的对照溶液和质控样品溶液。黄芩苷血浆质控样品浓度分别为54.69、437.5和1 750 ng·mL-1, B6G血浆质控样品浓度分别为70.31、562.5和2 250 ng·mL-1, 所有溶液均在4 ℃保存。
药代动力学 取SD大鼠42只, 随机分为黄芩苷+水、黄芩苷+ 50% PEG400、黄芩苷+ 100% PEG400、黄芩苷+ 50% PEG1000、黄芩苷+ 100% PEG1000、黄芩苷+ 50% PEG4000及黄芩苷+ 100% PEG4000等7组, 每组6只, 实验前自由饮水并禁食12 h; 大鼠灌胃黄芩苷(剂量168 mg·kg-1) 相应的混悬溶液(药物与溶剂按1∶10的比例加入相应体积的生理盐水或PEGs, 超声混匀即可)。收集给药后0.5、1、2、4、6、7、8、9、10、12、14、16和24 h的全血, 4 ℃下以4 000 r·min-1离心10 min分离血浆, -80 ℃保存待测。
血浆样品处理 将冻存的血浆样品室温下完全解冻, 吸取空白血浆100 μL, 加入内标溶液10 μL和0.5 mol·L-1 HCl溶液50 μL, 混匀, 加入两次乙酸乙酯, 每次1 mL并涡旋振荡进行液-液萃取10 min, 取上清液置于离心管中, 4 ℃下以4 000 r·min-1离心10 min, 取尽上清液, 37 ℃下以温和的氮气吹干, 最后用流动相(1∶1) 进行复溶, 4 ℃下以12 000 r·min-1离心10 min, 取上清液5 μL注入UPLC-MS/MS系统进行分析。
方法学考察专属性考察 分别取大鼠空白血浆、空白血浆+混合对照品+内标溶液以及大鼠口服给药黄芩苷8 h后的血浆样品, 按“血浆样品处理”下的方法进行预处理, 并按UPLC-MS/MS条件测定, 记录色谱图以考察该方法的专属性。
标准曲线及线性范围 取黄芩苷及B6G血浆系列对照样品, 按“血浆样品处理”下的方法进行预处理, 并按UPLC-MS/MS条件测定, 横坐标为测得的待测物浓度, 纵坐标为待测物与内标的峰面积之比, 进行线性回归, 分别得到黄芩苷及B6G的血浆标准曲线。
精密度和准确度考察 分别取黄芩苷及B6G的3个浓度的血浆质控样品各6份, 按“血浆样品处理”下的方法进行预处理, 并按UPLC-MS/MS条件连续测定3天, 根据随行标准曲线, 计算出实际浓度, 考察方法的精密度(RSD) 及准确度(RE)。
萃取回收率和基质效应 分别取黄芩苷及B6G的3个浓度的血浆质控样品各6份, 按UPLC-MS/MS条件进行分析, 通过比较黄芩苷及B6G的3个浓度的血浆质控样品的峰面积与在空白血浆提取后掺入相同浓度的两个分析物的峰面积来计算萃取回收率。通过比较空白血浆的质控样品的峰面积和流动相中相同浓度待测物的峰面积来评价基质效应。
稳定性 考察黄芩苷及B6G的3个浓度的血浆质控样品在不同储存条件下的稳定性(在室温放置24 h、4 ℃自动进样器中放置12 h、-80 ℃反复冻融3次以及-80 ℃下放置20天)。
黄芩素重组酶孵育 分别设定黄芩素组、黄芩素+ PEG400组、黄芩素+ PEG1000组及黄芩素+ PEG4000组, 每组重复3个样品。整个孵育体系(100 μL) 含有50 mmol·L-1 Tris-HCl缓冲液(pH 7.4)、5 mmol·L-1 MgCl2溶液、UGT1A8 (0.1 mg·mL-1)/UGT1A9 (0.1 mg·mL-1) 以及PEG400/PEG1000/PEG4000 (0、2.5%、5%、10%、20%)。在对照和实验混合孵育体系中, 有机溶剂的最终比例均不超过1%。孵育体系在冰上预孵育10 min后, 将底物黄芩素(2.5、5、10和20 μmol·L-1) 添加到孵育体系中, 通过添加UDPGA (5 mmol·L-1) 启动反应, 并在37 ℃下恒温孵育30 min。最后通过添加含有内标(染料木素) 的冰冷乙腈(100 μL) 终止反应。将所有溶液彻底混合2 min后, 将混合物在4 ℃下以13 333 r·min-1离心15 min。取上清液(80 μL) 转移到进样器样品瓶中, 并将2 μL注入UPLC-MS/MS系统进行分析。v表示探针底物的消耗速率或代谢物的生成速率, 通常以此表达代谢酶活性, 其具体表示为: v [pmol·(min·mg)-1] = △C·(b·t)-1, 其中△C为底物黄芩素或生成物黄芩苷及B6G的浓度(μmol), b为微粒体蛋白浓度(mg·mL-1), t为孵育时间(min)。
数据处理 应用DAS 3.0软件(中国药理学会) 对黄芩苷和B6G的药代动力学参数和药时数据进行分析, 并用SPSS ver 22.0软件(SPSS公司, 美国伊利诺伊州芝加哥) 进行统计学分析。实验数据和药代动力学参数均为平均值±标准差。
结果 1 方法学验证 1.1 专属性大鼠空白血浆、空白血浆+ 混合对照品+ 内标溶液以及大鼠口服黄芩苷水溶液8 h后的血浆样品的SRM色谱图见图 1。结果发现各待测成分及内标均能实现良好分离, 空白血浆中的内源性物质对待测物和内标的测定没有明显干扰。
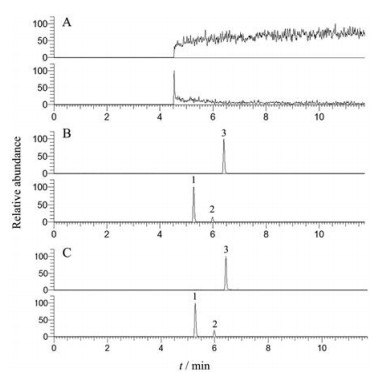
|
Figure 1 SRM chromatogram of each component in plasma. A: Blank plasma; B: Blank plasma + internal standard solution + mixed reference substance; C: Plasma sample 8 h after gavage. 1: Baicalin (BG); 2: Baicalein 6-O-β-D-glucuronide (B6G); 3: Genistein (IS) |
黄芩苷与B6G在大鼠血浆中的线性范围分别为54.69~3 500 ng·mL-1和70.31~4 500 ng·mL-1。回归方程分别为Y = 0.808 8X + 0.028 2 (R2 = 0.997 8) 和Y = 1.148X + 0.044 8 (R2 = 0.998 4), 根据信噪比≥10, 确定黄芩苷与B6G的定量限分别为10和5 ng·mL-1。
1.3 精密度和准确度两种待测物的3个浓度的质控样品日间和日内精密度的RSD均小于15%, RE处于-6.91%~3.65%。表明本方法符合生物样品精密度的要求。
1.4 提取回收率和基质效应黄芩苷、B6G和内标的平均萃取回收率和平均基质效应分别为84.72%~96.37%和88.17%~94.22%, RSD分别为2.2%~7.3%和1.6%~6.7%。表明该方法的平均萃取回收率达到生物样品测定的要求, 无明显的基质效应。
1.5 稳定性考察黄芩苷和B6G的3个浓度的质控样品在室温下放置24 h后的RE处于-7.6%~-2.5%, RSD < 9.6%; -80 ℃反复冻融3次后的RE处于-9.1%~-3.5%, RSD < 10.3%; -80 ℃放置20天后的RE处于-8.6%~ -3.1%, RSD < 10.9%; 4 ℃进样器中放置12 h后的RE处于-7.2%~2.4%, RSD < 9.3%。表明样品具有良好的稳定性。
2 药代动力学大鼠口服给药黄芩苷(168 mg·kg-1) 后, 通过血样绘制的药时曲线如图 2、3所示。由图可知, 黄芩苷和B6G的吸收曲线符合双峰吸收, 具有肝肠循环的特点。在不同浓度的考察中, 100%的PEGs对黄芩苷吸收的影响较为显著, 50%的PEGs次之, 表明黄芩苷的吸收对PEGs具有浓度依赖性。此外, 溶剂的选择会使得PEGs的效果发生改变, 这可能是不同溶剂的分子间力不同, 或改变了PEGs的两亲性或分子质量, 导致体内PEGs的有效浓度降低。不同相对分子质量的考察中, PEG400、PEG1000和PEG4000皆对黄芩苷及B6G的药代动力学行为产生了影响, 其中PEG400的影响程度最为显著。黄芩苷及B6G的药代动力学参数见表 1, 由表可知, 与正常给药的黄芩苷+水组相比, PEG400组的黄芩苷及B6G的AUC0-t分别提高了2.33和1.76倍; PEG1000组的黄芩苷及B6G的AUC0-t分别提高了2.11和1.36倍; PEG4000组的黄芩苷及B6G的AUC0-t分别提高了2.20和1.29倍。以上数据表明3种相对分子质量的PEGs皆可提高黄芩苷和B6G在大鼠体内的吸收, 其影响程度依次为: PEG400 > PEG1000 > PEG4000, 这可能是由于其质量分数不同, 与体内药物代谢酶的亲和力不同, 从而对药物吸收的影响程度不同。
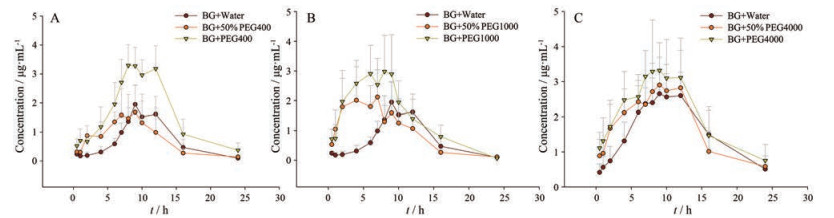
|
Figure 2 Plasma concentration time curve of BG with different PEG400 (A), PEG1000 (B), and PEG4000 (C). n = 6, x ± s |
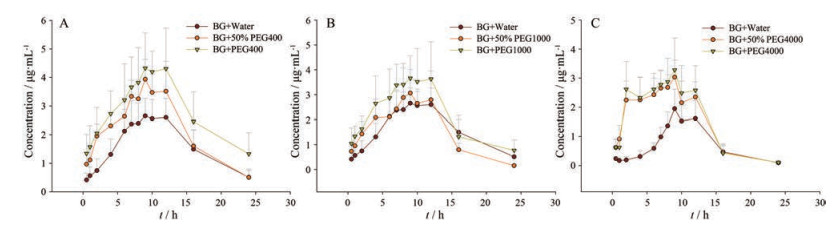
|
Figure 3 Plasma concentration time curve of B6G with different PEG400 (A), PEG1000 (B), and PEG4000 (C). n = 6, x ± s |
| Table 1 Pharmacokinetic parameters. n = 6, x±s. *P < 0.05 vs BG+water group (baicalin); #P < 0.05 vs BG+water group (B6G) |
不同相对分子质量PEGs对UGT1A8及UGT1A9重组酶孵育体系的最佳酶活性值如表 2所示, 与正常孵育组相比, 黄芩素+ PEG400组中UGT1A8与UGT1A9活性分别提高了2.28和1.32倍。黄芩素+ PEG1000组中UGT1A8与UGT1A9活性分别提高了1.81和1.10倍。黄芩素+ PEG4000组中UGT1A8与UGT1A9活性分别提高了1.46和1.06倍。底物黄芩素的消耗速率增加, 表明单位时间内生成黄芩苷或B6G的速率提高。PEGs对UGT1A8及UGT1A9作用的Dioxn图如图 4、5所示, 结果表明, 随着PEGs浓度的提高, UGT1A8及UGT1A9的活性逐渐提高, PEGs诱导代谢酶的活性增强。其中PEG400、PEG1000及PEG4000对UGT1A8的Ki指数分别为21.12、22.55和26.15 μmol·L-1; 对UGT1A9的Ki指数分别为27.91、30.52和33.89 μmol·L-1, 表明PEGs能够不同程度地促进UGT1A8及UGT1A9的酶活性, 且对UGT1A8的亲和力大于UGT1A9, 进而使得B6G的生成速率大于黄芩苷, 此外不同相对分子质量的PEGs对药酶UGT1A8及UGT1A9的影响程度依次为: PEG400 > PEG1000 > PEG4000, 这与药代动力学影响结果一致。本研究初步表明, 不同相对分子质量的PEGs能够通过对UGT1A8及UGT1A9活性的影响, 从而调控黄芩苷的药代动力学行为。
| 表 2 The maximum activity of uridine diphosphate glucuronosyl-transferases (UGTs) in each group after incubation in vitro. n = 3, x±s. *P < 0.05, #P < 0.05 vs normal group |

|
Figure 4 Primary Dioxn plot, the secondary plot for Ki in the promotion of substrate metabolism by various concentrations of PEGs (2.5%, 5%, 10%, 20%) in UGT1A8. A: Dioxn plot of PEG400; B: Dioxn plot of PEG1000; C: Dioxn plot of PEG4000; D: Ki plot of PEGs |
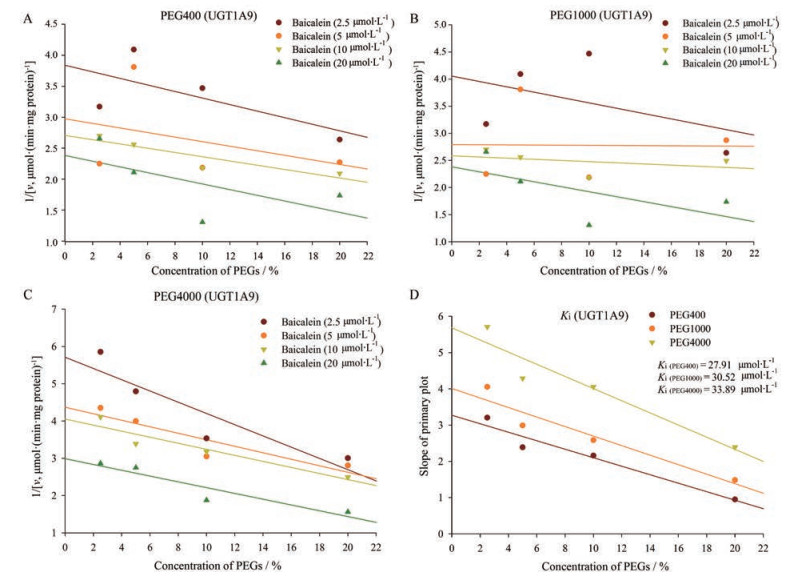
|
Figure 5 Primary Dioxn plot, the secondary plot for Ki in the promotion of substrate metabolism by various concentrations of PEGs (2.5%, 5%, 10%, 20%) in UGT1A9. A: Dioxn plot of PEG400; B: Dioxn plot of PEG1000; C: Dioxn plot of PEG4000; D: Ki plot of PEGs |
本实验结果表明3种相对分子质量的PEGs均能够提高黄芩苷和B6G在大鼠体内的吸收且存在着浓度依赖性(100%的PEGs效果优于50% PEGs), 其影响程度依次为: PEG400 > PEG1000 > PEG4000。这可能是相对分子质量较小的PEGs, 主要通过被动扩散进行转运, 使得跨膜能力提高, 更易于达到作用靶点, 从而与代谢酶或转运体的相互作用更多[14]。此外, 不同相对分子质量PEGs的分子间力不同, 与药物结合的能力不同, 在体内的处置能力也不同, 这通常体现在不同药物的聚乙二醇化修饰上。最后PEGs作为药物制剂新技术与新剂型研究及制备常见的高分子聚合物药用辅料, 其对难溶性药物具有固体分散、增溶的作用, 从而会增加药物在体内的吸收, 这也是其增加黄芩苷及B6G体内吸收的其中原因。
大多数的黄酮类化合物如金丝桃苷[15]、野黄芩苷[16]、槲皮素[17]等黄酮类化合物均与黄芩苷一样为多极性酚羟基化合物, 亲水性及亲脂性均不好; 在体内主要经肠道菌群及其产生的GUS水解为相应苷元, 再由6种不同亚型的尿苷二磷酸葡萄糖醛酸转移酶(UGT1A1、1A3、1A7、1A8、1A9及2B15) 和硫酸化酶的作用发生结合反应生成糖苷, 其中黄芩素主要在UGT1A9作用下生成黄芩苷, 在UGT1A8作用下生成B6G[18], 因此黄芩素在肝脏内的代谢过程是影响黄芩苷吸收的一个重要环节。由于肝肠中的UGTs催化速率远远大于GUS[7, 8], 本文主要研究不同相对分子质量的PEGs对肝脏药物代谢酶(UGT1A8和UGT1A9) 的影响, 并考察了UGTs在黄芩素代谢过程中起到的调控作用。课题组前期关于PEG400对黄芩苷及其主要代谢物胆汁排泄的影响研究表明, 与黄芩苷+ 水组相比, 黄芩苷+ PEG400组大鼠12 h内胆汁中黄芩苷及其主代谢物B6G的累积排泄量分别增加了1.8和2.2倍; 初步证实了PEG400能够促使胆汁排至肠道的黄芩苷及B6G的浓度增多, 通过肝肠循环和肾脏的重吸收作用, 使得血液中两种代谢物的浓度增加[19]。另一方面也表明了辅料能够通过对药物代谢酶的影响, 从而对药物产生调控, 这将会对黄芩苷类黄酮药物的临床安全制剂提供理论依据。
在人体内, 外来化合物总是在不同的酶和具有不同功能的转运体之间转移, 它们通过代谢酶来增加水溶性, 并最终通过某些转运蛋白(P-gp、BCRP或MRP) 排出体外, 因此药物的处置通常是由代谢酶及转运蛋白共同调控的。已有研究表明, PEG400可通过对P-gp的抑制而改善受P-gp介导药物的吸收[20, 21]。此外, 黄芩素在肠黏膜转化为黄芩苷后, 约有一半的黄芩苷通过多药耐药相关蛋白2 (MRP2) 返回组织[22], Ma等[23]研究表明二苯乙烯苷下调了大鼠肝脏和小肠中UGT1A8和UGT1A9的mRNA表达, 从而会抑制大黄素的葡萄糖醛酸化。这些证据表明药物在机体内的处置过程会收到多重调控, 无论是代谢酶的活性或转运蛋白的表达都会对药物的体内过程产生影响, 因此药用辅料对药物药代动力学的影响机制不仅要考虑到代谢酶和转运体的唯一作用, 还应该考虑到酶转运体联盟的协同作用。本研究基于体外孵育系统探讨了不同相对分子质量的PEGs对UGT1A8及UGT1A9酶活性的影响, 以初步证实辅料与药物代谢酶之间的相互作用。但是药用辅料对黄芩苷的外排转运蛋白(如MRP2) 及UGT酶表达的影响还有待进一步的研究。
作者贡献: 周明皓、曹思源和杨七妹负责药代动力学、方法学验证及重组酶孵育实验; 张敏和孟小夏负责论文的指导; 王鹏娇和张硕负责实验所需试剂及材料的准备; 周明皓负责数据的分析和统计、文献查阅和文章内容的撰写。所有作者均已批准该稿件的最终版本。
利益冲突: 所有作者均声明不存在利益冲突。
| [1] |
Lu Y, Joerger R, Wu C. Study of the chemical composition and antimicrobial activities of ethanolic extracts from roots of Scutellaria baicalensis Georgi[J]. J Agric Food Chem, 2011, 59: 10934-10942. DOI:10.1021/jf202741x |
| [2] |
Lee W, Ku SK, Bae JS. Anti-inflammatory effects of baicalin, baicalein, and wogonin in vitro and in vivo[J]. Inflammation, 2015, 38: 110-125. DOI:10.1007/s10753-014-0013-0 |
| [3] |
Luo R, Wang J, Zhao L, et al. Synthesis and biological evaluation of baicalein derivatives as potent antitumor agents[J]. Bioorg Med Chem Lett, 2014, 24: 1334-1338. DOI:10.1016/j.bmcl.2014.01.053 |
| [4] |
Zhao T, Tang H, Xie L, et al. Scutellaria baicalensis Georgi. (Lamiaceae): a review of its traditional uses, botany, phytochemistry, pharmacology and toxicology[J]. J Pharm Pharmacol, 2019, 71: 1353-1369. DOI:10.1111/jphp.13129 |
| [5] |
Liu J, Qiu L, Gao J, et al. Preparation, characterization and in vivo evaluation of formulation of baicalein with hydroxypropyl-beta-cyclodextrin[J]. Int J Pharm, 2006, 312: 137-143. DOI:10.1016/j.ijpharm.2006.01.011 |
| [6] |
Xing J, Chen X, Sun Y, et al. Interaction of baicalin and baicalein with antibiotics in the gastrointestinal tract[J]. J Pharm Pharmacol, 2005, 57: 743-750. |
| [7] |
Tang H, Tang LL, Xun RJ, et al. Research progress on phase Ⅱ metabolites of some flavonoids and their pharmacological activities[J]. Chin New Drugs J (中国新药杂志), 2012, 21: 144-150. |
| [8] |
Liu ZM, Ma YM, Wang TM, et al. Metabolic transformation of baicalin and baicalein in isolated rat liver, kidney, small intestine and bladder[J]. Acta Pharm Sin (药学学报), 2008, 43: 664-668. |
| [9] |
Giacomini KM, Huang SM, Tweedie DJ, et al. Membrane transporters in drug development[J]. Nat Rev Drug Discov, 2010, 9: 215-236. DOI:10.1038/nrd3028 |
| [10] |
Hillgren KM, Keppler D, Zur AA, et al. Emerging transporters of clinical importance: an update from the international transporter consortium[J]. Clin Pharmacol Ther, 2013, 94: 52-63. DOI:10.1038/clpt.2013.74 |
| [11] |
Ashiru-Oredope DA, Patel N, Forbes B, et al. The effect of polyoxyethylene polymers on the transport of ranitidine in Caco-2 cell monolayers[J]. Int J Pharm, 2011, 409: 164-168. DOI:10.1016/j.ijpharm.2011.02.059 |
| [12] |
Shen Q, Lin Y, Handa T, et al. Modulation of intestinal P-glycoprotein function by polyethylene glycols and their derivatives by in vitro transport and in situ absorption studies[J]. Int J Pharm, 2006, 313: 49-56. DOI:10.1016/j.ijpharm.2006.01.020 |
| [13] |
Gu T, Zhang S, Zhang M, et al. Effect of PEG400 on pharmacokinetics of baicalin and baicalein in rats with dysbacteriosis[J]. Chin J Chin Mater Med (中国中药杂志), 2019, 44: 1034-1040. |
| [14] |
Wang T, Guo Y, He Y, et al. Impact of molecular weight on the mechanism of cellular uptake of polyethylene glycols (PEGs) with particular reference to P-glycoprotein[J]. Acta Pharm Sin B, 2020, 10: 2002-2009. DOI:10.1016/j.apsb.2020.02.001 |
| [15] |
AI G, Huang ZM, Wang DW, et al. Pharmacokinetics of hyperoside in rats[J]. Chin J Exp Tradit Med Form (中国实验方剂学杂志), 2013, 19: 157-161. |
| [16] |
Lu WL, Guo JX, Ping QN, et al. Pharmacokinetics of breviscapine liposome for injection in Beagle dogs[J]. Acta Pharma Sin (药学学报), 2006, 41: 24-29. |
| [17] |
Zeng C, Mi SQ, Luo SP, et al. Pharmacokinetics of quercetin in semen cuscutae[J]. Tradit Chin Drug Res Pharmacol (中药新药与临床药理), 2004, 15: 37-40. |
| [18] |
Zhang L, Lin G, Zuo Z. Involvement of UDP-glucuronosyltrans ferases in the extensive liver and intestinal first-pass metabolismof flavonoid baicalein[J]. Pharm Res, 2012, 24: 81. |
| [19] |
Zhu YN, Zhang S, Zhang M, et al. Effect of polyethylene glycol 400 on bile excretion of baicalin and its main metabolite[J]. Chin J Exp Tradit Med Form (中国实验方剂学杂志), 2020, 26: 88-93. |
| [20] |
Zhao J, Wei YH, Zhang GQ, et al. The effect of pluronic F68 and polyethylene glycol 400 on rifampicin bile and renal excretion[J]. Chin J Hosp Pharm (中国医院药学杂志), 2014, 34: 29-33. |
| [21] |
Huang JW, Huang BB, Liu PJ, et al. Study on the permeability of P-glycoprotein substrate rhodamine 123 through the intestinal mucosa of polyethylene glycol 400[J]. J China Pharm (中国药房), 2008, 19: 888-891. |
| [22] |
Akao T, Kawabata K, Yanagisawa E, et al. Baicalin, the predominant flavone glucuronide of scutellariae radix, is absorbed from the rat gastrointestinal tract as the aglycone and restored to its original form[J]. J Pharm Pharmacol, 2000, 52: 1563-1568. |
| [23] |
Ma J, Zheng L, Deng T, et al. Stilbene glucoside inhibits the glucuronidation of emodin in rats through the down-regulation of UDP-glucuronosyltransferases 1A8:application to a drug-drug interaction study in Radix Polygoni Multiflori[J]. J Ethnopharmacol, 2013, 147: 335-340. DOI:10.1016/j.jep.2013.03.013 |
 2021, Vol. 56
2021, Vol. 56


