2. 扬州大学, 江苏省人兽共患病重点实验室, 江苏 扬州 225009;
3. 浙江康恩贝中药有限公司, 浙江 丽水 323400
2. Jiangsu Key Laboratory of Zoonosis, Yangzhou University, Yangzhou 225009, China;
3. Zhejiang Conbazy Chinese Medicine Co., Ltd., Lishui 323400, China
流行性感冒简称流感, 是由流感病毒(influenza virus) 引起的一类急性呼吸道疾病。流感病毒属于单股负链RNA病毒, 根据核蛋白的抗原性可以分为甲、乙、丙、丁四型, 甲型流感病毒(influenza A virus, IAV) 又根据病毒表面糖蛋白血凝素(hemagglutinin, HA) 和神经氨酸酶(neuraminidase, NA) 的抗原性, 分为18个HA (H1~H18) 和11个NA (N1~N11) 亚型[1]。其中甲型流感病毒容易发生变异, 多次引起流感大流行, 如1918年西班牙流感、1968年香港流感和2009年新型H1N1流感, 共造成数千万人死亡, 以及1997年出现的H5N1禽流感和2013年的H7N9禽流感, 病死率非常高, 流感病毒给人类健康造成了巨大威胁[2]。
目前, 主要通过接种流感疫苗和药物治疗进行流感的防治。流感病毒极易发生变异, 只有针对当年流行株抗原的疫苗才具有保护作用, 而且疫苗的保护率仅为60%左右[3]。目前, 临床抗流感病毒的药物主要分为以下几类: M2离子通道抑制剂如金刚烷胺和金刚乙胺, 这类药物耐药非常严重, 其仅对甲型流感病毒有效, 目前已经不建议使用[4]; 神经氨酸酶抑制剂如奥司他韦和扎那米韦等, 达菲(磷酸奥司他韦) 仅在流感发病36~48 h内使用有效, 且对达菲的耐药率也在不断增加; RNA聚合酶抑制剂法匹拉韦, 对甲型和乙型流感病毒均有活性[5]; 聚合酶酸性蛋白(polymerase acid protein, PA) 核酸内切酶抑制剂巴洛沙韦, 于2018年10月获得美国食品药品监督管理局批准上市。鉴于RNA病毒高突变率以及病毒之间重组现象的普遍发生, 导致直接抗病毒药物出现耐药性。因此, 需要研发新的药物用于流感的防治。
中草药在中国、韩国、日本等多个国家作为基础性药物广泛使用, 国内外研究认为中草药成分复杂, 含有多酚类、黄酮类、皂苷类、生物碱类等化合物, 作用靶点多, 通过多种机制和多条途径发挥直接或间接抗流感病毒作用, 所以对中药进行抗流感病毒作用的研究具有广阔的应用前景。鱼腥草(Houttuynia cordata Thunb.) 为三白草科植物蕺菜的干燥地上部分, 具有抗菌、抗病毒、提高机体免疫力、利尿等作用[6]。文献报道, 鱼腥草对多种病毒[IAV、human immunodeficiency virus (HIV) 和herpes simplex virus-1 (HSV-1)] 均有很好的抑制作用[7]。鱼腥草注射液对H1N1型流感病毒感染小鼠具有很好的防治作用, 可以改善肺部炎症损伤, 降低肺脏指数[8]。黄芩及其成分对流感病毒感染的肺炎小鼠有治疗作用; 黄芩苷通过抑制神经氨酸酶的活性抑制流感病毒达菲耐药株的复制[9, 10]。以上研究均以中药提取物或其中的单一成分为研究对象, 本文研究的复方鱼腥草合剂(compound houttuynia mixture, CHM) 是鱼腥草、黄芩、板蓝根、连翘和金银花五味中药组成的复方制剂, 其药理作用广泛, 临床上常用于外感风热引起的咽喉疼痛、急性咽炎、扁桃腺炎等有风热证候者[11-13], 但有关复方鱼腥草合剂抗流感病毒的研究未见报道, 本文对其抗流感病毒作用及其初步作用阶段进行研究, 希望为其临床治疗流感提供一定的理论基础和依据。
材料与方法细胞和病毒 马达犬肾细胞(MDCK)、人肺癌细胞(Calu3)、流感病毒A/Fort Monmouth/1/1947 (FM1, H1N1) 和A/PR/8/34 (PR8, H1N1) 购自美国典型菌种保藏中心。流感病毒临床分离株达菲耐药株A/TianjinJinnan/15/2009 (H1N1)、金刚烷胺耐药株A/Hunanzhuhui/1222/2010 (H3N2) 和A/Jiangxidonghu/312/2006 (H3N2) 由中国疾病预防控制中心病毒病预防控制所舒跃龙教授提供。本室流感病毒毒株常规用鸡胚传代后于-80 ℃冰箱保存。禽流感病毒A/Duck/Jiangsu/Sheyang/2004 (H5N1) 和A/Chicken/Jiangsu/JTC4/2013 (H7N9) 病毒株由扬州大学农业部畜禽传染病学重点开放实验室分离鉴定并保存, 涉及禽流感病毒的实验均在扬州大学动物生物安全三级实验室完成。
试剂和药物 复方鱼腥草合剂(CHM) 由浙江康恩贝中药有限公司提供, 批号为B190324, 由五味药材(鱼腥草、黄芩、板蓝根、连翘和金银花)、辅料(蔗糖和蜂蜜) 及防腐剂(苯甲酸钠和羟苯乙酯) 组成。CHM质量控制标准已载入2020版《中国药典》[14]。后续实验中, CHM可根据需要进行适当的稀释后使用[15]。阳性对照药磷酸奥司他韦(oseltamivir phosphate, OP)、利巴韦林(ribavirin, RBV) 和金刚烷胺(amantadine, AH) (MCE公司)。细胞培养所用MEM培养基(minimum essential medium)、胎牛血清、NEAA (non-essential amino acids)、青链霉素混合液(100×) 和pH为7.2的磷酸盐缓冲液(phosphate buffer saline, PBS) (Invitrogen公司); 牛血清白蛋白(bovine serum albumin, BSA) 和TPCK胰酶(Sigma公司); β-actin抗体(Cell Signaling公司); 流感病毒非结构蛋白1 (nonstructural protein 1, NS-1) 抗体(Santa Cruz公司)。
仪器 二氧化碳孵箱和低温高速离心机(美国Thermo公司); 凝胶成像仪(美国伯乐公司); 酶标仪(ELX808, 美国BioTeK公司); 7500-fast real time PCR system (Applied Biosystems公司); 生物安全柜(美国NUAIRE公司); 倒置显微镜(奥林巴斯公司)。
细胞毒性测定[CCK (cell counting kit) 法] MDCK细胞(每孔1.5×104个) 和Calu3细胞(每孔2.5×104个) 接种于96孔板内, 于37 ℃、5% CO2孵箱培养过夜, 用细胞维持液(MEM培养基、0.08% BSA、1% NEAA、2 μg·mL-1胰酶和1%双抗) 按浓度梯度稀释药物, 平行3孔, 加入到培养板中(原培养基吸弃) 继续培养48 h, 每孔加入10 μL CCK试剂, 于37 ℃放置1 h后测定450 nm的吸收值, 用Reed-Muench法计算半数毒性浓度(50% toxic concentration, TC50)。
细胞病变效应(cytopathic effects, CPE) 利用倒置显微镜观察各孔细胞的生长状态, 以正常细胞为对照, 细胞状态改变或死亡比例分别标记为4+ (细胞死亡比例75%~100%)、3+ (细胞死亡比例50%~75%)、2+ (细胞死亡比例25%~50%)、1+ (细胞死亡比例0~25%)、0+ (细胞形态未发生变化或全部存活)。用Reed-Muench法计算药物对病毒的半数抑制浓度(50% inhibitory concentration, IC50) 并计算治疗指数[SI (selective index) = TC50/IC50]。
流感病毒蛋白表达(Western blot法) MDCK细胞(每毫升5×105个) 或Calu3细胞(每毫升5×105个) 接种于12孔板中培养过夜, PBS洗涤1次后用不同的流感病毒株[MOI (multiplicity of infection) = 0.002或0.02] 感染细胞2 h, 感染的同时加入不同浓度待测药液, 阳性对照药在感染后2 h加入。培养24 h后提取细胞总蛋白, 进行Western blot检测。β-Actin一抗(1∶1 000) 和NS-1一抗(1∶400) 均4 ℃孵育过夜, Tris-HCl缓冲盐溶液(Tris-HCl buffer saline Tween, TBST) 洗3次后孵育辣根过氧化物酶标记的二抗1 h, TBST洗二抗3次后, 加增强型化学发光(enhanced chemiluminescent, ECL) 显影液(Thermo公司), 利用凝胶成像仪进行显影。
流感病毒RNA水平测定(qRT-PCR法) Calu3细胞(每毫升5×105个) 接种于12孔板中培养过夜, 流感病毒FM1 (MOI = 0.02) 感染细胞2 h, 感染的同时加入不同浓度待测药液, 阳性对照药在感染后2 h加入。培养12 h后用RNeasy Mini Kit提取细胞内总RNA, 流感病毒M2的mRNA表达水平用荧光定量法检测。使用荧光定量qRT-PCR试剂盒(TransScriptTM Green One-Step qRT-PCR SuperMix, TransGen Biotech), 反应体系按照50 ℃ 5 min, 94 ℃ 30 s, 35个循环(94 ℃ 5 s, 60 ℃ 15 s, 72 ℃ 10 s) 进行荧光定量反应。用2-ΔΔCt相对定量的方法测定细胞中GAPDH (glyceraldehyde-3-phosphate dehydrogenase) 和流感病毒M2的RNA水平。引物见表 1。
| Table 1 Oligonucleotides used for quantitive reverse transcription PCR (qRT-PCR). GAPDH: Glyceraldehyde-3-phosphate dehydrogenase |
时间进程分析 MDCK细胞(每毫升5×105个) 接种于12孔板中培养过夜, 流感病毒FM1 (H1N1) (MOI = 0.02) 感染细胞2 h后换液, 在感染的不同时间加入待测药液处理。在病毒感染后8 h提取细胞总蛋白, 进行Western blot检测[16]。
病毒滴度检测 Calu3细胞(每毫升5×105个) 接种于12孔板中培养过夜, 流感病毒FM1 (MOI = 0.02) 感染细胞2 h后换液, 感染的同时加入不同浓度待测药液, 阳性对照药在感染后2 h加入。感染24 h后三冻三融, 离心去除细胞碎片收上清, 梯度稀释上清并感染MDCK细胞, 48 h后读取CPE, 记录并用Reed-Muench法计算病毒半数组织细胞感染量(50% tissue culture infective dose, TCID50)。
抗H5N1和H7N9流感病毒活性检测(血凝法) MDCK细胞(每孔1.5×104个) 接种96孔培养板, 置5% CO2、37 ℃条件培养。24 h后感染100 TCID50流感病毒, 吸附1 h后弃病毒液, 加入含有不同稀释度待测样品及阳性对照药的维持液, 同时设细胞对照孔和病毒对照孔。待病毒对照组病变程度(CPE) 达3+以上时采用血凝实验检测每孔的病毒滴度。按Reed-Muench计算50%抑制病毒复制的浓度(IC50) 和治疗指数(SI)。血凝实验方法与判定标准参照文献进行[17]。
统计学分析 对于实验数据的统计分析应用GraphPad Prism 6.0软件来完成, 数据表示为x±s, 选用单因素方差分析(one-way ANOVA) 并用Holm-Sidak法进行组间的多重比较。P < 0.05表示具有显著性统计学意义。
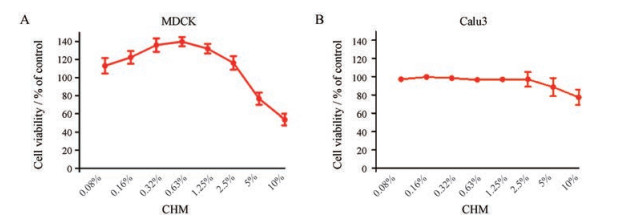
结果 1 CCK法测定细胞毒性结果采用CCK法对CHM在不同细胞中的毒性进行检测(图 1), CHM在MDCK和Calu3两种细胞中的无毒浓度(atoxic concentration, TC0) 均为CHM的2.5%, 因此在后续药效实验中所使用浓度均小于2.5%的CHM。
|
Figure 1 The cytotoxicity of compound houttuynia mixture (CHM) on MDCK and Calu3 cells by CCK assay. The MDCK (A) and Calu3 (B) cells were cultured in the 96-well plates. The various concentrations of CHM were added to the MDCK and Calu3 cells for 48 h. The cell viability of CHM was measured by cell counting kit (CCK) assay |
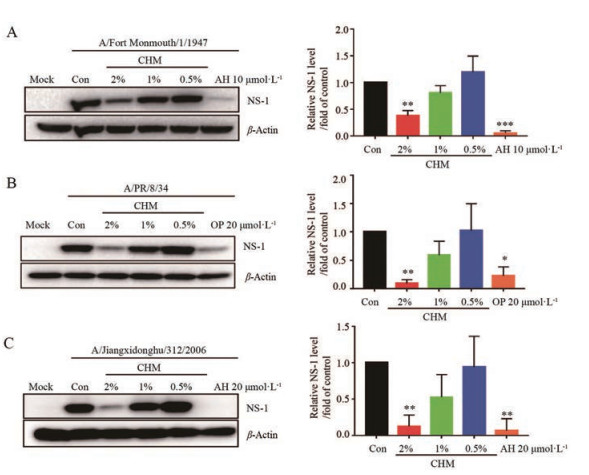
首先, 在MDCK细胞中检测复方鱼腥草合剂对流感病毒蛋白表达的影响。如图 2所示, 复方鱼腥草合剂对流感病毒国际通用株A/FM/1/47 (H1N1) 和A/PR/8/34 (H1N1) 以及我国临床分离株A/Jiangxidonghu/312/2006 (H3N2) 3个季节性流感病毒株均有很好抑制作用, 可剂量依赖性抑制各毒株的非结构蛋白NS-1的表达。
|
Figure 2 Effects of CHM against seasonal influenza virus. MDCK cells were infected with influenza virus A/Fort Monmouth/1/1947 [multiplicity of infection (MOI) = 0.002, A], A/PR/8/34 (MOI = 0.002, B), and A/Jiangxidonghu/312/2006 (MOI = 0.002, C) for 2 h, and treated with CHM (2%, 1%, and 0.5%) for 24 h at the same time. After treatment, cells were harvested and lysed. Western blot analysis was performed to detect the influenza virus nonstructural protein 1 (NS-1) protein. The NS-1 and β-actin protein blots were used for densitometric analysis. n = 3, x±s. *P < 0.05, **P < 0.01, ***P < 0.001 vs control (Con). AH: Amantadine; OP: Oseltamivir phosphate |
除了检测CHM对季节性流感病毒的影响外, 本研究还对高致病性的禽流感病毒毒株进行了检测。实验结果显示, CHM对高致病性禽流感病毒A/Duck/Jiangsu/Sheyang/2004 (H5N1) 和A/Chicken/Jiangsu/JTC4/2013 (H7N9) 均有一定抑制活性, 其IC50分别为CHM的1.8%和1.6% (表 2)。
| Table 2 The inhibitory activities of CHM on influenza H5N1 and H7N9. RBV: Ribavirin; TC50: 50% Toxic concentration; IC50: 50% Inhibitory concentration; SI: Selective index, SI = TC50/IC50. a: The unit of CHM concentration is volume fraction |
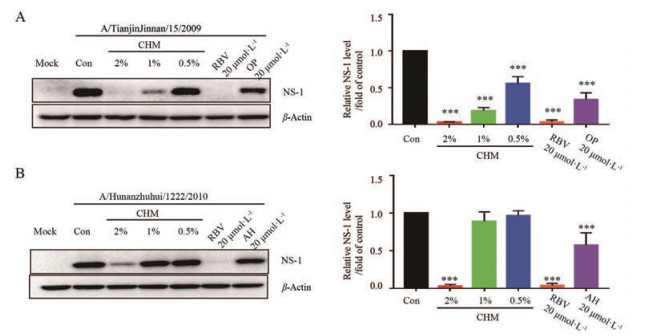
耐药是导致临床抗病毒治疗失败的主要原因之一, 前期研究发现CHM对季节性流感病毒和高致病性禽流感病毒有明显抗病毒作用, 在此作者研究了CHM对临床分离的达菲耐药株A/TianjinJinnan/15/2009 (H1N1) 和金刚烷胺耐药株A/Hunanzhuhui/1222/2010 (H3N2) 的作用。结果显示, CHM对耐药株同样具有很好抑制作用(图 3), 表明CHM具有广谱抗流感病毒的作用且与达菲和金刚烷胺无交叉耐药现象。
|
Figure 3 Effects of CHM against drug resistant strains of influenza virus. MDCK cells were infected with influenza virus A/TianjinJinnan/15/2009 (MOI = 0.02, A), A/Hunanzhuhui/1222/2010 (MOI = 0.02, B) for 2 h and treated with CHM (2%, 1%, and 0.5%) for 24 h at the same time. After treatment, cells were harvested and lysed. Western blot analysis was performed to detect the influenza virus NS-1 protein. The NS-1 and β-actin protein blots were used for densitometric analysis. n = 3, x±s. ***P < 0.001 vs Con |
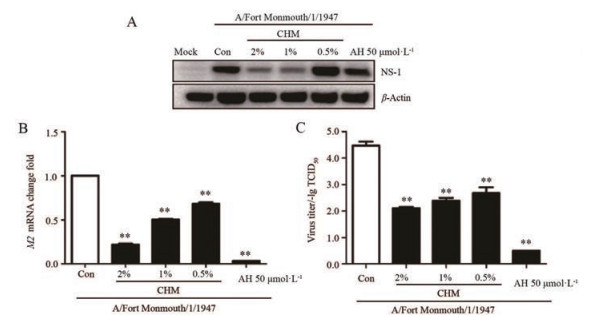
尽管MDCK细胞是进行抗流感病毒药物研究的经典细胞, 但MDCK细胞非人源细胞, 因此作者又选择了一种人肺癌细胞Calu3, 对CHM的抗流感病毒作用进行确证。如图 4A所示, 在Calu3细胞中, CHM对流感病毒同样具有很好抑制作用, 可剂量依赖性抑制流感病毒NS-1蛋白的表达。实时荧光定量PCR检测结果显示, CHM可剂量依赖性抑制流感病毒M2的mRNA水平(图 4B)。另外, 通过对子代流感病毒的滴度检测, 发现CHM可剂量依赖性抑制子代流感病毒的产生(图 4C)。以上结果说明, 在Calu3细胞中, CHM依然具有很好的抗流感病毒作用。
|
Figure 4 Inhibitory activities of CHM against influenza virus in Calu3 cells. Calu3 cells were infected with influenza A/Fort Monmouth/1/1947 (MOI = 0.02) for 2 h in the presence of CHM (2%, 1%, and 0.5%). A: After 24 h of infection, proteins were collected for Western blot analysis; B: After 12 h of infection, the total RNA extracts were used for qRT-PCR analysis; C: Calu3 cells infected with virus for 24 h were frozen and melted thrice, and cell culture supernatant were collected and subjected to virus titer assay using MDCK cells with a series of ten-fold dilutions of the supernatants. n = 3, x±s. **P < 0.01 vs Con. TCID50: 50% Tissue culture infective dose |
综合以上结果确定了CHM具有较好的广谱抗流感病毒作用, 接下来将初步研究它是如何发挥抗流感病毒作用的。作者在MDCK细胞中通过时间进程分析实验进行研究。首先, 如图 5A所示, 在流感病毒感染后的不同时间加入CHM, 结果显示在加入病毒的同时加入CHM具有显著的抗病毒作用, 而在感染后2 h及以后开始给药, CHM均无明确的抗流感病毒作用。为了进一步验证上述结果, 作者又采用分阶段给药的方式进行研究(图 5B)。结果显示, 和方案一的结果一致, CHM处理细胞0~2 h时段, 具有显著的抗病毒作用, 而其他时间段给药均没有作用。以上结果说明, CHM可能作用于流感病毒的进入阶段。
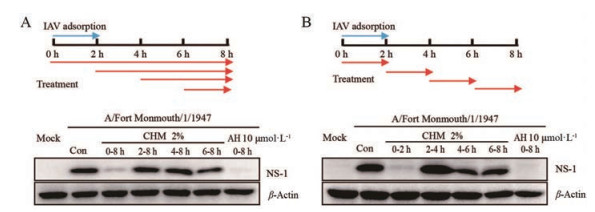
|
Figure 5 Time-of-addition of CHM on the replication of influenza A virus (IAV). A and B: MDCK cells infected with influenza A/Fort Monmouth/1/1947 (MOI = 0.02) were treated with 2% CHM at different time described in figures, and virus protein NS-1 were detected by Western blot at 8 h post infection |
直接靶向病毒的抗病毒药物在流感病毒治疗中发挥了重要作用, 但也存在耐药和治疗窗窄等问题, 因此需要研发新的抗流感病毒药物。传统中药在中国医药史上发挥极为重要作用, 至今中药依然在抗流感中占有重要地位。复方鱼腥草合剂具有清热解毒、抗菌消炎、抗病毒及增强免疫力等广泛药理作用[18-21]。本研究采用两种细胞和多个流感病毒株研究CHM抗流感病毒活性。结果显示, CHM在RNA、蛋白和细胞水平均可剂量依赖性抑制流感病毒的复制。尤其是针对目前临床上出现的达菲耐药株和金刚烷胺耐药株, CHM对其均有显著的抑制作用; 此外, CHM对高致病性禽流感病毒H5N1和H7N9也有显著的抗流感病毒作用, 表明CHM具有广谱的抗流感病毒作用。
干预流感病毒复制周期中的任何阶段都可以阻断流感病毒的复制, 如抑制病毒吸附、膜融合、病毒复制或病毒粒子释放[22]。在研究CHM对流感病毒复制周期影响时, 作者发现CHM只有在流感病毒感染的0~2 h给药才具有抗病毒作用, 说明其可能作用于流感病毒的早期阶段。流感病毒复制的早期阶段包含流感病毒的吸附、进入和膜融合等过程, 作者将进一步研究CHM抗流感病毒的作用阶段, 寻找其潜在抗流感病毒作用靶点, 为其临床抗流感病毒应用提供理论基础。
中药复方制剂CHM, 其成分非常复杂, 含有绿原酸、隐绿原酸、毛蕊花糖苷或其异构体、连翘酯苷、罗汉松脂苷、白杨素-6-C-阿拉伯糖-8-C-葡萄糖苷、槲皮苷、黄芩苷、黄芩素和汉黄芩素等化学成分[23]。据报道[24], 从鱼腥草中分离的黄酮类成分槲皮苷具有明显抑制流感病毒A/WS/33的作用, 其通过与病毒粒子的间接作用抑制流感病毒复制的早期阶段。板蓝根有效成分多糖类、生物碱类和木脂素类在体外具有抑制流感病毒复制作用[25]; Zhou[26]研究发现金银花和连翘抑制流感病毒H1N1的活性成分主要是隐绿原酸、绿原酸和新绿原酸等, 且二者配伍的抗病毒效果均优于单味药[27]; 黄芩的主要有效成分为黄芩苷、黄芩素和汉黄芩素等, 研究表明[9], 黄芩及其成分对多种流感病毒感染的肺炎动物模型确有效果。因此, CHM中的黄酮类和多酚类等可能是其发挥抗流感病毒作用的主要成分。CHM和其他具有清热解毒抗病毒作用的中药可能通过多途径、多靶点发挥抗病毒作用, 还需对其体内抗病毒作用机制进行深入研究, 为其临床抗流感病毒应用提供理论支撑。
作者贡献: 颜海燕负责部分药效学和初步作用机制研究实验、实验结果分析和文章初稿撰写; 王萌和张评浒负责部分药效学实验; 王辉强和金汉台负责文献调研和对文章撰写进行指导; 李玉环负责实验设计和论文审阅。
利益冲突: 所有作者均声明没有利益冲突。
| [1] |
Le TH, Nguyen NTB. Evolutionary dynamics of highly pathogenic avian influenza A/H5N1 HA clades and vaccine implementation in Vietnam[J]. Clin Exp Vaccine Res, 2014, 3: 117-127. DOI:10.7774/cevr.2014.3.2.117 |
| [2] |
Cox NJ, Subbarao K. Global epidemiology of influenza: past and present[J]. Annu Rev Med, 2000, 51: 407-421. DOI:10.1146/annurev.med.51.1.407 |
| [3] |
Doherty M, Schmidt-Ott R, Santos JI, et al. Vaccination of special populations: protecting the vulnerable[J]. Vaccine, 2016, 34: 6681-6690. DOI:10.1016/j.vaccine.2016.11.015 |
| [4] |
Pinto LH, Lamb RA. The M2 proton channels of influenza A and B viruses[J]. J Biol Chem, 2006, 281: 8997-9000. DOI:10.1074/jbc.R500020200 |
| [5] |
Zhang Q, Zhao QJ, Xiong RS, et al. Research progress of anti-influenza virus agents[J]. Acta Pharm Sin (药学学报), 2010, 45: 289-299. |
| [6] |
Xiang FF. Summary of medicinal use of Houttuynia cordata[J]. J Pract Tradit Chin Med (实用中医药杂志), 2004, 20: 601. |
| [7] |
Hayashi K, Kamiya M, Hayashi T. Virucidal effects of the steam distillate from Houttuynia cordata and its components on HSV-1, influenza virus, and HIV[J]. Planta Med, 1995, 61: 237-241. DOI:10.1055/s-2006-958063 |
| [8] |
Liu FZ, Shi H, Shi YJ, et al. Pharmacodynamic experiment of the antivirus effect of Houttuynia Cordata Injection on influenza virus in mice[J]. Acta Pharm Sin (药学学报), 2010, 45: 399-402. |
| [9] |
Zhi HJ, Zhu HY, Zhang YY, et al. In vivo effect of quantified flavonoids-enriched extract of Scutellaria baicalensis root on acute lung injury induced by influenza A virus[J]. Phytomedicine, 2019, 57: 105-116. DOI:10.1016/j.phymed.2018.12.009 |
| [10] |
Jin J, Chen Y, Wang D, et al. The inhibitory effect of sodium baicalin on oseltamivir-resistant influenza A virus via reduction of neuraminidase activity[J]. Arch Pharm Res, 2018, 41: 664-676. DOI:10.1007/s12272-018-1022-6 |
| [11] |
Chen L, Lin XJ. Clinical effect and mechanism of compound herba houttuyniae mixture for the children with macrolide-resistant myeoplasma pneumonia[J]. Int J Tradit Chin Med (国际中医中药杂志), 2018, 40: 715-718. |
| [12] |
Tang ZW. Effect observation on compound Yuxingcao mixture combined with ambroxol hydrochloride oral liquid for bronchopneumonia in children[J]. J New Chin Med (新中医), 2018, 50: 160-162. |
| [13] |
Qiao SP, Liu XZ, Jiang SY. Treatment of acute upper respiratory tract infection with houttuynia mixture[J]. J Southeast China National Def Med Sci (南京部队医药), 2000, 2: 43-44. |
| [14] |
National Pharmacopoeia Commission. Pharmacopoeia of the People's Republic of China: Part 1(中华人民共和国药典: 一部)[S]. Beijing: China Medical Science and Technology Press, 2020: 1328-1329.
|
| [15] |
Li L, Zhang B, Lu FG, et al. Effect of type A influenza virus on autophagy of lung macrophages and intervention of serum of Maxing Shigan decoction[J]. Chin Pharmacol Bull (中国药理学通报), 2019, 35: 883-888. |
| [16] |
Yan H, Ma L, Wang H, et al. Luteolin decreases the yield of influenza A virus in vitro by interfering with the coat protein Ⅰ complex expression[J]. J Nat Med, 2019, 73: 487-496. DOI:10.1007/s11418-019-01287-7 |
| [17] |
Simonsen L, Clarke MJ, Schonberger LB. Pandemic versus epidemic influenza mortality: a pattern of changing age distribution[J]. J Infect Dis, 1998, 178: 53-60. DOI:10.1086/515616 |
| [18] |
Hu L, Shen ZS, Wei R, et al. Effect of co-herba houttuyniae oral liquid to the stress function of radiation injured mice[J]. Pharm J China PLA (解放军药学学报), 2002, 18: 44-45. |
| [19] |
Li YK, Li W, Fu CM, et al. Lonicerae japonicae flos and Lonicerae flos: a systematic review of ethnopharmacology, phytochemistry and pharmacology[J]. Phytochem Rev, 2020, 19: 1-61. DOI:10.1007/s11101-019-09655-7 |
| [20] |
Zhou W, Zhang XY. Research progress of Chinese herbal medicine Radix isatidis (banlangen)[J]. Am J Chin Med, 2013, 41: 743-764. DOI:10.1142/S0192415X1350050X |
| [21] |
Dong ZL, Lu XY, Tong XL, et al. Forsythiae Fructus: a review on its phytochemistry, quality control, pharmacology and pharmacokinetics[J]. Molecules, 2017, 22: 1466-1515. DOI:10.3390/molecules22091466 |
| [22] |
Xiu SY, Zhang J, Ju H, et al. Progress on IFV drug targets and small molecule inhibitors[J]. Acta Pharm Sin (药学学报), 2020, 55: 611-626. |
| [23] |
Ying K, Wang JF, Cha HJ, et al. Fingerprints analysis of compound Yuxingcao mixture by HPLC[J]. Mod Chin Med (中国现代中药), 2020. DOI:10.13313/j.issn.1673-4890.20191104003 |
| [24] |
Choi HJ, Song JH, Park KS, et al. Inhibitory effects of quercetin 3-rhamnoside on influenza A virus replication[J]. Eur J Pharm Sci, 2009, 37: 329-333. DOI:10.1016/j.ejps.2009.03.002 |
| [25] |
Huang Y, Li J, Xu KY, et al. Research progress on anti-influenza effective components of Isatidis Radix[J]. Chin J Mod Appl Pharm (中国现代应用药学), 2019, 36: 2618-2623. |
| [26] |
Zhou W. Study on the Evaluation System of Bioavailability for Chinese Medicine Orally and Its Application to Pharmaceutics Based on Flos Lonicerae-Fructus Forsythiae Herb Couples (基于"银翘"药对的中药制剂生物有效性综合评价体系的构建与应用)[D]. Nanjing: Nanjing University of Chinese Medicine, 2014.
|
| [27] |
Luo X, Shen X, Hu BX. Molecular docking-based study on the anti-influenza H7N9 of Flos Lonicerae and Fructus Forsythiae[J]. Mod Tradit Chin Med (现代中医药), 2016, 36: 75-78. |
 2021, Vol. 56
2021, Vol. 56


