2. 中国医学科学院、北京协和医学院医药生物技术研究所, 抗感染药物研究北京市重点实验室, 北京 100050
2. Beijing Key Laboratory of Antimicrobial Agents, Institute of Medicinal Biotechnology, Chinese Academy of Medical Sciences and Peking Union Medical College, Beijing 100050, China
冠状病毒呈全球分布并具有持续流行的趋势, 其感染者多表现出无显著临床症状或类似普通感冒样症状, 少数可发展为肺炎[1]。但严重急性呼吸系统综合征冠状病毒(severe acute respiratory syndrome coronavirus, SARS-CoV)、中东呼吸综合征冠状病毒(Middle East respiratory syndrome coronavirus, MERS-CoV) 和2019新型冠状病毒(severe acute respiratory syndrome coronavirus 2, SARS-CoV-2) 的感染则可引起严重急性呼吸综合征, 其高致死率或高致病性使冠状病毒受到广泛关注[1]。
冠状病毒是带有包膜的单股正链RNA病毒, 属于巢(套式) 病毒目(Nidovirales) 冠状病毒科(Coronaviridae) 的冠状病毒属(Coronavirus)[1]。根据血清型和基因组特点, 冠状病毒亚科又分为α、β、γ和δ 4个属, 其中α和β属冠状病毒主要感染哺乳动物, γ属冠状病毒主要感染鸟类, 而δ属冠状病毒既可以感染鸟类也可以感染哺乳动物。目前可感染人类的冠状病毒有7种, 分别是人冠状病毒HCoV-229E、HCoV-OC43、HCoV-NL63和HCoV-HKU1, 以及SARS-CoV、MERS-CoV和SARS-CoV-2。其中HCoV-229E和HCoV-NL63为α属冠状病毒, HCoV-OC43、HCoV-HKU1、SARS-CoV、MERS-CoV和SARS-CoV-2则为β属冠状病毒[2]。到目前为止, 针对人冠状病毒的感染尚无特效治疗药物和疫苗, 而在SARS-CoV-2仍肆虐全球且在死亡率已达到2.3%的状况下, 临床上仍然采用传统的抗病毒药物结合其他支持治疗药物进行治疗[3], 因此研发具有抗冠状病毒活性的药物迫在眉睫[4]。
清肺排毒汤(Qing-Fei-Pai-Du decoction, QFPDD) 源自中医古籍《伤寒杂病论》, 主要由麻黄、炙甘草、杏仁和生石膏等21味中药组成, 涉及麻杏石甘汤、五苓散、小柴胡汤及射干麻黄汤4个经方[5-7]。在国家卫生健康委办公厅2020年3月3日印发的《新型冠状病毒肺炎诊疗方案(试行第七版)》中, QFPDD被列为临床治疗期推荐处方[8], 并取得了较好的治疗效果[9, 10]。
鉴于新型冠状病毒SARS-CoV-2需要在生物安全3级(biosafety level 3, BSL-3) 实验室进行相关操作, 而中药具有多靶点的特点, 作者认为QFPDD治疗新冠肺炎并不是特异性地作用于SARS-CoV-2, 而是极可能具有广谱抗冠状病毒活性[11, 12], 因此采用两株普通冠状病毒株展开研究。
本研究拟对QFPDD体外抗HCoV-229E和HCoV-OC43作用及其初步作用机制进行研究, 为其临床应用提供一定的理论依据。
材料和方法细胞和病毒 人肝癌细胞Huh7及人肝癌细胞Huh7.5由本所彭宗根研究员提供; 人大细胞肺癌细胞H460由本所王真研究员提供; THP1-Dual细胞购自InvivoGen公司; 人肝癌细胞C3A细胞和HCoV-229E病毒购自美国典型培养物保藏中心(American Type Culture Collection, ATCC) 公司; HCoV-OC43病毒由地坛医院赵学森副教授提供。Huh7、Huh7.5及H460细胞使用DMEM培养基; C3A细胞使用MEM培养基; THP1-Dual细胞使用1640培养基。所有细胞每隔2~3天进行传代。
实验试剂 细胞培养所用培养基、胎牛血清(fetal bovine serum, FBS)、青链霉素混合液(100×)、磷酸盐缓冲液(phosphate buffer saline, PBS, pH 7.2~7.4)、蛋白裂解液和蛋白酶抑制剂(Invitrogen公司); 细胞活性检测试剂(PrestoBlueTM Cell Viability Reagent, Thermo Fisher公司); qRT-PCR试剂盒(TransScript® Ⅱ Probe One-Step qRT-PCR SuperMix及TransScript® Ⅱ Green One-Step qRT-PCR SuperMix, TransGen Biotech公司); RNA提取试剂盒(RNeasy mini kit, QIAGEN公司); 冠状病毒NP (nucleocapsid) 抗体(Millipore公司)。
药物 实验所用QFPDD喷干粉由九州通医药集团股份有限公司提供(每克干粉相当于15 g总方的生药量, 批号为JZT-QFQFPDD-0318-PG-0321); 阳性对照药利巴韦林(ribavirin, RBV) 购自湖北天药药业股份有限公司(批号31712252)。
细胞毒测定(PrestoBlue法) Huh7、Huh7.5、H460及C3A细胞分别按照细胞数每孔2.5×104、2.5×104、2×104及3×104个接种到96孔培养板, 37 ℃培养过夜后, 用含2% FBS的DMEM培养基按浓度梯度稀释药物(每个浓度3个平行孔) 并加入到96孔培养板继续培养, 给药48 h后, 加入PrestoBlue进行细胞增殖率测定。
一步法实时荧光定量PCR检测 实验采用并参照TransGen Biotech公司荧光定量qRT-PCR试剂盒TransScript® Ⅱ Probe One-Step qRT-PCR SuperMix及TransScript® Ⅱ Green One-Step qRT-PCR SuperMix完成。qRT-PCR引物均由生工生物工程(上海) 股份有限公司合成(表 1)。
| Table 1 Primer sequences. GAPDH: Glyceraldehyde-3 phosphate dehydrogenase; NP: Nucleocapsid; IFN: Interferon; IFITM3: Interferon induced transmembrane protein 3; OAS1: 2'-5'-Oligoadenylate synthetase 1; PKR: Double strand RNA-activated protein kinase |
免疫荧光检测病毒双链RNA (double strand RNA, dsRNA) 及NP蛋白表达 Huh7及C3A细胞分别按照每毫升2.5×105及3×105个接种到96孔培养板, 每孔100 μL, 37 ℃培养过夜后分别感染HCoV-229E和HCoV-OC43, 感染同时加入梯度浓度QFPDD, 继续培养24 h后, 将培养板中处理好的细胞用PBS洗3次, 每次3 min。加入4%多聚甲醛室温孵育15 min固定爬片, 固定结束后PBS洗3次, 每次5 min。加入含0.5% Triton X-100的PBS室温孵育20 min透化细胞, 透化结束后PBS洗3次, 每次5 min。加入含1%牛血清白蛋白(bovine serum albumin, BSA) 的TBST室温封闭1 h。加入识别dsRNA或病毒NP蛋白的一抗室温孵育1 h或4 ℃孵育过夜。PBST洗3次, 每次5 min。加入荧光二抗, 室温避光孵育1 h, PBST洗3次, 每次5 min。加入Hoechst 33342室温孵育10~30 min, 封片并拍照。
时间进程分析 C3A细胞以每孔3×104个的数量接种到96孔培养板, 37 ℃过夜培养后, 病毒感染2 h, 并在感染后0~2 h、2~5 h、5~8 h及8~12 h 4个时段加入1 mg·mL-1 QFPDD, 药物处理时段结束后除去含药物的培养基, 替换为含2% FBS的MEM培养至24 h, 并采用qRT-PCR检测病毒RNA水平变化, 同时采用免疫荧光法检测病毒蛋白水平变化。
病毒吸附和穿入检测 ①病毒吸附检测: C3A细胞以每毫升3×105个的密度接种到3.5 cm培养皿中, 37 ℃过夜培养后于4 ℃放置1~2 h使细胞冷却, 感染病毒HCoV-OC43, 同时加药处理, 继续于4 ℃培养2 h后收细胞提取RNA, 通过qRT-PCR法检测细胞表面病毒载量变化; ②病毒穿入检测: C3A细胞以每毫升3×105个的密度接种到3.5 cm培养皿中, 37 ℃过夜培养后于4 ℃放置1~2 h使细胞冷却, 感染病毒HCoV-OC43并在4 ℃培养2 h, 弃病毒液, 加药35 ℃处理1 h后收细胞提取RNA, 通过qRT-PCR法检测胞内病毒载量。
药物诱导干扰素检测 THP1-Dual细胞稳定表达ISG54启动子与5个IFN刺激的应答元件, 并在其下游加入可诱导的分泌型luciferase报告基因, 因此luciferase表达变化即可表征胞内IRF (interferon regulatory factor) 通路的活化情况。THP1-Dual细胞按照每孔2×105个的数量接种到96孔板中, 同时加入终浓度为1 mg·mL-1 QFPDD, 培养48 h后检测荧光素酶表达变化。检测时取10 μL经过处理的细胞上清液与50 μL配制好的QUANTI-LucTM (将提供的干粉溶解于25 mL无菌水中) 检测试剂混合, 加入白色或黑色96孔培养板中, 通过酶标仪检测luciferase值。
统计学分析 应用GraphPad Prism软件进行实验数据分析, 实验结果以x±s形式表示, 多组数据间统计学检验通过单因素方差分析, 分别以“*”、“**”和“***”表示P < 0.05、P < 0.01及P < 0.001。
结果 1 QFPDD的细胞毒性评价在评价QFPDD的抗冠状病毒药效前, 首先采用PrestoBlue法检测了QFPDD对不同细胞的体外毒性。如图 1所示, 在浓度为2.22 mg·mL-1及以下时, QFPDD对肝癌细胞系Huh7、Huh7.5和C3A, 肺癌细胞系H460以及巨噬细胞THP-1均无显著毒性, 因此, 选择1 mg·mL-1及以下浓度的QFPDD进行后续药效评价和机制研究。
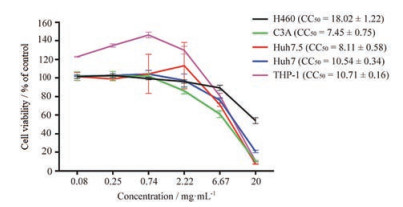
|
Figure 1 Cytotoxicity of Qing-Fei-Pai-Du decoction (QFPDD) determined by PrestoBlue cell viability assay. CC50: 50% cytotoxic concentration |
在体外药效检测中, 首先检测QFPDD对冠状病毒RNA水平的影响(图 2)。如图 2A、B所示, QFPDD在Huh7和Huh7.5细胞中均能剂量依赖性降低HCoV-229E的RNA水平, 而且QFPDD对HCoV-229E复制过程中dsRNA的产生同样具有抑制作用(图 2E)。如图 2C、D所示, QFPDD在H460和C3A细胞中同样能剂量依赖性降低HCoV-OC43的RNA水平, 而且QFPDD对HCoV-OC43复制过程中dsRNA的产生同样具有抑制作用(图 2F)。另外, 在体外实验中, RBV同样能够在RNA水平有效抑制冠状病毒。以上结果表明, QFPDD在体外水平具有很好的抑制冠状病毒RNA的作用。
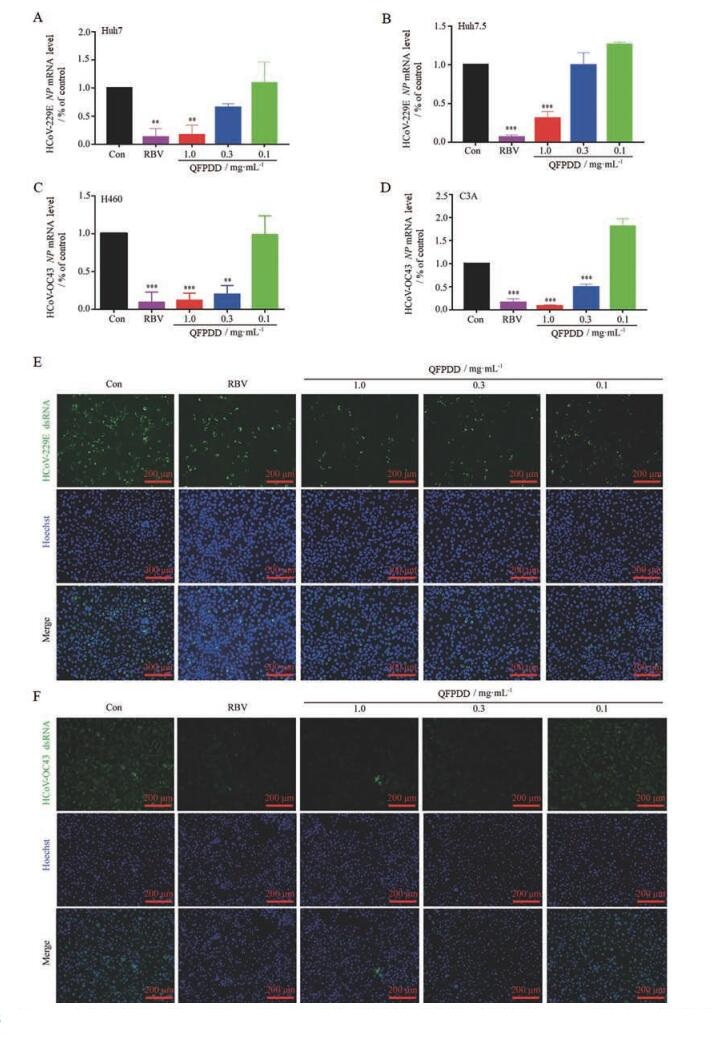
|
Figure 2 Decreased viral RNA level in multiple cell lines treated with QFPDD. Huh7 and Huh7.5 cells were infected with HCoV-229E, H460 and C3A cells were infected with HCoV-OC43, and cells were treated with indicated concentrations of QFPDD simultaneously and incubated for 24 h, 50 μg·mL-1 ribavirin (RBV) was used as control drug. Cells were lysed and RNA were extracted, intracellular viral RNA (NP) were determined by qRT-PCR assays in Huh7 (A), Huh7.5 (B), H460 (C), and C3A (D) cells. NP gene expression level were tested, 50 μg·mL-1 RBV was used as the control drug. Huh7 (E) and C3A (F) cells were fixed after viral infection and QFPDD treatment and intracellular viral double strand RNA (dsRNA) were detected with immunofluorescence (IF) assay. **P < 0.01, ***P < 0.001 vs control (Con) |
上述结果表明, QFPDD对冠状病毒RNA的复制具有较好抑制作用, 作者进一步检测了其在H460和C3A细胞中对冠状病毒的蛋白水平是否同样具有抑制作用。结果显示, QFPDD可以剂量依赖性抑制冠状病毒HCoV-OC43的NP蛋白水平, 且1 mg·mL-1的QFPDD对病毒蛋白的抑制作用与50 μg·mL-1 RBV相当(图 3)。
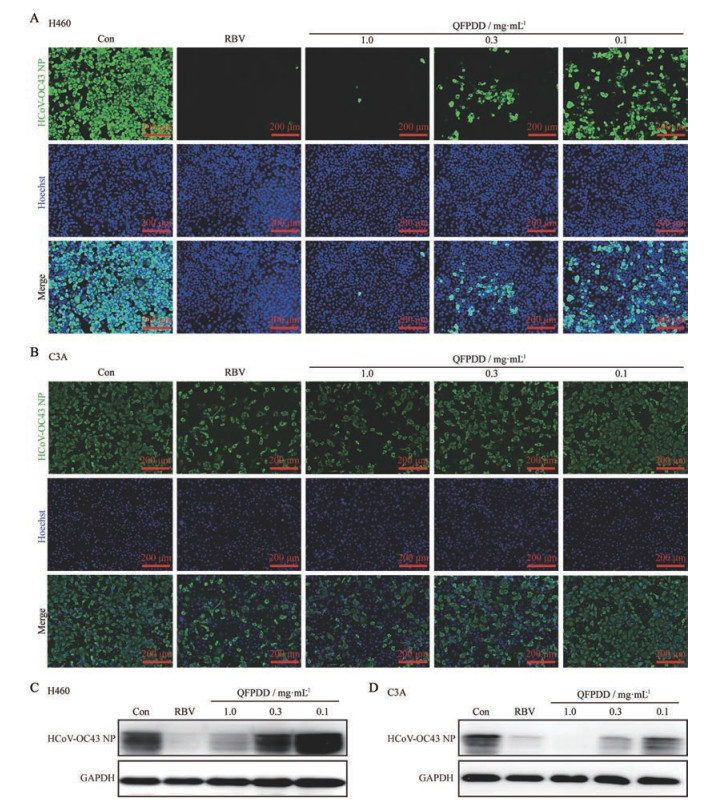
|
Figure 3 Decreased viral protein level in multiple cell lines treated with QFPDD. H460 (A and C) and C3A (B and D) cells were infected with HCoV-OC43 [multiplicity of infection (MOI) = 5] and treated with QFPDD immediately after the infection (50 μg·mL-1 RBV was used as control drug). After 24 h incubation, intracellular HCoV-OC43 NP protein level was determined by immunofluorescence staining (A and B) or Western blot (C and D) |
以上结果表明, QFPDD在多种细胞中对冠状病毒HCoV-229E和HCoV-OC43的复制具有抑制作用, 接着拟对其作用于病毒复制周期的阶段进行研究。通过在病毒感染后不同时间段内加入1 mg·mL-1 QFPDD, 发现QFPDD在冠状病毒感染的0~8 h内加药均有一定抗病毒作用, 且在感染最早期0~2 h加药的抗病毒作用最好(图 4)。以上结果提示, QFPDD作用于病毒复制的早期阶段。

|
Figure 4 Time-of-addition analysis of QFPDD antiviral activity against HCoV-OC43 in C3A cells. The cells were infected with HCoV-OC43 and treated with QFPDD during 4 different periods of time as showed in the upper panel. After 24 h, intracellular viral RNA level and protein level of NP were determined by qRT-PCR and IF assay, respectively. *P < 0.05, **P < 0.01, ***P < 0.001 vs control |
通过时间进程分析, 作者发现QFPDD作用于病毒复制的早期阶段, 特别是0~2 h加药时产生的抗病毒活性最强, 推测QFPDD可能作用于冠状病毒进入宿主细胞的过程, 因此, 对QFPDD对冠状病毒吸附和穿入过程的影响分别进行检测。如图 5所示, QFPDD对冠状病毒的穿入过程无影响, 但能够显著抑制病毒的吸附。
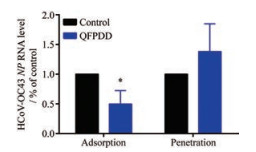
|
Figure 5 Influence of QFPDD on HCoV-OC43 adsorption and penetration to C3A cells. C3A cells were pre-chilled and infected with HCoV-OC43 at 4 ℃ for 2 h, then the cells were treated with 1 mg·mL-1 QFPDD either together with viral infection at 4 ℃ for 2 h (left) or after the infection at 35 ℃ for 1 h (right). Cells were lysed and RNA were extracted, viral RNA attached to cell surface (left) or entered in cell (right) were examined by qRT-PCR assay. *P < 0.05 vs control |
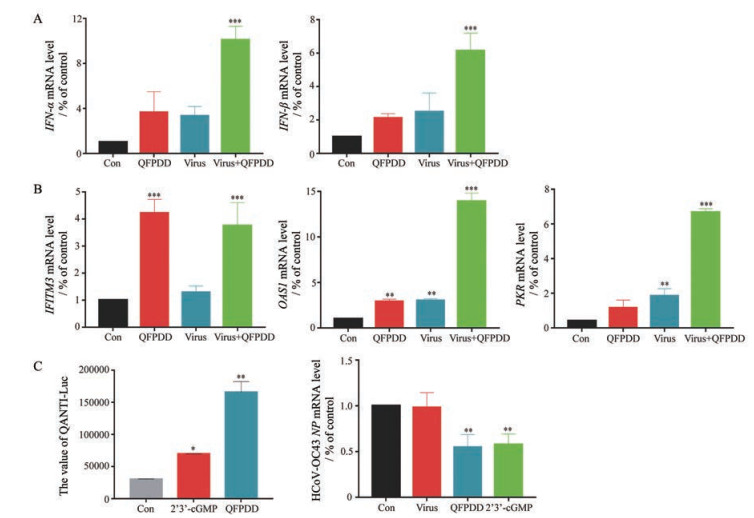
上述研究中, 在利用时间进程分析发现QFPDD能够通过多个步骤抑制冠状病毒的复制(特别是0~2 h给药时对冠状病毒的抑制作用最强) 的同时, 作者还发现QFPDD能够抑制冠状病毒的吸附, 实验结果表明, 1 mg·mL-1的QFPDD可以抑制50%的冠状病毒吸附, 而时间进程分析实验中, 在病毒感染后24 h收样时病毒大约经过两轮复制, 此时1 mg·mL-1 QFPDD可以抑制90%以上的冠状病毒NP蛋白的表达水平, 说明QFPDD抗冠状病毒的作用机制显然不仅止于抑制病毒吸附。作为一个组成复杂的中药方剂, 作者猜测QFPDD应该具有多靶点和多方向调节病毒复制的作用。结果显示(图 6), QFPDD能够激活IRF通路(图 6C, 左), 并在mRNA水平上调IFN-α和IFN-β (图 6A)。进一步研究发现, QFPDD能够显著上调干扰素诱导蛋白OAS1 (2'-5'-oligoadenylate synthetase 1)、PKR (dsRNA-activated protein kinase) 及IFITM3 (interferon induced transmembrane protein 3) 的mRNA水平(图 6B), 说明QFPDD能够上调干扰素及其诱导蛋白的表达。此外, 将QFPDD处理THP1-Dual细胞24 h后的细胞上清加入HCoV-OC43感染的H460细胞, 结果显示, HCoV-OC43的RNA水平被抑制(图 6C, 右), 表明QFPDD处理THP1-Dual后的细胞上清中可能具有抗病毒作用的干扰素, 进一步说明QFPDD可以通过增强干扰素等相关基因的表达发挥抗冠状病毒作用。
|
Figure 6 QFPDD induced IRF pathway activation and increased the mRNA levels of IFN genes as well as interferon stimulated genes (ISGs). A and B: THP1-Dual cells were infected with HCoV-OC43, and QFPDD was incubated with either infected or non-infected cells for 48 h. Cells were lysed and RNA were extracted. RNA expressional levels of IFN-α/β (A) and ISGs genes (B), including OAS1, PKR, and IFITM3, were tested by qRT-PCR; C: Left: THP1-Dual cells were incubated with 1 mg·mL-1 QFPDD for 48 h, and the trigger of IRF pathway was examined by quantification the secreted Lucia luciferase in the supernatants; Right: H460 cells infected with HCoV-OC43 were treated with the media harvested from QFPDD-treated THP1-Dual cells. After 48 h incubation, H460 cells were lysed and RNA were extracted, viral RNA (NP) expressional level was examined by qRT-PCR, IFN inducible drug 2'3'-cGMP was used as control. QANTI-LucTM is the detect reagent supplied with the cells. IRF: Interferon regulatory factor |
2019年12月以来, 新型冠状病毒逐步在全球肆虐, 给人民群众造成了不可估量的生命和财产损失。我国虽然较好地控制了SARS-CoV-2在全国范围的大流行, 但随着病例的增多, 一些地区可能很快会面临第二波病毒暴发流行的威胁。国内外专家预测, 新冠肺炎疫情可能会进入到常态化, 抗击新冠病毒将是一场持久战, 因此, 当务之急除了加快预防性疫苗的研发外, 抗病毒药物的研发是防控疫情和治疗新冠病毒感染的重要手段。然而, 到目前为止针对人冠状病毒感染尚无特效治疗药物和疫苗[13]。
普通冠状病毒的感染一般具有自限性, 无需特殊治疗。而SARS-CoV和MERS-CoV的临床治疗则以抗病毒药物利巴韦林、干扰素和糖皮质激素联合用药为主。目前SARS-CoV-2仍在全球肆虐, 其死亡率达到2.3%, 但临床上仍然以抗病毒药物、干扰素和其他支持治疗药物为主进行治疗[13]。新冠肺炎疫情暴发后, 国内外首先开展的工作就是从临床治疗药物中寻找具有抗新型冠状病毒的药物用于应急防控(“老药新用”), 如蛋白酶抑制剂(克立芝和卡莫司他)、RNA聚合酶抑制剂(利巴韦林、法匹那韦和瑞德西韦)、病毒进入抑制剂(氯喹和羟氯喹) 等[4, 14, 15]。虽然部分药物(如瑞德西韦) 在临床治疗中能够起到一定的治疗效果, 但是其疗效和潜在的不良反应仍使这些药物的临床使用极具争议[16, 17]。
在应对新冠肺炎的治疗中, 中国的传统中医药发挥了重要作用[5, 18]。在《新型冠状病毒肺炎诊疗方案(试行第七版)》中, QFPDD被列为临床治疗期推荐处方[8], 并取得了较好的治疗效果。中国传统医学研究认为新型冠状病毒引起的肺炎属于一种“寒湿疫”[19, 20], 而QFPDD可通过多味中药共同作用, 多管齐下治疗新冠肺炎, 实现宣肺止咳、清热化湿和解毒祛邪的功效[5, 6]。但是, 虽然在临床治疗中已经观察到较好的疗效, 由于QFPDD组成的复杂性, 对于其发挥抗病毒活性的具体机制并不明确, 阻碍其临床应用及国际化推广。因此, 本文主要研究了QFPDD的抗冠状病毒作用及初步机制。另外, 由于新冠肺炎病毒(SARS-CoV-2) 需要在BSL-3实验室进行操作, 因此本研究采用可感染人的冠状病毒HCoV-229E和HCoV-OC43, 对QFPDD的药效及作用机制进行了初步研究。
首先, 在抗病毒药效方面, 作者从多个角度证明QFPDD具有较好的体外抗冠状病毒活性。其次, 在作用机制方面, 通过时间点实验发现QFPDD主要作用于病毒感染的早期阶段。进一步的研究发现, QFPDD可抑制HCoV-OC43在C3A细胞表面的吸附, QFPDD是否是通过影响冠状病毒表面的S蛋白与细胞表面受体的结合来抑制冠状病毒的侵入尚需进一步验证。作为一个组成复杂的中药方剂, 作者猜测QFPDD应该具有多靶点和多方向的调节病毒复制的作用。干扰素所介导的先天免疫反应是宿主细胞抵御病毒感染的第一道防线[21]。在病毒感染初期, 宿主病原模式识别受体(pattern recognition receptor system, PRRs) 识别病原相关分子模式(pathogen associated molecular pattern, PAMP) 并产生干扰素, 例如I型干扰素IFNα/β等, 而新生成的干扰素则进一步上调干扰素刺激基因(ISGs) 的转录, 使机体释放更多抗病毒效应分子, 这一级联反应将使被感染细胞及其邻近细胞迅速进入抗病毒状态, 减缓病毒感染进程[22, 23]。本研究发现, QFPDD诱导细胞内IFN-α/β mRNA表达上调, 同时也诱导ISGs (OAS1、PKR及IFITM3) 的表达, 说明QFPDD可多通路激活宿主先天免疫反应发挥抗病毒作用。
综上所述, 本研究证明QFPDD具有较好的体外抗冠状病毒活性并初步阐明了其作用机制, 但由于QFPDD组分的复杂性, 本研究还需对不同组分或经方进行单独研究以明确QFPDD各组分的功能及作用机制差异。
作者贡献: 王琨是负责实验设计、部分实验及论文初稿撰写; 颜海燕和吴硕负责部分实验; 王辉强负责文献调研及数据整理; 李玉环和蒋建东为本文通讯作者, 负责实验设计和稿件修改等工作。
利益冲突: 本文所有作者均声明不存在利益冲突关系。
| [1] |
Cui J, Li F, Shi ZL. Origin and evolution of pathogenic coronaviruses[J]. Nat Rev Microbiol, 2019, 17: 181-192. DOI:10.1038/s41579-018-0118-9 |
| [2] |
Coronaviridae Study Group of the International Committee on Taxonomy of Viruses. The species severe acute respiratory syndrome-related coronavirus: classifying 2019-nCoV and naming it SARS-CoV-2[J]. Nat Microbiol, 2020, 5: 536-544. DOI:10.1038/s41564-020-0695-z |
| [3] |
Shereen MA, Khan S, Kazmi A, et al. COVID-19 infection: origin, transmission, and characteristics of human coronaviruses[J]. J Adv Res, 2020, 24: 91-98. DOI:10.1016/j.jare.2020.03.005 |
| [4] |
Yang L, Wang HQ, Li YH. Research progress on therapeutic drugs for corona virus disease 2019[J]. Acta Pharm Sin (药学学报), 2020, 55: 1081-1090. |
| [5] |
He QH, Liu YK, Sun XR, et al. Chinese medicine to novel coronavirus pneumonia sword--the meaning and role of Qing-Fei-Pai-Du decoction issued by the State Administration of traditional Chinese Medicine[J/OL]. J Tradit Chin Med (中医杂志), 2020. http://kns.cnki.net/kcms/detail/11.2166.R.20200224.1038. 008.html.
|
| [6] |
Mao J, Lu TL. Discussion on COVID-19 treated by Qing Fei Pai Du Tang from theory of traditional Chinese medicine[J]. J Pract Tradit Chin Int Med (实用中医内科杂志), 2020, 34: 1-4. |
| [7] |
Yang R, Liu H, Bai C, et al. Chemical composition and pharmacological mechanism of Qingfei Paidu Decoction and Ma Xing Shi Gan Decoction against Coronavirus Disease 2019(COVID-19): in silico and experimental study[J]. Pharmacol Res, 2020, 157: 104820. DOI:10.1016/j.phrs.2020.104820 |
| [8] |
National Health Commission. Novel coronavirus pneumonia diagnosis and treatment plan (Trial Version 7) (新型冠状病毒肺炎诊疗方案(试行第七版))[S/OL]. 2020-3-3. http://www.nhc.gov.cn/yzygj/s7653p/202003/46c9294a7dfe4cef80dc7f5912eb1989.shtml.
|
| [9] |
Xin S, Cheng X, Zhu B, et al. Clinical retrospective study on the efficacy of Qingfei Paidu decoction combined with Western medicine for COVID-19 treatment[J]. Biomed Pharmacother, 2020, 129: 110500. DOI:10.1016/j.biopha.2020.110500 |
| [10] |
Lu ZZ, Lu XS. Qingfei Paidu decoction demonstrates the anti-epidemic effects and self-confidence of traditional Chinese medicine[J]. J Tradit Chin Med (中医杂志), 2020, 61: 833-834. |
| [11] |
Wu H, Wang JQ, Yang YW, et al. Preliminary exploration of the mechanism of Qingfei Paidu decoction against novel coronavirus pneumonia based on network pharmacology and molecular docking technology[J]. Acta Pharm Sin (药学学报), 2020, 55: 374-383. |
| [12] |
Zhao J, Tian SS, Yang J, et al. Investigating mechanism of Qing-Fei-Pai-Du-Tang for treatment of COVID-19 by network pharmacology[J]. Chin Tradit Herb Drugs (中草药), 2020, 51: 829-835. |
| [13] |
Abd El-Aziz TM, Stockand JD. Recent progress and challenges in drug development against COVID-19 coronavirus (SARS-CoV-2)-an update on the status[J]. Infect Genet Evol, 2020, 83: 104327. DOI:10.1016/j.meegid.2020.104327 |
| [14] |
Zhang C, Chen SB, Zhang J, et al. Analysis of chemical drugs applied for clinical trial for the treatment of COVID-19[J]. Acta Pharm Sin (药学学报), 2020, 55: 355-365. |
| [15] |
Wang HR, Wang X. Advances in research of novel coronavirus related drugs and biological products[J]. Acta Pharm Sin (药学学报), 2020, 55: 349-354. |
| [16] |
Wang Y, Zhang D, Du G, et al. Remdesivir in adults with severe COVID-19:a randomised, double-blind, placebo-controlled, multicentre trial[J]. Lancet, 2020, 395: 1569-1578. DOI:10.1016/S0140-6736(20)31022-9 |
| [17] |
Beigel JH, Tomashek KM, Dodd LE, et al. Remdesivir for the treatment of Covid-19-final report[J]. N Engl J Med, 2020, 383: 1813-1826. DOI:10.1056/NEJMoa2007764 |
| [18] |
Yang Y, Islam MS, Wang J, et al. Traditional Chinese medicine in the treatment of patients infected with 2019-new coronavirus (SARS-CoV-2): a review and perspective[J]. Int J Biol Sci, 2020, 16: 1708-1717. DOI:10.7150/ijbs.45538 |
| [19] |
Fan YP, Wang YP, Zhang HM, et al. Analysis on the treatment of new coronavirus pneumonia (COVID-19) from the cold epidemic treatment[J]. J Tradit Chin Med (中医杂志), 2020, 61: 369-374. |
| [20] |
Tong XL, Li XY, Zhao LH, et al. Discussion on traditional Chinese medicine prevention and treatment strategies of coronavirus disease 2019(COVID-19) from the perspective of "cold-dampness pestilence"[J]. J Tradit Chin Med (中医杂志), 2020, 61: 465-470, 553. |
| [21] |
Schoggins JW, Wilson SJ, Panis M, et al. A diverse range of gene products are effectors of the type Ⅰ interferon antiviral response[J]. Nature, 2011, 472: 481-485. DOI:10.1038/nature09907 |
| [22] |
Ivashkiv LB, Donlin LT. Regulation of type Ⅰ interferon responses[J]. Nat Rev Immunol, 2014, 14: 36-49. DOI:10.1038/nri3581 |
| [23] |
Schneider WM, Chevillotte MD, Rice CM. Interferon-stimulated genes: a complex web of host defenses[J]. Annu Rev Immunol, 2014, 32: 513-545. DOI:10.1146/annurev-immunol-032713-120231 |
 2021, Vol. 56
2021, Vol. 56


