2. 江苏省中医药研究院, 江苏 南京 210028
2. Jiangsu Academy of Traditional Chinese Medicine, Nanjing 210028, China
国际糖尿病联盟2019年统计数据显示[1], 中国糖尿病患者人数已高达1.164亿, 糖尿病及其导致的各类并发症已成为威胁公众健康的重大社会问题。抑郁症状影响着约30%的糖尿病患者, 不仅降低患者生活质量, 且共病状态导致患者临床结局变差, 糖尿病合并抑郁症患者与非抑郁糖尿病患者相比, 慢性肾病、心血管疾病风险及死亡率都显著上升[2]。大量证据表明糖尿病和抑郁症之间存在互相高诱发的双向联系[3], 针对二者共病的治疗, 目前主要针对抑郁症采用心理疗法或抗抑郁药, 而糖尿病则进行常规治疗[4], 缺乏一种药物在帮助患者控制血糖的同时, 改善其抑郁症状。
葛根作为传统中药用于糖尿病的治疗, 效果明显, 治疗预后良好。作者前期研究报道了葛根活性成分葛根素降糖作用的新机制[5], 发现葛根素能够上调胰岛β细胞胰高血糖素样肽-1受体(glucagon-like peptide-1 receptor, GLP-1R) 的表达, 进而增强GLP-1R通路激活, 实现保护胰岛β细胞, 促进胰岛素分泌, 降低糖尿病小鼠血糖的作用。此外, GLP-1R在脑部也有广泛表达, 包括海马体[6], 其GLP-1信号的激活不仅涉及能量代谢与食物摄入, 还能增强γ-氨基丁酸信号转导, 调节海马体功能[7], 也能促进神经元分化、增殖和长时程增强, 保护神经[8]。实验结果显示, 葛根和山楂果实合用能激活前额叶皮层中细胞外信号调节蛋白激酶(extracellular regulated protein kinases, ERK), 上调脑源性神经营养因子(brain-derived neurotrophic factor, BDNF), 改善糖尿病大鼠抑郁行为[9]。环磷腺苷效应元件结合蛋白(cAMP-response element binding protein, CREB) 是ERK的下游靶标, 海马体中二者磷酸化水平降低参与抑郁的发生, 且磷酸化水平下调可被抗抑郁药逆转[10]。雷帕霉素靶蛋白(mammalian target of rapamycin, mTOR) 的激活可增强BDNF释放, 间接调节神经发生和树突棘生长, 并起到抗抑郁作用[11]。β-Catenin与重度抑郁症有关, 增加慢性社交衰竭应激小鼠的β-catenin水平可逆转抑郁样行为[12]。
近年临床研究表明, 葛根及其复方制剂抗抑郁作用疗效肯定, 广泛用于脑卒中后抑郁、心血管病合并抑郁等的治疗[13], 但葛根素是否能够改善2型糖尿病导致的抑郁症状, 及其可能的调控机制尚不明确。高脂饲料(high-fat diet, HFD) 喂养诱导的HFD肥胖糖尿病小鼠模型是常用的2型糖尿病动物模型, 近年多项研究也报道HFD小鼠模型出现抑郁样表型[14, 15]。本研究将采用HFD小鼠模型, 综合评价葛根素对2型糖尿病导致的抑郁症状的疗效, 并对其作用机制进行初步探讨。
材料与方法试剂 高脂实验饲料(斯莱康上海普路腾生物科技有限公司); 葛根素(纯度 > 98%, 上海阿拉丁试剂公司); 盐酸氟西汀(常州四药制药有限公司); 高糖DMEM培养基、胎牛血清、胰酶和链霉素-青霉素双抗(Gibco公司); 葡萄糖、PVDF (polyvinylidene fluoride)膜和羧甲基纤维素钠(CMC-Na) (美国Sigma-Aldrich公司); 0.9%氯化钠注射液(安徽丰原药业); 小鼠白介素(interleukin, IL)-1β和IL-6 ELISA (enzyme-linked immunosorbent assay) 试剂盒(Neobioscience生物科技公司); 小鼠皮质酮(corticosterone, CORT) ELISA试剂盒(美国Cayman公司); 小鼠5-羟色胺(5-hydroxytryptamine, 5-HT) ELISA试剂盒(南京建成生物工程研究所); TUNEL (terminal deoxynucleotidyl transferase-mediated dUTP nick-end labeling) 亮红细胞凋亡检测试剂盒A113 (南京诺唯赞公司); 皮质酮、蛋白酶抑制剂与磷酸酶抑制剂(Med Chem Express公司); RIPA (radio-immunoprecipitation assay) 强裂解液和BCA (bicinchoninic acid) 蛋白定量试剂盒(碧云天生物技术有限公司); ECL (electrochemiluminescence) 化学发光显色液(南京诺唯赞公司); β-actin抗体、p-CREB抗体、CREB抗体、p-ERK抗体、ERK抗体、BDNF抗体和p-β-catenin抗体(Bioworld公司); cleaved caspase-3 (c-casp3) 抗体和p-mTOR抗体(Cell Signaling公司); GLP-1R抗体(Abcam公司); 血糖仪试纸(德国罗氏公司)。
仪器 Milli-Q型纯水机(美国Millipore公司); 冷冻离心机(Thermo Fisher Scientific公司); ACCU-CHEK血糖仪(德国罗氏公司); 动物行为学实验箱及动物行为视频分析系统(上海吉量软件科技有限公司); 垂直摇床(江苏新康公司); 酶标仪(Molecular Devices公司); 奥林帕斯IX73倒置荧光显微镜(奥林帕斯公司); Western blot凝胶电泳转膜系统(美国Bio-Rad公司); 化学发光凝胶成像系统(上海天能公司)。
实验动物 4周龄正常雄性C57BL/6J小鼠, 购自上海斯莱克实验动物有限责任公司, 合格证号SCXK (沪) 2017-0005。小鼠饲养于南京中医药大学附属中西医结合医院SPF级动物中心, 动物实验获得南京中医药大学附属中西医结合医院动物伦理委员会批准(批准号AEWC-025)。
动物模型建立与分组给药 所有小鼠适应性喂养1周, 小鼠分笼饲养, 每笼3~5只, 分对照组和模型组, 对照组给予正常饮食, 模型组给予高脂饲料, 保证饮食充足和正常昼夜交替。喂养24周后, 进行空腹血糖检测和行为学实验, 若小鼠空腹血糖大于8 mmol·L-1, 则认为糖尿病模型造模成功。随后将造模成功小鼠随机分组, 每组8只, 灌胃给药, 每日1次。葛根素给药组按150 mg·kg-1·day-1灌胃给药, 盐酸氟西汀给药组按15 mg·kg-1·day-1灌胃给药, 同时对照组与模型组给予生理盐水灌胃。连续给药6周, 葛根素给药剂量参考文献[16]。给药最后1周进行行为学实验测试分析, 空腹血糖检测和口服糖耐受实验, 并分离血清和组织, -80 ℃保存。
空腹血糖检测 小鼠禁食后(夜晚20点至次日8点, 共12 h), 尾末端切小口取血, 使用ACCU-CHEK血糖仪检测小鼠血糖值。
口服糖耐受实验(oral glucose tolerance test, OGTT) 小鼠禁食后(夜晚20点至次日8点, 共12 h), 以2毫克葡萄糖每克小鼠体重灌胃葡萄糖溶液, 小鼠尾末端切小口取血, 使用ACCU-CHEK血糖仪检测0 min血糖值和灌胃后的30、60、90、120 min的小鼠血糖值。
糖水偏好实验(sucrose preference test, SPT) 配制2%的蔗糖水作为糖水供实验动物饮用。第1天, 放置对等的两瓶糖水训练24 h; 第2天, 将其中一瓶糖水替换成洁净清水训练24 h; 第3天, 禁水禁食6 h后, 洁净清水和糖水称重记录, 让对象可以自由选择饮用洁净清水和糖水1 h, 之后称重求出洁净清水和糖水的消耗量, 计算糖水饮用质量占总饮水量的百分比。
悬尾实验(tail suspension test, TST) 将小鼠尾部后1/3处用胶带固定, 悬挂于支架上, 头部距离台面15 cm, 进行摄像, 摄像背景与小鼠毛色呈明显反差, 黑色小鼠采用白色背景。计时6 min后停止, 利用动物行为学分析软件对小鼠后4 min (3~6 min) 的不动时间进行统计。悬尾实验不存在时辰效应, 即一天当中不同时间进行实验, 结果是一致的。微机记录的不动时间应该与人实际观察到的情况进行不动阈值的校正。最后, 用动物行为学分析软件分析小鼠不动和挣扎时间。
ELISA 小鼠摘眼球取血, 室温静置1 h待血清析出, 随后室温3 000 r·min-1离心15 min, 取上层血清分装, -80 ℃保存备用。参照检测试剂盒说明书取各组小鼠血清样品进行检测, 操作按试剂盒的说明进行。
Western blot 取小鼠海马体组织冰上融化, 剪去60~70 mg组织, 记录质量。按组织质量∶裂解液体积= 1 g∶6 mL, 酶抑制剂∶裂解液= 1∶100配制裂解液总管, 向各管加入200 μL的裂解液, 用电动研磨棒研磨匀浆, 之后按照由组织质量计算的所需裂解液体积量补加剩余的裂解液。置于4 ℃冰箱30 min。温度4 ℃, 转速12 000 r·min-1离心30 min, 取上清转移至预冷的新管。-20 ℃冰箱保存待用。取出-20 ℃蛋白样品在冰上融化, 进行SDS-PAGE (sodium dodecyl sulfate polyacrylamide gel electrophoresis) 电泳及转膜。PVDF膜用含有5%脱脂奶粉的TBST (Tris buffered saline Tween20) 溶液室温封闭2 h, 加入稀释后的相应抗体, 4 ℃孵育过夜。TBST洗涤3次, 每次6 min, 加入辣根过氧化物酶标记的二抗(1∶4 000稀释), 室温孵育1 h, TBST洗涤3次, 滴加ECL化学发光显色, 天能化学发光凝胶成像系统采集图像并进行分析。
小鼠海马神经元细胞(HT22) 形态观察实验和细胞凋亡检测 HT22细胞按照每毫升1×105密度接种到24孔板, 过夜后细胞贴壁生长, 细胞密度70%时, 模型组采用葡萄糖(150 mmol·L-1) 和皮质酮(200 μmol·L-1) 给药[17], 模拟糖尿病合并抑郁环境。同步葛根素分别给药50和100 μmol·L-1。给药24 h, 可见光下观察采集细胞形态图片。随后采用诺唯赞TUNEL试剂盒进行细胞凋亡检测, 奥林帕斯IX73倒置荧光显微镜观察拍照。细胞凋亡检测按TUNEL试剂盒的说明进行。
统计学分析 数据用x±s表示, 采用SPSS 21.0统计软件进行t检验和单因素方差分析。柱形图绘制采用GraphPad 8.0软件进行分析制作。
结果 1 葛根素有效改善HFD小鼠糖尿病症状HFD小鼠(HFD) 空腹血糖值明显升高, 与对照组(con) 小鼠存在显著性差异(图 1A, P < 0.05), 而葛根素给药组(HDF/pue) 小鼠空腹血糖值降低, 虽未达到对照组水平, 但与HFD差异具有统计学意义(P < 0.05), 氟西汀给药组(HFD/flu) 空腹血糖值相比HFD仍处于高位, 未得到改善。OGTT结果(图 1B) 显示HFD小鼠各时间点血糖值高, 且降糖趋势缓慢, 而HFD/pue相比HFD各时间段血糖值低且下降趋势大, 曲线下面积(area under curve, AUC) 小。HFD/flu虽然在30~90 min存在一定血糖下降, 但初始段和末端与HFD无异, 氟西汀总体上无改善血糖效果。
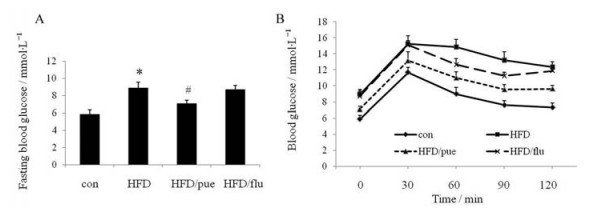
|
Figure 1 The effects of puerarin on fasting blood glucose (FBG) of mice (A) and the results of oral glucose tolerance test (OGTT) of each group (B). con: Control; HFD: High-fat diet; HFD/pue: HFD mice treated by puerarin; HFD/flu: HFD mice treated by fluoxetine hydrochloride. n = 6, x±s. *P < 0.05 vs con; #P < 0.05 vs HFD |
对各组小鼠进行悬尾实验(图 2A) 和糖水偏好检测(图 2B), 悬尾实验显示, HFD相比con不动时间更长(P < 0.05), 而HFD/pue和HFD/flu两组则相较于HFD, 不动时间明显缩短(P < 0.05), 并且两组不动时间水平相当, 提示葛根素治疗缓解了HFD小鼠的行为绝望状态。糖水偏好实验中, HFD对糖水偏好程度明显下降(P < 0.05), 而相较于HFD, HFD/pue糖水偏好增加(P < 0.05), HFD/flu则进一步显著增加(P < 0.05), 结果表明葛根素治疗有恢复快感缺失的作用。TST和SPT均显示葛根素具有治疗抑郁的效果。

|
Figure 2 The effects of puerarin on the immobility time of mice in tail suspension test (TST) (A) and the proportion of sucrose preference of mice in sucrose preference test (SPT) (B). n = 6, x±s. *P < 0.05 vs con; #P < 0.05 vs HFD |
5-HT的一个关键功能是调节焦虑和压力, 作为产生愉悦情绪的信使, 5-HT的降低与抑郁有着直接关系[18]。而在本研究检测中(图 3A), HFD小鼠5-HT明显较con低(P < 0.05), 这可能是HFD的抑郁症状在内分泌中的一种表现。而治疗组中, HFD/pue和HFD/flu的5-HT水平相较HFD均明显上调(P < 0.05)。在皮质酮检测结果(图 3B) 中HFD的皮质酮水平升高(P < 0.05), 而高水平皮质酮会降低胰岛素敏感性, 诱导抑郁样行为[19], 这与之前的行为学结果相对应。HFD小鼠给予葛根素治疗后, 其皮质酮水平明显降低(P < 0.05), HFD/flu则没有这种效果, 这表明葛根素可降低皮质酮水平从而缓解糖尿病代谢压力引发的抑郁症状, 而氟西汀作为一种5-HT重摄取抑制剂, 不具备改善代谢压力下血清中过高皮质酮的功能, 提示葛根素在改善糖尿病诱发的抑郁相关表型中具有一定优势。
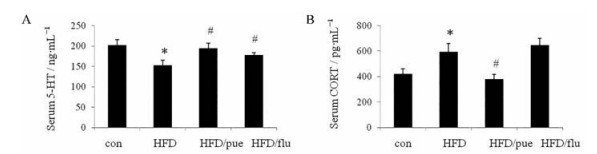
|
Figure 3 The effects of puerarin on concentration of 5-hydroxytryptamine (5-HT) in the serum of mice (A) and the concentration of corticosterone (CORT) in the serum of mice (B). n = 6, x±s. *P < 0.05 vs con; #P < 0.05 vs HFD |
糖尿病涉及慢性炎症, 表现为活性氧的产生、促炎细胞因子的表达和其他炎症介质的激活和表达[20], 而炎症又会引发一定的神经损伤。IL-1β是糖尿病环境下主要的促炎细胞因子之一, 可造成胰岛β细胞功能受损、胰岛素抵抗及神经细胞损害等不良后果。IL-6是急性期反应的有效诱导剂, 而作为一种炎症标志物, 在没有炎症的情况下也会影响多种生理过程[21]。如IL-6参与了中枢神经系统与瘦素类似的信号传导机制[22], 且抑郁症总伴随更高的IL-6, 而非IL-1β的必然升高[23]。在本研究中, HFD小鼠血清中IL-1β和IL-6水平明显升高(图 4, P < 0.05)。其中葛根素给药后IL-1β显著下降(P < 0.05), IL-6下降但无显著差异; 氟西汀给药后IL-6下降明显(P < 0.05), 但IL-1β无差异。这可能是由于氟西汀的作用主要集中于中枢神经, 因而下调了参与中枢神经信号转导的IL-6, 而对IL-1β影响较小。而葛根素具有抗炎作用并能抑制炎症反应[24], 可缓解脂多糖诱导的疾病[25, 26], 因此葛根素对IL-1β下调具有显著差异。

|
Figure 4 The effects of puerarin on interleukin (IL)-1β concentration in the serum of mice (A) and IL-6 concentration in the serum of mice (B). n = 6, x±s. *P < 0.05 vs con; #P < 0.05 vs HFD |
对con、HFD和HFD/pue三组小鼠的大脑海马体进行相关蛋白的检测(图 5)。其中HFD小鼠海马体GLP-1R信号通路的上游GLP-1R表达降低(P < 0.05), 而信号传导途径中ERK和CREB的磷酸化水平显著降低, 后续的BDNF表达也显著降低(P < 0.01), 而BDNF有营养神经、增加突触可塑性和神经发生的作用, 其表达减少是HFD小鼠神经损害的表现。HFD/pue组中, 这种情况得到明显改善, ERK和CREB磷酸化水平升高, 这对神经细胞的存活至关重要, 另外BDNF (P < 0.05)也显著升高, 并且接近达到con水平, 表明葛根素可调控海马体神经中GLP-1R信号通路, 保护神经细胞。文献报道[27, 28], GLP-1R通路可激活β-catenin与mTOR, 其与海马神经可塑性及抑郁症也密切相关, 因此也对其进行了检测。HFD/pue组中p-mTOR较HFD升高, Wnt信号中关键蛋白p-β-catenin同样如此变化, 表明葛根素可通过激活GLP-1R通路, 进一步激活β-catenin与mTOR。此外, HFD/pue还有效降低HFD引起的c-casp3水平上调, 提示葛根素对海马神经元凋亡存在一定的抑制作用。
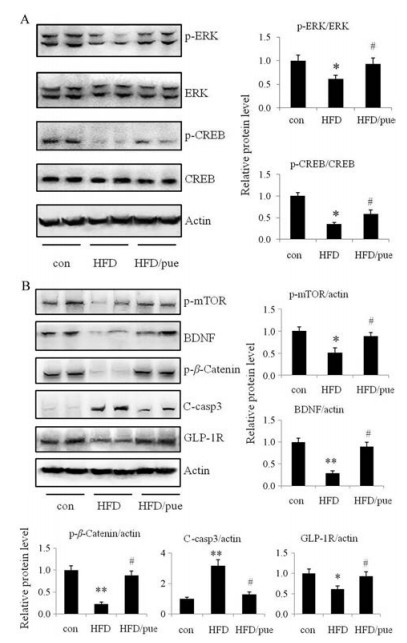
|
Figure 5 The expression of extracellular regulated protein kinases (ERK)/cAMP-response element binding protein (CREB) in the hippocampus of mice (A) and the expression of phospho-mammalian target of rapamycin (p-mTOR)/brain-derived neurotrophic factor (BDNF)/phospho-β-catenin (p-β-catenin)/cleaved caspase-3 (c-casp3)/glucagon-like peptide-1 receptor (GLP-1R) in the hippocampus of mice (B). n = 4, x±s. *P < 0.05, **P < 0.01 vs con; #P < 0.05 vs HFD |
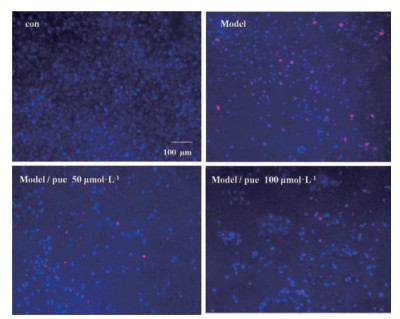
进一步采用小鼠海马神经元细胞系HT22细胞, 采用高糖联合皮质酮给药模拟糖尿病合并抑郁环境, 考察在模拟糖尿病合并抑郁环境下, 葛根素对海马神经元细胞形态与生存的影响。如图 6细胞形态观察结果所示, 对照组HT22细胞光泽度好, 突起交错分布且相互连接, 有较为明显的突起相连形态, 而高糖与皮质酮处理后, 细胞光泽较差且突起连接部分断裂消失, 可观察到细胞变圆皱缩现象。葛根素给药后, 细胞的形态得到有效改善, 突起间连接更紧密。而凋亡TUNEL染色实验结果如图 7, 蓝色为DAPI (4', 6-diamidino-2-phenylindole) 染色的细胞核, 红色为TUNEL染色阳性。可以观察到, 高糖与皮质酮处理后, 红色荧光显著增多, 表明凋亡阳性细胞增加, 而葛根素能够有效降低TUNEL阳性细胞比例, 提示葛根素能够抑制高糖与皮质酮环境下海马神经元细胞凋亡, 保护海马神经元细胞的生存。
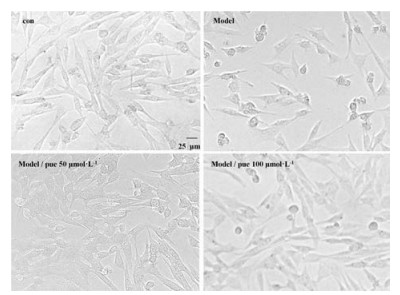
|
Figure 6 Morphology of HT22 in each group after administration by the inverted microscope. con: Control; Model: Glucose 150 mmol·L-1 + CORT 200 μmol·L-1; Model/pue 50 μmol·L-1: Treated by puerarin 50 μmol·L-1 after treated with glucose 150 mmol·L-1 and CORT 200 μmol·L-1; Model/pue 100 μmol·L-1: Treated by puerarin 100 μmol·L-1 after treated with glucose 150 mmol·L-1 and CORT 200 μmol·L-1 |
|
Figure 7 Terminal deoxynucleotidyl transferase-mediated dUTP nick-end labeling (TUNEL) staining chart of HT22 about apoptosis in each group after administration. 4', 6-Diamidino-2-phenylindole (DAPI): Blue; TUNEL: Red. con: Control; Model: Glucose 150 mmol·L-1 + CORT 200 μmol·L-1; Model/pue 50 μmol·L-1: Treated by puerarin 50 μmol·L-1 after treated with glucose 150 mmol·L-1 and CORT 200 μmol·L-1; Model/pue 100 μmol·L-1: Treated by puerarin 100 μmol·L-1 after treated with glucose 150 mmol·L-1 and CORT 200 μmol·L-1 |
糖尿病并发抑郁是糖尿病患者在长期的代谢压力下产生的一种继发并发症, 其产生原因涉及胰岛素等激素代谢异常[29]、氧化应激和炎症[20]、线粒体功能障碍[30]、非酶糖基化[31]以及神经发生减少[32]。因此, 糖尿病抑郁病因复杂, 临床治疗困难, 而中医药在治疗抑郁中的临床价值正得到越来越多的关注[33]。为了解HFD诱导的糖尿病小鼠的抑郁症状, 作者对小鼠采用长期HFD造模, 并在此基础上探究小鼠的抑郁症状。实验结果表明, 长期HFD小鼠出现抑郁表型, 而葛根素能够改善高脂诱导的糖尿病合并抑郁症状, 抗抑郁药氟西汀对HFD小鼠糖尿病指标无作用, 提示葛根素在治疗此类并发症方面具有一定的独特优势。
空腹血糖和口服糖耐受实验显示长期HFD小鼠出现明显的糖尿病表现, 即2型糖尿病相关的空腹血糖显著升高, 口服葡萄糖清除能力减弱。同时, 悬尾实验结果表明, HFD小鼠在压力状态下, 不动时间更长, 求生欲减弱, 有一定行为绝望。糖水偏好实验结果表明, 小鼠对糖的喜好减弱, 快感缺失。而葛根素给药后, 小鼠空腹血糖明显降低且OGTT曲线下面积减小, 这符合葛根素治疗糖尿病的预期。令人意外的是, 葛根素组小鼠在各项行为学实验中评分增加, 相比传统的抗抑郁药氟西汀, 其对糖尿病并发抑郁症此类共病的综合疗效值得关注。
在葛根素确切疗效的基础上, 考虑到葛根素抗炎作用[34], 作者检测了各组小鼠血清中IL-6和IL-1β水平, 结果显示, 模型组小鼠两种炎症因子均显著升高, 这与糖尿病通过炎症引发神经损伤密切相关。而葛根素给药后, IL-1β显著下调, 提示葛根素可通过抗炎介导糖尿病并发抑郁症的治疗。另外HFD小鼠血清中5-HT水平降低, 这和抑郁直接相关, 而模型组小鼠的皮质酮升高是糖尿病引发HPA (hypothalamic-pituitary-adrenal) 轴紊乱[35]的一种表现, 提示模型组小鼠激素代谢异常。在葛根素给药后, 不仅恢复了5-HT的水平, 相对于氟西汀, 还有降低皮质酮异常升高的作用。
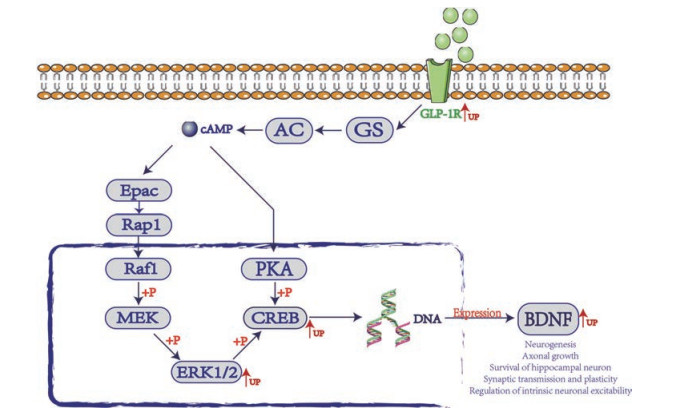
GLP-1参与调节突触可塑性, 改善学习和记忆, 并能保护运动活动和多巴胺能神经元[36], 其类似物具有抗抑郁的潜力[37]。GLP-1R作为G蛋白偶联受体, 激活后会触发信号级联反应, 引发cAMP环化酶激活和cAMP升高, 并引起下游ERK1/2和CREB磷酸化, 从而调控对应基因表达BDNF (图 8), BDNF则可以维持神经发生和海马体神经细胞的存活, 以及增加突触可塑性, 并起到抗抑郁[38]的作用。基于此, 检测了各组小鼠海马体中各蛋白的变化, 发现葛根素能改善HFD引起的GLP-1R、p-ERK1/2、p-CREB和BDNF的下调, 增强GLP-1信号, 发挥海马体神经保护以及抗抑郁的作用。另外, 葛根素还上调了p-β-catenin到正常水平, 由于其水平下调参与抑郁的发生[39], 以及Wnt/β-catenin信号影响神经元增殖、分化以及凋亡, p-β-catenin水平的恢复提示葛根素可能直接或间接地影响Wnt/β-catenin而达到抗抑郁的疗效。葛根素治疗还部分恢复了HFD造成的p-mTOR下调, 由于mTOR控制的信号通路参与调节神经元发育、突触可塑性、记忆存储和认知[40], 葛根素治疗在此路径也有部分影响。c-casp3是细胞凋亡过程中最主要的终末剪切酶, 而葛根素治疗可下调HFD引起的高水平c-casp3, 提示葛根素治疗参与抑制HFD引发的海马细胞凋亡, 相应的体外实验显示, 葛根素能恢复高糖和皮质酮给HT22细胞带来的形态损害, 并抑制模型HT22的凋亡, 以实现保护海马神经元的功能。
|
Figure 8 Variation of related proteins in GLP-1R signaling after puerarin administration. GS: Stimulatory G protein; AC: Adenylyl cyclase; cAMP: Cyclic adenosine monophosphate; Epac: Exchange protein directly activated by cAMP; Rap1: Ras-related protein 1; Raf1: Proto-oncogene serine/threonine-protein kinase 1; MEK: Mitogen-activated protein kinase kinase; PKA: Protein kinase A |
综上所述, 本研究表明, 葛根素能够显著改善高脂诱导的糖尿病小鼠抑郁症状, 其作用可能是通过激活GLP-1R/Wnt/mTOR信号通路, 改善海马神经可塑性而实现。GLP-1R/Wnt通路在调控机体糖代谢中同样发挥重要作用, 葛根素的这一双效作用, 在治疗糖尿病合并抑郁此类并发症方面具有一定的独特优势, 本研究有望为葛根的潜在临床应用提供实验支持。
作者贡献: 胡子奇、廖雁君和刘玉民负责实验研究; 胡子奇、李淑坤和仝萌负责数据处理; 舒娈、汪晶和胡子奇负责提出研究思路、设计实验方案、撰写和修改论文。
利益冲突: 全体作者声明不存在任何利益冲突。
| [1] |
Saeedi P, Petersohn I, Salpea P, et al. Global and regional diabetes prevalence estimates for 2019 and projections for 2030 and 2045:results from the International Diabetes Federation Diabetes Atlas, 9th edition[J]. Diabetes Res Clin Pract, 2019, 157: 107843. DOI:10.1016/j.diabres.2019.107843 |
| [2] |
Novak M, Mucsi I, Rhee CM, et al. Increased risk of incident chronic kidney disease, cardiovascular disease, and mortality in patients with diabetes with comorbid depression[J]. Diabetes Care, 2016, 39: 1940-1947. DOI:10.2337/dc16-0048 |
| [3] |
Moulton CD, Pickup JC, Ismail K. The link between depression and diabetes: the search for shared mechanisms[J]. Lancet Diabetes Endocrinol, 2015, 3: 461-471. DOI:10.1016/S2213-8587(15)00134-5 |
| [4] |
Sartorius N. Depression and diabetes[J]. Dialogues Clin Neurosci, 2018, 20: 47-52. DOI:10.31887/DCNS.2018.20.1/nsartorius |
| [5] |
Yao JH, Wang J, Hu ZQ, et al. Exendin-4 promotes the anti-diabetic effects of puerarin in high fat diet diabetic mice[J]. Acta Pharm Sin (药学学报), 2020, 55: 1209-1213. |
| [6] |
Cork SC, Richards JE, Holt MK, et al. Distribution and characterisation of glucagon-like peptide-1 receptor expressing cells in the mouse brain[J]. Mol Metab, 2015, 4: 718-731. DOI:10.1016/j.molmet.2015.07.008 |
| [7] |
Korol SV, Jin Z, Babateen O, et al. GLP-1 and exendin-4 transiently enhance GABAA receptor-mediated synaptic and tonic currents in rat hippocampal CA3 pyramidal neurons[J]. Diabetes, 2015, 64: 79-89. DOI:10.2337/db14-0668 |
| [8] |
Mansur RB, Lee Y, Subramaniapillai M, et al. Cognitive dysfunction and metabolic comorbidities in mood disorders: a repurposing opportunity for glucagon-like peptide 1 receptor agonists?[J]. Neuropharmacology, 2018, 136: 335-342. DOI:10.1016/j.neuropharm.2018.01.048 |
| [9] |
Luo C, Ke Y, Yuan Y, et al. A novel herbal treatment reduces depressive-like behaviors and increases brain-derived neurotrophic factor levels in the brain of type 2 diabetic rats[J]. Neuropsychiatr Dis Treat, 2016, 12: 3051-3059. DOI:10.2147/NDT.S117337 |
| [10] |
Wang JQ, Mao L. The ERK pathway: molecular mechanisms and treatment of depression[J]. Mol Neurobiol, 2019, 56: 6197-6205. DOI:10.1007/s12035-019-1524-3 |
| [11] |
Zanos P, Thompson SM, Duman RS, et al. Convergent mechanisms underlying rapid antidepressant action[J]. CNS Drugs, 2018, 32: 197-227. DOI:10.1007/s40263-018-0492-x |
| [12] |
Deng ZF, Zheng HL, Chen JG, et al. miR-214-3p targets β-catenin to regulate depressive-like behaviors induced by chronic social defeat stress in mice[J]. Cereb Cortex, 2019, 29: 1509-1519. DOI:10.1093/cercor/bhy047 |
| [13] |
Huang SJ, WU W, Wang YY. Radix Puerariae in antidepressant research and application[J]. Liaoning J Tradit Chin Med (辽宁中医杂志), 2014, 41: 1333-1336. |
| [14] |
Hassan AM, Mancano G, Kashofer K, et al. High-fat diet induces depression-like behaviour in mice associated with changes in microbiome, neuropeptide Y, and brain metabolome[J]. Nutr Neurosci, 2019, 22: 877-893. DOI:10.1080/1028415X.2018.1465713 |
| [15] |
Vagena E, Ryu JK, Baeza-Raja B, et al. A high-fat diet promotes depression-like behavior in mice by suppressing hypothalamic PKA signaling[J]. Transl Psychiatry, 2019, 9: 141. DOI:10.1038/s41398-019-0470-1 |
| [16] |
Yang L, Yao D, Yang H, et al. Puerarin protects pancreatic β-cells in obese diabetic mice via activation of GLP-1R signaling[J]. Mol Endocrinol, 2016, 30: 361-371. DOI:10.1210/me.2015-1213 |
| [17] |
Lin J, Yang Q, Liu J, et al. Effects of zuogui jiangtang jieyu formula on hippocampus neuron apoptosis related proteins under diabetes mellitus with depression states[J]. Chin J Inf Tradit Chin Med (中国中医药信息杂志), 2017, 24: 35-39. |
| [18] |
Mahar I, Bambico FR, Mechawar N, et al. Stress, serotonin, and hippocampal neurogenesis in relation to depression and antidepressant effects[J]. Neurosci Biobehav Rev, 2014, 38: 173-192. DOI:10.1016/j.neubiorev.2013.11.009 |
| [19] |
van Donkelaar EL, Vaessen KRD, Pawluski JL, et al. Long-term corticosterone exposure decreases insulin sensitivity and induces depressive-like behaviour in the C57BL/6NCrl mouse[J]. PLoS One, 2014, 9: e106960. DOI:10.1371/journal.pone.0106960 |
| [20] |
Shukla V, Shakya AK, Perez-Pinzon MA, et al. Cerebral ischemic damage in diabetes: an inflammatory perspective[J]. J Neuroinflamm, 2017, 14: 21. DOI:10.1186/s12974-016-0774-5 |
| [21] |
Del Giudice M, Gangestad SW. Rethinking IL-6 and CRP: why they are more than inflammatory biomarkers, and why it matters[J]. Brain Behav Immun, 2018, 70: 61-75. DOI:10.1016/j.bbi.2018.02.013 |
| [22] |
Timper K, Denson JL, Steculorum SM, et al. IL-6 improves energy and glucose homeostasis in obesity via enhanced central IL-6 trans-signaling[J]. Cell Rep, 2017, 19: 267-280. DOI:10.1016/j.celrep.2017.03.043 |
| [23] |
Stieglitz J, Trumble BC, Thompson ME, et al. Depression as sickness behavior? A test of the host defense hypothesis in a high pathogen population[J]. Brain Behav Immun, 2015, 49: 130-139. DOI:10.1016/j.bbi.2015.05.008 |
| [24] |
Meresman GF, Götte M, Laschke MW. Plants as source of new therapies for endometriosis: a review of preclinical and clinical studies[J]. Hum Reprod Update, 2020. DOI:10.1093/humupd/dmaa039 |
| [25] |
Wang X, Yan J, Xu X, et al. Puerarin prevents LPS-induced acute lung injury via inhibiting inflammatory response[J]. Microb Pathog, 2018, 118: 170-176. DOI:10.1016/j.micpath.2018.03.033 |
| [26] |
Deng HF, Wang S, Wang XL, et al. Puerarin protects against LPS-induced vascular endothelial cell hyperpermeability via preventing downregulation of endothelial cadherin[J]. Inflammation, 2019, 42: 1504-1510. DOI:10.1007/s10753-019-01014-0 |
| [27] |
Gao L, Li SL, Li YK. Liraglutide promotes the osteogenic differentiation in MC3T3-E1 cells via regulating the expression of Smad2/3 through PI3K/Akt and Wnt/β-catenin pathways[J]. DNA Cell Biol, 2018, 37: 1031-1043. DOI:10.1089/dna.2018.4397 |
| [28] |
Xie J, El Sayed NM, Qi C, et al. Exendin-4 stimulates islet cell replication via the IGF1 receptor activation of mTORC1/S6K1[J]. J Mol Endocrinol, 2014, 53: 105-115. DOI:10.1530/JME-13-0200 |
| [29] |
Fanne RA, Nassar T, Heyman SN, et al. Insulin and glucagon share the same mechanism of neuroprotection in diabetic rats: role of glutamate[J]. Am J Physiol Regul Integr Comp Physiol, 2011, 70: R668-R673. |
| [30] |
Rehni A, Nautiyal N, Perez-Pinzon M, et al. Hyperglycemia/hypoglycemia-induced mitochondrial dysfunction and cerebral ischemic damage in diabetics[J]. Metab Brain Dis, 2015, 30: 437-447. DOI:10.1007/s11011-014-9538-z |
| [31] |
Abbas G, Al-Harrasi AS, Hussain H, et al. Antiglycation therapy: discovery of promising antiglycation agents for the management of diabetic complications[J]. Pharm Biol, 2016, 54: 198-206. DOI:10.3109/13880209.2015.1028080 |
| [32] |
Pugazhenthi S, Qin L, Reddy PH. Common neurodegenerative pathways in obesity, diabetes, and Alzheimer's disease[J]. Biochim Biophys Acta Mol Basis Dis, 2017, 1863: 1037-1045. DOI:10.1016/j.bbadis.2016.04.017 |
| [33] |
Zhu SW, Gao XX, Tian JS, et al. Research progress of traditional Chinese antidepressant herb-pair[J]. Acta Pharm Sin (药学学报), 2019, 54: 235-244. |
| [34] |
Tu YM, Gong CX, Ding L, et al. A high concentration of fatty acids induces TNF-α as well as NO release mediated by the P2X4 receptor, and the protective effects of puerarin in RAW264.7 cells[J]. Food Funct, 2017, 8: 4336-4346. DOI:10.1039/C7FO00544J |
| [35] |
Yokoyama K, Yamada T, Mitani H, et al. Relationship between hypothalamic-pituitary-adrenal axis dysregulation and insulin resistance in elderly patients with depression[J]. Psychiatry Res, 2015, 226: 494-498. DOI:10.1016/j.psychres.2015.01.026 |
| [36] |
Grieco M, Giorgi A, Gentile MC, et al. Glucagon-like peptide-1:a focus on neurodegenerative diseases[J]. Front Neurosci, 2019, 13: 1112. DOI:10.3389/fnins.2019.01112 |
| [37] |
Weina H, Yuhu N, Christian H, et al. Liraglutide attenuates the depressive- and anxiety-like behaviour in the corticosterone induced depression model via improving hippocampal neural plasticity[J]. Brain Res, 2018, 1694: 55-62. DOI:10.1016/j.brainres.2018.04.031 |
| [38] |
Licznerski P, Jonas EA. BDNF signaling: harnessing stress to battle mood disorder[J]. Proc Natl Acad Sci U S A, 2018, 115: 3742-3744. DOI:10.1073/pnas.1803645115 |
| [39] |
Teo CH, Soga T, Parhar IS. Brain beta-catenin signalling during stress and depression[J]. Neurosignals, 2018, 26: 31-42. DOI:10.1159/000487764 |
| [40] |
Bockaert J, Marin P. mTOR in brain physiology and pathologies[J]. Physiol Rev, 2015, 95: 1157-1187. DOI:10.1152/physrev.00038.2014 |
 2021, Vol. 56
2021, Vol. 56


