2. 河北医科大学第三医院检验科, 河北 石家庄 050000;
3. 河北医科大学第四医院科研中心, 河北 石家庄 050000;
4. 华北理工大学, 河北 唐山 063200
2. Department of Laboratory Medicine, the Third Hospital of Hebei Medical University, Shijiazhuang 050000, China;
3. Research Center, the Fourth Hospital of Hebei Medical University, Shijiazhuang 050000, China;
4. North China University of Science and Technology, Tangshan 063200, China
食管癌是严重危害人类健康的消化道恶性肿瘤之一, 其发病率和病死率位居世界癌症发病率和病死率的第8位和第6位[1]。全世界每年食管癌新发病例超过60万, 其中大多数发生在中国[2]。目前, 治疗食管癌的主要方法包括手术切除和化疗。然而, 对于复发或转移的患者, 手术切除有很大的局限性, 术后化疗的效果也不能满足所有患者的需要。此外, 耐药表型的频繁获得和“继发性恶性肿瘤”的发生往往与化疗有关[3]。因此, 选择合适、有效的化疗药物是一个难点。近年来, 基于表观遗传学方法的去甲基化药物在抗肿瘤方面展现了良好的前景, 目前临床常用的去甲基化药物是地西他滨和阿扎胞苷, 它们主要用于血液系统肿瘤, 但对实体瘤效果不佳。Zebularine [1-(β-D-核呋喃糖基)-1, 2-二氢嘧啶-2-酮] 是第二代去甲基化药物, 目前尚处于临床前研究阶段, 与传统去甲基化药物相比, 具有稳定性和低毒性[4]。研究发现, zebularine具有更广谱的抗肿瘤效果, 可抑制多种肿瘤细胞生长, 在膀胱癌、前列腺癌、肺癌、结肠癌和胰腺癌细胞系中均发现, 其对癌细胞有较高的靶向作用[5]。Zebularine还可通过去甲基化上调抑癌基因的表达[6], 进而诱导肿瘤凋亡途径的激活, 而且是同类药物中第一种能够通过口服给药来激活表观遗传沉默基因的药物。到目前为止, 关于zebularine对人食管癌的抗肿瘤作用, 尚未见相关报道。本实验通过研究zebularine对食管癌细胞活性和凋亡机制的影响, 为食管癌的治疗提供新的思路和依据。
材料与方法细胞系 人食管癌细胞系ECA109和KYSE170购自ATCC。细胞复苏后, 加入含10%胎牛血清的RPMI1640培养基中, 置于37 ℃、5% CO2的培养箱中培养, 2~3天更换1次培养液。当细胞生长至70%以上进行消化传代, 以进行后续实验。
试剂 Zebularine (Selleck公司); Annexin V/FITC-PI (BD公司); 反转录试剂盒和实时定量PCR试剂盒(Thermo公司); 细胞蛋白提取试剂盒(北京索莱宝公司); CCK-8试剂盒, 抗β-catenin、cyclinD1和c-Myc抗体(Abcam公司); siRNA (上海生工公司); DNA甲基化试剂盒(美国ZYMO Research公司)。
CCK-8法检测细胞活力 收集对数期的ECA109和KYSE170细胞, 胰蛋白酶消化配成单细胞悬液, 以每孔1×104个细胞均匀接种到96孔板。细胞贴壁后更换培养基, 分别加入0、25、50、100、200和400 μmol·L-1 zebularine。每组设置3个复孔, 作用72 h后, 加入含CCK-8质量分数为10%的新鲜培养基100 μL, 孵育4 h, 通过酶标仪检测各孔在波长450 nm处的吸光度值(A), 以对照组调零, 绘制曲线。然后选用100 μmol·L-1 zebularine作用细胞, 在0、12、24、48和72 h不同时间点分别测吸光度值。细胞存活率(%) = (A实验组 - A空白组) / (A对照组 - A空白组)×100%。
流式细胞术检测细胞凋亡 食管癌细胞以每孔1×106个细胞数接种于6孔板中, 经100 μmol·L-1 zebularine处理48 h, 收集细胞, PBS溶液洗涤2次, 1 000 r·min-1离心5 min, 然后用结合缓冲液500 μL溶液重悬管中细胞, 每管加入5 μL Annexin V-FITC染液, 室温避光孵育10 min, 再加入PI染液5 μL, 轻轻混匀后继续孵育10 min, 经流式细胞仪检测分析。
Western blot检测蛋白表达 收集细胞, BCA法检测蛋白含量。取等量蛋白(40 μg), 经10%~12% SDS-PAGE电泳1.5 h, 电转膜2 h, 3%脱脂奶粉封闭2 h, 加入一抗(抗Bax、Bcl-2、cleaved-caspase-3、cleaved-PARP、β-catenin、cyclin D1和c-Myc) 和GAPDH (1∶1 000抗体), 4 ℃过夜, PBS漂洗3次, 加HRP标记二抗(1∶200), 37 ℃孵育1 h, 显色。凝胶成像分析系统测定光密度, 进行蛋白表达定量分析。
实时荧光定量PCR检测Wnt信号通路上游负调控基因表达水平 收集对照组和zebularine (100 μmol·L-1) 作用48 h后的ECA109和KYSE170细胞, Trizol试剂一步法提取细胞总RNA并鉴定RNA的完整性。以RNA为模板逆转录合成cDNA。实时荧光定量PCR仪进行PCR扩增, 引物序列见表 1。反应条件: 95 ℃ 1 min, 95 ℃ 5 s, 60 ℃ 1 min, 40个循环。结果采用2-ΔΔCt法进行相对定量分析, 以GAPDH为内参照。
| Table 1 Primer sequences. DACT: Dishevelled-binding antagonist of beta-catenin; SFRP: Secreted frizzled related protein; Dkk: Dickkopf; GAPDH: Glyceraldehyde-3-phosphate dehydrogenase |
MSP检测SFRP2和Dkk3基因的甲基化状态 Zebularine作用48 h后, 分别收集对照组和处理组细胞, 常规酚-氯仿法提取细胞基因组DNA, 用亚硫氢盐修饰试剂盒修饰纯化DNA。取3 μL修饰后的DNA为模板进行PCR扩增, 反应条件: 95 ℃预变性4 min, 92 ℃变性45 s, 60 ℃退火30 s, 72 ℃延伸30 s, 共35个循环, 72 ℃再延伸10 min。PCR产物进行琼脂糖凝胶电泳, 并在凝胶图像分析仪上分析成像。实验重复3次。根据SFRP2和Dkk3启动子设计MSP引物, 引物序列见表 1。
SFRP2和Dkk3 siRNA 转染对zebularine诱导凋亡的影响 根据GenBank上SFRP2和Dkk3基因序列, 参照siRNA设计原则设计合成SFRP2-siRNA、Dkk3-siRNA和Ctrl-siRNA, 序列如下: SFRP2-siRNA: 5'-GAGGAUGACAACGACAUAATT-3', anti-sense: 5'-UUAUGUCGUUGUCAUCCUCTT-3'; Dkk3-siRNA: 5'-AAUGGUCUGGUACUUAUUCCdGdC-3', anti-sense: 5'- GGAAUAAGUACCAGACCAUUGdCd-3'; Ctrl-siRNA: 5'- UUCUCCGAACGUGUCACGUTT-3', anti-sense: 5'-ACG UGACACGUUCGGAGAATT-3'。采用Lipofectamine 3000脂质体进行转染, 实验分组为Ctrl-siRNA组、SFRP2-siRNA组、Dkk3-siRNA组、zebularine + Ctrl-siRNA组、zebularine + SFRP2-siRNA组和zebularine + Dkk3-siRNA组, 收集各组细胞, 流式细胞仪检测凋亡率, Western blot检测β-catenin、cyclin D1和c-Myc蛋白表达变化。
统计学分析 实验数据采用SPSS 21.0软件进行分析。计量资料用均数±标准差(x±s) 表示, 多组间数据比较采用单因素方差分析, 两两比较采用SNK-q检验, 以P < 0.05表示差异有统计学意义。
结果 1 Zebularine对食管癌ECA109和KYSE170细胞活力的影响为了研究zebularine对食管癌细胞活力的影响, 使用25、50、100、200和400 μmol·L-1 zebularine作用细胞72 h, 结果显示50~400 μmol·L-1 zebularine均能抑制细胞活力(P < 0.05), 其中在100 μmol·L-1时细胞活力降低较明显(图 1A)。选用100 μmol·L-1 zebularine, 再以时间为横坐标, 对细胞存活率为纵坐标绘制曲线(图 1B), 可见在24~72 h内, zebularine作用组的细胞活力低于对照组(P < 0.05), 其中在48 h细胞活力降低较明显。选用抑制率为50%左右的zebularine作用的浓度和时间(分别为100 μmol·L-1和48 h) 用于后续实验。
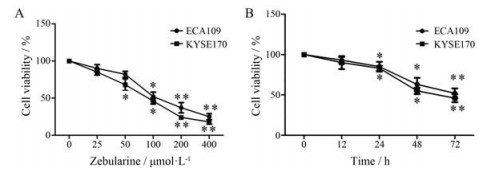
|
Figure 1 The effect of zebularine on the viability change in esophageal cancer cells. A: ECA109 and KYSE170 cells were treated with zebularine (25, 50, 100, 200, and 400 μmol·L-1) for 72 h; B: ECA109 and KYSE170 cells were treated with 100 μmol·L-1 zebularine for 0, 12, 24, 48, and 72 h. The cell viability was detected by CCK-8. *P < 0.05, **P < 0.01 vs control group |
为了确定zebularine对食管癌细胞凋亡的影响, 用100 μmol·L-1 zebularine处理ECA109和KYSE170细胞48 h, 经流式检测各组细胞凋亡情况。如图 2A所示, zebularine组中ECA109和KYSE170细胞的凋亡率分别为29.68%和23.41%, 与对照组的凋亡率(10.64%和12.13%) 相比, 差异有统计学意义(P < 0.01, P < 0.05)。Western blot结果显示, zebularine可影响凋亡相关蛋白的表达, 与对照组相比, zebularine可显著下调Bcl-2蛋白表达(P < 0.05), 上调Bax、cleaved-caspase-3和cleaved-PARP蛋白的表达(P < 0.05), 见图 2B。
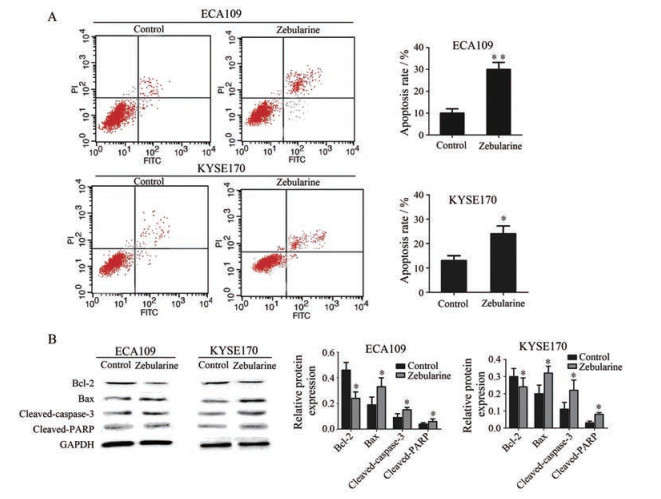
|
Figure 2 The effect of zebularine on the apoptosis of ECA109 and KYSE170 cells. A: The apoptosis was analyzed by flow cytometry; B: The protein expression levels of Bcl-2, Bax, cleaved-caspase-3, and cleaved-PARP were analyzed by Western blot. *P < 0.05, **P < 0.01 vs control group |
Western blot结果显示, zebularine作用ECA109和KYSE170细胞后, β-catenin、cyclin D1和c-Myc蛋白表达水平明显降低, 与对照组比较差异有统计学意义(P < 0.05) (图 3), 提示zebularine可抑制Wnt/β-catenin信号通路。
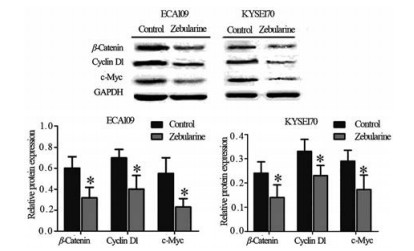
|
Figure 3 The effect of zebularine on the expression of Wnt/β-catenin signaling pathway related proteins in ECA109 and KYSE170 cells. After treatment with zebularine (100 μmol·L-1) for 48 h, β-catenin, cyclin D1, and c-Myc protein were detected by Western blot. *P < 0.05 vs control group |
为了明确zebularine如何影响Wnt/β-catenin信号通路, 采用实时定量PCR检测Wnt/β-catenin信号通路上游主要负调控基因: 包括DACT家族基因(DACT1、2和3)、Dkk家族基因(Dkk1、2和3) 和SFRP家族基因(SFRP1、2、4和5) 的表达情况。结果发现, zebularine作用后, SFRP2和Dkk3基因表达水平均明显升高, 与对照组相比差异有统计学意义(图 4A)。同时, MSP结果显示, zebularine作用后SFRP2和Dkk3启动子的甲基化水平降低, 非甲基化水平增加(图 4B)。以上结果提示, 在食管癌细胞中, zebularine上调SFRP2和Dkk3基因的表达是通过降低启动子甲基化状态实现的。
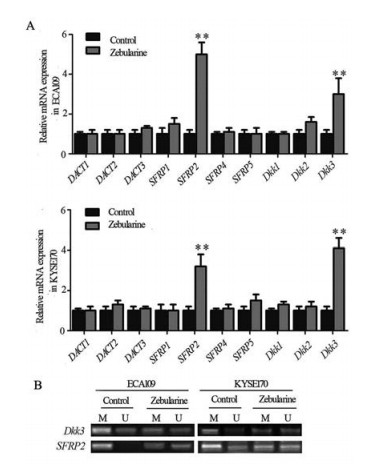
|
Figure 4 The effect of zebularine on the mRNA expression of negative regulatory genes of Wnt/β-catenin signaling pathway, and the demethylation of SFRP2 and Dkk3 gene in ECA109 and KYSE170 cells. A: The mRNA expression of negative regulatory genes of Wnt signaling pathway was detected by real-time quantitative PCR; B: The methylation status of SFRP2 and Dkk3 genes was detected by methylation specific PCR (MSP), M represents products amplified by methylated primers, U represents products amplified by unmethylated primers. **P < 0.01 vs control group |
为了进一步验证zebularine促进细胞凋亡的机制, 用SFRP2-siRNA和Dkk3-siRNA分别转染ECA109和KYSE170细胞, 观察zebularine作用后细胞凋亡变化和Wnt/β-catenin信号通路相关蛋白表达的变化。结果显示, 沉默SFRP2和Dkk3后的细胞再经zebularine作用后, 较未沉默SFRP2和Dkk3的细胞凋亡率明显降低(P < 0.05) (图 5A), β-catenin、cyclin D1和c-Myc蛋白表达水平升高(P < 0.05) (图 5B), 表明沉默SFRP2和Dkk3可降低zebularine对Wnt/β-catenin信号通路的抑制作用, 同时降低zebularine诱导的细胞凋亡。
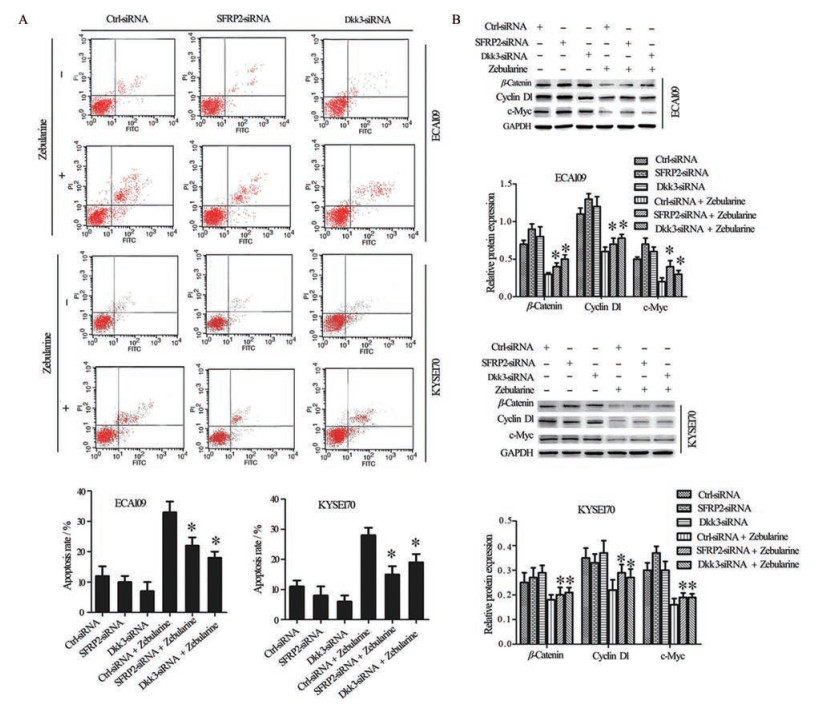
|
Figure 5 Effect of knockdown of SFRP2 and Dkk3 on zebularine induced apoptosis of esophageal cancer cells. A: The apoptosis was analyzed by flow cytometry; B: The protein expression levels of β-catenin, cyclin D1 and c-Myc were analyzed by Western blot. *P < 0.05 vs Ctrl-siRNA + Zebularine group |
表观遗传变化在致癌过程中起着重要作用, 研究报道表观遗传是治疗癌症的有效途径之一[7, 8]。DNA甲基化[9]是最重要的表观遗传修饰之一, 在抗肿瘤中越来越受关注。目前, 一些DNA甲基化抑制药物正在进行临床试验用于治疗多种癌症。Zebularine最初是作为胞苷脱氨酶抑制剂合成的, 然而, 越来越多的研究报道了它作为胞苷类似物的其他作用, 即抑制DNA甲基化和抗肿瘤增殖作用。国内外研究发现, zebularine可通过H2AX磷酸化诱导骨髓瘤细胞凋亡[10], 通过抑制ARHI甲基化增强骨肉瘤细胞的凋亡[11], 通过细胞周期停滞和细胞凋亡抑制肺癌细胞[12]、宫颈癌细胞[13]和恶性间皮瘤细胞[14]的生长。Zebularine还可诱导线粒体介导的胃癌细胞凋亡[15]。这些研究表明, zebularine可抑制多种肿瘤细胞增殖诱导凋亡, 并且在不同的肿瘤中zebularine抑制肿瘤的机制是不同的, 然而zebularine对食管癌的作用目前尚不清楚。本研究发现, zebularine可抑制食管癌细胞ECA109和KYSE170的活力, 随着浓度增大、作用时间延长, 对细胞抑制效果增强, 同时还发现zebularine可诱导ECA109和KYSE170细胞凋亡。今后, 本课题组还将对zebularine诱导食管癌细胞凋亡的机制进行深入探讨。
Wnt/β-catenin信号通路在肿瘤的发生发展和转移中发挥重要作用。Nakamura等[16]发现zebularine可通过DNMT1-Wnt轴促进胆管癌细胞死亡, 提示zebularine可调控Wnt/β-catenin信号通路, 然而, zebularine是否能通过调节Wnt/β-catenin信号通路促进食管癌的凋亡尚不清楚。因此, 本研究进一步探讨zebularine和Wnt/β-catenin信号通路在食管癌细胞凋亡中的作用机制。结果发现, 食管癌细胞经zebularine处理后, Wnt/β-catenin信号通路的下游靶分子β-catenin、cyclin D1和c-Myc表达降低, 提示zebularine可抑制Wnt/β-catenin信号通路。
接下来进一步深入研究zebularine如何作用于Wnt/β-catenin信号通路, 典型的Wnt/β-catenin信号从分泌的Wnt配体结合到Frizzled家族受体开始, 然后触发β-catenin信号级联反应[17]。这一途径受上游主要负调控基因调节, 包括DACT家族分子、Dkk家族分子和SFRP家族分子等。据报道, 这些Wnt/β-catenin信号通路上游主要负调控基因的表达水平在各种肿瘤中均不同程度地降低, 并且与疾病进展和不良预后相关[17]。本研究检测了zebularine对DACT家族基因(DACT1、2和3), Dkk家族基因(DKK1、2和3) 和SFRP家族基因(SFRP1、2、4和5) 表达的影响, 发现zebularine能显著上调SFRP2和Dkk3基因表达, 提示SFRP2和Dkk3基因参与了zebularine所诱导细胞凋亡。抑癌基因的甲基化是调节基因表达的重要机制[18, 19]。为了明确zebularine对SFRP2和Dkk3基因的调节是否与启动子区域甲基化水平有关, 本研究检测了启动子区域的甲基化水平, 发现ECA109和KYSE170细胞经过zebularine处理后, 细胞内SFRP2和Dkk3基因启动子甲基化水平降低, 非甲基化水平增加。这说明SFRP2和Dkk3启动子的甲基化在zebularine上调SFRP2和Dkk3表达中起重要作用, 结合PCR结果表明, zebularine通过影响SFRP2和Dkk3基因甲基化水平, 调节基因表达。最后为了进一步确定SFRP2和Dkk3在zebularine诱导的细胞凋亡中的作用, 应用siRNA敲低SFRP2和Dkk3, 发现沉默SFRP2和Dkk3后, zebularine对细胞凋亡的诱导效应明显降低, 对Wnt/β-catenin信号通路的抑制作用也降低, 表明SFRP2和Dkk3在zebularine诱导的食管癌细胞凋亡中起到关键的调节作用。
综上所述, zebularine可以抑制食管癌细胞的生长, 其具体机制主要涉及zebularine降低SFRP2和Dkk3基因启动子甲基化水平, 诱导SFRP2和Dkk3基因表达, 进而通过抑制Wnt/β-catenin信号通路诱导食管癌细胞凋亡。本实验可为研究zebularine在食管癌中的作用机制提供实验依据。
作者贡献: 张凤霞和张建东负责实验和数据分析, 完成文章撰写; 储金秀和单保恩负责指导实验思路; 所有作者均对本文有所贡献。
利益冲突: 无利益冲突。
| [1] |
Torre LA, Bray F, Siegel RL, et al. Global cancer statistics, 2012[J]. CA Cancer J Clin, 2015, 65: 87-108. DOI:10.3322/caac.21262 |
| [2] |
Lin Y, Totsuka Y, He Y, et al. Epidemiology of esophageal cancer in Japan and China[J]. J Epidemiol, 2013, 23: 233-242. DOI:10.2188/jea.JE20120162 |
| [3] |
Huang D, Wang Y, He Y, et al. Paraoxonase 3 is involved in the multi-drug resistance of esophageal cancer[J]. Cancer Cell Int, 2018, 18: 168-172. DOI:10.1186/s12935-018-0657-1 |
| [4] |
Andersen JB, Factor VM, Marquardt JU, et al. An integrated genomic and epigenomic approach predicts therapeutic response to zebularine in human liver cancer[J]. Sci Transl Med, 2010, 2: 54ra77. |
| [5] |
Cheng JC, Matsen CB, Gonzales FA, et al. Inhibition of DNA methylation and reactivation of silenced genes by zebularine[J]. J Natl Cancer Inst, 2003, 95: 399-409. DOI:10.1093/jnci/95.5.399 |
| [6] |
Cheng JC, Weisenberger DJ, Gonzales FA, et al. Continuous zebularine treatment effectively sustains demethylation in human bladder cancer cells[J]. Mol Cell Biol, 2004, 24: 1270-1278. DOI:10.1128/MCB.24.3.1270-1278.2004 |
| [7] |
Villanueva L, Álvarez-Errico D, Esteller M. The contribution of epigenetics to cancer immunotherapy[J]. Trends Immuno, 2020, 41: 676-691. DOI:10.1016/j.it.2020.06.002 |
| [8] |
Cao J, Yan Q. Cancer epigenetics, tumor immunity, and immunotherapy[J]. Trends Cancer, 2020, 6: 580-592. DOI:10.1016/j.trecan.2020.02.003 |
| [9] |
Skvortsova K, Stirzaker C, Taberlay P. The DNA methylation landscape in cancer[J]. Essays Biochem, 2019, 63: 797-811. DOI:10.1042/EBC20190037 |
| [10] |
Krzeminski P, García-Sanz R, Gutiérrez NC. Zebularine-induced myeloma cell death is accompanied by decreased c-Myc expression[J]. Cell Oncol (Dordr), 2020, 43: 743-750. |
| [11] |
Ye K, Wang S, Wang J, et al. Zebularine enhances apoptosis of human osteosarcoma cells by suppressing methylation of ARHI[J]. Cancer Sci, 2016, 107: 1851-1857. DOI:10.1111/cas.13088 |
| [12] |
You BR, Park WH. Zebularine inhibits the growth of A549 lung cancer cells via cell cycle arrest and apoptosis[J]. Mol Carcinog, 2014, 53: 847-857. DOI:10.1002/mc.22042 |
| [13] |
You BR, Park WH. Zebularine inhibits the growth of HeLa cervical cancer cells via cell cycle arrest and caspase-dependent apoptosis[J]. Mol Biol Rep, 2012, 39: 9723-9731. DOI:10.1007/s11033-012-1837-z |
| [14] |
Takemura Y, Satoh M, Hatanaka K, et al. Zebularine exerts its antiproliferative activity through S phase delay and cell death in human malignant mesothelioma cells[J]. Biosci Biotechnol Biochem, 2018, 82: 1159-1164. DOI:10.1080/09168451.2018.1459466 |
| [15] |
Tan W, Zhou W, Yu HG, et al. The DNA methyltransferase inhibitor zebularine induces mitochondria-mediated apoptosis in gastric cancer cells in vitro and in vivo[J]. Biochem Biophys Res Commun, 2013, 430: 250-255. DOI:10.1016/j.bbrc.2012.10.143 |
| [16] |
Nakamura K, Nakabayashi K, Htet AK, et al. DNA methyltransferase inhibitor zebularine induces human cholangiocarcinoma cell death through alteration of DNA methylation status[J]. PLoS One, 2015, 10: e012054. |
| [17] |
MacDonald BT, Tamai K, He X. Wnt/beta-catenin signaling: components, mechanisms, and diseases[J]. Dev Cell, 2009, 17: 9-26. DOI:10.1016/j.devcel.2009.06.016 |
| [18] |
Zhang J, Xing B, Song J, et al. Associated analysis of DNA methylation for cancer detection using CCP-based FRET technique[J]. Anal Chem, 2014, 86: 346-350. DOI:10.1021/ac402720g |
| [19] |
Wang B, Yu L, Luo X, et al. Detection of OPCML methylation, a possible epigenetic marker, from free serum circulating DNA to improve the diagnosis of early-stage ovarian epithelial cancer[J]. Oncol Lett, 2017, 14: 217-223. DOI:10.3892/ol.2017.6111 |
 2021, Vol. 56
2021, Vol. 56


