在肿瘤快速增殖过程中, 肿瘤细胞常处于缺氧、营养匮乏、内质网应激等应激环境中。这些应激因素均能引起细胞内大量活性氧自由基(reactive oxygen species, ROS) 产生。研究发现, 肿瘤细胞内适度的ROS可通过激活癌基因和诱导肿瘤免疫逃逸等多种机制促进肿瘤生长和转移。然而, 当氧化应激信号持续过度活化导致肿瘤细胞内ROS水平超过死亡阈值时, 肿瘤细胞则会发生凋亡[1]。肺癌治疗中常用的化疗药物如顺铂、卡铂等均可通过诱导细胞内ROS大量产生, 激活凋亡信号通路, 发挥抗肿瘤作用[2]。为维持应激条件下的存活以及抵抗化疗药物的杀伤作用, 肿瘤细胞会启动细胞内抗氧化体系程序, 进而恢复肿瘤细胞内氧化还原态。由此可见, 肿瘤细胞抗氧化能力增强与肿瘤的发生和发展, 特别是耐药产生密切相关。
核因子E2相关因子2 (nuclear factor erythroid 2-related factor 2, NRF2) 是细胞抗氧化应激体系中关键的转录因子, 在维护细胞内氧化还原平衡稳态中发挥关键作用[3, 4]。正常生理条件下, NRF2在细胞质中与kelch样环氧氯丙烷相关蛋白-1 (kelch-like ECH-associated protein-1, KEAP1) 结合, 处于易降解、非活性状态。氧化应激状态时, NRF2与KEAP1解离并转位至细胞核, 与细胞核内抗氧化反应元件(antioxidant response element, ARE) 结合, 启动下游抗氧化相关基因的转录[4]。研究发现, NRF2信号通路在肺癌、肝癌等多种实体肿瘤发生发展过程中均存在异常活化的现象[5-8]。异常活化的NRF2不仅介导细胞内氧化还原稳态维持, 同时促进肿瘤细胞代谢重编程并重塑免疫微环境, 促进肿瘤发生发展和肿瘤耐药的发生[9]。然而, 调控肿瘤细胞内NRF2异常活化的机制尚未完全阐明。
假性激酶TRIB3 (tribbles homolog 3) 作为压力和代谢应激蛋白在肿瘤的发生发展过程中具有重要作用。内质网应激、糖剥夺、缺氧及炎症因子刺激等多种应激条件均能上调TRIB3表达[6, 7, 10, 11]。肿瘤细胞内高表达的TRIB3可通过自噬抑制、肿瘤干性增强、促癌因子降低老化反应等多种机制促进肝癌、结肠癌、肺癌、乳腺癌、白血病和黑色素瘤等多种肿瘤的发生和发展进程[10-17]。
研究团队近期研究结果发现, TRIB3与表皮生长因子受体(epithelial growth factor receptor, EGFR) 相互作用, 促进肺癌细胞生长, 降低化疗药物的敏感性[13]。进一步通过基因富集分析(gene set enrichment analysis, GSEA) 等研究手段发现, NRF2信号在TRIB3高表达的肺癌患者中显著富集。敲低TRIB3显著增加肿瘤细胞内ROS的产生。基于以上研究证据, 本研究从调控氧化还原稳态的角度阐明在应激条件下的TRIB3促进肿瘤细胞存活并抑制其凋亡的分子机制, 进一步完善TRIB3促进肺癌恶性进展的研究。本研究将有助于阐明肿瘤细胞内氧化还原应激调控的关键机制, 为开发新型肺癌治疗策略提供理论基础。
材料与方法试剂 放线菌酮(cycloheximide, CHX; 货号C104450, Sigma-Aldrich公司); 胰酶、胎牛血清、RPMI-1640培养基、DMEM培养基和IMDM培养基(Gibco公司); 转染试剂VigoFect (货号T001, 北京威格拉斯生物技术有限公司); protein A/G琼脂糖珠(货号sc-2003, Santa Cruz公司); Lipofectamine LTX with Plus Reagent转染试剂(货号15338100) 和Lipofectamine™ RNAiMAX转染试剂(货号13778150) (美国Invitrogen公司); qPCR (real-time quantitative PCR) 引物(睿博兴科生物技术有限公司); BCA (bicinchoninic acid) 法蛋白质定量试剂盒(北京普利莱基因技术有限公司); TransZol Up、EasyScript® One-Step gDNA Removal and cDNA Synthesis SuperMix逆转录试剂盒(北京全式金生物技术有限公司); KAPA SYBR® fast qPCR试剂盒(美国KAPA Biosystems公司); 活性氧检测试剂盒(碧云天生物技术有限自公司); NRF2抗体和KEAP1抗体(美国Cell Signaling Technology公司); TRIB3抗体(武汉三鹰生物技术有限公司, Proteintech group); 抗DDK、GFP和HA抗体(北京博尔迈生物技术有限公司); GAPDH (glyceraldehyde-3-phosphate dehydrogenase) 抗体和辣根过氧化物酶(horseradish peroxidase, HRP) 标记二抗(中杉金桥生物技术有限公司)。
细胞培养 人肺癌细胞系NCI-H157、PC-9和NCI-H1975 (中国医学科学院基础医学研究所细胞中心), 培养于RPMI-1640培养基(含10%胎牛血清、青霉素100 u·mL-1、链霉素100 u·mL-1); 人胚肾细胞HEK293T由本实验室长期保存, 培养于含10%胎牛血清的IMDM培养基; 所有细胞置于37 ℃、5% CO2细胞培养箱中。
质粒 pGMARE-luc质粒(上海翊圣生物科技有限公司); KEAP1-HA、NRF2-DDK、TRIB3-GFP、TRIB3-HA、Ub-GFP和pRL-TK质粒由实验室长期保存; pGMARE-luc基因质粒(上海翊圣生物科技有限公司)。
主要仪器 电泳仪(六一仪器厂); 冷冻高速离心机(美国Beckman公司); 5200全自动化学发光成像系统(上海天能科技有限公司); 实时荧光定量PCR仪(美国Bio-Rad公司); 激光共聚焦显微镜(日本奥林巴斯公司); 流式细胞仪(美国BD公司); Countstar细胞计数仪(上海睿钰生物科技有限公司)。
质粒转染 HEK293T细胞采用VigoFect转染试剂进行质粒转染, 培养细胞密度达到70%时, 10 μg质粒稀释至200 μL IMDM培养基中, 轻轻混匀; 将4 μL VigoFect转染试剂稀释至200 μL IMDM培养基中, 轻轻混匀, 室温放置5 min; 将稀释的VigoFect逐滴加入稀释的质粒中, 轻轻混匀, 室温放置15 min; 将混匀的转染工作液逐滴加到细胞中, 转染后24~72 h检测质粒表达情况。PC9细胞采用LipofectamineTM LTX Reagent转染试剂进行质粒转染, 将适量细胞接种于6孔板中, 待其密度合适时, 将2.5 μg质粒稀释于250 μL Opti-MEM培养基中, 轻轻混匀; 加入3 μL PLUSTM Reagent, 混匀后室温孵育5 min; 加入9 μL LipofectamineTM LTX Reagent, 轻轻混匀, 室温孵育30 min后滴加到细胞中, 转染后24~72 h检测质粒表达情况。
siRNA转染 TRIB3 siRNA和NRF2 siRNA由广州锐博生物科技有限公司合成, 序列如下: si-h-TRIB3_001, CCAGAAACGAGCTCGAAGT, si-h-TRIB3_002, GTCGCTTTGTCTTCGCTGA; si-h-NRF2_001, CGTT TGTAGATGACAATGA, si-h-NRF2_002, GAGAAAG AATTGCCTGTAA。将适量细胞接种于6孔板中, 待其密度合适时, 将TRIB3 siRNA或NRF2 siRNA稀释于150 μL RPMI-1640培养基中; 将Lipofectamine RNAi MAX 9 μL稀释于150 μL RMPI-1640培养基中; 室温孵育5 min后, 将含有siRNA的培养基滴加到含有Lipofectamine RNAi MAX的培养基中, 轻轻混匀, 室温孵育30 min后滴加到细胞中, 转染后24~72 h检测siRNA表达情况。
蛋白质免疫印迹(Western blot) PBS (phosphate buffered saline) 清洗并收集细胞, 加入一定体积的RIPA (radio immunoprecipitation assay) 裂解液, 冰上裂解30 min, 于12 000 r·min-1离心30 min后, 取上清。BCA蛋白定量试剂盒对蛋白定量后, 用RIPA裂解液调整至均一浓度, 加入5×上样缓冲液于98 ℃变性10 min。蛋白样品进行聚丙烯酰胺凝胶电泳, 湿法转膜。PVDF (polyvinylidene difluoride) 膜用含5%脱脂奶粉的TBST (tris-buffered saline with tween 20) 封闭1 h, 加入特异性抗体4 ℃孵育过夜。次晨, TBST洗膜3次(每次10 min), 加入对应二抗室温孵育2 h, TBST洗膜3次。完成洗膜后, PVDF膜表面加ECL (electrochemiluminescence) 发光液, 置于Tanon 5200全自动化学发光成像系统中曝光拍照。
实时荧光定量PCR 采用Trizol法提取细胞总RNA, 并根据全式金EasyScript® One-Step gDNA Removal and cDNA Synthesis SuperMix逆转录试剂盒说明书将总RNA逆转录至cDNA。按照KAPA SYBR® fast qPCR试剂盒说明书配制qPCR反应体系并进行反应。以GAPDH作为内参, 按照2-ΔΔCt法进行数据处理。引物由睿博兴科生物技术有限公司合成, 序列如下所示: TRIB3-F: 5'-GCTTTGTCTTCGCTGACCGTGA-3', TRIB3-R: 5'-CTGAGTATCTCAGGTCCCACGT-3'; HMOX1 (heme oxygenase 1)-F: 5'-CCAGGCAGAGAATGCTG AGTTC-3', HMOX1-R: 5'-AAGACTGGGCTCTCCTTG TTGC-3'; NQO1 [NADP(H): quinone oxidoreductase 1]-F: 5'-CCTGCCATTCTGAAAGGCTGGT-3', NQO1-R: 5'-GTGGTGATGGAAAGCACTGCCT-3'; GCLC (glutamate-cysteine ligase catalytic subunit)-F: 5'-GGAAGTG GATGTGGACACCAGA-3', GCLC-R: 5'-GCTTGTAG TCAGGATGGTTTGCG-3'; GCLM (glutamate-cysteine ligase modifier subunit)-F: 5'-TCTTGCCTCCTGCTGT GTGATG-3', GCLM-R: 5'-TTGGAAACTTGCTTCAG AAAGCAG-3'; GAPDH-F: 5'-GTCTCCTCTGACTTC AACAGCG-3', GAPDH-R: 5'-ACCACCCTGTTGCTG TAGCCAA-3'。
免疫共沉淀实验(co-immunoprecipitation, CO-IP) 当培养细胞密度达到70%时, 按照VigoFect说明书进行质粒转染, 转染24~48 h后收集细胞, 加入含蛋白酶抑制剂的CO-IP裂解液, 冰上裂解30 min。离心后取上清, 获得总蛋白样品。吸取少量裂解液用于Western blot分析, 剩余裂解液加入3 μg抗体和20 μL protein A/G琼脂糖珠, 于4 ℃缓慢旋转过夜。次日, 使用CO-IP洗液清洗4次, 小心吸除上清, 留沉淀。加入2×上样缓冲液, 98 ℃变性10 min, 样品进行Western blot分析。CO-IP裂解液配方: 25 mmol·L-1 Tris-HCl、150 mmol·L-1 NaCl、0.5% NP40、2.5 mmol·L-1 MgCl2、1 mmol·L-1 EDTA和5% glycerol; CO-IP洗液配方: 25 mmol·L-1 Tris-HCl、150 mmol·L-1 NaCl、0.25% NP40、2.5 mmol·L-1 MgCl2、1 mmol·L-1 EDTA和5% glycerol。
细胞增殖检测 实验采用Countstar细胞计数仪测定细胞增殖情况。向对数生长期细胞转染相应siRNA或过表达质粒, 在指定时间点消化细胞, 将细胞样本与0.2%台盼蓝按照1∶1比例混匀染色后, 立即吸取20 μL样本加入计数板对应样本槽中, 将计数板插入载物台中进行测定, 计算细胞数目。
细胞凋亡检测 转染特定siRNA且状态良好的细胞给予化疗药物卡铂(30 μmol·L-1) 刺激。18 h后, 采用Annexin V 633细胞凋亡检测试剂盒(日本同仁化学研究所) 测定肿瘤细胞凋亡情况。
细胞ROS检测 实验采用活性氧检测试剂盒测定细胞内ROS。对数生长期细胞加入终浓度为10 μmol·L-1 DCFH-DA (2, 7-dichlorodihydrofluorescein diacetate), 在5% CO2培养箱中于37 ℃孵育30 min后, PBS洗3次, 选择激发波长488 nm及发射波长525 nm条件, 分别采用激光共聚焦显微镜和流式细胞仪进行检测。
GSEA分析 从UCSC Xena平台(https://xena.ucsc.edu/) 获取癌症基因组图谱TCGA数据库肺腺癌相关数据LUAD HiSeqV2_PANCAN (n = 576)。按照TRIB3表达高低将肺癌患者分为TRIB3高表达组(90%~100%, n = 58)和TRIB3低表达组(0%~10%, n = 58)。获取GSEA平台NRF2_01数据集(http://www.gsea-msigdb.org/gsea/index.jsp), 使用GSEA v4.1.0 for Windows软件进行信号通路分析, FDR q (false discovery rate q value) < 0.25视为具有显著性差异。
统计学分析 实验平均重复3次以上, 数据以平均值±标准误[mean ± SEM (standard error of the mean)] 表示, 使用GraphPad Prism 8软件进行数据分析, 组间比较采用t检验, P < 0.05视为有统计学差异。
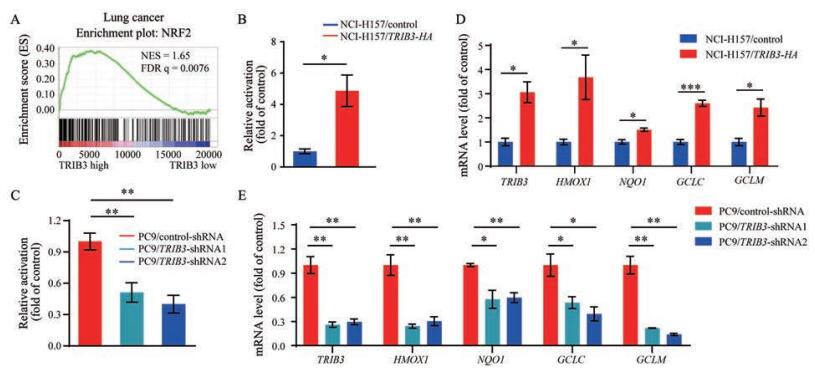
结果 1 TRIB3增强NRF2转录激活活性基于TCGA数据库肺癌数据信息, 将肺腺癌患者分为TRIB3高表达组(90%~100%, n = 58) 和TRIB3低表达组(0%~10%, n = 58)。采用GSEA基因富集方法分析TRIB3和NRF2信号之间的关系, 结果显示, TRIB3高表达组患者NRF2信号显著富集(图 1A)。采用基因载体pGMARE-luc和对照报告基因载体pRL-TK共转染TRIB3, 发现在TRIB3低表达的人非小细胞肺腺癌NCI-H157细胞中, 过表达TRIB3可增强NRF2的转录激活活性(图 1B); 在TRIB3高表达的人非小细胞肺腺癌PC9细胞上, 敲低TRIB3则抑制NRF2的转录激活活性(图 1C)。进一步采用荧光实时定量PCR检测TRIB3对NRF2靶基因转录的影响, 结果显示, 在NCI-H157细胞中过表达TRIB3后, NRF2抗氧化的靶基因即血红素氧合酶-1 (HMOX1)、苯琨还原酶1 (NQO1)、谷氨酰半胱氨酸连接酶催化亚基(GCLC) 和谷氨酰半胱氨酸连接酶修饰亚基(GCLM) 的表达均显著增加(图 1D)。在PC9细胞中敲低TRIB3后, 上述NRF2靶基因的表达显著降低(图 1E)。上述结果提示, TRIB3在非小细胞肺癌中能够增强NRF2的转录激活活性, 促进其下游靶基因表达。
|
Figure 1 Tribbles homolog 3 (TRIB3) promotes the transcriptional activity of nuclear factor erythroid 2-related factor 2 (NRF2) and enhances NRF2 antioxidative targets expression. A: Gene set enrichment (GSEA) enrichment plot for NRF2 gene signatures in TRIB3 high group and TRIB3 low group of lung adenocarcinoma patients from the cancer genome atlas (TCGA) database; B: Transcriptional activity of NRF2 in NCI-H157 cells with or without TRIB3 overexpression was measured by antioxidant response element (ARE)-driven luciferase report assay; C: Transcriptional activity of NRF2 in PC9 cells stably expressed control-shRNA or TRIB3-shRNA; D: Relative mRNA fold change of NRF2 downstream genes in NCI-H157 cells with or without TRIB3 overexpression; E: Relative mRNA fold change of NRF2 downstream genes in PC9 cells stably expressed control-shRNA or TRIB3-shRNA. n = 3, mean ± standard error of the mean (SEM). *P < 0.05, **P < 0.01, ***P < 0.001. HMOX1: Heme oxygenase 1; NQO1: NADP(H): quinone oxidoreductase 1; GCLC: Glutamate-cysteine ligase catalytic subunit; GCLM: Glutamate-cysteine ligase modifier subunit; shRNA: Short hairpin RNA |
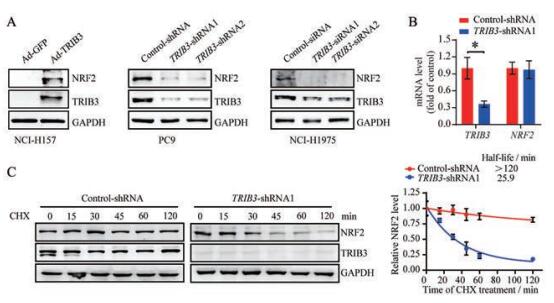
为明确TRIB3增强NRF2转录激活活性是否与其上调NRF2表达相关, 采用免疫印迹检测TRIB3对NRF2表达的影响。结果发现, NCI-H157过表达TRIB3上调NRF2蛋白表达; 而在PC9和NCI-H1975细胞上敲低TRIB3可明显减少NRF2表达量(图 2A)。实时荧光定量PCR检测结果显示, 敲低TRIB3并不影响NRF2的mRNA水平(图 2B), 提示TRIB3可能通过调节NRF2蛋白稳定性上调其表达。为验证上述假说, 采用蛋白合成抑制剂放线菌酮(CHX) 阻断NRF2从头合成途径, 进而检测TRIB3对NRF2稳定性的影响。结果显示, 敲低TRIB3后, NRF2蛋白降解半衰期缩短, 稳定性下降(图 2C)。以上结果提示, TRIB3通过增强NRF2稳定性上调其蛋白表达。
|
Figure 2 TRIB3 inhibits the degradation of NRF2. A: Western blot analyses of TRIB3 and NRF2 expression in the indicated NSCLC cell lines with TRIB3 manipulation; B: NRF2 and TRIB3 mRNA expression in control or TRIB3-silenced PC9 cells were determined by real-time quantitative PCR (qPCR); C: Control or TRIB3-silenced PC9 cells were treated with cycloheximide (CHX) at indicated intervals, and protein stability of NRF2 was analyzed by Western blot. n = 3, mean ± SEM. *P < 0.05. GFP: Green fluorescent protein; GAPDH: Glyceraldehyde-3-phosphate dehydrogenase |
研究发现, KEAP1经泛素连接酶cullin3介导的NRF2泛素化是促进NRF2降解的主要途径[4, 18, 19]。在非小细胞肺癌PC9中进行的免疫共沉淀研究发现, TRIB3与KEAP1具有相互作用(图 3A), 而TRIB3与KEAP1之间的相互作用可抑制KEAP1-NRF2相互作用(图 3B), 进而抑制NRF2泛素化(图 3C)。这些结果提示, TRIB3主要通过抑制KEAP1-NRF2相互作用, 增强NRF2稳定性, 进而促进NRF2表达。

|
Figure 3 TRIB3 interrupts the interaction between KEAP1 and NRF2. A: Co-immunoprecipitation (co-IP) assay analyzes the interaction of TRIB3 and KEAP1 in PC9 cells; B: Co-IP assay analyzes the effect of TRIB3 on the interaction between KEAP1 and NRF2; C: Co-IP assay analyzes the effect of TRIB3 on the ubiquitination of NRF2. IgG: Immunoglobulin G; KEAP1: Kelch-like ECH-associated protein-1; DDK: DYKDDDDK tag; NRS: Normal rabbit serum; Ub: Ubiquitin |
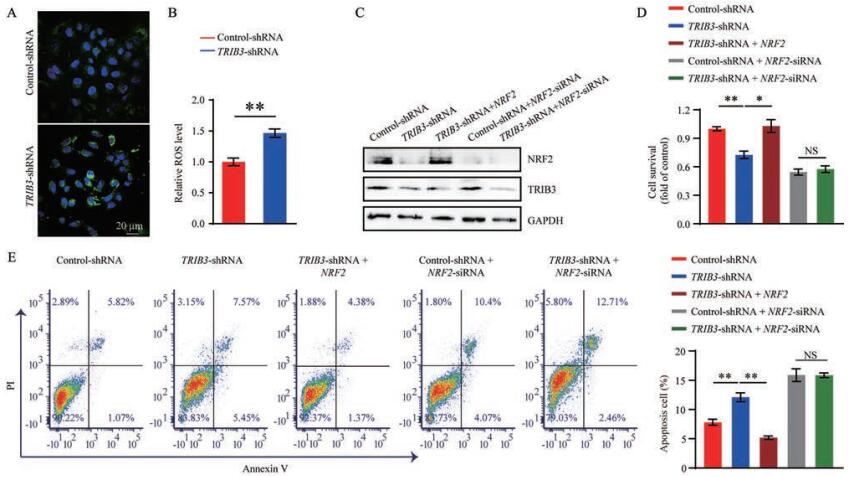
为确认TRIB3通过维持NRF2稳定性降低细胞内氧化还原水平, 进而促进非小细胞肺癌增殖, 作者首先运用DCFH-DA活性氧荧光探针检测细胞内氧化还原水平。结果显示, 敲低肺癌细胞PC9中TRIB3后, 肿瘤细胞内DCF荧光强度显著增加(图 4A、B)。采用Countstar细胞计数仪测定细胞增殖情况, 发现对照细胞敲低TRIB3后, 肿瘤细胞增殖能力显著降低; 过表达NRF2可逆转敲低TRIB3引起的细胞增殖速度减慢; 而在NRF2敲低的肿瘤细胞中抑制TRIB3并不影响细胞增殖(图 4C、D)。这些结果说明, 敲低TRIB3抑制肿瘤细胞增殖, 同时TRIB3促进肿瘤细胞增殖与其上调NRF2表达相关。
|
Figure 4 NRF2 is required for TRIB3 to restore redox balance and facilitate cancer cell proliferation. A: Immunofluorescent staining of reactive oxygen species (ROS) by 2, 7-dichlorodihydrofluorescein diacetate (DCFH-DA) in PC9 cells stably expressed control-shRNA or TRIB3-shRNA. Scale bar: 20 μm; B: ROS levels, as indicated by DCF fluorescence, were measured by flow cytometry in control or TRIB3-silenced PC9 cells; C: Western blot analyses of TRIB3 and NRF2 expression in the indicated cells; D: Cell proliferation was measured by Countstar cell analyzers in indicated cells transfected with indicated siRNA; E: Apoptosis levels were assessed by Annexin V/PI flow cytometry after 18 h treatment of 30 μmol·L-1 carboplatin. n = 3, mean ± SEM. *P < 0.05, **P < 0.01. NS: Non-significance; PI: Propidium iodide |
肺癌治疗中常用的铂类化疗药物, 如顺铂、卡铂等均可通过诱导细胞内产生大量ROS, 促进凋亡通路活化, 进而发挥抗肿瘤效果。为确认TRIB3对铂类药物化疗敏感性的影响, 采用Annexin V 633细胞凋亡检测试剂盒检测TRIB3对卡铂所致细胞凋亡的影响。结果发现, 敲低TRIB3显著增强卡铂诱导的细胞凋亡, 过表达NRF2可逆转敲低TRIB3产生的促凋亡效应; 而在NRF2敲低的细胞中抑制TRIB3并不会进一步增强细胞凋亡(图 4E)。以上结果表明, TRIB3介导的促增殖、抗凋亡作用与其上调NRF2水平密切相关。
讨论肺癌是世界范围内发病率和死亡率排名前列的恶性肿瘤, 其中非小细胞肺癌是最为常见的肺癌类型, 约占肺癌总数的85%左右。在过去的20年里, 随着分子靶向治疗和免疫治疗的应用, 非小细胞肺癌的临床治疗取得巨大进步。然而, 由于大多数非小细胞肺癌患者由于肿瘤缺乏有效生物标志物及免疫治疗不敏感, 化疗仍为肺癌首选的治疗方式[20]。肿瘤复发或化疗耐药问题依然是肺癌治疗面临的主要挑战。在正常细胞中, NRF2是维持氧化还原稳态以抵御外界不良刺激的关键转录因子。在肺癌细胞中, 大量表达转录因子NRF2不仅促进肺癌细胞在多种应激条件下增殖, 同时引发肺癌耐药发生[3, 7]。NRF2下游靶基因NQO1、HMOX1、GCLC和GCLM主要介导NRF2抗氧化功能, 进而维持肿瘤细胞在缺氧、营养匮乏和内质网应激等应激环境中存活。顺铂、卡铂等铂类药物以及泰素、博来霉素、多柔比星等其他常见化疗药物也主要是通过促进ROS诱导细胞凋亡产生抗肿瘤作用。上调NRF2的下游抗氧化靶基因也因此参与肿瘤细胞化疗药物耐药的形成。不仅如此, NRF2还可直接上调多药耐药相关蛋白家族成员MRP1 (multidrug resistance-associated protein 1)、MRP2、MRP3的表达, 共同参与肺癌耐药的形成[21]。本研究中, 作者发现肿瘤细胞内异常高表达的应激蛋白TRIB3通过增强NRF2表达调控细胞内氧化还原稳态, 进而促进肿瘤在应激条件下存活, 同时降低肺癌细胞对化疗药物卡铂的敏感性。靶向TRIB3降低其表达可上调细胞内ROS, 进而抑制肺癌增殖并增加化疗药物卡铂的敏感性, 因此TRIB3可能成为肺癌治疗的新药靶。
假性激酶TRIB3具有激酶样结构域, 但因缺乏ATP结合位点, 因而没有激酶活性, 主要是通过蛋白-蛋白相互作用发挥生物学效果。作者实验室近年来围绕TRIB3的促癌机制展开多项研究, 证实TRIB3可通过与p62、PML-RARα、β-catenin、EGFR等关键促肿瘤蛋白相互作用, 促进白血病及多种实体肿瘤的恶性进展[10-17]。在肺癌中, 作者既往研究探讨了TRIB3对促增殖信号的影响, 证实TRIB3通过与EGFR相互作用, 募集PKCα与EGFR形成复合物, 催化EGFR发生Thr654位磷酸化及后续的K63泛素化修饰。这种泛素化修饰促进EGFR回膜循环, 增强EGFR稳定性并促进非小细胞肺癌恶性进展[13]。本研究主要从TRIB3调控细胞内氧化还原稳态的角度, 探讨了在应激条件下TRIB3促进肿瘤细胞存活并抑制凋亡的分子机制。本研究结果表明, TRIB3主要通过与KEAP1相互作用, 抑制KEAP1-NRF2相互作用进而增强NRF2稳定性、上调NRF2表达。明确TRIB3与NRF2之间的作用关系不仅有助于解析应激条件下肿瘤细胞NRF2高表达的分子机制, 同时可完善TRIB3促进肺癌恶性进展的机制研究。
综上所述, 本研究有助于阐明肿瘤细胞内内质网应激及氧化还原应激调控的关键机制, 为设计和开发新型抗肿瘤药物并克服肺癌耐药提供了理论基础。
作者贡献: 花芳、崔冰负责实验设计和指导, 以及提供研究经费支持; 余娇娇负责实验方案实施及实验数据采集处理; 张诚和向昱瑾参与部分分子生物学实验和细胞实验; 胡卓伟审校。
利益冲突: 文章内容不涉及相关利益冲突, 无作者署名争议。
| [1] |
Hayes JD, Dinkova-Kostova AT, Tew KD. Oxidative stress in cancer[J]. Cancer Cell, 2020, 38: 167-197. DOI:10.1016/j.ccell.2020.06.001 |
| [2] |
Liu WJ, Du Y, Wen R, et al. Drug resistance to targeted therapeutic strategies in non-small cell lung cancer[J]. Pharmacol Ther, 2020, 206: 107438. DOI:10.1016/j.pharmthera.2019.107438 |
| [3] |
Rojo de la Vega M, Chapman E, Zhang DD. NRF2 and the hallmarks of cancer[J]. Cancer Cell, 2018, 34: 21-43. DOI:10.1016/j.ccell.2018.03.022 |
| [4] |
Cuadrado A, Rojo AI, Wells G, et al. Therapeutic targeting of the NRF2 and KEAP1 partnership in chronic diseases[J]. Nat Rev Drug Discov, 2019, 18: 295-317. DOI:10.1038/s41573-018-0008-x |
| [5] |
Liu Y, Tao S, Liao L, et al. TRIM25 promotes the cell survival and growth of hepatocellular carcinoma through targeting Keap1-Nrf2 pathway[J]. Nat Commun, 2020, 11: 348. DOI:10.1038/s41467-019-14190-2 |
| [6] |
DeNicola GM, Chen PH, Mullarky E, et al. NRF2 regulates serine biosynthesis in non-small cell lung cancer[J]. Nat Genet, 2015, 47: 1475-1481. DOI:10.1038/ng.3421 |
| [7] |
Homma S, Ishii Y, Morishima Y, et al. Nrf2 enhances cell proliferation and resistance to anticancer drugs in human lung cancer[J]. Clin Cancer Res, 2009, 15: 3423-3432. DOI:10.1158/1078-0432.CCR-08-2822 |
| [8] |
Zhang L, Chen Q, Wang J. Advances in anti-tumor drug research based on reactive oxygen regulation[J]. Acta Pharm Sin (药学学报), 2020, 55: 1453-1465. |
| [9] |
Abed DA, Goldstein M, Albanyan H, et al. Discovery of direct inhibitors of Keap1-Nrf2 protein-protein interaction as potential therapeutic and preventive agents[J]. Acta Pharm Sin B, 2015, 5: 285-299. DOI:10.1016/j.apsb.2015.05.008 |
| [10] |
Hua F, Li K, Yu JJ, et al. TRB3 links insulin/IGF to tumour promotion by interacting with p62 and impeding autophagic/proteasomal degradations[J]. Nat Commun, 2015, 6: 7951. DOI:10.1038/ncomms8951 |
| [11] |
Cui B, Patrick AE, Leonard LD, et al. Highlights of the 2nd International Symposium on Tribbles and Diseases: tribbles tremble in therapeutics for immunity, metabolism, fundamental cell biology and cancer[J]. Acta Pharm Sin B, 2019, 9: 443-454. DOI:10.1016/j.apsb.2018.12.007 |
| [12] |
Hua F, Shang S, Yang YW, et al. TRIB3 interacts with β-catenin and TCF4 to increase stem cell features of colorectal cancer stem cells and tumorigenesis[J]. Gastroenterology, 2019, 156: 708-721. DOI:10.1053/j.gastro.2018.10.031 |
| [13] |
Yu JJ, Zhou DD, Yang XX, et al. TRIB3-EGFR interaction promotes lung cancer progression and defines a therapeutic target[J]. Nat Commun, 2020, 11: 3660. DOI:10.1038/s41467-020-17385-0 |
| [14] |
Yu JM, Sun W, Wang ZH, et al. TRIB3 supports breast cancer stemness by suppressing FOXO1 degradation and enhancing SOX2 transcription[J]. Nat Commun, 2019, 10: 5720. DOI:10.1038/s41467-019-13700-6 |
| [15] |
Li K, Wang F, Cao WB, et al. TRIB3 promotes APL progression through stabilization of the oncoprotein PML-RARα and inhibition of p53-mediated senescence[J]. Cancer Cell, 2017, 31: 697-710. e7. DOI:10.1016/j.ccell.2017.04.006 |
| [16] |
Li K, Zhang TT, Wang F, et al. Metformin suppresses melanoma progression by inhibiting KAT5-mediated SMAD3 acetylation, transcriptional activity and TRIB3 expression[J]. Oncogene, 2018, 37: 2967-2981. DOI:10.1038/s41388-018-0172-9 |
| [17] |
Yeerjiang Z, Wang F, Yang Z, et al. TRIB3 promotes B-ALL progression by suppressing CTSZ-mediated BCR-ABL degradation[J]. Acta Pharm Sin (药学学报), 2020, 55: 2628-2635. |
| [18] |
Kobayashi A, Kang MI, Okawa H, et al. Oxidative stress sensor Keap1 functions as an adaptor for Cul3-based E3 ligase to regulate proteasomal degradation of Nrf2[J]. Mol Cell Biol, 2004, 24: 7130-7139. DOI:10.1128/MCB.24.16.7130-7139.2004 |
| [19] |
Zhang DD, Lo SC, Cross JV, et al. Keap1 is a redox-regulated substrate adaptor protein for a Cul3-dependent ubiquitin ligase complex[J]. Mol Cell Biol, 2004, 24: 10941-10953. DOI:10.1128/MCB.24.24.10941-10953.2004 |
| [20] |
Herbst RS, Morgensztern D, Boshoff C. The biology and management of non-small cell lung cancer[J]. Nature, 2018, 553: 446-454. DOI:10.1038/nature25183 |
| [21] |
Young LC, Campling BG, Cole SP, et al. Multidrug resistance proteins MRP3, MRP1, and MRP2 in lung cancer: correlation of protein levels with drug response and messenger RNA levels[J]. Clin Cancer Res, 2001, 7: 1798-1804. |
 2021, Vol. 56
2021, Vol. 56


