2. 安徽医科大学基础医学院, 安徽 合肥 230032
2. School of Basic Medicine, Anhui Medical University, Hefei 230032, China
类风湿关节炎(rheumatoid arthritis, RA) 是一种慢性炎症性自身免疫性疾病, 其基本病理特征是血管新生、关节滑膜炎、滑膜组织增生、血管翳形成, 以及关节软骨和骨的破坏[1]。血管新生为炎症部位输送炎性细胞和炎性因子, 维持RA慢性炎症状态; 促进血管翳形成和发展, 导致关节软骨的侵蚀和破坏。抑制滑膜血管新生可减轻滑膜炎症, 抑制血管翳形成, 从而缓解RA病情。RA中大量滑膜细胞增殖, 使得对氧的需求增加, 造成滑膜局部缺氧。在这种缺氧微环境中, 缺氧诱导因子(hypoxia-inducible factor, HIF) 水平升高(尤其是HIF-1α), 激活下游靶基因转录, 如血管内皮生长因子(vascular endothelial growth factor, VEGF)。VEGF可诱导内皮细胞中的怀布尔-帕拉德体(Weibel-Palade body, WPB) 释放血管生成素-2 (angiopoietin-2, Ang-2), 协同促进血管新生。本文通过在PubMed和中国知网数据库检索“HIF”、“VEGF”、“Ang-2”、“血管新生”和“RA”等关键词并梳理相关文献, 阐述HIF-VEGF-Ang-2信号转导介导的滑膜血管新生对RA的作用及其机制, 以期通过靶向HIF-VEGF-Ang-2信号转导, 抑制滑膜血管新生, 为RA治疗提供新思路。
1 血管新生血管新生是指在已有血管基础上形成新毛细血管的过程, 该过程受多种分子调控。正常情况下的促血管生成因子与抑血管生成因子处于动态平衡, 当受到某些因素刺激时, 促血管生成因子占优势, 促进血管新生。生理性血管新生在胚胎形成和创面愈合中发挥关键作用, 而病理性血管新生则会加快某些疾病的发展, 如RA和肿瘤等。RA关节滑膜内皮衬里细胞释放基质金属蛋白酶(matrix metalloproteinases, MMPs), 降解内皮细胞基底膜, 使周细胞脱落, 内皮细胞向血管周围基质迁移, 并增殖和黏附形成管腔。管腔交汇形成血管袢, 经基质重构、周细胞和血管平滑肌细胞缠绕及血管吻合形成血管网[2]。有研究发现, 与骨关节炎患者相比, RA患者滑膜组织中MMP14、VEGF和血管生成标记物CD31表达显著增加[3]。促血管生成因子如生长因子(VEGF、HIF和Ang)、MMPs、趋化因子以及促炎细胞因子在滑膜血管新生中直接或间接地发挥作用。其中, HIF、VEGF和Ang-2组成的信号转导在滑膜血管新生中发挥关键作用。
2 HIF-VEGF-Ang-2信号转导 2.1 HIF缺氧诱导因子(HIF) 是调节细胞对氧环境改变适应性的异源二聚体核转录因子, 由氧依赖性的α亚基和细胞核中组成性表达的β亚基构成[4]。HIF-α分为HIF-1α、HIF-2α和HIF-3α。HIF-1α和HIF-2α结构相似(图 1), 均含有碱性螺旋-环-螺旋(basic helix loop helix, bHLH) 结构域、PAS (PER-ARNT-SIM) 结构域、反式激活结构域(transactivation domains, N-TAD, C-TAD) 以及氧依赖性降解结构域(oxygen-dependent degradation domain, ODDD)。其中, bHLH结构域可与缺氧反应元件(hypoxia response element, HRE) 结合, PAS结构域是HIF-α与HIF-β结合形成二聚体的部位, C-TAD与转录共激活因子p300/CBP结合[CBP: 环腺苷酸效应元件结合蛋白结合蛋白(cyclic adenosine monophosphate response element binding protein binding protein)], 激活缺氧相关基因转录。HIF-3α也含有类似结构(图 1), 但其缺乏C-TAD, 不具有激活靶基因转录的活性[5]。HIF-1α在所有组织中表达, 是最主要的氧调节因子, 而HIF-2α的表达具有组织选择性。
2019年诺贝尔生理学或医学奖获得者美国医学家威廉·凯林(William G. Kaelin Jr.)、格雷格·塞门扎(Gregg L. Semenza) 和英国细胞和分子生物学家彼得·拉特克利夫(Peter J. Ratcliffe) 提出细胞感知和适应氧气的机制, 揭示细胞可以通过希佩尔-林道病肿瘤抑制基因(von Hippel-Lindau, VHL)/HIF信号通路适应氧环境变化。VHL位于人类第3号染色体短臂上, 表达肿瘤抑制蛋白(protein von Hippel-Lindau, pVHL), 该蛋白是E3泛素连接酶复合物的识别底物, 介导HIF-α泛素化, 使HIF-α被蛋白酶体降解。HIF-α脯氨酸残基羟基化调节VHL对HIF-α的降解作用, 这一羟基化过程由脯氨酸羟化酶(prolyl hydroxylase domains, PHDs) 完成。PHD是一种氧依赖性双加氧酶, 主要有PHD1、PHD2、PHD3和PHD4。HIF-1α和HIF-2α脯氨酸残基的羟基化分别由PHD2和PHD3完成[5]。
HIF-1α的表达受多种信号通路调控, 如氧依赖性通路PHDs/HIF-1α/pVHL, 以及非氧依赖性通路核因子κB、c-Jun氨基末端激酶/信号转导及转录激活蛋白和磷脂酰肌醇3-激酶/蛋白激酶B等[6]。在这些信号通路中, PHDs/HIF-1α/pVHL信号通路发挥主要作用。常氧条件下, HIF-1α的ODDD中脯氨酸残基(Pro402和Pro564) 被PHD2羟基化, 然后被pVHL识别, 经泛素-蛋白酶体途径降解。此外, HIF-1抑制因子(factor-inhibiting HIF-1, FIH-1) 羟基化HIF-1α的C-TAD中的天冬酰胺残基(Asn803), 阻止其与p300/CBP结合, 从而抑制HIF-1α激活缺氧相关基因转录的活性。低氧条件下, PHD2和FIH-1羟化作用受抑制, pVHL不能识别HIF-1α, 导致HIF-1α降解减少并在细胞质中积累, 然后转移至细胞核中与HIF-1β二聚化, HIF-1异源二聚体被p300/CBP识别, 并与靶基因启动子上游的HRE结合, 启动该基因的转录[4]。
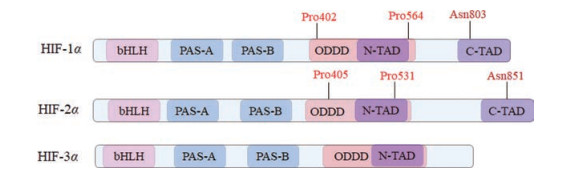
|
Figure 1 The structures of HIF-α. HIF: Hypoxia-inducible factor; bHLH: Basic helix loop helix; PAS: PER-ARNT-SIM; ODDD: Oxygen-dependent degradation domain; TAD: Transactivation domain |
RA关节中大量滑膜细胞增殖引起的缺氧导致HIF-1α在胞质中积聚, 并移位至细胞核与HIF-1β和p300/CBP结合, 最终诱导巨噬细胞样和成纤维细胞样滑膜细胞表达VEGF、肿瘤坏死因子-α (tumor necrosis factor-α, TNF-α)、白细胞介素-6 (interleukin-6, IL-6)、IL-8以及基质金属蛋白酶(MMP-1、MMP-3和MMP-13)[7], 从而诱导滑膜血管新生, 加重滑膜炎症和关节软骨的破坏。HIF-2α的表达也受氧依赖性途径PHDs/HIF-2α/pVHL的调控。低氧条件下, HIF-2α激活下游靶基因VEGF转录, 促进血管新生[8]。
2.2 VEGFVEGF是一种非常重要的促血管生成因子, 可作为血管内皮细胞的特异性有丝分裂原, 促进内皮细胞增殖和迁移, 同时还可以促进间质胶原酶分泌, 降解细胞基质, 在血管新生中发挥核心作用。VEGF家族包括VEGF-A、VEGF-B、VEGF-C、VEGF-D、VEGF-E、VEGF-F以及胎盘生长因子, 其中VEGF-A是最有效的促血管生成因子。血管内皮生长因子受体(vascular endothelial growth factor receptors, VEGFRs) 有酪氨酸激酶受体VEGFR-1、VEGFR-2和VEGFR-3, 以及非酪氨酸激酶受体如神经纤维网蛋白[9], 酪氨酸激酶受体是VEGF最主要的功能受体。VEGFR-1和VEGFR-2主要分布在血管内皮表面, 调节血管新生。VEGFR-3主要分布在淋巴内皮表面, 调节淋巴管生成。VEGF-A与VEGFR-1结合的亲和力高, 但VEGFR-1的酪氨酸激酶活性低于VEGFR-2, 故VEGFR-2是VEGF最重要的受体。
VEGF与滑膜血管内皮上的受体结合, 促进滑膜血管新生, 增加血管通透性和炎性因子的释放。在RA患者的血清中, VEGF水平较高, 并与滑膜炎严重程度和疾病活动性密切相关[10]。Li等[11]采用胶原诱导的关节炎(collagen-induced arthritis, CIA) 小鼠模型研究芹菜素对RA的治疗作用, 发现芹菜素可显著降低CIA小鼠滑膜组织中VEGF、VEGFR-1和VEGFR-2的蛋白表达水平, 从而抑制滑膜血管新生, 发挥对RA的治疗作用。
2.3 AngAng分为Ang-1、Ang-2、Ang-3和Ang-4。其中Ang-1和Ang-2在血管新生中发挥重要作用。酪氨酸激酶受体-2 (tyrosine kinase receptors with immunoglobulin and EGF homology domains-2, Tie-2) 为Ang的特异性受体, 主要由血管内皮细胞分泌。现有研究发现, 周细胞可以分泌少量Tie-2, 加强与内皮细胞的连接[12]。Tie-1为孤儿受体, 目前尚未发现能与其特异性结合的配体。Ang-1主要由周细胞表达, 通过旁分泌方式与内皮细胞上的Tie-2结合, 促进内皮细胞迁移和黏附。此外, Ang-1也可以通过自分泌方式作用于周细胞, 促进周细胞向内皮细胞募集, 包绕新生血管, 促进血管成熟和稳定, 在伤口愈合中发挥重要作用[13]。
Ang-2由内皮细胞分泌并储存在其特异性细胞器怀布尔-帕拉德体(WPB) 中。WPB是由血管性血友病因子(von Willebrand factor, vWF) 聚合形成的杆状细胞器, 在TNF、缺氧和VEGF等刺激下, WPB会迅速释放Ang-2[14]。Ang-2竞争性结合Tie-2, 抑制Ang-1作用。在非炎症环境中, Ang-2可作为Tie-2的弱激动剂; 而在炎症环境中, Ang-2主要起拮抗作用[14]。在RA患者滑膜组织中, Ang-2高表达[15], 抑制周细胞中Ang-1/Tie-2自分泌信号, 促进周细胞脱离血管内皮细胞, 使得内皮细胞去稳定, 这是内皮细胞出芽、迁移的关键步骤。裸露的血管内皮细胞在VEGF诱导下出芽、迁移并逐渐形成新的血管; VEGF不存在时, 原有血管则会退化。缺乏周细胞覆盖的血管不成熟, 结构和功能不完整, 通透性增大[16]。Ang-2在肿瘤血管内皮细胞中高表达, 诱导紊乱、渗漏的肿瘤微血管形成, 促进肿瘤细胞的侵袭和转移[17]。Kayakabe等[18]发现, IL-6上调VEGF和Ang-2的表达, 下调Ang-1的表达, 诱导滑膜形成不稳定和不成熟的微血管。
2.4 HIF-VEGF-Ang-2在RA滑膜缺氧微环境中, PHDs和FIH活性降低, HIF-1α和HIF-2α在胞质中降解受阻, 大量积聚, 并移位至细胞核中分别与HIF-1β和HIF-2β结合形成异源二聚体, 与p300/CBP相互作用形成复合物, 然后结合VEGF启动子上游核心序列为5'-A/GCGTG-3'的HRE, 形成转录起始复合物, 启动VEGF的转录, 使得滑膜巨噬细胞和成纤维细胞VEGF表达增加。VEGF与VEGFR, 尤其是VEGFR-2结合后, 刺激内皮细胞中的WPB释放Ang-2。Ang-2竞争性地结合Tie-2, 抑制Ang-1自分泌作用, 使嵌入血管内皮细胞表层基底膜中的周细胞脱落, 解除周细胞与内皮细胞连接。VEGF诱导活化的内皮细胞出芽, 启动血管新生(图 2)。
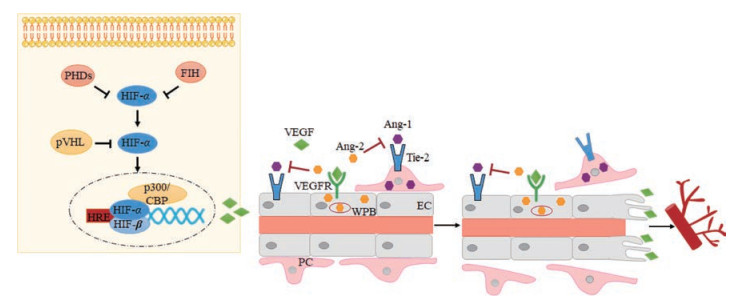
|
Figure 2 Mechanism of HIF-VEGF-Ang-2 signal transduction. In synovial hypoxia microenvironment of rheumatoid arthritis (RA), the activity of PHDs and FIH decrease. HIF-α accumulates and migrates to the nucleus, where it binds to HIF-β and p300/CBP to form a complex. The complex binds to the HRE of VEGF, activating VEGF transcription. VEGF-VEGFR binding stimulates WPB to release Ang-2. Ang-2 binds to Tie-2 competitively, inhibiting the recruitment of pericyte by Ang-1 and leaving endothelial cells exposed. Under the induction of VEGF, activated endothelial cells sprout and form new microvessels gradually. PHDs: Prolyl hydroxylase domains; FIH: Factor-inhibiting HIF; CBP: Cyclic adenosine monophosphate response element binding protein binding protein; pVHL: Protein von Hippel-Lindau; HRE: Hypoxia response element; VEGF: Vascular endothelial growth factor; VEGFR: Vascular endothelial growth factor receptor; Ang: Angiopoietin; Tie-2: Tyrosine kinase receptors with immunoglobulin and EGF homology domains-2; WPB: Weibel-Palade body; EC: Endothelial cell; PC: Pericyte |
Forsythe等[19]于1996年研究发现, HIF-1α可以与VEGF上的HRE结合, 激活VEGF转录。随后, Carroll等[20]发现, HIF-2α可以激活肾癌细胞中VEGF的转录。这表明VEGF是HIF-1α和HIF-2α共同的靶基因。Ryu等[21]在CIA小鼠和RA患者滑膜组织中检测到HIF-1α和HIF-2α高表达。构建短发卡RNA (short hairpin RNA, shRNA) 慢病毒表达载体, 转染CIA大鼠滑膜细胞干扰HIF-1α, 可以显著降低VEGF的蛋白表达水平, 并减少滑膜新生血管数量[22]。目前的研究证实, HIF/VEGF信号途径可以促进滑膜血管新生[23]。有研究发现, VEGF与内皮细胞上的VEGFR-2结合可以诱导人脐静脉内皮细胞中的WPB释放vWF和Ang-2[24]。与正常大鼠相比, CIA大鼠滑膜组织中VEGF的mRNA水平和Ang-2蛋白表达水平明显升高[25]。Jiang等[26]研究表明, 外源性VEGF可以显著增加离体RA患者滑膜组织中Ang-2蛋白表达, 并发现IL-35可通过抑制VEGF/Ang-2信号途径, 抑制RA滑膜血管新生。
3 滑膜血管新生在类风湿关节炎中的作用RA初期, 滑膜衬里层的巨噬细胞样和成纤维细胞样滑膜细胞大量增殖。同时, 滑膜下层被CD4+ T细胞、B细胞和巨噬细胞浸润[27]。滑膜细胞过度增殖以及炎症细胞迁移, 使得滑膜对氧的需求增加; 此外, 滑膜增生导致滑膜细胞与邻近血管的距离增加, 超过氧的扩散范围, 使得氧供不足; 同时, 滑膜液运动和积聚破坏滑膜的血管系统, 导致血供不足, 从而加剧缺氧[28]。HIF-α响应缺氧, 刺激巨噬细胞样和成纤维细胞样滑膜细胞表达大量的VEGF, VEGF诱导内皮细胞中的WPB释放Ang-2, HIF-VEGF-Ang-2信号转导被激活, 诱导滑膜血管新生, 改善滑膜组织缺氧, 但由于新生血管的结构和功能异常, RA滑膜仍维持缺氧状态。RA后期主要表现为大量微血管形成。新生微血管向炎性滑膜输送炎症细胞, 促进炎性因子释放, 加重RA滑膜炎症。同时, 新生血管、炎症细胞和滑膜细胞共同构成血管翳, 侵蚀、破坏关节软骨和骨, 导致关节变薄, 发黏和破裂, 严重时导致关节功能丧失[27]。
RA滑膜新生血管的数量与滑膜增生、关节肿胀和关节破坏程度密切相关。抑制滑膜血管新生, 可以有效治疗RA。Xu等[29]建立CIA小鼠模型, 采用免疫组织化学法和酶联免疫吸附法检测VEGF和HIF-1α水平, 进行关节炎指数评分、组织病理学评分和滑膜微血管密度(microvessel density, MVD) 分析, 探究紫杉醇对RA的治疗作用及其机制, 发现紫杉醇可通过下调HIF-1α和VEGF水平, 抑制滑膜血管新生, 从而降低CIA小鼠的关节炎指数评分和MVD, 并改善其关节骨的破坏。
4 靶向HIF-VEGF-Ang-2信号转导目前, 治疗RA的药物主要有糖皮质激素、非甾体抗炎药(nonsteroidal antiinflammatory drugs, NSAIDs)、传统合成病情缓解抗风湿药物(conventional synthetic disease-modifying antirheumatic drugs, csDMARDs) 和生物病情缓解抗风湿药物(biologic disease-modifying antirheumatic drugs, bDMARDs)。糖皮质激素不良反应较多, 仅在短期内低剂量联合DMARDs用于RA患者早期治疗。NSAIDs的作用主要是减轻炎症, 缓解疼痛, 但不能抑制关节破坏。甲氨蝶呤(methotrexate, MTX) 是一线csDMARDs, 可单用或与其他DMARDs联合使用, 其治疗RA存在剂量依赖性反应, 高剂量MTX容易产生肝毒性、肾毒性和致癌等不良反应[30]。与csDMARDs相比, bDMARDs作用更明确, 针对性更强, 但长期使用这些药物会影响免疫功能, 增加感染风险[31]。现有治疗RA的药物存在一些毒副作用(表 1)[32, 33], 因此, 急需寻找高效、低毒的RA治疗药物。
| Table 1 Side effects of drugs for rheumatoid arthritis. NSAIDs: Non-steroidal anti-inflammatory drugs; csDMARDs: Conventional synthetic disease-modifying antirheumatic drugs; bDMARDs: Biologic disease-modifying antirheumatic drugs |
血管新生抑制疗法已经广泛应用于肿瘤治疗。靶向HIF-VEGF-Ang-2信号转导, 抑制滑膜血管新生, 可以有效缓解RA病情。目前, HIF抑制剂的研发思路主要是抑制HIF-α的mRNA水平和蛋白表达水平, 促进HIF-α降解, 抑制HIF-α和HIF-β的二聚化, 阻断HIF-α/p300蛋白-蛋白相互作用, 以及抑制HIF-α与靶基因结合等。非选择性HIF抑制剂有拓扑替康(topotecan)、多柔比星(doxorubicin) 和2-甲氧基雌二醇(2-methoxyestradio)。拓扑替康是美国批准用于治疗小细胞肺癌的二线化疗药物, 它可以在转录和翻译水平上抑制HIF-α, 并抑制VEGF的生成[34]。多柔比星用于乳腺癌的临床治疗, 可以阻断HIF-1α和HIF-2α与靶基因的结合[35, 36]。HIF-1α选择性抑制剂有棘霉素(echinomycin)、EZN-2968和壳聚糖(chetomin), 均未用于临床。棘霉素与VEGF上的HRE结合, 竞争性抑制HIF-1α与VEGF的结合[37], 已进入治疗实体瘤的Ⅱ期临床试验, 但由于其对难治性实体瘤未显示疗效, 被暂停研究。最近有研究发现, 将棘霉素制成纳米脂质体制剂可以有效抑制实体瘤生长和转移[38]。HIF-2α抑制剂有PT2385和PT2399, 均可抑制HIF-2α二聚化。
靶向VEGF/VEGFR信号通路的抗血管新生药物在临床上应用较多, 主要有单克隆抗体贝伐单抗(bevacizumab)、阿帕替尼(apatinib), 以及小分子多激酶抑制剂舒尼替尼(sunitinib)、索拉非尼(sorafenib) 和卡博替尼(cabozantinib)。贝伐单抗是第一个成功上市的抗肿瘤血管新生药物, 它可与VEGF-A选择性结合, 阻止VEGF-A与VEGFR结合[39]。阿帕替尼是我国自主研发的抗血管新生药物, 它通过与VEGFR-2结合, 抑制VEGF与VEGFR-2结合, 用于晚期胃癌治疗[40]。
目前, 靶向Ang-2的药物处于临床或临床前研究阶段。MEDI3617是抗Ang-2的单克隆抗体, 已进入治疗晚期实体瘤的Ⅰ期临床试验阶段。近期研究表明, MEDI3617治疗卵巢癌会出现严重水肿反应, 已终止研究[41]。LY-3127804作为抗Ang-2的单克隆抗体, 处于治疗晚期和转移性实体瘤的Ⅱ期临床试验阶段[42]。Faricimab是靶向VEGF-A和Ang-2的双特异性抗体, 处于治疗糖尿病性黄斑水肿的Ⅲ期临床试验阶段[43]。靶向HIF-VEGF-Ang-2信号转导药物的靶点或机制、临床试验阶段和治疗类型见表 2。
| Table 2 Summary of drugs targeting HIF-VEGF-Ang-2 signal transduction. PDGFR: Platelet-derived growth factor receptor; FDA: Food and Drug Administration; NMPA: National Medical Products Administration |
HIF-VEGF-Ang-2信号转导在滑膜血管新生中发挥关键作用, 靶向该信号转导, 抑制滑膜血管新生, 缓解RA病情, 为RA治疗提供新靶点。同时, 需要注意地是, 血管新生是多分子、多信号通路参与调控的复杂过程。因此, 探讨更多的信号通路在滑膜血管新生中的作用机制, 靶向多个信号通路, 可以更好地发挥抗血管新生作用, 更加有效地治疗RA。
作者贡献: 甘珮荣负责文章撰写及图表绘制; 刘超和吴虹提供文章的方向和思路; 董心同负责文献查找; 柯江涛和陈芳园负责语句修改和文章润色。
利益冲突: 所有作者均声明不存在利益冲突。
| [1] |
Ross CL, Ang DC, Almeida-Porada G. Targeting mesenchymal stromal cells/pericytes (MSCs) with pulsed electromagnetic field (PEMF) has the potential to treat rheumatoid arthritis[J]. Front Immunol, 2019, 10: 266. DOI:10.3389/fimmu.2019.00266 |
| [2] |
Balogh E, Biniecka M, Fearon U, et al. Angiogenesis in inflammatory arthritis[J]. Isr Med Assoc J, 2019, 5: 345-352. |
| [3] |
Chen Z, Wang H, Xia Y, et al. Therapeutic potential of mesenchymal cell-derived miRNA-150-5p-expressing exosomes in rheumatoid arthritis mediated by the modulation of MMP14 and VEGF[J]. J Immunol, 2018, 201: 2472-2482. DOI:10.4049/jimmunol.1800304 |
| [4] |
Guo X, Chen G. Hypoxia-inducible factor is critical for pathogenesis and regulation of immune cell functions in rheumatoid arthritis[J]. Front Immunol, 2020, 11: 1668. DOI:10.3389/fimmu.2020.01668 |
| [5] |
Serocki M, Bartoszewska S, Janaszak-Jasiecka A, et al. miRNAs regulate the HIF switch during hypoxia: a novel therapeutic target[J]. Angiogenesis, 2018, 21: 183-202. DOI:10.1007/s10456-018-9600-2 |
| [6] |
Sun MH, Wu H, Bu YH, et al. Research progress of signaling pathways involved in expression of hypoxia-inducible factor-1α in rheumatoid arthritis[J]. Chin Pharmacol Bull (中国药理学通报), 2019, 35: 1197-1202. |
| [7] |
Hua S, Dias TH. Hypoxia-inducible factor (HIF) as a target for novel therapies in rheumatoid arthritis[J]. Front Pharmacol, 2016, 7: 184. |
| [8] |
Befani C, Liakos P. The role of hypoxia-inducible factor-2 alpha in angiogenesis[J]. J Cell Physiol, 2018, 233: 9087-9098. DOI:10.1002/jcp.26805 |
| [9] |
Melincovici CS, Boşca AB, Şuşman S, et al. Vascular endothelial growth factor (VEGF)-key factor in normal and pathological angiogenesis[J]. Rom J Morphol Embryol, 2018, 59: 455-467. |
| [10] |
Kim JW, Kong JS, Lee S, et al. Angiogenic cytokines can reflect the synovitis severity and treatment response to biologics in rheumatoid arthritis[J]. Exp Mol Med, 2020, 52: 843-853. DOI:10.1038/s12276-020-0443-8 |
| [11] |
Li Y, Yang B, Bai JY, et al. The roles of synovial hyperplasia, angiogenesis and osteoclastogenesis in the protective effect of apigenin on collagen-induced arthritis[J]. Int Immunopharmacol, 2019, 73: 362-369. DOI:10.1016/j.intimp.2019.05.024 |
| [12] |
Teichert M, Milde L, Holm A, et al. Pericyte-expressed Tie2 controls angiogenesis and vessel maturation[J]. Nat Commun, 2017, 8: 16106. DOI:10.1038/ncomms16106 |
| [13] |
Yan M, Hu Y, Yao M, et al. GM-CSF ameliorates microvascular barrier integrity via pericyte-derived Ang-1 in wound healing[J]. Wound Repair Regen, 2017, 25: 933-943. DOI:10.1111/wrr.12608 |
| [14] |
Saharinen P, Eklund L, Alitalo K. Therapeutic targeting of the angiopoietin-TIE pathway[J]. Nat Rev Drug Discov, 2017, 16: 635-661. DOI:10.1038/nrd.2016.278 |
| [15] |
Balogh E, Veale DJ, McGarry T, et al. Oxidative stress impairs energy metabolism in primary cells and synovial tissue of patients with rheumatoid arthritis[J]. Arthritis Res Ther, 2018, 20: 95. DOI:10.1186/s13075-018-1592-1 |
| [16] |
Kazerounian S, Lawler J. Integration of pro- and anti-angiogenic signals by endothelial cells[J]. J Cell Commun Signal, 2018, 12: 171-179. DOI:10.1007/s12079-017-0433-3 |
| [17] |
Qian C, Zheng WW, Zou W, et al. Research progress on the role of Ang/Tie axis in angiogenesis and metastasis[J]. Acta Pharm Sin (药学学报), 2020, 55: 2291-2297. |
| [18] |
Kayakabe K, Kuroiwa T, Sakurai N, et al. Interleukin-6 promotes destabilized angiogenesis by modulating angiopoietin expression in rheumatoid arthritis[J]. Rheumatology (Oxford), 2012, 51: 1571-1579. DOI:10.1093/rheumatology/kes093 |
| [19] |
Forsythe JA, Jiang BH, Iyer NV, et al. Activation of vascular endothelial growth factor gene transcription by hypoxia-inducible factor 1[J]. Mol Cell Biol, 1996, 16: 4604-4613. DOI:10.1128/MCB.16.9.4604 |
| [20] |
Carroll VA, Ashcroft M. Role of hypoxia-inducible factor (HIF)-1alpha versus HIF-2 alpha in the regulation of HIF target genes in response to hypoxia, insulin-like growth factor-I, or loss of von Hippel-Lindau function: implications for targeting the HIF pathway[J]. Cancer Res, 2006, 66: 6264-6270. DOI:10.1158/0008-5472.CAN-05-2519 |
| [21] |
Ryu JH, Chae CS, Kwak JS, et al. Hypoxia-inducible factor-2α is an essential catabolic regulator of inflammatory rheumatoid arthritis[J]. PLoS Biol, 2014, 12: e1001881. DOI:10.1371/journal.pbio.1001881 |
| [22] |
Hu Y, Zhang T, Chen J, et al. Downregulation of hypoxia-inducible factor-1α by RNA interference alleviates the development of collagen-induced arthritis in rats[J]. Mol Ther Nucleic Acids, 2020, 19: 1330-1342. DOI:10.1016/j.omtn.2020.01.014 |
| [23] |
Li Y, Liu Y, Wang C, et al. Succinate induces synovial angiogenesis in rheumatoid arthritis through metabolic remodeling and HIF-1α/VEGF axis[J]. Free Radic Biol Med, 2018, 126: 1-14. DOI:10.1016/j.freeradbiomed.2018.07.009 |
| [24] |
Xiong Y, Huo Y, Chen C, et al. Vascular endothelial growth factor (VEGF) receptor-2 tyrosine 1175 signaling controls VEGF-induced von Willebrand factor release from endothelial cells via phospholipase C-gamma 1- and protein kinase A-dependent pathways[J]. J Biol Chem, 2009, 284: 23217-23224. DOI:10.1074/jbc.M109.019679 |
| [25] |
Guo Y, Xing E, Liang X, et al. Effects of total saponins from Rhizoma Dioscoreae Nipponicae on expression of vascular endothelial growth factor and angiopoietin-2 and Tie-2 receptors in the synovium of rats with rheumatoid arthritis[J]. J Chin Med Assoc, 2016, 79: 264-271. DOI:10.1016/j.jcma.2015.10.012 |
| [26] |
Jiang S, Li Y, Lin T, et al. IL-35 Inhibits angiogenesis through VEGF/Ang2/Tie2 pathway in rheumatoid arthritis[J]. Cell Physiol Biochem, 2016, 40: 1105-1116. DOI:10.1159/000453165 |
| [27] |
Leblond A, Allanore Y, Avouac J. Targeting synovial neoangiogenesis in rheumatoid arthritis[J]. Autoimmun Rev, 2017, 16: 594-601. DOI:10.1016/j.autrev.2017.04.005 |
| [28] |
Quiñonez-Flores CM, González-Chávez SA, Pacheco-Tena C. Hypoxia and its implications in rheumatoid arthritis[J]. J Biomed Sci, 2016, 23: 62. DOI:10.1186/s12929-016-0281-0 |
| [29] |
Xu J, Feng Z, Chen S, et al. Taxol alleviates collagen-induced arthritis in mice by inhibiting the formation of microvessels[J]. Clin Rheumatol, 2019, 38: 19-27. DOI:10.1007/s10067-017-3646-1 |
| [30] |
Wang W, Zhou H, Liu L. Side effects of methotrexate therapy for rheumatoid arthritis: a systematic review[J]. Eur J Med Chem, 2018, 158: 502-516. DOI:10.1016/j.ejmech.2018.09.027 |
| [31] |
Sparks JA. Rheumatoid arthritis[J]. Ann Intern Med, 2019, 170: ITC1-ITC16. |
| [32] |
Smolen JS, Aletaha D, Barton A, et al. Rheumatoid arthritis[J]. Nat Rev Dis Primers, 2018, 4: 18001. DOI:10.1038/nrdp.2018.1 |
| [33] |
Wilson JC, Sarsour K, Gale S, et al. Incidence and risk of glucocorticoid-associated adverse effects in patients with rheumatoid arthritis[J]. Arthritis Care Res (Hoboken), 2019, 71: 498-511. DOI:10.1002/acr.23611 |
| [34] |
Li Y, Liu Y, Du B, et al. Reshaping tumor blood vessels to enhance drug penetration with a multistrategy synergistic nanosystem[J]. Mol Pharm, 2020, 17: 3151-3164. DOI:10.1021/acs.molpharmaceut.0c00077 |
| [35] |
Portugal J. Challenging transcription by DNA-binding antitumor drugs[J]. Biochem Pharmacol, 2018, 155: 336-345. DOI:10.1016/j.bcp.2018.07.030 |
| [36] |
Peng S, Zhang J, Tan X, et al. The VHL/HIF axis in the development and treatment of pheochromocytoma/paraganglioma[J]. Front Endocrinol (Lausanne), 2020, 11: 586857. DOI:10.3389/fendo.2020.586857 |
| [37] |
Latha MS, Saddala MS. Molecular docking based screening of a simulated HIF-1 protein model for potential inhibitors[J]. Bioinformation, 2017, 13: 388-393. DOI:10.6026/97320630013388 |
| [38] |
Bailey CM, Liu Y, Peng G, et al. Liposomal formulation of HIF-1α inhibitor echinomycin eliminates established metastases of triple-negative breast cancer[J]. Nanomedicine, 2020, 29: 102278. DOI:10.1016/j.nano.2020.102278 |
| [39] |
Chellappan DK, Leng KH, Jia LJ, et al. The role of bevacizumab on tumour angiogenesis and in the management of gynaecological cancers: a review[J]. Biomed Pharmacother, 2018, 102: 1127-1144. DOI:10.1016/j.biopha.2018.03.061 |
| [40] |
Liao J, Jin H, Li S, et al. Apatinib potentiates irradiation effect via suppressing PI3K/AKT signaling pathway in hepatocellular carcinoma[J]. J Exp Clin Cancer Res, 2019, 38: 454. DOI:10.1186/s13046-019-1419-1 |
| [41] |
Hyman DM, Rizvi N, Natale R, et al. Phase I study of MEDI3617, a selective angiopoietin-2 inhibitor alone and combined with carboplatin/paclitaxel, paclitaxel, or bevacizumab for advanced solid tumors[J]. Clin Cancer Res, 2018, 24: 2749-2757. DOI:10.1158/1078-0432.CCR-17-1775 |
| [42] |
Martin-Liberal J, Hollebecque A, Aftimos P, et al. First-in-human, dose-escalation, phase 1 study of anti-angiopoietin-2 LY3127804 as monotherapy and in combination with ramucirumab in patients with advanced solid tumours[J]. Br J Cancer, 2020, 123: 1235-1243. DOI:10.1038/s41416-020-1011-7 |
| [43] |
Hussain RM, Neiweem AE, Kansara V, et al. Tie-2/Angiopoietin pathway modulation as a therapeutic strategy for retinal disease[J]. Expert Opin Investig Drugs, 2019, 28: 861-869. DOI:10.1080/13543784.2019.1667333 |
 2021, Vol. 56
2021, Vol. 56


