恶性肿瘤是对全人类健康造成重大威胁的主要疾病, 2018年全球新增恶性肿瘤病例超过1 800万, 死亡病例达960万[1]。Coleman等[2]利用统计学方法预测未来10年内, 每年仍将有2 000余万人罹患癌症, 复发和转移仍是导致癌症高死亡率的重要原因。目前, 尽管已有放射治疗、化学治疗和手术治疗等多种治疗方法, 但其不良反应较大, 且治疗效果亟待提升。因此, 积极开发高选择性的分子靶向抗癌药物刻不容缓。
Wnt/β-catenin信号通路作为经典的细胞信号通路, 在胚胎发育与肿瘤恶性分化等过程中发挥着重要作用[3]。在正常细胞中, 胞质中的β-catenin通过泛素化与蛋白酶体途径降解, 因此不存在Wnt/β-catenin信号通路。但在恶性肿瘤细胞中, 胞质中蓄积的β-catenin能够通过核孔大量进入细胞核, 与T细胞因子4 (T-cell factor 4, TCF4) 或淋巴细胞增强因子1 (lymphoid enhancer factor 1, LEF1) 相互作用形成转录调控复合体, 高度活化Wnt信号通路, 启动原癌基因的转录与表达, 促进肿瘤的生长、分化、转移与复发[4, 5]。目前, 靶向β-catenin/TCF4相互作用的抑制剂已在结直肠癌和肝癌的实验治疗中展现出了良好的应用前景。
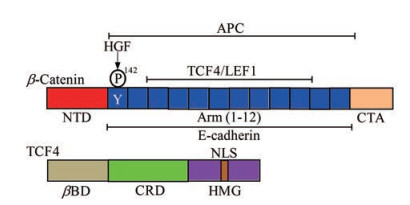
1 β-Catenin与TCF4分子结构β-Catenin分子结构主要由氨基端结构域、中间结构域和羧基端结构域组成。氨基端结构域(N-terminal domain, NTD) 含130个氨基酸, 有多个苏(丝) 氨酸磷酸化位点, 能够与轴蛋白(axin)、腺瘤息肉蛋白(adenomatous polyposis coli, APC)、糖原合成酶激酶3β (glycogen synthase kinase 3β, GSK3β) 和酪蛋白激酶1α (casein kinase 1α, CK1α) 等组成破坏性复合体。破坏性复合体中的CK1α和GSK3β可磷酸化β-catenin的丝氨酸残基, 使其通过泛素化和蛋白酶体途径降解, 原癌基因转录与表达呈沉默状态[6]。羧基端含100个氨基酸, 是重要的转录激活结构域(carboxy-terminal transactivation domain, CTA)。中间结构域是其核心结构域, 主要由12个连续重复的犰狳样蛋白质重复片段(armadillo repeats, Arm) 组成, 这些片段互相折叠, 可形成狭长的凹槽样空间结构, 可与Wnt信号通路中重要的功能蛋白质分子相互作用, 调控Wnt信号通路的活化(图 1)。
|
Figure 1 Overview of β-catenin and TCF4 structures. APC: Adenomatous polyposis coli; HGF: Hepatocyte growth factor; TCF4: T-cell factor 4; LEF1: Lymphoid enhancer factor 1; NTD: N-terminal domain; Arm: Armadillo repeats; CTA: Carboxy-terminal transactivation domain; βBD: β-Catenin binding domain; CRD: Context-dependent regulatory domain; HMG: High mobility group; NLS: Nuclear localization sequence |
TCF家族蛋白是一类通过高速泳动结构域(high mobility group, HMG) 结合DNA的核转录因子。哺乳动物基因组中一般含有TCF1、LEF1、TCF3和TCF4等4个基因, 但每个基因都可以利用可变剪切(alternative splicing) 和启动子使用差异(different promoter usage) 产生变异体。
TCF4分子结构主要包括3个特征性结构域: N端含有53个氨基酸, 是β-catenin结合结构域(β-catenin binding domain, βBD), 介导TCF4与β-catenin的特异结合, 形成转录复合体, 启动Wnt信号通路中原癌基因的转录与表达; C端是结合DNA的HMG结构域, 包含一段特殊的核定位信号序列(nuclear localization sequence, NLS), 能够介导TCF4识别特定的靶基因序列, 也能使靶DNA序列发生折叠, 有利于与其他转录因子的结合; βBD与HMG之间的区域被称为环境依赖性调节结构域(context-dependent regulatory domain, CRD), 与其剪切变异体的产生密切相关, 使得它们与靶基因结合上呈现一定的选择性(图 1)。
2 β-Catenin生物学功能 2.1 介导细胞间黏附位于细胞膜上的β-catenin能与细胞膜表面的黏附分子E-cadherin的胞内肽段结合, 再与α-catenin和actin等细胞骨架蛋白质分子相互作用, 形成E-cadherin-actin复合物, 锚定β-catenin于细胞膜上, 介导细胞间黏附, 这对于维持上皮细胞的极性和完整性发挥了重要作用。但β-catenin中的Tyr142经肝细胞生长因子(hepatocyte growth factor, HGF) 磷酸化后将导致β-catenin/E-cadherin相互作用减弱, 增强了β-catenin的信号转导能力(图 1)。另外, Tyr654的磷酸化会引起β-catenin分子构象的改变, 使细胞黏附功能下降, 促进Wnt信号通路的活化[7]。
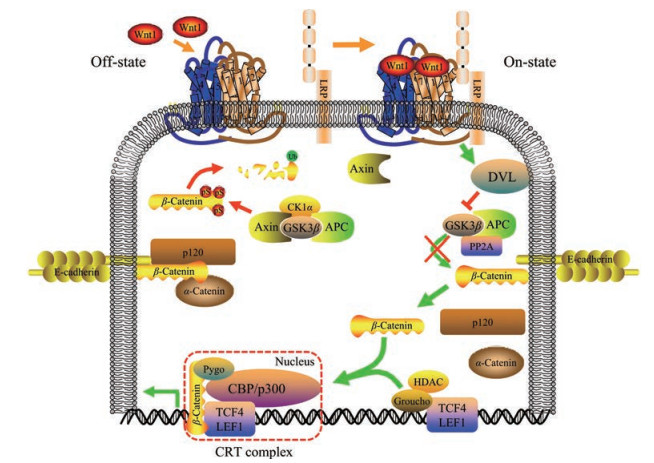
2.2 活化Wnt信号通路在恶性肿瘤细胞中, 分泌到胞外的Wnt蛋白质与卷曲蛋白受体(frizzled receptors, FZD) 及低密度脂蛋白受体相关蛋白质5/6 (LDL receptor related protein 5/6, LRP5/6) 结合形成复合物, 该复合物进而募集蓬乱蛋白质(disheveled protein, DVL) 导致LRP5/LRP6磷酸化。磷酸化的LRP5/LRP6大量募集Axin, 形成的Axin-LRP5/LRP6-DVL复合物使破坏性复合体失活, 导致β-catenin在胞质内稳定蓄积。虽然β-catenin不具有核定位信号序列, 但β-catenin依然能通过核孔复合物(nuclear pore complex, NPC) 进入到细胞核中, 因为其犰狳样蛋白质重复片段与β-importin结构具有一定的相似性, 能够直接与核孔蛋白质相互作用[8]。另外, 多种蛋白质分子(如importin-11、LEF1等) 也参与了对β-catenin入核运输调节, 促进了β-catenin的细胞核转运[9, 10]。进入细胞核的β-catenin与核转录因子TCF4或LEF1相互作用, 形成转录调控复合体, 启动Wnt靶基因(如c-Myc、cyclin D、survivin等) 的转录与活化, 促进了恶性肿瘤的发生与发展(图 2)。
|
Figure 2 Overview of the canonical Wnt signaling pathway. Wnt Off-state: In the absence of Wnt signaling, a destruction complex consisting of Axin, APC, and GSK3β phosphorylates β-catenin to facilitate its ubiquitylation (Ub) and proteasomal degradation. Wnt On-state: The binding of Wnt ligand to FZD and LRP5/6 at the plasma membrane leads to the inhibition of the destruction complex, and stabilization of β-catenin which accumulates and translocates to the nucleus where it serves as a co-activator for TCF4/LEF1 to drive the transcription of Wnt target oncogenes including c-Myc, cyclin D, and survivin. FZD: Frizzled receptor; LRP: Low density lipoprotein receptor-related protein; DVL: Disheveled protein; CK1α: Casein kinase 1α; GSK3β: Glycogen synthase kinase 3β; CBP: Cyclic AMP response element binding protein; HDAC: Histone deacetylase; CRT: β-Catenin-responsive transcription |
目前, Wnt/β-catenin信号通路中的多种功能蛋白质分子在非小细胞肺癌(non-small cell lung cancer, NSCLC) 中呈异常高表达, 约80%的NSCLC患者呈β-catenin高表达, NSCLC患者的不良预后与核内β-catenin表达量呈正相关[11, 12]。
在NSCLC患者中, 核转录因子TCF4的亚细胞分布与其分化程度有关, 且TCF4的高表达也与其细胞分化程度密切相关[13]。另外, TCF4基因的剪切性突变体可能与肿瘤晚期侵袭性有关。与TCF4功能类似, LEF1在Wnt/β-catenin信号通路介导的肿瘤细胞信号转导中也发挥了重要作用。在某些TCF4阳性的结直肠癌患者中, 核内LEF1高水平表达, 会以一种正反馈调控方式协同加强Wnt/β-catenin信号通路的活化[14]。在NSCLC脑转移患者的临床免疫组化检测中发现核内LEF1呈高水平表达, LEF1/TCF4核内协同高表达使NSCLC患者预后不良, 生存期明显缩短[15]。最近研究表明, 异常活化的Wnt/β-catenin信号通路在NSCLC脑转移和骨转移中发挥了重要作用, 一方面通过调控信号转导分子HOXB9 (homeobox B9) 和LEF1, 以β-catenin/LEF1相互作用介导的正反馈调控机制协同活化Wnt/β-catenin信号通路, 促进上皮-间质转化(epithelial-mesenchymal transition, EMT) 和岩藻糖转移酶8 (fucosyltransferase 8, FUT8) 的表达, 使肿瘤细胞表面黏附分子和表皮生长因子受体(epidermal growth factor receptor, EGFR) 糖基化, 改变肿瘤微环境, 促进肿瘤细胞趋化、浸润和脑(骨) 转移的形成[16, 17]; 另一方面, Wnt/β-catenin信号通路活化对于维持肿瘤干细胞(cancer stem cells, CSC) 的分化和自我更新具有重要的促进作用, 参与维持肿瘤干细胞休眠体的形成, 促进了恶性肿瘤的耐药与复发[18, 19]。
多种信号通路中重要效应分子的高频率基因突变是引发肿瘤异质性和化疗耐药的重要原因, 但Wnt/β-catenin信号通路中的APC和β-catenin基因突变在NSCLC患者中却罕有发生[20]。若以β-catenin为相关治疗靶点, 将极大地减少因药物靶点基因突变而产生耐药性。另外, 由于效应信号分子β-catenin通过与E-cadherin相互作用而促进细胞黏连复合体的形成, 胞浆内高水平的β-catenin对于NSCLC患者的良好预后具有重要意义[20, 21]。因此, 通过特异性靶向β-catenin下游转录调控分子(如TCF4、LEF1等) 的抑制剂阻断其生物学功能, 高选择性抑制Wnt/β-catenin信号通路, 但不影响胞浆β-catenin/E-cadherin相互作用, 这对于NSCLC等恶性肿瘤患者的分子靶向治疗具有重要意义, 这也使β-catenin/TCF4相互作用成为新型抗NSCLC转移药物开发的理想靶标之一。
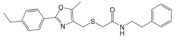
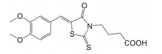
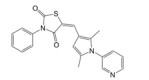
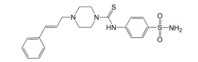
3 靶向β-catenin/TCF4相互作用抑制剂的发现与肿瘤分子治疗迄今, 基于β-catenin/TCF4相互作用为靶标, 已利用多种高通量筛选方法成功筛选到了PKF118-744、PKF222-815、CGP049090、PKF115-584、ZTM000990、iCRT-3/5/14、LF3、血根碱及多肽类抑制剂(表 1), 这些抑制剂在结直肠癌、肝癌和乳腺癌等肿瘤的分子治疗中已展现出了良好的应用前景。
| Table 1 The reported small-molecule inhibitors targeting β-catenin/TCF4 interaction. HTS: High-throughput screening; ELISA: Enzyme linked immunosorbent assay; RNAi: RNA interference; FP: Fluorescence polarization |
Lepourcelet等[22]利用包被的β-catenin与谷胱甘肽S-转移酶-TCF4 (glutathione S-transferase-TCF4, GST-TCF4) 相互作用建立了基于酶联免疫吸附实验(enzyme linked immunosorbent assay, ELISA) 原理的高通量筛选模型, 通过判断实验体系中A450值的改变即可筛选到苗头化合物。利用上述高通量筛选模型对微生物来源的天然产物库进行高通量筛选, 成功筛选到了6个苗头化合物。其中, PKF115-584、CGP049090和PKF222-815来源于真菌代谢产物, PKF118-744、PKF118-310和ZTM000990来源于放线菌代谢产物。TOP-Flash实验证实, 苗头化合物以剂量依赖性方式抑制细胞内β-catenin/TCF4相互作用, 显著地抑制了Wnt靶基因的转录与表达, 证实了β-catenin/TCF4相互作用可能是其抗癌活性的潜在靶标之一。在裸鼠荷瘤实验中, PKF115-584、PKF118-310和CGP049090能够显著抑制HCT116和HepG2移植瘤的生长与Wnt靶基因的表达, 诱导了肿瘤细胞的大量凋亡[22, 23]。此外, 已有研究证实, PKF115-584与CGP049090对MEC-1和JVM-3有明显的细胞毒性, 但其对正常细胞的毒性相对较小。免疫共沉淀实验表明, 其可以抑制β-catenin/LEF1相互作用, 并抑制Wnt靶基因的转录与表达, 再次证实了β-catenin介导的转录调控是其抗癌活性的潜在靶标。PKF115-584与CGP049090在JVM-3移植瘤治疗实验中也表现出了良好的抗癌活性和耐受性, 在慢性淋巴细胞白血病的实验治疗中展现出良好的应用前景[24]。虽然PKF222-815、PKF115-584和CGP049090能够有效抑制β-catenin介导的转录调控, 但上述化合物对β-catenin/APC相互作用也具有一定的抑制作用, 还需要通过化学改造策略, 以提高化合物的体外选择性和成药性。另外, 基于ELISA原理的高通量筛选模型虽具有高特异性、高灵敏度等优点, 但其操作步骤繁琐且筛选成本较高, 较大限制了其在大规模高通量筛选中的应用。
3.2 iCRT-3/5/14Gonsalves等[25]利用RNA干扰技术(RNA interference, RNAi) 干扰Axin在胞质内的表达, 再应用β-catenin/TCF4相互作用介导的荧光素酶报告基因法, 建立了基于RNA干扰原理的化学遗传学筛选法(RNAi-based chemical genetic screening assay)。虽然此类筛选方法操作复杂、灵敏度较差、筛选成本和假阳性率较高, 但利用上述筛选方法对14 997库容的化合物库进行高通量筛选, 成功筛选到了iCRT3、iCRT5和iCRT14对β-catenin/TCF4相互作用具有良好的抑制活性, 且iCRT14还可以有效抑制TCF4与DNA的结合, 但上述化合物对β-catenin/E-cadherin与β-catenin/α-catenin相互作用的抑制作用较小。iCRT-3/5/14可将HT29和HCT116细胞周期阻滞于G0/G1期, 但在HEK293和C57MG等Wnt信号通路低度活化的细胞中却未表现出明显的G0/G1期阻滞, 这说明上述化合物诱导肿瘤细胞的周期阻滞与Wnt信号通路的高度活化密切相关。分子对接结果显示, iCRT-5/3能与β-catenin核心结构域中的Lys435和Arg469结合, 且iCRT-5的羧基恰好位于TCF4的Asp16与β-catenin的Lys435相互作用的位置, iCRT-3的N-苯乙基能与β-catenin的Arg469形成氢键, 破坏了β-catenin/TCF4相互作用的稳定性, 这也为定向化学改造奠定了理论基础。在裸鼠荷瘤实验中, iCRT-3/5/14能够显著地抑制结直肠癌移植瘤在实验动物体内的生长, 且具有良好的耐受性, 是一类具有广阔开发前景的靶向β-catenin/TCF4相互作用小分子抑制剂。
3.3 TAT-NLS-BLBD-6Hsieh等[26]基于β-catenin/LEF1相互作用结构生物学信息, 将β-catenin/LEF1结合结构域(β-catenin/LEF1 binding domain, BLBD)、跨膜序列(TAT) 和核定位信号(NLS) 设计成具有跨膜功能的融合多肽, 并成功鉴定了TAT-NLS-BLBD-6具有良好的抑制活性。细胞毒性实验表明, TAT-NLS-BLBD-6能够以时间和剂量依赖性的方式抑制乳腺癌细胞的生长与增殖, 但其对正常细胞不产生细胞毒性。免疫共沉淀实验证实, TAT-NLS-BLBD-6在MCF7与MDA-MB-231细胞核中抑制β-catenin/LEF1相互作用, 进而抑制Wnt信号通路中原癌基因的表达。在裸鼠荷瘤实验中, TAT-NLS-BLBD-6能够显著抑制乳腺癌细胞在实验动物体内的生长, 且耐受性良好, 开辟了乳腺癌分子靶向治疗的新策略。但由于TAT-NLS-BLBD-6的稳定性较差, 较大程度限制了此类多肽抑制剂的临床前研究。考虑到β-catenin与TCF4和LEF1相互作用位点的相似性, TAT-NLS-BLBD-6对靶向β-catenin/TCF4相互作用多肽类抑制剂的分子设计也具有一定的借鉴和启发。
3.4 LF3Fang等[27]将镍螯合的供体珠和GST包被的受体珠分别与TCF4-His和GST-β-catenin孵育建立Alpha筛选法, 通过检测520~620 nm发射光强度对16 000个化合物进行初步筛选, 获得了5个候选苗头化合物。再利用ELISA筛选法对候选苗头化合物进行了第二轮筛选, 发现LF3对β-catenin/TCF4相互作用具有良好的抑制活性。构效关系研究表明, LF3分子中带负电的磺酰胺基能与带正电荷的β-catenin的Lys435结合, 竞争性抑制了其与TCF4中的Asp16的结合; 此外, LF3的疏水尾部可自由插入到由β-catenin的Cys466和Pro463所形成的疏水口袋中, 协同增强了LF3的抑制作用。免疫共沉淀实验表明, LF3显著抑制了HCT116细胞内β-catenin与TCF4和LEF1的相互作用, 抑制了c-Myc、cyclin D等Wnt靶基因的转录与表达。更为重要的是, 在较高浓度下, LF3基本不影响由β-catenin/E-cadherin相互作用介导的细胞间黏附。此外, LF3能够显著抑制结直肠癌干细胞在实验动物体内的自我更新与分化, 是一类极具有开发前景的新型抗结直肠癌转移药物, 已在德国开启了临床前研究。虽然Alpha筛选法因其高昂的筛选成本限制了其在大规模高通量筛选中的应用, 但以ELISA筛选法进行初步筛选获得候选苗头化合物, 再以Alpha筛选法进行进一步的活性评价, 两种筛选方法的联合应用也将是未来新型Wnt抑制剂快速筛选的有效策略之一。
3.5 P2-T3-A6Hua等[28]发现tribbles假性激酶3 (tribbles homolog 3, TRIB3) 通过与β-catenin及TCF4形成异源三聚体, 活化了Wnt信号通路, 进而维持了结直肠癌干细胞特性, 促进结直肠癌的复发与耐药。为了筛选有效的多肽抑制剂, 研究者首先基于TRIB3的分子结构设计了与TRIB3具有良好亲和力的多肽T3-A6, 然后再将对细胞有穿透作用的P2多肽与T3-A6多肽融合, 构建融合多肽P2-T3-A6。细胞药理学实验表明, 融合多肽P2-T3-A6在细胞内与TRIB3具有较高的亲和力, 且具有良好的体外细胞毒性选择性, 能够在细胞内抑制β-catenin/TRIB3和β-catenin/TCF4相互作用。在原发性HCT8细胞中, 融合多肽P2-T3-A6显著抑制了β-catenin介导的转录调控以及Wnt信号通路中靶基因的转录与表达。另外, 免疫共沉淀实验证实, P2-T3-A6不影响β-catenin/APC和β-catenin/E-cadherin相互作用。裸鼠荷瘤实验表明, P2-T3-A6在移植瘤实验中能够显著抑制结直肠癌细胞的生长, 并使对5-氟尿嘧啶耐药的结直肠癌细胞重新恢复化疗敏感性, 对结直肠癌的分子靶向治疗展现出了良好的应用前景。
3.6 血根碱血根碱是传统中药博落回的主要药效成分之一, 具有抗肿瘤、抗菌、抗病毒和抗炎等药理活性[29-31]。研究表明, 血根碱可通过抑制Wnt/β-catenin信号通路中的原癌基因的转录与表达, 进而抑制肺癌干细胞的生长与分化, 抑制结直肠癌细胞的上皮-间质转化与肺转移, 发挥抗癌活性, 但血根碱在Wnt/β-catenin信号通路中的潜在分子靶标迄今尚未明确[32, 33]。本实验室以异硫氰酸荧光素(fluorescence isothiocyanate, FITC) 标记的TCF4多肽作为荧光探针, 通过优化FITC-TCF4与β-catenin反应浓度, 成功建立了靶向β-catenin/TCF4相互作用小分子抑制剂的荧光偏振(fluorescence polarization, FP) 高通量筛选模型。通过对本室天然产物化合物库进行高通量筛选, 成功筛选到血根碱对β-catenin/TCF4相互作用具有良好的抑制活性。表面等离子共振(surface plasmon resonance, SPR) 实验证实, 血根碱与靶标β-catenin的解离常数值(dissociation constant, KD) 为50.8 μmol·L-1, 说明β-catenin/TCF4相互作用是血根碱抗癌活性的潜在分子靶标之一[34, 35]。
荧光偏振技术主要基于偏振荧光强弱与荧光分子大小正相关原理, 具有均相反应、操作简便、检测灵敏和成本低廉等优点, 已被广泛应用于药物高通量筛选、蛋白质活性鉴定和药物分析等领域[34-37]。但在本荧光偏振高通量筛选模型中, 所使用的荧光探针FITC-TCF4仅是一条短肽, 在理化性质和空间结构上并不能完全模拟TCF4的生物学功能, 所以初筛的候选苗头化合物还需要再基于ELISA筛选法、Alpha筛选法、GST-pull down实验及SPR实验等深入进行体外抑制活性评价, 进一步确证苗头化合物的潜在分子靶标。
4 结论与展望在经典Wnt信号通路中, β-catenin/TCF4相互作用在多种恶性肿瘤的发生、发展、耐药、转移及复发过程中发挥了重要的促进作用, 已被认为是新型高选择性抗结直肠癌和NSCLC转移药物开发的理想靶标之一[4, 5]。但β-catenin在体内具有广泛的生物学功能, 一方面通过与E-cadherin相互作用, 介导细胞间黏附, 减弱了恶性肿瘤细胞的迁移能力; 另一方面通过与核转录因子TCF4和LEF1相互作用, 调控Wnt信号通路中原癌基因的转录与表达。因此, 高选择性抑制β-catenin/TCF4相互作用, 但不影响胞浆β-catenin的细胞黏附功能, 这对于基于β-catenin/TCF4相互作用为靶标的肿瘤分子靶向治疗具有重要意义。
与TCF4的生物学功能不同, β-catenin/LEF1相互作用除了介导Wnt信号通路的活化外, LEF1还是重要的分子伴侣, 协助β-catenin从细胞质进入细胞核, 协同活化Wnt信号通路[38-40]。因此, 靶向β-catenin/LEF1相互作用也将是未来高选择性Wnt抑制剂开发的重要策略。另外, 深入研究β-catenin的入核过程, 挖掘上述过程中的潜在分子靶标以开发新型Wnt抑制剂, 既抑制β-catenin入核, 又阻断β-catenin介导的转录调控复合体的形成, 也将是高选择性Wnt抑制剂发展的重要方向之一[8]。
目前, 已报道的β-catenin/TCF4相互作用抑制剂均表现较低的选择性, 基于上述小分子抑制剂的化学结构, 积极利用药物化学策略进行结构优化, 从而提高其对靶标的选择性, 减小对β-catenin/E-cadherin相互作用的影响将是本类小分子抑制剂当下研究的重要内容。多肽类抑制剂也是未来高选择性β-catenin/TCF4相互作用抑制剂开发的重要方向, 但需要提高多肽药物的稳定性、靶向性和组织渗透性, 改善多肽药物的成药性[41-43]。此外, 基于肿瘤表面标志物和LEF1 βBD结构域, 积极构建兼有靶向性与穿透性, 并能抑制β-catenin入核与转录调控的新型融合蛋白质药物也将是未来高选择性Wnt抑制剂开发的重要策略之一。作者相信, 高选择性β-catenin/TCF4相互作用抑制剂的应用将成为未来恶性肿瘤精准治疗的新策略。
作者贡献: 付正豪和陈云雨负责完成文献整理、综述撰写与修改; 闫干干、戚海燕和刘晓平负责完成图例设计与文献补充; 所有作者均对本文有所贡献。
利益冲突: 全体作者均声明无利益冲突。
| [1] |
Bray F, Ferlay J, Soerjomataram I, et al. Global cancer statistics 2018:GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. CA Cancer J Clin, 2018, 68: 394-424. DOI:10.3322/caac.21492 |
| [2] |
Coleman MP. Cancer survival: global surveillance will stimulate health policy and improve equity[J]. Lancet, 2014, 383: 564-573. DOI:10.1016/S0140-6736(13)62225-4 |
| [3] |
Zhong Z, Virshup DM. Wnt signaling and drug resistance in cancer[J]. Mol Pharmacol, 2020, 97: 72-89. DOI:10.1124/mol.119.117978 |
| [4] |
Nusse R, Clevers H. Wnt/β-catenin signaling, disease, and emerging therapeutic modalities[J]. Cell, 2017, 169: 985-999. DOI:10.1016/j.cell.2017.05.016 |
| [5] |
Zhan T, Rindtorff N, Boutros M. Wnt signaling in cancer[J]. Oncogene, 2017, 36: 1461-1473. DOI:10.1038/onc.2016.304 |
| [6] |
Cheng X, Xu X, Chen D, et al. Therapeutic potential of targeting the Wnt/β-catenin signaling pathway in colorectal cancer[J]. Biomed Pharmacother, 2019, 110: 473-481. DOI:10.1016/j.biopha.2018.11.082 |
| [7] |
Cui C, Zhou X, Zhang W, et al. Is β-catenin a druggable target for cancer therapy?[J]. Trends Biochem Sci, 2018, 43: 623-634. DOI:10.1016/j.tibs.2018.06.003 |
| [8] |
Jamieson C, Sharma M, Henderson BR. Targeting the β-catenin nuclear transport pathway in cancer[J]. Semin Cancer Biol, 2014, 27: 20-29. DOI:10.1016/j.semcancer.2014.04.012 |
| [9] |
Shang S, Hua F, Hu Z. The regulation of β-catenin activity and function in cancer: therapeutic opportunities[J]. Oncotarget, 2017, 8: 33972-33989. DOI:10.18632/oncotarget.15687 |
| [10] |
Mis M, O'Brien S, Steinhart Z, et al. IPO11 mediates β-catenin nuclear import in a subset of colorectal cancers[J]. J Cell Biol, 2020, 219: e201903017. DOI:10.1083/jcb.201903017 |
| [11] |
Xu X, Sun PL, Li JZ, et al. Aberrant Wnt1/β-catenin expression is an independent poor prognostic marker of non-small cell lung cancer after surgery[J]. J Thorac Oncol, 2011, 6: 716-724. DOI:10.1097/JTO.0b013e31820c5189 |
| [12] |
Yang J, Chen J, He J, et al. Wnt signaling as potential therapeutic target in lung cancer[J]. Expert Opin Ther Targets, 2016, 20: 999-1015. DOI:10.1517/14728222.2016.1154945 |
| [13] |
Rice SJ, Liu X, Hyland V, et al. Mutations in genes connected with the TCF7L2 transcription factor are associated with a poor prognosis in non-small cell lung cancer[J]. Lung Cancer, 2020, 141: 97-100. DOI:10.1016/j.lungcan.2020.01.015 |
| [14] |
Hovanes K, Li TW, Munguia JE, et al. Beta-catenin-sensitive isoforms of lymphoid enhancer factor-1 are selectively expressed in colon cancer[J]. Nat Genet, 2001, 28: 53-57. |
| [15] |
Bleckmann A, Siam L, Klemm F, et al. Nuclear LEF-1/TCF-4 correlate with poor prognosis but not with nuclear β-catenin in cerebral metastasis of lung adenocarcinomas[J]. Clin Exp Metastasis, 2013, 30: 471-482. DOI:10.1007/s10585-012-9552-7 |
| [16] |
Nguyen DX, Chiang AC, Zhang XH, et al. WNT/TCF signaling through LEF-1 and HOXB9 mediates lung adenocarcinoma metastasis[J]. Cell, 2009, 138: 51-62. DOI:10.1016/j.cell.2009.04.030 |
| [17] |
Chen CY, Jan YH, Juan YH, et al. Fucosyltransferase 8 as a functional regulator of non-small cell lung cancer[J]. Proc Natl Acad Sci U S A, 2013, 110: 630-635. DOI:10.1073/pnas.1220425110 |
| [18] |
Iqbal W, Alkarim S, AlHejin A, et al. Targeting signal transduction pathways of cancer stem cells for therapeutic opportunities of metastasis[J]. Oncotarget, 2016, 7: 76337-76353. DOI:10.18632/oncotarget.10942 |
| [19] |
Ghosh N, Hossain U, Mandal A, et al. The Wnt signaling pathway: a potential therapeutic target against cancer[J]. Ann N Y Acad Sci, 2019, 1443: 54-74. DOI:10.1111/nyas.14027 |
| [20] |
Stewart DJ. Wnt signaling pathway in non-small cell lung cancer[J]. J Natl Cancer Inst, 2014, 106: djt356. DOI:10.1093/jnci/djt356 |
| [21] |
Jin J, Zhan P, Katoh M, et al. Prognostic significance of β-catenin expression in patients with non-small cell lung cancer: a meta-analysis[J]. Transl Lung Cancer Res, 2017, 6: 97-108. DOI:10.21037/tlcr.2017.02.07 |
| [22] |
Lepourcelet M, Chen YN, France DS, et al. Small-molecule antagonists of the oncogenic Tcf/beta-catenin protein complex[J]. Cancer Cell, 2004, 5: 91-102. DOI:10.1016/S1535-6108(03)00334-9 |
| [23] |
Wei W, Chua MS, Grepper S, et al. Small molecule antagonists of Tcf4/beta-catenin complex inhibit the growth of HCC cells in vitro and in vivo[J]. Int J Cancer, 2010, 126: 2426-2436. |
| [24] |
Gandhirajan RK, Staib PA, Minke K, et al. Small molecule inhibitors of Wnt/beta-catenin/lef-1 signaling induces apoptosis in chronic lymphocytic leukemia cells in vitro and in vivo[J]. Neoplasia, 2010, 12: 326-335. DOI:10.1593/neo.91972 |
| [25] |
Gonsalves FC, Klein K, Carson BB, et al. An RNAi-based chemical genetic screen identifies three small-molecule inhibitors of the Wnt/wingless signaling pathway[J]. Proc Natl Acad Sci U S A, 2011, 108: 5954-5963. DOI:10.1073/pnas.1017496108 |
| [26] |
Hsieh TH, Hsu CY, Tsai CF, et al. A novel cell penetrating peptide suppresses breast tumorigenesis by inhibiting β-catenin/LEF-1 signaling[J]. Sci Rep, 2016, 6: 19156. DOI:10.1038/srep19156 |
| [27] |
Fang L, Zhu Q, Neuenschwander M, et al. A small-molecule antagonist of the β-catenin/TCF4 interaction blocks the self-renewal of cancer stem cells and suppresses tumorigenesis[J]. Cancer Res, 2016, 76: 891-901. DOI:10.1158/0008-5472.CAN-15-1519 |
| [28] |
Hua F, Shang S, Yang YW, et al. TRIB3 interacts with β-catenin and TCF4 to increase stem cell features of colorectal cancer stem cells and tumorigenesis[J]. Gastroenterology, 2019, 156: 708-721. DOI:10.1053/j.gastro.2018.10.031 |
| [29] |
Achkar IW, Mraiche F, Mohammad RM, et al. Anticancer potential of sanguinarine for various human malignancies[J]. Future Med Chem, 2017, 9: 933-950. DOI:10.4155/fmc-2017-0041 |
| [30] |
Almeida IV, Fernandes LM, Biazi BI, et al. Evaluation of the anticancer activities of the plant alkaloids sanguinarine and chelerythrine in human breast adenocarcinoma cells[J]. Anticancer Agents Med Chem, 2017, 17: 1586-1592. |
| [31] |
Fu C, Guan G, Wang H. The anticancer effect of sanguinarine: a review[J]. Curr Pharm Des, 2018, 24: 2760-2764. DOI:10.2174/1381612824666180829100601 |
| [32] |
Yang J, Fang Z, Wu J, et al. Construction and application of a lung cancer stem cell model: antitumor drug screening and molecular mechanism of the inhibitory effects of sanguinarine[J]. Tumor Biol, 2016, 37: 13871-13883. DOI:10.1007/s13277-016-5152-5 |
| [33] |
Zhu M, Gong Z, Wu Q, et al. Sanguinarine suppresses migration and metastasis in colorectal carcinoma associated with the inversion of EMT through the Wnt/β-catenin signaling[J]. Clin Transl Med, 2020, 10: 1-12. DOI:10.1002/ctm2.1 |
| [34] |
Chen YY, Hu K, Fu ZH, et al. Development of a fluorescence polarization-based high-throughput screening assay to identify antagonists targeting β-catenin/TCF4 interaction[J]. Acta Pharm Sin (药学学报), 2020, 55: 884-891. |
| [35] |
Chen Y, Fu Z, Li D, et al. Optimizations of a novel fluorescence polarization-based high-throughput screening assay for β-catenin/LEF1 interaction inhibitors[J]. Anal Biochem, 2021, 612: 113966. DOI:10.1016/j.ab.2020.113966 |
| [36] |
Niu XY, Han MC, Li M, et al. Optimization of prokaryotic expression conditions and biological activity identification of recombinant human β-catenin[J]. J Microbiol (微生物学杂志), 2020, 40: 58-66. |
| [37] |
Glahn-Martínez B, Benito-Peña E, Salis F, et al. Sensitive rapid fluorescence polarization immunoassay for free mycophenolic acid determination in human serum and plasma[J]. Anal Chem, 2018, 90: 5459-5465. DOI:10.1021/acs.analchem.8b00780 |
| [38] |
Behrens J, von Kries JP, Kühl M, et al. Functional interaction of beta-catenin with the transcription factor LEF-1[J]. Nature, 1996, 382: 638-642. DOI:10.1038/382638a0 |
| [39] |
Huber O, Korn R, McLaughlin J, et al. Nuclear localization of beta-catenin by interaction with transcription factor LEF-1[J]. Mech Dev, 1996, 59: 3-10. DOI:10.1016/0925-4773(96)00597-7 |
| [40] |
Morgan RG, Ridsdale J, Payne M, et al. LEF-1 drives aberrant β-catenin nuclear localization in myeloid leukemia cells[J]. Haematologica, 2019, 104: 1365-1377. DOI:10.3324/haematol.2018.202846 |
| [41] |
Araste F, Abnous K, Hashemi M, et al. Peptide-based targeted therapeutics: focus on cancer treatment[J]. J Control Release, 2018, 292: 141-162. DOI:10.1016/j.jconrel.2018.11.004 |
| [42] |
Erak M, Bellmann-Sickert K, Els-Heindl S, et al. Peptide chemistry toolbox-transforming natural peptides into peptide therapeutics[J]. Bioorg Med Chem, 2018, 26: 2759-2765. DOI:10.1016/j.bmc.2018.01.012 |
| [43] |
He JY, Liang J, Xuan MS, et al. Effective strategies for improving the stability of peptides in vivo[J]. Acta Pharm Sin (药学学报), 2020, 55: 25-32. |
 2021, Vol. 56
2021, Vol. 56