2. 山东省农业科学院生物技术研究中心, 山东 济南 250100
2. Bio-Tech Research Center, Shandong Academy of Agricultural Sciences, Jinan 250100, China
在植物生长过程中, 当营养生长到一定阶段后开始转向生殖生长即开花结果, 是植物生长发育的重要生理过程之一[1]。植物成花受遗传和外在环境等多因素影响, 目前在伞形科植物中已有flowerring locus T (FT)、constans (CO)、short vegetativephase (SVP) 等成花基因的相关研究, 在基因调控植物成花分子机制方面取得重要进展[2-6]。伞形科植物北柴胡(Bupleurum chinense DC.) 的干燥根属常用中药, 具清退虚热、疏肝解郁、升举阳气之效, 常用于治疗感冒发热、寒热往来、疟疾、肝郁气滞、胸肋胀痛、脱肛、子宫脱垂、月经不调等病症, 应用历史悠久, 临床需求量大, 目前主要依靠人工栽培满足需要。北柴胡为多年生植物, 种植周期一般为2年, 第一年主要进行营养生长, 第二年开始成花进入生殖生长。植株一旦成花, 生殖器官便成为营养消耗中心, 生产中常通过疏花、打顶来提高柴胡药材的产量和质量, 但耗费人工较多[7-11]。因此, 探究北柴胡植株成花机制, 并采取有效措施予以控制, 是提高柴胡药材产量与质量的有效途径。
本研究通过在NCBI (National Center for Biotechnology Information) 上blast比对已公布的其他物种开花相关基因的保守氨基酸和核苷酸序列, 结合课题组前期全基因组测序结果, 首次在北柴胡植株中克隆得到与成花相关的short vegetativephase (SVP)、proteasome alpha subunit F1 (PAF1) 复合体、constans (CO)、flowering locus t (FT) 4个基因, 分别命名为BcSVP、BcPAF1、BcCO、BcFT。利用实时荧光定量PCR (real-time quantitative PCR, qRT-PCR) 技术[12], 从actin、α-tubulin、β-tubulin、cyclophilin和EF-1α等5个常用植物内参基因中筛选出2个, 对不同花期根、茎、叶、花等器官中4个基因的差异表达水平进行分析, 为了解北柴胡成花相关基因在花发育过程中的功能及明确北柴胡植株成花机制奠定基础。
材料与方法材料 2020年7~8月采集于山东省济南市章丘区百味堂北柴胡种植基地, 原植物经山东中医药大学周凤琴教授鉴定, 系伞形科植物北柴胡Bupleurum chinense DC.。分别在植株开花之前、花蕾期、开花初期、盛花初期、盛花中期、盛花末期、谢花期等7个生长发育时期, 于柴胡种植基地大田中随机选择3株长势基本一致的植株, 取其不同器官组织置于5 mL透明冻存管中, 并将冻存管置于液氮中带回实验室, -80 ℃冰箱保存。
试剂 广谱型植物RNA提取试剂盒(DNaseⅠ) (北京诺贝莱生物科技有限公司); SYBR Preminx EX TaqTM (ROX) 和RT反转录试剂盒(TaKaRa公司); DNA分子量MakerDL2000、电泳上样缓冲液等PCR反应试剂[宝生物工程(大连) 有限公司]; 引物由上海捷瑞生物工程有限公司负责合成。
仪器 主要仪器有Quant Studio 7Flex荧光定量PCR仪(美国ABI); Nano Drop Lite超微量核酸检测仪(赛默飞世尔); TaKaRa PCR仪[宝生物工程(大连) 有限公司]; 5424D型高速离心机(Eppendorf公司); 凝胶成像仪(Bid-Rad公司)。
引物设计与合成 基于课题组前期北柴胡全基因组测序结果, 并结合其他物种成花基因, 用DNAman8.0软件比对相关成花基因的序列信息, 以Primer 5.0设计相应目的基因的引物(具体引物序列信息及退火温度见表 1)。
| Table 1 Primers designed for gene cloning and real-time PCR detection |
参考北柴胡植株内参基因筛选相关文献[13], 选取5个常用植物内参基因作为候选基因(actin、α-tubulin、β-tubulin、EF-1α、cyclophilin) 进行实验, 筛选出能够稳定表达的内参基因(内参引物序列信息见表 2)。
| Table 2 Reference gene sequence information |
RNA提取及cDNA合成 取-80 ℃保存的样品在液氮中迅速研磨成细粉, 用植物RNA提取试剂盒提取RNA, 2%琼脂糖凝胶电泳检测RNA完整度, 用超微量核酸检测仪检测RNA浓度, 并按照Prime ScriptRT reagent Kit (TaKaRa公司) 说明书将RNA反转录合成cDNA第1链, 所得产物于-20 ℃保存备用。
开花基因的克隆 取盛花中期长势良好的北柴胡植株, 对其根、茎、叶、花4种器官混合提取总RNA, 以反转得到的cDNA为模板进行第一轮扩增, PCR反应采用25 μL体系: 10×buffer 2.5 μL、dNTP (2.5 mmol·L-1) 2.0 μL、Taq酶(5 U) 0.125 μL、上下游引物(10 μmol·L-1) 各1.0 μL、DNA模板(10 ng) 2.0 μL, 补水至25 μL。反应条件: 94 ℃、3 min; 94 ℃、30 s; 56 ℃、30 s; 72 ℃、1 min, 30个循环; 72 ℃、10 min。将PCR产物切胶回收并纯化目的DNA条带, 连接到PMD18-T载体上, 转化感受态细胞DH5α, 蓝白斑筛选, 挑取白斑, 测序验证, -20 ℃保存备用。使用DNAMAN 8.0将克隆得到的序列与其他植物物种进行同源性分析, 并与北柴胡基因组测序结果(未公布) 进行对比; 并在NCBI网站进行其他物种同源性比对, 定义所克隆基因。
实时荧光定量PCR分析 将反转录得到的cDNA样品10倍稀释后取2 μL作为模板, 根据SYBR Preminx EX TaqTM (ROX) 试剂盒操作说明进行实验, 使用Quant Studio 7Flex荧光定量PCR仪, 采用双标准曲线法对目的基因在北柴胡中的时空表达进行相对定量分析。实时荧光PCR扩增体系(20 μL): SYBR Premix EX Taq (2×) 10 μL、上下游引物(10 μmol·L-1) 各1.0 μL、Rox 0.2 μL、DNA模板(10 ng) 2.0 μL, 补水至25 μL。cDNA模板2 μL、Rox 0.2 μL, 补水至20 μL。扩增程序: 预变性, 95 ℃、2 min, 1个循环; 变性95 ℃、10 s, 延伸60 ℃、35 s (在此收集荧光信号), 40个循环; PCR结束后, 95 ℃、15 s, 60 ℃、60 s, 95 ℃、30 s, 60 ℃、15 s, 熔解曲线分析, 每个样品设立3个平行样。
数据处理 采用Comparative CT(2-ΔΔCT) 法[14]分析基因的相对表达量, 分析成花基因在北柴胡植株不同开花期、不同器官中的差异表达情况, 根据标准曲线获得qRT-PCR的Ct值, 转化为相对定量数据, 并使用GraphPad Prism 7.0绘制柱状图。
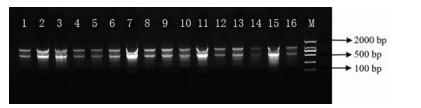
结果与分析 1 总RNA的质量检测使用NanoDrop核酸定量检测仪测定总RNA浓度和A260/A280吸光值, 每个样品3次重复, RNA浓度平均值为0.266 mg·L-1, A260/A280平均值为2.1; 另取5 μL RNA用2%琼脂糖凝胶电泳检测(电泳实验结果如图 1), 样品存在拖尾现象, 但可以看出明显的2条带, 存在拖尾现象的原因可能是室温情况下进行实验, 且耗时较长, 导致RNA存在部分降解的情况。结合课题组前期预实验结果分析, 提取RNA质量可用于后续基因时空表达分析。
|
Figure 1 Partial RNA gel map. 1-4: Root; 5-8: Stem; 9-12: Leaf; 13-16: Flower. M: DNA marker DL2000 |
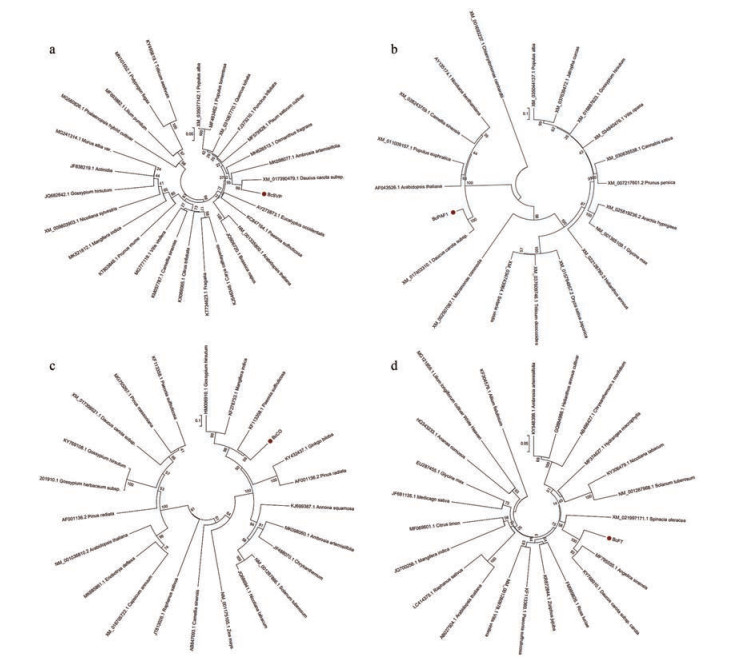
取盛花中期长势良好的北柴胡植株, 对植株进行总RNA提取, 将RNA反转录得cDNA为模板, 经PCR扩增产物回收、克隆和测序, 在北柴胡中得到4个与成花相关的基因。通过对BcSVP、BcPAF1、BcCO、BcFT基因氨基酸序列进行多重序列比对及同源性分析, 并利用MEGA 5.0软件将目标序列与检索到的其他植物物种氨基酸序列构建系统进化树(图 2), 评估4个基因在各物种之间亲缘性。
|
Figure 2 Phylogenetic tree analysis of the deduced amino acid sequence of genes in different species (a: BcSVP; b: BcPAF1; c: BcCO; d: BcFT) |
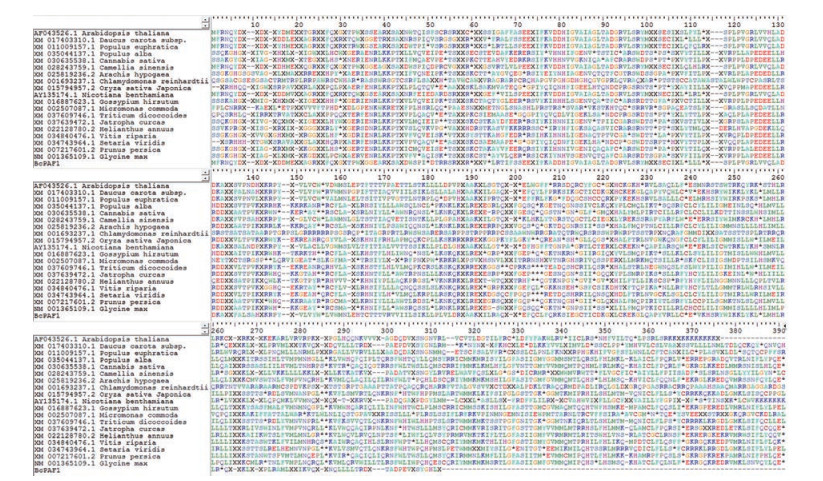
结果显示: 不同BcCO蛋白的氨基酸序列之间保守性较差, 进一步分析克隆得到该基因无起始密码子(图 3), BcSVP、BcPAF1和BcFT蛋白的氨基端序列之间存在几个较明显的保守区域(图 4~6)。BcSVP与胡萝卜亲缘关系最近, 同源性为82.04%; BcPAF1与胡萝卜同源性达88.33%以上; BcCO基因在伞形科植物中少有研究, 分析可知北柴胡中的BcCO基因与胡萝卜亲缘关系最近, 同源性为75.22%; BcFT基因与伞形科植物当归亲缘关系最近, 为88.39%, 胡萝卜次之, 同源性为87.23%, 且该基因研究较多, 物种之间同源性大。

|
Figure 3 Alignment of BcCO deduced amino acid sequence with several other CO proteins |

|
Figure 4 Alignment of BcSVP deduced amino acid sequence with several other SVP proteins |
|
Figure 5 Alignment of BcPAF1 deduced amino acid sequence with several other PAF1 proteins |

|
Figure 6 Alignment of BcFT deduced amino acid sequence with several other FT proteins |
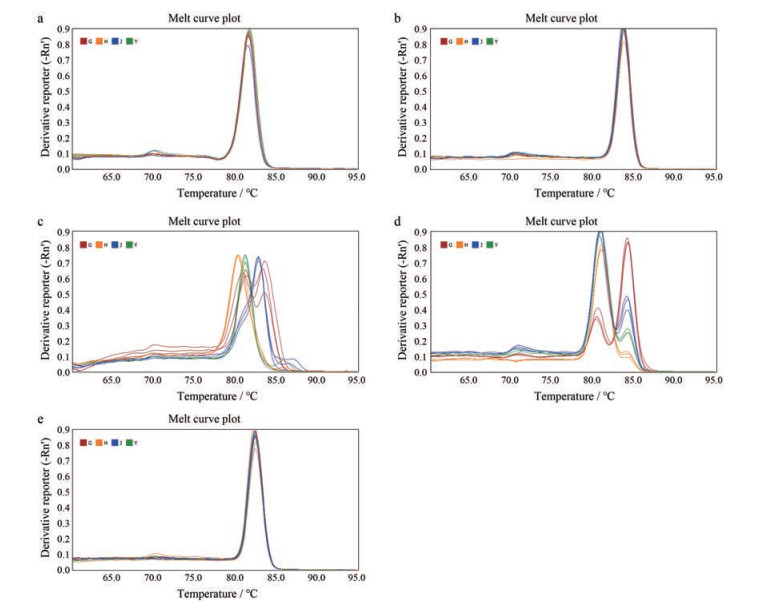
通过文献阅读, 本实验选取actin、α-tubulin、β-tubulin、cyclophilin、EF-1α等5个常用北柴胡内参基因作为候选, 利用实时荧光定量PCR技术检测各候选内参基因能否在北柴胡中稳定表达, 并对候选内参基因的稳定性进行验证, 以期筛选到合适的内参基因用于分析北柴胡成花基因的时空表达模式。候选内参基因引物熔解曲线如图所示(图 7): actin、α-tubulin、EF-1α基因的熔解曲线呈现单一峰值、引物特异性较强, 进一步实验发现actin、EF-1α基因在北柴胡不同发育时期和不同器官组织中表达相对稳定。因此, 选取了actin、EF-1α基因作为本实验内参基因, 进行后续目的基因时空表达分析。
|
Figure 7 Primer dissolution curve of internal reference gene. G: Root; J: Stem; Y: Leaf; H: Flower. a: Actin; b: α-Tubulin; c: β-Tubulin; d: Cyclophilin; e: EF-1α |
用qRT-PCR考察4个成花相关基因在北柴胡植株不同开花时期根、茎、叶、花各器官组织中的相对表达水平(图 8), 结果显示: 4个基因在北柴胡植株营养器官(根茎叶) 和生殖器官(花) 中均有表达, BcSVP主要在营养器官中表达, 根中表达量最高, 是花的4.75倍, 器官组织中的表达丰度为根 > 茎 > 叶 > 花, 随着花期延续, 花中的表达丰度呈先上升后下降趋势, 茎和叶呈稳中有升趋势, 根中表达较为稳定, 这与杨堃等[15]对葡萄的研究结果相似; BcPAF1在北柴胡各器官组织中表达丰度基本一致, 伴随着花期推进, 呈先上升后下降趋势, 在盛花初期达到最大; BcCO在叶中表达量最大, 是根部表达量的1.5倍, 各器官组织表达丰度为: 叶 > 花 > 茎 > 根, 开花前表达量小, 花期整体相对表达量较为稳定, 各个时期之间的表达差异不明显; BcFT主要在茎中表达, 花中表达量最小, 时空表达差异显著, 相对表达量在盛花初期急剧上升并在盛花末期达到最大值。综上所述, 在北柴胡植株开花进程中相对表达量最大的是BcFT, 最小的是BcSVP, BcPAF1和BcCO的相对表达量基本一致。
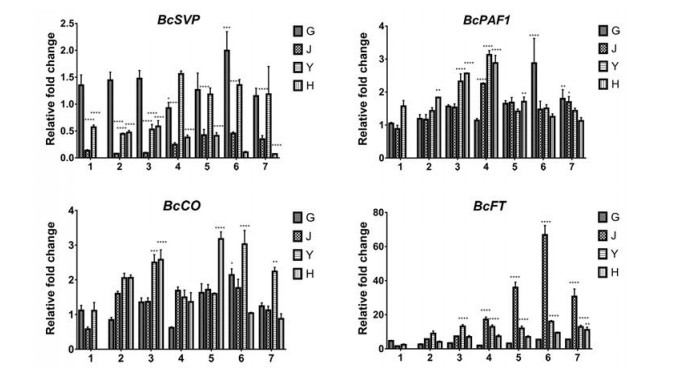
|
Figure 8 Expression pattern of genes in different parts of flower development. *P < 0.05, **P < 0.01, ***P < 0.001, ****P < 0.000 1 vs control (1-G of each gene was used as a control). G: Root; J: Stem; Y: Leaf; H: Flower; 1: Before flowering; 2: Bud stage; 3: Early flowering; 4: Early blooming; 5: Mid-blooming; 6: End of bloom; 7: Flower wither period |
本研究以常用中药柴胡的主要原植物北柴胡Bupleurum chinense DC.作为研究对象, 首次在北柴胡中克隆得到与成花相关4个基因, 并采取双内参的方式对不同发育期根、茎、叶、花等器官中成花基因的差异表达水平进行分析, 4个基因随着开花进程的推进表达量呈现一定规律, 推测它们可能处于北柴胡成花诱导的关键部位。BcSVP与胡萝卜亲缘关系最近, 同源性为82.04%; BcPAF1基因与胡萝卜同源性达88.33%; BcCO基因与胡萝卜亲缘关系最近, 同源性为75.22%, 推测BcCO可能是北柴胡CO家族的成员CONSTANS-LIKE之一, 是一种转录因子且在伞形科植物中少有研究; BcFT基因与伞形科植物当归亲缘关系最近, 为88.39%, 胡萝卜次之, 同源性为87.23%, 物种之间同源性大。
有研究证明, 以根部药用的伞形科植物, 抑制其生殖生长, 如除花、打顶, 能促进根长、根粗增加, 提高柴胡皂苷a、d及醇溶性浸出物含量[16]。有人综述了伞形科药用植物的早期抽薹问题, 认为研究春化基因、开花调控基因将是开展伞形科药用植物种质筛选和培育的关键和发展趋势[17]。因此, 研究北柴胡的成花基因, 明确其成花机制, 对于药材生产中高产优质措施制定具有重要的指导意义。
在植物某一特定发育阶段, 基因的表达量是一个动态变化过程, 这种在不同器官或组织中, 按照特定时间或空间进行基因有序表达的方式叫作基因的差别表达[18]。对基因表达量进行差异分析, 是了解生物体生长、发育和调控机制的重要途径, 也是荧光定量PCR应用最普遍的方式[19, 20]。Ye等[21]选用双内参的方式分析目的基因在巴戟天不同组织中的相对表达量, 发现使用2个稳定内参组合对目的基因进行均一化处理有利于提高基因表达分析的准确性。本研究采取双内参组合的形式对目的基因进行表达验证, 在北柴胡成花过程中BcSVP相对表达量最低, BcFT表达量最高, 后者是前者的13.5倍, 提示在开花时开花抑制因子表达量低, 而与开花正相关的基因表达量高; BcCO在叶中表达量最大, 开花前表达量小, 花期相对表达量较稳定, 各时期之间表达差异不明显; BcPAF1在不同器官间的表达丰度基本一致, 盛花初期表达量达到最大。
Zhang等[22]对拟南芥开花时间调控的分析发现, 至少64个基因涉及开花诱导6条遗传调控途径, 通过对模式植物拟南芥开花途径的研究, 发现不同的开花途径之间既相互独立, 又彼此联系, 最终通过FT等整合基因来调控开花。SVP是抑制植物开花的重要调控因子, 在植物成花过程中能够抑制FT基因表达; 而CO是FT的上游基因, 能够正向调控FT基因, 进而诱导植物成花, 是植物开花光周期途径中的关键基因。FT是CO的下游基因, 被确定为一种与成花相关的蛋白, 被称为开花素, 其主要功能是促进植物开花[23-26]。彼此之间相互作用从而起到调控植物开花的时间, PAF1是在春化途径中一个与开花抑制因子相关的复合体, 能够加强对成花的抑制作用[27]。本研究只是对成花基因在北柴胡中的时空表达情况进行了初步探讨, 接下来将对4个基因在柴胡中的功能进行深入研究, 以期能解析它们的作用机制, 得出更全面的结论。
综上所述, 本研究首次从北柴胡中分离克隆了4个与成花相关的基因, 并探讨了其在北柴胡中的时空表达差异模式, 为北柴胡成花基因的功能及其调控网络奠定了基础, 也为北柴胡基因克隆、功能验证等相关基因分子作用机制研究提供了参考。
作者贡献: 第一作者李敏负责实验、数据分析及论文撰写; 通讯作者张永清对选题依据及研究思路提供指导和论文修改; 张全芳、蒲高斌为本研究提供实验指导并对论文初稿进行修改; 步迅、刘艳艳、刘谦参与实验及数据分析。
利益冲突: 本文不存在利益冲突。
| [1] |
Kobayashi Y, Weigel D. Move on up, it's time for change-mobile signals controlling photoperiod-dependent flowering[J]. Genes Dev, 2007, 21: 2371-2384. DOI:10.1101/gad.1589007 |
| [2] |
Fu YF, Meng FJ. Gene regulation of flowering transition[J]. Plant Physiol J (植物生理学通讯), 1997, 33: 393-400. |
| [3] |
Ou CG, Mao JH, Liu LJ, et al. Characterising genes associated with flowering time in carrot (Daucus carota L.) using transcriptome analysis[J]. Plant Biol, 2017, 19: 286-297. DOI:10.1111/plb.12519 |
| [4] |
Lv B. Genetic Transformation of Plant Flowering Gene FT and Its Involvement in Flowering Control (植物开花基因FT的遗传转化及其参与开花调控的研究)[D]. Taian: Shandong Agricultural University, 2014.
|
| [5] |
Liu LJ, Ou CG, Zhao ZW, et al. Function analysis of carrot SOC1 homologues responding to photoperiod[J]. Acta Hort Sin (园艺学报), 2016, 43: 1099-1106. |
| [6] |
Blümel M, Dally N, Jung C. Flowering time regulation in crops: what did we learn from Arabidopsis?[J]. Curr Opin Biotechnol, 2015, 32: 121-129. DOI:10.1016/j.copbio.2014.11.023 |
| [7] |
Chinese Pharmacopoeia Commission. Pharmacopeia of People's Republic of China (中华人民共和国药典)[J]. Beijing: China Medical Science Press, 2015, 280-281. |
| [8] |
Qin XM, Gao Y, Tian JS, et al. Ideas and strategies from quality evaluation of Radix Bupleurum for development of new anti-depressant drugs[J]. Acta Pharm Sin (药学学报), 2019, 54: 1402-1408. |
| [9] |
Xin G, Zhao XT, Huang XW, et al. Research progress on chemical constituents and pharmacological effects of Bupleurum[J]. Jilin J Chin Med (吉林中医药学报), 2018, 38: 1196-1198. |
| [10] |
Meng XC, Sun H, Yang G, et al. Effect of topping on yield and quality of Bupleurum chinense[J]. J Chin Med Mater (中药材), 2008, 31: 336-337. |
| [11] |
Yu Y, Wang XQ, Liu X, et al. Influence of inflorescence plucking and tip pruning on vegetative characters and root production of Bupleurum chinense[J]. J Jilin Agric Univ (吉林农业大学学报), 2003, 25: 303-306. |
| [12] |
Zhou LY, Liu T, Wang S, et al. Real-time PCR and its application in study of traditional Chinese medicine[J]. Mod Chin Med (中国现代中药), 2016, 18: 246-251, 262. |
| [13] |
Zhao Y, Yang LL, Han M, et al. Correlation between content of saikosaponin and expression of key enzyme genes in different parts of Bupleurum chinense[J]. Chin Tradit Herb Drugs (中草药), 2019, 50: 2433-2441. |
| [14] |
Livak KJ, Schmittgen TD. Analysis of relative gene expression data using real-time quantitative PCR and the 2-ΔΔCT method[J]. Method, 2001, 25: 402-408. DOI:10.1006/meth.2001.1262 |
| [15] |
Yang K, Zhang CH, Li SX, et al. Cloning and expression analysis of grape SVP-like MADS-box gene[J]. J Northwest Forest Univ (西北林学院学报), 2012, 27: 117-123. |
| [16] |
Cao AN. Study on the Key Factors Affecting the Quality and Yield of Bupleurum Chinense DC (影响柴胡质量与产量的关键因素研究)[D]. Lanzhou: Gansu Agricultural University, 2016.
|
| [17] |
Zhao DY, Hao QX, Kang LP, et al. Advance in studying early bolting of Umbelliferae medicinal plant[J]. China J Chin Mater Med (中国中药杂志), 2016, 41: 20-23. |
| [18] |
Ono K, Hirohata M, Yamada M. Alpha-synuclein assembly as a therapeutic target of Parkinson's disease and related disorders[J]. Curr Pharm Design, 2008, 14: 3247-3266. DOI:10.2174/138161208786404191 |
| [19] |
Yuan BC, Li WD, Ma YS, et al. The molecular identification of Bupleurum medicinal species and the quality investigation of Bupleuri Radix[J]. Acta Pharm Sin (药学学报), 2017, 52: 162-171. |
| [20] |
Kim YJ, Jeon JN, Jang MG, et al. Ginsenoside profiles and related gene expression during foliation in Panax ginseng Meyer[J]. J Gins Res, 2014, 38: 66-72. DOI:10.1016/j.jgr.2013.11.001 |
| [21] |
Ye YJ, Xie DJ, Yang DM, et al. Selection of reference genes for quantitative real-time PCR in Morinda officinalis[J]. Chin Tradit Herb Drugs (中草药), 2020, 51: 1060-1068. |
| [22] |
Zhang YN, Zhou YP, Chen QH, et al. Molecular basis of flowering time regulation in Arabidopsis[J]. Chin Bull Bot (植物学报), 2014, 49: 469-482. DOI:10.3724/SP.J.1259.2014.00469 |
| [23] |
Suárez-López P, Wheatley K, Robson F, et al. CONSTANS mediates between the circadian clock and the control of flowering in Arabidopsis[J]. Nature, 2001, 410: 1116-1120. DOI:10.1038/35074138 |
| [24] |
Zhu FJ, Liu J, Yuan Y, et al. Expression analysis of Hsp70-related miRNA in Lonicera japonica Thunb. during different flowering stages[J]. Acta Pharm Sin (药学学报), 2018, 53: 1202-1208. |
| [25] |
Spanudakis E, Jackson S. The role of microRNAs in the control of flowering time[J]. Exp Bot, 2014, 65: 365-380. DOI:10.1093/jxb/ert453 |
| [26] |
Yamaguchi A, Kobayashi Y, Goto K, et al. TWIN SISTER OF FT (TSF) acts as a floral pathway integractor redundantly with FT[J]. Plant Cell Physiol, 2005, 46: 1175-1189. DOI:10.1093/pcp/pci151 |
| [27] |
Yun H, Hyun Y, Kang MJ, et al. Identification of regulators required for the reactivation of FLOWERING LOCUS C during Arabidopsis reproduction[J]. Planta, 2011, 234: 1237-1250. DOI:10.1007/s00425-011-1484-y |
 2021, Vol. 56
2021, Vol. 56


