2. 陕西省天芪生物科技有限责任公司, 陕西 榆林 718400
2. Shaanxi TianQi Biotechnology Limited Liability Company, Yulin 718400, China
植物在长期的进化过程中形成了一系列复杂的细胞信号转导及调控网络以适应不断变化的环境, 转录因子在其中起重要的调控作用[1]。植物中转录因子有58个家族, MYB转录因子家族是成员众多且功能多样的一大类, 其DNA结合结构域通常包含1~4个不完全重复域, 该结构域由两部分构成, 前者由51~52个高度保守的氨基酸残基组成, 后者包含18~19个氨基酸, 它们共同构成螺旋-转角-螺旋结构(helix-turn-helix, HTH)[2]; 根据HTH结构域的数目, MYB一般分为1R-MYB、R2R3-MYB、R1R2R3-MYB和4R-MYB四大类[3]。植物R2R3-MYB家族成员序列高度保守, 报道较为普遍, 拟南芥已鉴定有126个R2R3-MYB[4], 丹参有110个[5], 铁皮石斛有136个[6], 广泛参与植物形态建成、次生代谢调控及对生物和非生物胁迫逆境适应。拟南芥AtMYB32和AtMYB4可通过调控苯丙烷代谢途径来影响花粉发育, 从而影响花粉壁的组成[7]。甘草GlMYB4和GlMYB88受茉莉酸甲酯(MeJA) 诱导以正向调节类黄酮的合成[8]。人参PgMYB1受脱落酸(ABA)、水杨酸(SA)、盐和冷胁迫诱导表达, MeJA处理则抑制其表达[9]。
大黄作为我国常用大宗药材, 药理药效作用明确, 临床应用广泛。掌叶大黄Rheum palmatum L.系大黄三基原之一, 以干燥根及根茎入药, 具有泻下攻积、清热泻火、凉血解毒、逐瘀通经、利湿退黄等功效[10]。现代药理研究表明, 大黄有调节胃肠功能、心脑血管保护、抗肿瘤及免疫调节等活性[11]。大黄耐寒, 喜光照, 常生长于向阳山地林边草地、山地灌丛、草甸之间, 分布海拔在2 500~4 400 m, 野生资源相对较少[11]。目前, 大黄主要栽培于甘肃、青海、陕西等高海拔适生区, 这种特殊的生态环境对其次生代谢物合成与积累乃至药材品质形成至关重要。为解析大黄蒽醌类有效成分的合成途径及调控机制, 课题组前期对一年生掌叶大黄根、根茎和叶片进行比较转录组测序(SRR10855670), 挖掘大量与大黄生长发育、次生代谢及逆境胁迫等生物学过程密切相关的基因。本研究从中鉴定到一个R2R3-MYB家族成员基因Cluster-7329.53230 (1 395 bp), 包含完整ORF (738 bp), 与植物R2R3-MYB家族成员序列相似性较高(> 61%); 比较转录组测序分析其转录本在大黄根、根茎、叶片中差异积累, 鉴于R2R3-MYB家族在植物次生代谢调控的重要功能, 初步推测该基因可能参与掌叶大黄蒽醌类物质次生代谢。本研究进行该基因RT-PCR克隆、生物信息学分析, 同时进行该基因的组织、激素(MeJA、SA、ABA) 及非生物(干旱、盐、高温、低温、损伤) 胁迫处理表达分析, 为下一步研究其分子功能提供依据。
材料与方法材料 2019年10月在甘肃省陇南市宕昌县阿坞乡麻界村(东经104°10′4.98″, 北纬34°16′50.9″, 海拔2 377 m) 分别采集掌叶大黄一年生植株和成熟种子, 经陕西中医药大学胡本祥教授鉴定为掌叶大黄R. palmatum L.。在实验室取大黄根、根茎、叶、叶柄4个部位及种子样品置液氮速冻后放入-80 ℃冰箱保存备用。
参考Hei等[12]建立的方法培养大黄无菌实生苗。选取生命旺盛、长势均匀的一个月龄幼苗, 分别喷施200 μmol·L-1的MeJA、SA、ABA激素作为处理组, 以不含激素的溶剂模拟喷施作为对照; 同时, 对无菌苗进行干旱(10% PEG 6000)、盐(100 mmol·L-1 NaCl)、高温(40 ℃)、低温(4 ℃)、机械损伤(针刺叶片) 等非生物胁迫处理, 以无菌水处理为对照组, 两组材料均以0 h为空白对照, 所有样品重复3次, 分别于处理后1、3、6、12和24 h取处理和对照组样品, 液氮速冻后置-80 ℃冰箱保存备用。
本氏烟Nicotiana benthamiana Domin由本实验室保存。
总RNA提取及cDNA合成 使用植物RNA提取试剂盒RN38 (艾德莱, 北京) 提取掌叶大黄各样品的总RNA, 用1.0%琼脂糖凝胶电泳检测其完整性, 用K5800自动检测超微量分光光度计(凯奥, 中国) 检测RNA浓度和纯度; 使用PrimeScriptTM RT Master Mix反转录试剂盒(TaKaRa, 中国) 合成cDNA第一链, -20 ℃保存备用。所有操作均按试剂盒说明书进行。
基因克隆 掌叶大黄MYB基因Cluster-7329.53230 ORF 738 bp, 利用Primer Premier 5.0设计跨ORF引物: RpMYB4-ORF-F 5'-ATGAGAAAGCCGTGCTGCG-3', RpMYB4-ORF-R 5'-TCATGTAAAGAGGACAAGAGT ACTAGGG-3'。PCR体系为25 μL: 2×Es Taq MasterMix 12.5 μL、Forward Primer 1 μL、Reverse Primer 1 μL、Template DNA 1 μL、ddH2O 9.5 μL; PCR扩增条件: 预变性95 ℃ 5 min、变性95 ℃ 30 s, 退火60 ℃ 30 s, 40个循环, 延伸72 ℃ 2 min、彻底延伸72 ℃ 5 min, 4 ℃保温。将获得的PCR特异性片段经1.0%琼脂糖凝胶电泳后, 用DNA胶回收试剂盒(TianGen, 中国) 纯化回收, 连入pUC19载体(TaKaRa, 中国), 转化大肠杆菌DH5α感受态细胞, 随机选取3个带有目的产物的阳性克隆质粒, 送由上海生工完成测序。
生物信息学分析 使用在线工具分析基因核酸及蛋白序列分析, 在NCBI BLASTx (https://blast.ncbi.nlm.nih.gov/Blast.cgi?PROGRAM=blastx&PAGE_TYPE=BlastSearch&LINK_LOC=blasthome) 分析cDNA; ExPASy (https://www.expasy.org/) 一系列工具分析基因编码蛋白质的结构域和基元, InterProScan (https://www.ebi.ac.uk/interpro/result/InterProScan/iprscan5-R20191011-031954-0959-15799854-p2m/) 与PROSITE (https://prosite.expasy.org/cgi-bin/prosite/PSScan.cgi) 分析蛋白的保守结构域与基元SOPMA (https://npsa-prabi.ibcp.fr/cgi-bin/npsa_automat.pl?page=/NPSA/npsa_sopma.html) 和Compute pI/MW (https://web.expasy.org/ compute_pi/) 分析蛋白质理化性质和二级结构, SignalP4.0 (http://www.cbs.dtu.dk/services/SignalP-4.0/) 和TMHMM预测信号肽和跨膜区域, Plant-mPLoc (http://www.csbio. sjtu.edu.cn/bioinf/plant-multi/) 和WolfPSORT (https://wolfpsort.hgc.jp/) 预测亚细胞定位; 借助MegAlign6.0进行多序列比对, 利用MEGA 6.0构建系统进化树。
亚细胞定位 为验证RpMYB4的亚细胞定位, 在RpMYB4 ORF扩增引物两端分别加入NcoⅠ和SpeⅠ酶切位点: RpMYB4orf-GFP-F: 5'-CCATGGATGAGAAA GCCGTGCTGCGA-3', RpMYB4orf-GFP-R: 5'-ACTAGTTGTAAAGAGGACAAGAGTAC-3', 克隆后连接至pCAMBIA1302构建重组载体, CaCl2法转入农杆菌感受态细胞EHA105 (唯地, 上海), 倒置培养2天, 挑取阳性克隆接种到含有抗生素的5 mL LB培养基中, 28 ℃, 200 r·min-1培养至菌液浑浊后, 用5 mL农杆菌缓冲液洗涤3次, 稀释至菌体浓度(A600) 为200时, 避光静置2 h。选择长有8叶左右的本氏烟的第2~4叶, 快速撕取内表皮, 平铺于MS固体培养基, 25 ℃下暗培养36 h。农杆菌注射法将质粒pCAMBIA1302-GFP、pCAMBIA1302-RpMYB4-GFP转化到内表皮, 25 ℃共培养36 h后, 用10 μg·mL-1 4', 6-二脒基-2-苯基吲哚(4', 6-diamidino-2-phenylindole, DAPI) 染色20 min, 再用pH 7.2的磷酸盐缓冲液清洗3次, 制片, 用Olympus FV3000激光共聚焦显微镜(Olympus, 日本) 观察。
基因表达模式 利用实时荧光定量PCR分析RpMYB4在一年生掌叶大黄不同组织部位、激素和非生物胁迫处理下的表达特征。以β-actin为内参基因[13], qPCR引物序列为: RpMYB4-qPCR-F 5'-ATCACATCC AACCCTCGTCAC-3', RpMYB4-qPCR-R 5'-TGTCCG ATGCCGTAGTAAGC-3', 扩增产物长度188 bp。使用TB Green® Premix Ex TaqTM II (Tli RNaseH Plus) (TaKaRa, 中国) 进行qPCR。20 μL反应体系: 2×TB Green® Premix Ex TaqTM II (Tli RNaseH Plus) 10 μL、Forward/Reverse Primer各0.8 μL、cDNA模板2 μL、50×ROX Reference Dye 0.4 μL、ddH2O 7 μL。反应程序: 预变性95 ℃ 30 s, 变性95 ℃ 5 s, 退火60 ℃ 30 s, 延伸60 ℃ 34 s, 40个循环, 融解曲线95 ℃ 15 s, 60 ℃ 1 min, 95 ℃ 15 s。同时绘制熔解曲线, 包括不加模板的对照在内, 所有qPCR反应技术重复和实验重复各3次, 利用StepOnePlus® Real-Time (Applied Biosystems, 美国) 进行qPCR检测, 使用2-∆∆Ct法[14]计算相对表达量。
结果与分析 1 基因克隆分析以掌叶大黄无菌苗的cDNA为模板, 利用RpMYB4-ORF-F/R进行RT-PCR。扩增产物通过1.0%琼脂糖凝胶电泳检测, 获得清晰明亮的单条带(图 1)。目标条带经克隆测序获得738 bp的序列, 与原Cluster-7329.53230 ORF一致, BLASTx比对发现其与苦荞麦FtMYB4 (GenBank登录号KR072701) 相似性高达74.69%, 命名为RpMYB4 (MW269546)。

|
Figure 1 Agarose gel electrophoresis of the amplified RpMYB4 ORF fragment |
Compute pI/MW预测RpMYB4基因编码蛋白的分子式为C1170H1883N355O357S11, 分子质量为26.99 kDa, 等电点为8.71, RpMYB4蛋白带正电残基(Arg+Lys) 34, 负电荷残基(Asp+Glu) 30。该蛋白不稳定系数为43.4, 脂肪系数为77.18, 亲水性系数为-0.641。SOPMA分析表明, RpMYB4二级结构主要由α螺旋(alpha helix, 25.71%)、随机卷曲(random coil, 55.10%)、延伸链(extended strand, 13.88%) 和少量的β转角(beta turn, 5.31%) 组成。
利用InterProScan与PROSITE分析预测一致, RpMYB4包含两个典型的MYB结构域, 分别含有52个和54个氨基酸(图 2), PROSITE SCAN分析表明该蛋白中包含1个N-糖基化位点(146~149)、1个蛋白激酶C磷酸化位点(52~54)、4个酪蛋白激酶II磷酸化位点(18~21、100~103、150~153、174~177)、1个酪氨酸激酶磷酸化位点(99~107)、8个N-豆蔻酰化位点(11~16、35~40、45~50、86~91、120~125、162~167、167~172、228~233)、1个酰胺化位点(206~209) 和1个ATP/GTP结合位点基序A (P环) (45~52)。使用SignalP 4.1和TMHMM在线分析一致表明该蛋白无信号肽或跨膜域, 同时Plant-mPLoc和WolfPSORT一致预测RpMYB4定位在细胞核。

|
Figure 2 PROSITE analysis of the deduced RpMYB4 protein |
借助DNAStar6.0软件中的MegAlign对目的蛋白和其他MYB家族植物蛋白进行多序列比对。图 3分析显示, RpMYB4蛋白序列中包含两个MYB基序, 属于典型的植物R2R3亚家族MYB转录因子, 与苦荞Fagopyrum tataricum (AKV16373)、大豆Glycine soja (KHN20933)、豇豆Vigna unguiculata (XP_027939617)、桉树Eucalyptus grandis (XP_010044170)、木薯Manihot esculenta (XP_021601304)、杨梅Morella rubra (KAB1211278)、李Prunus persica (XP_007215900)、核桃Juglans regia (XP_018816947)、石榴Punica granatum (XP_031394004) 等蛋白的相似性较高, 分别为74.69%、67.5%、66.83%、66.67%、66.5%、64.34%、64.16%、63.52%、61.02%。

|
Figure 3 Multiple sequence alignments of RpMYB4 with MYB proteins from other plants |
从NCBI GenBank (http://www.ncbi.nlm.nih.gov/genbank) 和phytozome (https://phytozome.jgi.doe.gov/pz/portal.html) 数据库中下载拟南芥、苦荞麦、丹参、人参和桃等植物R2R3-MYB蛋白家族成员, 采用MEGA 6.0软件邻接法(Neighbour-Joining) 分析RpMYB4基因编码蛋白的分子进化关系。图 4结果显示所选取的24个基因被划分在R2R3-MYB的S4和S6亚家族, RpMYB4与苦荞麦FtMYB8关系最近, 被聚在S4亚家族。
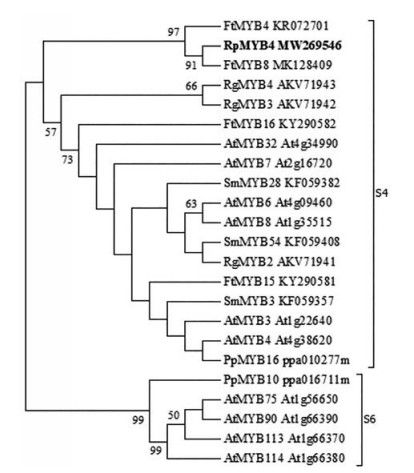
|
Figure 4 Phylogenetic relationship of RpMYB4 with MYBs from other plants |
用激光共聚焦显微镜观察PCR检测阳性的本氏烟叶片表皮细胞。图 5结果表明, 细胞核和细胞质均出现空载对照的绿色荧光; RpMYB4-GFP融合蛋白的绿色荧光在细胞核可以被观察到, 且绿色荧光信号十分明亮。

|
Figure 5 Subcellular localization of RpMYB4 in leaf epidermal cells of N. benthamiana |
分别提取掌叶大黄根、根茎、叶、叶柄、种子各样品总RNA, 利用qPCR检测不同组织部位中的基因表达。从图 6可以看出, RpMYB4基因在大黄5种组织中的相对表达量差异显著, 基因转录本在叶、叶柄中丰度最高, 分别为根中的16.84、15.58倍, 根茎中相对表达量为根中的4.03倍, 而在种子中的表达量最低, 仅为根中的0.05倍。
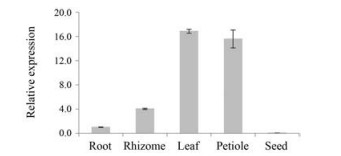
|
Figure 6 Expression analyses of RpMYB4 in different tissues |
对掌叶大黄无菌苗喷施外源激素MeJA、SA、ABA, 以0 h (CK) 为对照, qPCR分别检测处理后1、3、6、12、24 h后RpMYB4的相对表达量(图 7), Mock在处理1 h内迅速下调至CK的0.3倍后缓慢恢复, MeJA应答RpMYB4表达持续下调至24 h为CK的0.43倍, SA显著上调RpMYB4, 在12 h持续上升为CK的2.26倍, 24 h为CK的2.54倍; ABA应答基因表达未见明显变化。
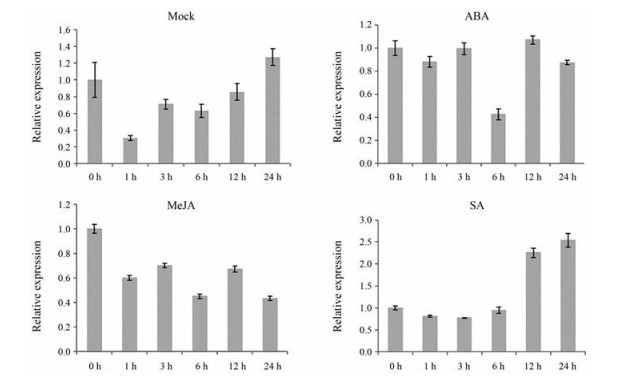
|
Figure 7 Expression analyses of RpMYB4 in response to treatment with exogenous hormones |
掌叶大黄无菌苗经干旱、盐、高温、低温、机械损伤5种非生物胁迫处理, 以0 h (CK) 为对照, 分析了在处理后1、3、6、12、24 h的RpMYB4相对表达量(图 8)。结果显示RpMYB4基因在Mock组中的表达变化不显著; 其转录本在10% PEG, 高温胁迫处理24 h均显著上调, 分别为CK的2.17、2.6倍; 该基因响应低温胁迫, 其表达量先下调后恢复, 在6 h处达谷值为CK的0.35倍; 损伤胁迫下表达量先上调后恢复, 在3 h处达峰值为CK的3.91倍; 盐胁迫下基因表达水平未见显著影响。

|
Figure 8 Expression analyses of RpMYB4 in response to various abiotic stresses |
MYB作为最大的转录因子家族之一, 在植物特定形态发生、细胞生长发育及次生代谢调控等方面都有明确的研究进展[1]。目前在模式植物和农作物中的研究最为广泛, 为药用植物等其他重要类群MYB转录因子的鉴定及功能研究提供线索[3]。本研究首次从掌叶大黄中分离到RpMYB4, 其与GenBank中多个植物MYB基因一致性较高, 编码蛋白分子质量为26.99 kDa, 并且包含2个MYB-DBD结构域, 符合R2R3-MYB的结构特征。通过本氏烟叶表皮亚细胞定位与在线预测结果一致显示RpMYB4为核定位蛋白, 符合转录因子在细胞核内与特定基因的启动子区域结合实现调控表达的特点[1]。因此RpMYB4为掌叶大黄R2R3-MYB家族新鉴定的成员。
生物体功能基因家族成员通常具有相似的结构域和进化关系。巴戟天MoMYB45和MoMYB65系统进化共同聚在S4亚家族, 该亚家族蛋白C端含有保守的EAR基序, 被认为二者在苯丙烷代谢途径中功能有相似性—作为抑制剂抑制一些关键酶基因的表达[15]。本研究分子进化分析显示RpMYB4聚在植物R2R3-MYB S4亚家族, 与苦荞麦FtMYB8关系最近。前期研究结果表明S4亚家族MYB转录因子在次生代谢调控水平上多抑制植物细胞苯丙烷类生物合成通路[16]。抑制拟南芥AtMYB32表达可增加COMT基因转录水平, 降低与原花色素生物合成相关的DFR和ANS基因水平[7]。AtMYB4通过调节肉桂酸4-羟化酶基因的表达负调控对羟基肉桂酸代谢, 并且受损伤和紫外光胁迫下调[17]。苦荞FtMYB8可以抑制花青素与原花青素积累以及阻碍苦荞幼叶边缘腺毛发育[18]。因此, 推测RpMYB4可能直接或间接地参与苯丙烷类次生代谢合成与调控。
MYB基因家族的成员通常具有组织表达特性, 这与其所调控的生命活动有关。研究发现银杏GbMYB26和GbMYB31转录本在叶和雌蕊中丰度很高, 可能参与叶和雌蕊中类黄酮物质的合成与调节[19]。红花CtMYB-TF7在根、茎及叶中表达量低, 但花中表达量较高, 且系统进化与已报道的两个黄酮类成分调控转录因子关系较近, 预测CtMYB-TF7可能参与红花黄酮类成分的调控[20]。本研究qPCR结果揭示RpMYB4的表达模式依此为叶片 > 叶柄 > 根茎 > 根 > 种子, 说明其可能主要在叶片和叶柄中发挥作用。
植物适应环境胁迫的转录调控研究通常结合转录因子对不同激素或生物或非生物胁迫的响应研究。紫草LeMYB1响应MeJA快速上调表达, 且蒽醌类化合物紫草素也显著诱导积累, 而2, 4-D同时抑制LeMYB1的表达及紫草素的合成[21]。水稻OsMYB84受ABA、高盐处理显著诱导表达, 可能通过依赖ABA信号通路参与盐胁迫应答[22]。本研究结果表明大黄RpMYB4对各激素和非生物胁迫处理的响应存在一定差异。RpMYB4基因受SA处理24 h显著上调, 与GbMYB26响应SA的表达模式类似[19], 推测RpMYB4可能通过水杨酸信号通路起作用。MeJA处理抑制RpMYB4基因表达, 而低温胁迫下6 h显著下调其表达水平, MeJA又是植物CBF/DREB1冷胁迫响应途径的早期关键信号[23], 暗示RpMYB4可能与MeJA负调控冻害胁迫的耐受过程有关。RpMYB4基因表达变化不受ABA处理的影响, 而受高温和干旱处理24 h诱导, 这与厚叶旋蒴苣苔BcMYB1干旱诱导具有一定相似性[24], 说明RpMYB4可能通过一种不依赖ABA的信号通路参与大黄对干旱的生理适应。机械损伤被认为是诱导植物通过苯丙烷途径防御的重要手段之一[25], RpMYB4表达受针刺损伤在3 h显著上调, 在时间点上基因表达远早于其他胁迫条件, 说明该基因可能作用于苯丙烷类或其他保护性次生代谢物的合成以保护机体免受损伤。RpMYB4响应激素和胁迫的差异表达, 对于后续研究该基因在大黄活性成分合成调控及抗逆生理过程中的作用有重要意义, 尚需进一步深入研究。
作者贡献: 第一作者李元敏负责实验、数据分析及论文撰写; 通讯作者张岗、李依民负责实验设计、数据分析和论文修改; 张娜、李慧参与实验及数据分析; 张明英、彭亮、颜永刚参与样品采集和数据分析。
利益冲突: 本文所有的作者之间不存在利益冲突。
| [1] |
Hai D, Li Z, Liu L, et al. Biochemical and molecular characterization of plant MYB transcription factor family[J]. Biochem (Mosc), 2009, 74: 1-11. DOI:10.1134/S0006297909010015 |
| [2] |
Rosinski JA, Atchley WR. Molecular evolution of the MYB family of transcription factors: evidence for polyphyletic origin[J]. J Mol Evol, 1998, 46: 74-83. DOI:10.1007/PL00006285 |
| [3] |
Katiyar A, Smita S, Lenka S, et al. Genome-wide classification and expression analysis of MYB transcription factor families in rice and Arabidopsis[J]. BMC Genomics, 2012, 13: 544. DOI:10.1186/1471-2164-13-544 |
| [4] |
Dubos C, Stracke R, Grotewold E, et al. MYB transcription factors in Arabidopsis[J]. Trends Plant Sci, 2010, 15: 573-581. DOI:10.1016/j.tplants.2010.06.005 |
| [5] |
Li CL, Lu SF. Genome-wide characterization and comparative analysis of R2R3-MYB transcription factors shows the complexity of MYB-associated regulatory networks in Salvia miltiorrhiza[J]. BMC Genomics, 2014, 15: 1-12. |
| [6] |
Li SY, Li TT, Li L, et al. Genome-wide identification and bioinformatics analysis of Dendrobium officinale R2R3-MYB transcription factor[J]. Mol Plant Breeding (分子植物育种). https://kns.cnki.net/kcms/detail/46.1068.S.20200923.0903.002.html.
|
| [7] |
Preston J, Wheeler J, Heazlewood J, et al. AtMYB32 is required for normal pollen development in Arabidopsis thaliana[J]. Plant J, 2004, 40: 979-995. DOI:10.1111/j.1365-313X.2004.02280.x |
| [8] |
Li Y, Chen X, Wang J, et al. Two responses to MeJA induction of R2R3-MYB transcription factors regulate flavonoid accumulation in Glycyrrhiza uralensis Fisch[J]. PLoS One, 2020, 15: e0236565. DOI:10.1371/journal.pone.0236565 |
| [9] |
Afrin S, Zhu J, Cao H, et al. Molecular cloning and expression profile of an abiotic stress and hormone responsive MYB transcription factor gene from Panax ginseng[J]. Acta Biochim Biophys Sin, 2015, 47: 267-77. DOI:10.1093/abbs/gmv012 |
| [10] |
Chinese Pharmacopoeia Commission. Pharmacopoeia of the People's Republic of China (中华人民共和国药典)[S]. Part Ⅰ. 2020 ed. Beijing: China Medical Science Press, 2020: 24.
|
| [11] |
Yang Y, Shui PX, Chen Y, et al. Efficacy of rhubarb in clinical application and its pharmacological effects[J]. Genom Appl Biol, 2017, 36: 1226-1231. |
| [12] |
Hei XB, Li YY, Li H, et al. Investigation on seeds characteristics and establishment of aseptic cultural system for Rheum palmatum[J]. Chin Tradit Herb Drugs (中草药), 2019, 50: 4430-4437. |
| [13] |
Sun ML, Wang YS, Yang DQ, et al. Reference genes for real-time fluorescence quantitative PCR in Camellia sinensis[J]. Chin Bull Bot (植物学报), 2010, 45: 579-587. |
| [14] |
Pfaffl MW. A new mathematical model for relative quantification in real-time RT-PCR[J]. Nucleic Acids Res, 2001, 29: e45. DOI:10.1093/nar/29.9.e45 |
| [15] |
Xie DJ, Ye YJ, Yang DM, et al. Identification and analysis of the R2R3-MYB transcription factor based on a transcriptome database in Morinda officinalis[J]. Acta Pharm Sin (药学学报), 2020, 55: 160-167. |
| [16] |
Zhou M, Zhang K, Sun Z, et al. LNK1 and LNK2 corepressors interact with the MYB3 transcription factor in phenylpropanoid biosynthesis[J]. Plant Physiol, 2017, 174: 1348-1358. DOI:10.1104/pp.17.00160 |
| [17] |
Jin H, Cominelli E, Bailey P, et al. Transcriptional repression by AtMYB4 controls production of UV-protecting sunscreens in Arabidopsis[J]. EMBO J, 2000, 19: 6150-6161. DOI:10.1093/emboj/19.22.6150 |
| [18] |
Huang Y, Wu Q, Wang S, et al. FtMYB8 from Tartary buckwheat inhibits both anthocyanin/proanthocyanidin accumulation and marginal trichome initiation[J]. BMC Plant Biol, 2019, 19: 263. DOI:10.1186/s12870-019-1876-x |
| [19] |
Liu X, Yu W, Zhang X, et al. Identification and expression analysis under abiotic stress of the R2R3-MYB genes in Ginkgo biloba L.[J]. Physiol Mol Biol Plant, 2017, 23: 503-516. DOI:10.1007/s12298-017-0436-9 |
| [20] |
Chen J, Tang XH, Ren CX, et al. Cloning and expression analysis of MYB transcription factor genes in safflower[J]. Acta Pharm Sin (药学学报), 2018, 53: 144-149. |
| [21] |
Zhao H, Baloch SK, Kong LR, et al. Molecular cloning, characterization, and expression analysis of LeMYB1 from Lithospermum erythrorhizon[J]. Biol Plant, 2014, 58: 436-444. DOI:10.1007/s10535-014-0411-z |
| [22] |
Lu B, Zhang WZ, Li CY, et al. The MYB transcription factor OsMYB84 confers salt stress response trough the ABA pathway[J]. J Fudan Univ (Nat Sci), (复旦大学学报自然科学版), 2015, 54: 591-600. |
| [23] |
Qiu WY, Wang SY, Li XF, et al. Functions of plant MYB transcription factors in response to abiotic stress and plant hormones[J]. Acta Agric Zhejiang (浙江农业学报), 2020, 32: 1317-1328. |
| [24] |
Chen BJ, Wang Y, Hu YL, et al. Cloning and characterization of a drought-inducible MYB gene from Boea crassifolia[J]. Plant Sci, 2005, 168: 493-500. DOI:10.1016/j.plantsci.2004.09.013 |
| [25] |
Bohlmann J, Crock J, Jetter R, et al. Terpenoid-based defenses in conifers: cDNA cloning, characterization, and functional expression of wound-inducible(E)-α-bisabolene synthase from grand fir (Abies grandis)[J]. Proc Natl Acad Sci U S A, 1998, 95: 6756-6761. DOI:10.1073/pnas.95.12.6756 |
 2021, Vol. 56
2021, Vol. 56


