扑热息痛(paracetamol) 又称对乙酰氨基酚(acetaminophen, APAP), 是世界范围内广泛使用的解热镇痛药, 在常规剂量(< 4 g·d-1) 内安全有效, 但过量服用可能导致严重肝损伤, 甚至死亡[1]。APAP所致肝损伤是药源性肝损伤(drug-induced liver injury, DILI)[2]和急性肝衰竭(acute liver failure, ALF)[3]的主要来源。其导致肝损伤的作用机制为细胞色素P450酶[cytochrome P450, CYP450, 主要为CYP2E1和CYP3A4 (小鼠CYP3A11)] 介导APAP代谢激活, 生成毒性中间体N-乙酰对苯醌亚胺(N-acetyl-p-benzoquinone imine, NAPQI), 与肝脏内源性谷胱甘肽(glutathione, GSH) 结合生成APAP-GSH复合物, 使GSH耗竭, 最终导致肝细胞坏死[4]。APAP-GSH复合物最终代谢为APAP-半胱氨酸复合物(APAP-cysteinyl, APAP-CYS) 和APAP-N-乙酰半胱氨酸复合物(APAP-N-acetylcysteinyl, APAP-NAC)[5]。抑制APAP的代谢激活是抵抗APAP所致肝损伤的主要防治策略之一。研究表明, 敲除APAP代谢相关CYP450酶[6]或给予CYP450酶抑制剂[7, 8]均可减少APAP代谢激活, 从而抵抗APAP所致肝损伤。
五酯片(Wuzhi Tablet, WZ) 是传统中药南五味子的醇浸膏制剂, 主要活性成分为联苯环辛烯类木脂素[9], 临床上作为护肝中药用于肝炎及各种肝损伤的治疗。作者前期研究[10-14]显示, WZ及五味子醇乙等木脂素类活性单体均可显著预防和治疗APAP所致肝损伤。相关机制包括: 抑制CYP450酶活性从而抑制APAP代谢激活、调控核因子红细胞系相关因子-2 (nuclear factor erythroid 2-related factor 2, NRF2) 通路从而抗氧化应激、促进肝再生等。由于代谢酶抑制作用与抑制剂浓度密切相关, 因此, WZ与代谢酶底物药物的不同给药时间间隔对CYP3A4等代谢酶活性的抑制作用可能会有差异, 从而导致对底物药物代谢过程产生不同的影响。前期研究[15]发现, 单次灌胃给予WZ (250 mg·kg-1) 0、0.5、2 h后再灌胃给予他克莫司(CYP3A4底物药物), 可分别使他克莫司的AUC升高1.76、1.26、2.48倍, 表明WZ与底物药物给药间隔的不同造成对代谢酶活性抑制程度不同, 因而对他克莫司的代谢和血药浓度产生不同程度的影响。基于此, 作者推测WZ与APAP的不同给药间隔, 也可能由于WZ对代谢酶抑制作用程度的差异, 从而对APAP代谢激活及其所致肝损伤产生不同程度的影响。
本研究采用APAP所致小鼠肝损伤模型, 通过考察WZ与APAP不同间隔给药后, 其肝损伤指标变化、APAP代谢物生成情况和APAP代谢激活相关CYP450酶活性, 研究WZ不同预处理时间抵抗APAP所致肝损伤的作用及机制, 为临床应用WZ防治APAP所致肝损伤提供更多数据。
材料与方法药品和试剂 APAP (美国Sigma公司); 五酯片(广西方略药业集团有限公司); 通用型组织固定液(武汉塞维尔生物科技有限公司); 氢氧化钠(上海阿拉丁公司); 丙二醛(malonaldehyde, MDA) 测定试剂盒、微量GSH测定试剂盒(南京建成生物工程研究所); 甲醇、甲酸(色谱纯, 美国TEDIA公司); APAP-NAC、APAP-CYS、6-羟基氯唑沙宗(6-OH-chlorzoxazone, 6-OH-CHL)、氧化硝苯地平(oxidized nifedipine-d6, DNIF)、酮康唑(ketoconazole, KET) (加拿大Toronto Research Chemicals公司); 对氨基苯甲酸(4-aminobenzoic acid, PABA)、4-甲基吡唑(4-methylpyrazole, 4-ME)、氯唑沙宗(chlorzoxazone, CHL)、硝苯地平(nifedipine, NIF)、还原型辅酶Ⅱ四钠盐(NADPH) (上海源叶生物有限公司); 氯雷他定(loratadine, LOR) (大连美仑生物有限公司); RIPA裂解液(上海博彩生物科技有限公司); Anti-CYP3A11 (武汉爱博泰克生物科技有限公司); Anti-CYP2E1 (上海生工生物工程有限公司); Anti-GAPDH、Anti-rabbit IgG-HRP (美国Cell Signaling Technology公司); 组织线粒体分离试剂盒、loading buffer (上海碧云天生物技术有限公司); BCA蛋白定量试剂盒、预染蛋白marker (美国Thermo Fisher Scientific公司); ECL显影试剂盒(北京恩格英生物技术有限公司)。
仪器 Ultimate 3000 UPLC系统、TSQ Quantum Access系统、Multiskan Go酶标仪(美国Thermo Fisher Scientific公司); 超纯水仪(美国Millipore公司); Precellys24多功能样本均质仪(法国Bertin公司); 5417R低温高速离心机、微量移液器(德国Eppendorf公司); 低温超高速离心机(美国Beckman公司); AE260电子天平(美国Mettler Toledo公司); RM2016切片机(德国Leica公司); CX48生物显微镜(日本Olympus公司); Mini-Protein3电泳系统、Mini Trans-Blot转移系统(美国Bio Rad公司); Image Quantity LAS 4000成像仪(美国General Electric公司)。
实验动物 C57BL/6雄性小鼠, 6~8周龄, 由广东省医学实验动物中心提供, 生产许可证号: SCXK (粤) 2018-0002, 使用许可证号: SYXK (粤) 2018-0002; 饲养于中山大学(东校园) 实验动物中心SPF级环境, 温度22~24 ℃, 湿度55%~60%, 光照循环12 h, 自由摄取水和食物, 实验前12 h禁食, 不禁水。动物实验经中山大学动物伦理委员会审核通过(批准号: 东-C2020-000035XS)。
动物分组与给药 小鼠随机分为4组, 即APAP对照组(saline + APAP)、WZ间隔0 h组(WZ + APAP 0 h)、WZ间隔0.5 h组(WZ + APAP 0.5 h) 及WZ间隔2 h组(WZ + APAP 2 h)。
取WZ研细, 精密称取适量粉末, 加入生理盐水溶解, 超声处理10 min, 制得35 mg·mL-1 WZ灌胃混悬液(灌胃体积为0.02 mL·g-1, 剂量为700 mg·kg-1)。取APAP粉末适量于温水中溶解, 加入适量氢氧化钠溶液(2 mol·L-1) 调节至pH 10左右, 制得40 mg·mL-1 APAP溶液(腹腔注射体积为0.01 mL·g-1, 剂量为400 mg·kg-1)。各WZ间隔组(WZ + APAP 0、0.5、2 h) 分别在单次灌胃WZ混悬液0、0.5和2 h后, 腹腔注射APAP溶液。APAP对照组(生理盐水+ APAP) 单次灌胃生理盐水后, 腹腔注射APAP溶液。各组小鼠在给予APAP 6 h后, 摘眼球取血, 颈椎脱臼处死, 解剖并收取肝脏。
组织切片染色及观察 肝脏组织于固定液中固定24 h以上, 脱水后石蜡包埋, 厚度约3 μm, 60 ℃烘片后脱蜡, 0.5%伊红-苏木素染色, 梯度酒精脱水, 树脂封片。显微镜观察及拍照。
测定血清转氨酶水平 血液室温静置30 min, 于3 500 r·min-1、4 ℃离心10 min, 取得血清。送样广东省医学实验动物中心生化检测室检测丙氨酸氨基转移酶(alanine aminotransferase, ALT) 及天冬氨酸氨基转移酶(aspartate aminotransferase, AST) 水平。
测定肝脏组织总MDA、总GSH和线粒体GSH水平 称取肝组织约50 mg于匀浆管中, 加入生理盐水500 μL匀浆, 然后3 500 r·min-1、4 ℃离心10 min。按线粒体分离试剂盒操作, 制得肝脏组织线粒体裂解液。按MDA和GSH试剂盒说明书, 使用硫代巴比妥酸法和二硫代二硝基苯甲酸法, 测定肝脏组织总MDA、总GSH水平和线粒体GSH水平。
血清样品处理 取血清5 μL, 加入内标PABA溶液(2 μg·mL-1) 10 μL和甲醇85 μL, 涡旋10 min, 置于-20 ℃冰箱冷冻静置20 min, 15 000 r·min-1, 4 ℃离心15 min, 取上清20 μL, 加入0.1%甲酸水溶液980 μL稀释, 充分涡旋混匀, 15 000 r·min-1、4 ℃离心10 min, 取上清待测。
HPLC-MS/MS方法测定血清APAP代谢物水平 建立血清中APAP代谢物APAP-CYS和APAP-NAC的HPLC-MS/MS检测分析方法。色谱条件: 选用Thermo Fisher Scientific的Hypurity C18 (150 mm×2.1 mm, 5 μm) 色谱柱, 柱温为40 ℃; 流动相为甲醇: 0.1%甲酸-水(80∶20), 等梯度洗脱; 流速为0.2 mL·min-1, 扫描时间为5 min; 进样量为10 μL, 进样器温度为15 ℃。质谱条件: 离子源为电喷雾离子源, 喷雾正电压为2 500 V, 毛细管温度为350 ℃; 离子检测方式为选择反应监测, 定量监测分析的离子对分别为APAP-NAC, [M+H]+, m/z 312.90→207.80; APAP-CYS, [M+Na]+, m/z 271.00→139.90; PABA, [M+H]+, m/z 138.10→120.00。配制系列浓度范围的APAP-CYS (30 000、15 000、7 500、3 750、1 875、937.5、468.75和234.375 ng·mL-1) 和APAP-NAC (2 000、1 000、500、250、125、62.5、31.25、15.625 ng·mL-1) 标准曲线样品, 加入内标PABA溶液(2 μg·mL-1) 10 μL, 于HPLC-MS/MS系统测得APAP-CYS和APAP-NAC的标准曲线。待测样品按上述血清样品处理方法处理, 于HPLC-MS/MS系统测定APAP代谢物水平。
肝微粒体提取 小鼠断头处死, 摘取肝脏, 使用4 ℃预冷蔗糖溶液漂洗, 加入肝重2倍体积蔗糖溶液, 冰上手动匀浆, 16 000 ×g、4 ℃离心20 min, 上清置于超高速离心管中, 100 000 ×g、4 ℃离心60 min。弃上清, 焦磷酸钾溶液清洗沉淀, 100 000 ×g、4 ℃离心60 min。弃上清, Tris-HCl缓冲液重悬后进行蛋白定量, 制得小鼠肝微粒体蛋白。
WZ提取物溶液制备 按已建立方法[16]制备WZ提取物溶液, 取WZ研细, 精密称取适量粉末, 加100倍体积无水乙醇混匀后超声60 min, 3 500 r·min-1离心10 min, 取上清液; 残渣重复上述过程, 合并2次上清并挥干溶剂, 加入适量DMSO溶解, 制得0.125、0.25和0.5 mg·mL-1的WZ提取物溶液。
肝微粒体孵育及样品处理 按已建立方法[10]制备肝微粒体孵育体系, 含小鼠肝微粒体蛋白和混合探针底物(CHL和NIF), 阳性对照组加入KET及4-ME, 空白组加入甲醇, 给药组加入WZ提取物溶液(0.125、0.25和0.5 mg·mL-1)。体系于37 ℃水浴预孵育, 加入NADPH启动反应, 37 ℃水浴孵育20 min, 加入冰乙酸乙酯终止反应。加入内标LOR溶液(2 μg·mL-1) 10 μL, 旋涡振荡2 min, 静置10 min, 3 500 r·min-1离心10 min, 转移上清并挥干有机溶剂。进样前, 加入80%甲醇水溶液200 μL复溶, 加入内标LOR溶液(2 μg·mL-1) 10 μL, 涡旋振荡1 min, 16 000 r·min-1离心5 min, 制得进样样品。
HPLC-MS/MS方法测定CYP450酶活性 建立肝微粒体孵育体系中探针底物代谢物6-OH-CHL和DNIF的HPLC-MS/MS检测分析方法。色谱条件: 选用Waters的Xetrra C18 (100 mm×2.1 mm, 5 μm) 色谱柱, 柱温为40 ℃; 流动相为甲醇: 0.1%甲酸-水(70∶30), 等梯度洗脱, 流速为0.3 mL·min-1, 分析时间为3.5 min; 进样量为10 μL, 进样器温度为15 ℃。质谱条件: 离子源为电喷雾离子源, 喷雾正电压为3 500 V, 喷雾负电压为2 500 V, 毛细管温度为350 ℃; 离子检测方式为选择反应监测, 定量监测分析的离子对分别为6-OH-CHL, [M-H]-, m/z 184.107→120.20; DNIF, [M+H]+, m/z 345.132→284.107; LOR, [M+H]+, m/z 382.00→266.00。配制系列浓度范围的6-OH-CHL (6.4、3.2、1.6、0.8、0.4、0.2和0.1 μmol·L-1) 和DNIF (4、2、1、0.5、0.25、0.125和0.062 5 μmol·L-1) 标准曲线样品, 加入内标LOR溶液(2 μg·mL-1) 10 μL, 于HPLC-MS/MS系统测得6-OH-CHL和DNIF的标准曲线。进样样品于HPLC-MS/MS系统测定肝微粒体孵育样品中探针代谢物含量, 计算CYP450酶活性。
Western blot测定CYP450蛋白水平 按文献[16]方法, 取小鼠肝组织加入RIPA裂解液(含苯甲基磺酰氟) 匀浆, 用BCA试剂盒测定并调整各组匀浆蛋白浓度, 加入loading buffer, 95 ℃水浴使蛋白变性。进行SDS-PAGE电泳和转膜, 5%脱脂牛奶封闭后孵育一抗(Anti-CYP2E1 1∶1 000、Anti-CYP3A11 1∶1 000、Anti-GAPDH 1∶2 000) 4 ℃过夜, 次日孵育二抗(Anti-rabbit IgG-HRP 1∶2 000) 后显影。使用ImageJ软件扫描条带灰度值, 计算相对蛋白表达水平。
统计学方法 本实验各项数据以mean ± S.E.M. 表示, 使用GraphPad Prism 8软件进行统计分析, 采用unpaired Student's t-test检验比较各间隔组与对照组的组间差异。P < 0.05表示差异有统计学意义。
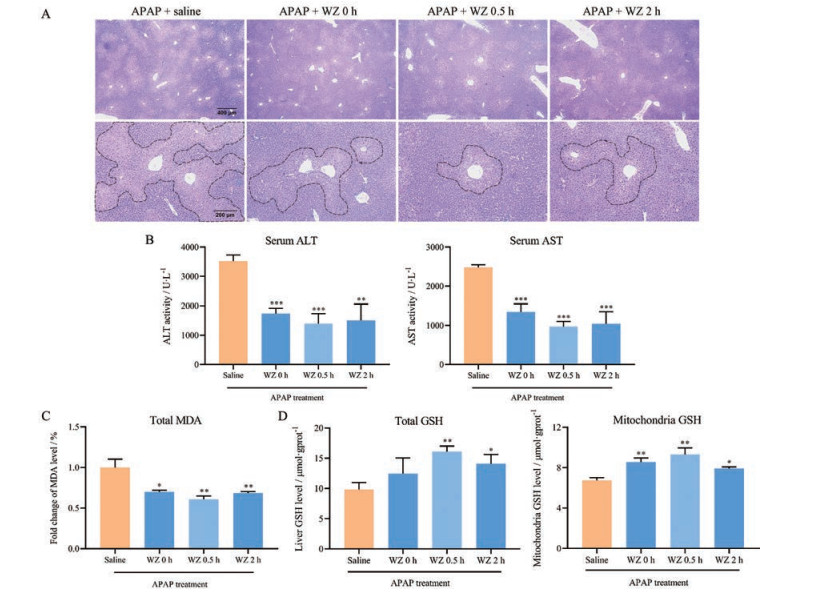
结果 1 WZ不同给药间隔抵抗APAP所致肝损伤的作用小鼠肝脏切片H & E染色结果如图 1A所示。APAP对照组各中央静脉区出现肝细胞融合性坏死, 肝小叶间出现肝细胞桥接样坏死, 表明APAP造模导致小鼠肝组织严重损伤; WZ间隔给药各组肝细胞坏死区域显著缩小, 肝组织损伤程度较APAP对照组均显著减轻。血清转氨酶水平变化如图 1B所示。与APAP对照组相比, WZ间隔给药各组血清转氨酶水平均显著下降(P < 0.01); 其中间隔0.5 h组转氨酶水平下降最显著, ALT和AST水平分别降低至1 400 ± 337.9 U·L-1 (-60.25%, P < 0.001) 及968.4 ± 134.3 U·L-1 (-60.97%, P < 0.001)。肝脏总MDA水平变化如图 1C变化所示。相较APAP对照组, WZ间隔给药各组肝脏总MDA水平均显著下降(P < 0.05); 其中间隔0.5 h组降低MDA水平最显著, 相较对照组下降了39.07% (P < 0.01)。肝脏总GSH和线粒体GSH水平变化如图 1D所示。除WZ间隔0 h组的总GSH无显著变化外, 其他WZ间隔给药各组总GSH和线粒体GSH水平相较APAP对照组均显著上升(P < 0.05); 其中间隔0.5 h组减轻GSH耗竭最显著, 其总GSH和线粒体GSH水平相较对照组上升至16.10 ± 0.91 μmol·g-1 (+63.85%, P < 0.01) 及9.30 ± 0.65 μmol·g-1 (+37.92%, P < 0.01)。结果表明, WZ不同给药间隔均起到保护APAP所致肝损伤的作用, 其中间隔0.5 h (即APAP给药前0.5 h给予WZ) 的保护效果最显著。
|
Figure 1 Pretreatment with WZ protects against APAP-induced hepatotoxicity in mice. Mice were pretreated with WZ at 0, 0.5, and 2 h before APAP exposure. A: Morphological photographs of liver section; B: Serum biochemical indexes; C: Liver total MDA level; D: Liver total GSH level and mitochondria GSH level. APAP: Acetaminophen; ALT: Alanine aminotransferase; AST: Aspartate aminotransferase; MDA: Malonaldehyde; GSH: Glutathione. n = 5 or 6, x±s. *P < 0.05, **P < 0.01, ***P < 0.001 vs the saline + APAP group |
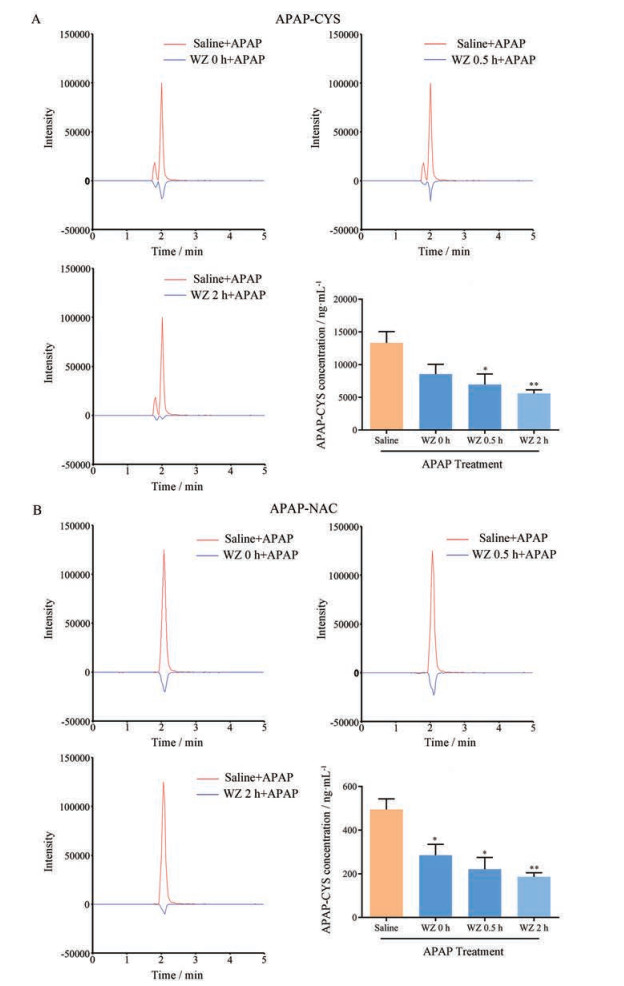
小鼠血清APAP代谢物APAP-CYS和APAP-NAC水平变化分别如图 2A和2B所示。除间隔0 h组APAP-CYS外, WZ预处理间隔给药各组血清APAP-CYS、APAP-NAC水平相较APAP对照组均显著降低(P < 0.05); 其中间隔2 h组的APAP代谢物水平降低最显著, APAP-CYS和APAP-NAC水平分别降低至5 588 ± 552.4 ng·mL-1 (-47.80%, P < 0.01) 及186.3 ± 18.41 ng·mL-1 (-62.30%, P < 0.01)。结果表明, WZ不同预处理给药间隔均显著降低了APAP代谢物水平, 其中WZ预处理2 h后APAP造模的代谢物水平降低最显著。
|
Figure 2 Pretreatment with WZ reduces the production of APAP metabolites. Mice were pretreated with WZ at 0, 0.5, and 2 h before APAP exposure. A: APAP-CYS level; B: Serum APAP-NAC level. APAP-CYS: APAP-cysteinyl; APAP-NAC: APAP-N-acetylcysteinyl. n = 5 or 6, x±s. *P < 0.05, **P < 0.01 vs the saline + APAP group |
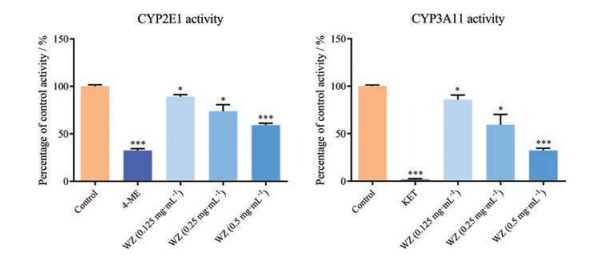
WZ提取物溶液与小鼠肝微粒体共孵育后, APAP代谢相关CYP450酶CYP2E1及CYP3A11活性变化如图 3所示。CYP2E1及CYP3A11阳性抑制剂4-ME及KET均显著降低了探针底物代谢物水平, 表明4-ME和KET显著抑制了CYP2E1和CYP3A11活性(P < 0.001)。WZ各浓度组均显著降低CYP2E1和CYP3A11探针底物代谢物水平, 表明WZ显著抑制CYP2E1和CYP3A11活性, 且呈明显的浓度依赖性, WZ高浓度(0.5 mg·mL-1) (P < 0.001) 的抑制效果相较低浓度(0.125和0.25 mg·mL-1) (P < 0.05) 更为显著。结果表明, WZ对APAP代谢酶CYP2E1和CYP3A11有显著抑制作用, 且呈明显的浓度依赖性。
|
Figure 3 WZ significantly inhibits the activities of CYP2E1 and CYP3A11 in mouse liver microsomes. CYPs: Cytochrome P450. n = 3, x±s. *P < 0.05, ***P < 0.001 vs the control group |
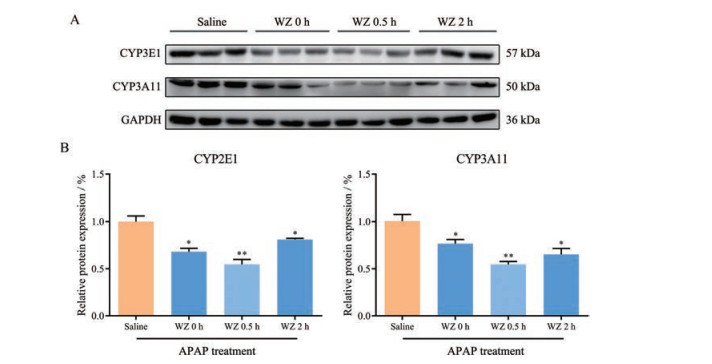
小鼠肝脏APAP代谢酶CYP2E1和CYP3A11的蛋白水平变化如图 4所示。WZ间隔给药各组小鼠肝脏CYP2E1和CYP3A11蛋白水平较APAP对照组均显著下调(P < 0.05); 其中WZ间隔0.5 h组下调最显著(P < 0.01), CYP2E1和CYP3A11蛋白水平分别为对照组的54.62%和54.63%。结果表明, WZ不同预处理给药间隔均显著下调了CYP450酶蛋白水平, 且0.5 h时下调最显著。
|
Figure 4 Pretreatment with WZ reduces CYPs protein expression. Mice were pretreated with WZ at 0, 0.5, and 2 h before APAP exposure. A: Western blots of target proteins; B: Grey scanning analysis of CYP2E1 and CYP3A11 blots. n = 3, x±s. *P < 0.05, **P < 0.01 vs the saline + APAP group |
作者此前在WZ抵抗APAP所致肝损伤的保护作用研究中, 采用的给药方案是连续给予WZ三天, 最后一次给药后间隔15 min给予APAP造模, 阐明了WZ通过抑制代谢激活、抗氧化应激、促进肝修复等多种机制对APAP所致肝损伤的显著预防作用[10-13]。本研究重点考察单次不同间隔时间给予WZ进行预处理抵抗APAP所致肝损伤的作用, 发现WZ预处理(0、0.5和2 h) 均可以显著减轻APAP所致肝组织病理损伤, 降低血清转氨酶、肝组织MDA的升高, 减轻肝总GSH和线粒体GSH耗竭, 从而发挥抵抗APAP所致肝损伤的作用。WZ上述给药方案均能发挥显著抵抗APAP肝损伤的作用, 提示WZ抗APAP肝损伤是一个涉及多重作用机制协同发挥作用的复杂过程。
APAP过量后, 经CYP450酶代谢激活生成毒性代谢产物NAPQI。因此抑制CYP450酶活性, 进而抑制APAP代谢激活, 是抵抗APAP所致肝损伤的重要策略之一。作者前期研究[17]显示, WZ可抑制CYP450酶, 其机制包括竞争性抑制(与目标底物竞争CYP450酶, 具有浓度依赖性) 和不可逆抑制(与CYP450酶形成复合物, 不可逆地抑制CYP450酶活性)。本研究确证了WZ可浓度依赖性抑制APAP代谢激活相关CYP450酶活性, 从而减少APAP代谢物APAP-CYS、APAP-NAC的生成, 抵抗APAP所致肝损伤。由于代谢酶抑制作用与抑制剂浓度密切相关, 因此, WZ给药后不同时间其血药浓度不同从而抑制代谢酶活性的程度也不同, 导致WZ对代谢酶底物药物的体内代谢和处置过程产生不同的影响[15]。
作者前期研究WZ与他克莫司(CYP3A4底物药物) 相互作用时也发现不同给药间隔的类似影响。WZ中含量最高的三种成分五味子酯甲、五味子甲素及五味子醇乙在大鼠体内的半衰期分别为2.79 ± 1.51、3.65 ± 0.94及4.51 ± 1.75 h, 整体代谢消除较快[18]。进一步研究显示, WZ与他克莫司的不同给药间隔, 会不同程度影响WZ升高他克莫司血药浓度: 单次灌胃给予WZ (250 mg·kg-1) 0、0.5和2 h后再灌胃给予他克莫司, 可使他克莫司的AUC分别升高1.76、1.26和2.48倍, 表明WZ预处理时间的长短对代谢酶有不同影响, 从而显著影响了他克莫司血药浓度[15]。基于不同给药间隔对WZ-他克莫司药物相互作用的影响, 作者推测不同给药间隔对WZ-APAP相互作用有类似作用, 从而影响WZ对APAP肝损伤的作用, 因此, 本研究着重考察了预处理给药间隔对WZ抵抗APAP肝损伤作用的影响。
本研究发现WZ与APPA间隔0、0.5和2 h给药均具有显著抵抗APAP所致肝损伤的作用, 其中WZ预处理0.5 h组(即APAP造模0.5 h前给予WZ) 逆转各项指标效果最为显著。作者此前曾考察了大鼠单次灌胃给予WZ (250 mg·kg-1) 后, WZ中木脂素单体在各组织的分布, 发现给药后0.25 h大鼠肝脏中可检测到五味子甲素、醇甲、醇乙、酯甲, 且均为峰值, 表明五味子甲素、醇甲、醇乙、酯甲灌胃后可以被迅速吸收至肝脏; 给药后0.25 h到1.5 h期间, 这些木脂素单体在大鼠肝脏的浓度下降较快[19]。基于代谢激活在APAP所致肝损伤的重要作用及WZ对代谢激活相关代谢酶的抑制作用, 作者推测可能是由于相较于同时给药或预处理后2 h, APAP造模前0.5 h给予WZ, 此时WZ在肝脏的浓度较高, 能充分抑制CYP450酶活性及其介导的代谢激活; 相比之下, 0 h (同时) 给药时, WZ可能未完全到达肝脏, 而2 h时肝脏中WZ木脂素单体浓度已开始下降, 其肝药浓度低于0.5 h时, 因此, WZ预处理0.5 h组(即APAP造模0.5 h前给予WZ) 抵抗APAP所致肝损伤的效果稍优于同时给药组及预处理2 h组。但总体而言, 由于WZ灌胃后迅速到达肝脏, 且在2 h内血药及肝药浓度均较高, 所以, 无论是APAP与WZ同时给药, 还是APAP造模前0.5 h或2 h给予WZ, 均发挥抵抗APAP肝损伤的显著作用。
本研究还观察到, WZ单次预处理给药显著下调了CYP2E1和CYP3A11的蛋白表达水平。作者此前研究发现, WZ预处理三天后可逆转APAP所致的CYP2E1及CYP3A11蛋白水平下调[13], 且WZ长期给药可诱导大鼠肝脏CYP3A蛋白表达[16], 亦证明了WZ对CYP3A瞬时抑制、长期诱导的复杂作用。但本次研究仅为WZ单次给药, 故其对CYP450的诱导作用未能体现。因此, 本研究WZ单次预处理给药可下调APAP代谢激活相关CYP2E1和CYP3A11的蛋白水平和活性, 抑制APAP代谢激活, 从而抵抗APAP所致肝损伤。
综上所述, 本研究采用APAP所致小鼠急性肝损伤模型, 进一步确证了WZ通过抑制CYP2E1和CYP3A11等代谢酶活性、抑制APAP代谢激活, 从而抵抗APAP所致肝损伤的作用, 证明了WZ不同预处理给药间隔均显著抵抗APAP所致肝损伤, 但作用程度稍有差异。本研究结果为应用WZ预防和治疗APAP所致肝损伤提供更多数据和参考。
作者贡献: 徐乐千负责部分实验设计与实施、统计分析结果、撰写论文; 周艳莹负责部分实验设计与实施、统计分析结果、部分修订; 姜伊鸣负责部分指导实验; 邢云惠负责实施部分实验; 黄民与毕惠嫦负责研究思路的提出及实验设计、统筹指导实验、修订论文。
利益冲突: 本文所有作者之间不存在利益冲突。
| [1] |
Schilling A, Corey R, Leonard M, et al. Acetaminophen: old drug, new warnings[J]. Cleve Clin J Med, 2010, 77: 19-27. DOI:10.3949/ccjm.77a.09084 |
| [2] |
Katarey D, Verma S. Drug-induced liver injury[J]. Clin Med (Lond), 2016, 16: 104-109. |
| [3] |
Bernal W, Lee WM, Wendon J, et al. Acute liver failure: a curable disease by 2024?[J]. J Hepatol, 2015, 62: 112-120. DOI:10.1016/j.jhep.2014.12.016 |
| [4] |
McGill MR, Jaeschke H. Metabolism and disposition of acetaminophen: recent advances in relation to hepatotoxicity and diagnosis[J]. Pharm Res, 2013, 30: 2174-2187. DOI:10.1007/s11095-013-1007-6 |
| [5] |
Athersuch TJ, Antoine DJ, Boobis AR, et al. Paracetamol metabolism, hepatotoxicity, biomarkers and therapeutic interventions: a perspective[J]. Toxicol Res (Camb), 2018, 7: 347-357. DOI:10.1039/c7tx00340d |
| [6] |
Gonzalez FJ. The use of gene knockout mice to unravel the mechanisms of toxicity and chemical carcinogenesis[J]. Toxicol Lett, 2001, 120: 199-208. DOI:10.1016/S0378-4274(01)00296-X |
| [7] |
Luo DD, Chen JF, Liu JJ, et al. Tetrahydrocurcumin and octahydrocurcumin, the primary and final hydrogenated metabolites of curcumin, possess superior hepatic-protective effect against acetaminophen-induced liver injury: role of CYP2E1 and Keap1-Nrf2 pathway[J]. Food Chem Toxicol, 2019, 123: 349-362. DOI:10.1016/j.fct.2018.11.012 |
| [8] |
Wang YX, Du Y, Liu XF, et al. A hepatoprotection study of Radix Bupleuri on acetaminophen-induced liver injury based on CYP450 inhibition[J]. Chin J Nat Med, 2019, 17: 517-524. |
| [9] |
Szopa A, Ekiert R, Ekiert H. Current knowledge of Schisandra chinensis (Turcz.) Baill. (Chinese magnolia vine) as a medicinal plant species: a review on the bioactive components, pharmacological properties, analytical and biotechnological studies[J]. Phytochem Rev, 2017, 16: 195-218. DOI:10.1007/s11101-016-9470-4 |
| [10] |
Jiang Y, Fan X, Wang Y, et al. Hepato-protective effects of six schisandra lignans on acetaminophen-induced liver injury are partially associated with the inhibition of CYP-mediated bioactivation[J]. Chem Biol Interact, 2015, 231: 83-89. DOI:10.1016/j.cbi.2015.02.022 |
| [11] |
Jiang Y, Fan X, Wang Y, et al. Schisandrol B protects against acetaminophen-induced hepatotoxicity by inhibition of CYP-mediated bioactivation and regulation of liver regeneration[J]. Toxicol Sci, 2015, 143: 107-115. DOI:10.1093/toxsci/kfu216 |
| [12] |
Fan X, Chen P, Jiang Y, et al. Therapeutic efficacy of Wuzhi tablet (Schisandra sphenanthera extract) on acetaminophen-induced hepatotoxicity through a mechanism distinct from N-acetylcysteine[J]. Drug Metab Dispos, 2015, 43: 317-324. DOI:10.1124/dmd.114.062067 |
| [13] |
Fan X, Jiang Y, Wang Y, et al. Wuzhi tablet (Schisandra Sphenanthera extract) protects against acetaminophen-induced hepatotoxicity by inhibition of CYP-mediated bioactivation and regulation of NRF2-ARE and p53/p21 pathways[J]. Drug Metab Dispos, 2014, 42: 1982-1990. DOI:10.1124/dmd.114.059535 |
| [14] |
Zhou Y, Fan X, Jiao T, et al. SIRT6 as a key event linking P53 and NRF2 counteracts APAP-induced hepatotoxicity through inhibiting oxidative stress and promoting hepatocyte proliferation[J]. Acta Pharm Sin B, 2021, 11: 89-99. DOI:10.1016/j.apsb.2020.06.016 |
| [15] |
Qin XL, Li JL, Wang SH, et al. Co-administration of Wuzhi tablet (Schisandra sphenanthera extract) alters tacrolimus pharmacokinetics in a dose- and time-dependent manner in rats[J]. J Ethnopharmacol, 2020, 263: 113233. DOI:10.1016/j.jep.2020.113233 |
| [16] |
Qin X, Duan W, Li L, et al. Effect of long-term treatment of Wuzhi tablet on the expression and activity of cytochrome P450 3A in rats[J]. Acta Pharm Sin (药学学报), 2016, 51: 1407-1411. |
| [17] |
Qin XL, Chen X, Wang Y, et al. In vivo to in vitro effects of six bioactive lignans of Wuzhi tablet (Schisandra sphenanthera extract) on the CYP3A/P-glycoprotein-mediated absorption and metabolism of tacrolimus[J]. Drug Metab Dispos, 2014, 42: 193-199. DOI:10.1124/dmd.113.053892 |
| [18] |
Qin XL, Chen X, Zhong GP, et al. Effect of Tacrolimus on the pharmacokinetics of bioactive lignans of Wuzhi tablet (Schisandra sphenanthera extract) and the potential roles of CYP3A and P-gp[J]. Phytomedicine, 2014, 21: 766-772. DOI:10.1016/j.phymed.2013.12.006 |
| [19] |
Qin XL, Bi HC, Wang CX, et al. Study of the effect of Wuzhi tablet (Schisandra sphenanthera extract) on tacrolimus tissue distribution in rat by liquid chromatography tandem mass spectrometry method[J]. Biomed Chromatogr, 2010, 24: 399-405. |
 2021, Vol. 56
2021, Vol. 56


