衰老是人体伴随年龄增加而发生的自身内环境稳定能力和应激能力下降, 机体结构、功能和机能退行性病变的系列不可逆转的生理、病理现象[1]。衰老并非疾病, 但却是多种老年疾病, 如心血管疾病、神经退行性疾病、糖尿病、癌症等的致病因素[2]。延缓机体衰老对于提升个人生活质量具有重要意义, 因此已经成为世界范围内研究的重要科学问题[3]。中医认为机体衰老的主要原因是五脏虚衰、阴阳失衡[4]。肝是保持人体气机正常升降出入的重要脏腑[5, 6]。在古籍《灵枢·天年》中记载着“五十岁, 肝气始衰”, 明确指出肝为衰老的始动因子, 肝气衰可导致其他脏腑功能受损[7]。近年来, 哺乳动物雷帕霉素靶蛋白/雷帕霉素机能靶蛋白(mammalian/mechanistic target of rapamycin, mTOR), 一类丝/苏氨酸蛋白激酶, 成为了研究如何抑制衰老, 提高人类寿命的重要靶点[8-10]。
二至丸是由女贞子和墨旱莲两味中药等比组成, 临床上常用于治疗肝肾阴虚所引起的肝肾疾病。本课题组前期通过体外实验已经表明了二至丸含药血清对于衰老肾细胞的保护作用[11]。为了进一步探索二至丸的抗肝细胞衰老作用, 本文将基于H2O2诱导的肝细胞衰老模型, 结合血清药理学对二至丸、其分段提取物以及特征性成分群——环烯醚萜苷类的抗衰老作用进行研究。利用LC-MS/MS技术鉴定与分析二至丸及各部位中的成分差异, 并以mTOR为对接受体, 通过分子对接技术快速筛选二至丸中可能的抗衰老成分, 为阐明二至丸抗衰老的药效物质基础和后期作用机制研究提供实验依据。
材料与方法药物与试剂 含药血清为实验室自制。PBS (美国Hyclone公司, 批号AE29456443); DMEM (美国Gibco公司, 批号8120286); 0.25%胰蛋白酶(美国Gibco公司, 批号2120736); 胎牛血清(FBS) (杭州四季青公司, 批号11011-8611); 链霉素-青霉素(双抗, 上海碧云天生物技术有限公司, 批号2185224); MTT (上海阿拉丁试剂有限公司, 批号C2025115); H2O2 (美国Sigma公司, 批号STBH9407); 细胞衰老β-半乳糖苷酶染色试剂盒(上海碧云天生物技术有限公司, 批号043020200526); 二氯二氢荧光素-乙酰乙酸酯(2′, 7′-dichlorodihydrofluorescein diacetate, DCFH-DA) 活性氧检测试剂盒(上海碧云天生物技术有限公司, 批号041720200930)。女贞子和墨旱莲均购自铜陵禾田中药饮片股份有限公司, 由南京中医药大学中医药吴啟南教授鉴定分别为木犀科植物女贞(Ligustrum lucidum Ait.) 的干燥成熟果实和菊科植物鲤肠(Eclipta prostrata L.) 的干燥地上部分。
仪器 Shimadzu快速液相色谱仪(日本岛津公司, 包括LC-20AD XR型泵, SIL-20A XR型自动进样器, CTO-20AC型柱温箱); Triple-TOFTM 5600+型质谱仪(美国AB Sciex公司, 包括Analyst TF 1.6数据采集工作站和Peak View 1.2数据分析软件); CO2恒温培养箱(美国Thermo Fisher公司); 超净工作台(苏州苏净公司); Dmi8倒置荧光显微镜(德国Leica公司); 光谱扫描多功能酶标仪(澳大利亚Tecan公司); 细胞计数仪Contess®II FL (美国Thermo Fisher公司); 旋转蒸发仪(巩义宇翔仪器有限公司); 真空干燥箱(上海和晟仪器科技有限公司); 流式细胞仪(美国BD公司)。
动物与细胞 实验方案经南京中医药大学实验动物福利与伦理委员会审查(批准号: 201906A029); 清洁级SD大鼠购于浙江省医学科学院, 生产许可证号SCXK (浙) 2019-0002, 雄性, 体重220~260 g, 饲养于南京中医药大学实验动物中心屏障环境设施中。大鼠肝(BRL) 细胞株购于中国科学院典型培养物保藏委员会细胞库。
二至丸样品及提取物的制备 按照文献[12]优化的炮制工艺制备酒女贞子, 超微粉碎。取墨旱莲药材适量, 加入10倍量水(w/v) 煎煮2次, 每次1 h, 过滤后合并滤液, 浓缩减压干燥得浸膏。按生药量1∶1混合酒女贞子超微粉与墨旱莲浸膏。按照文献[11]提取石油醚、乙酸乙酯、正丁醇和水提部位, 即取二至丸样品适量, 加少许水混匀, 按质量1∶1加入硅藻土拌匀, 减压干燥。加入10倍量(w/v) 石油醚回流提取至无色, 每次1 h, 过滤, 合并滤液, 减压干燥成浸膏。将滤渣于通风橱挥干, 按照石油醚部位提取步骤依次用乙酸乙酯、正丁醇和水提取, 最终得各部位浸膏。环烯醚萜苷类成分在二至丸中的含量较高, 且其中的特女贞苷是《中国药典》中二至丸质量评价的指标成分, 故单独提取此类成分以研究其生物活性, 其提取方法参考文献[13, 14], 即取女贞子适量, 粉碎, 加入14倍量(w/v) 70%乙醇回流提取3次, 每次2.5 h, 过滤浓缩, 滤液上D101型大孔树脂, 用5倍柱体积(bed volume, BV) 水洗脱, 5 BV 50%乙醇以2 BV·h-1流速洗脱, 收集乙醇洗脱液, 减压回收乙醇, 50 ℃减压干燥得浸膏。
含药血清的制备 用0.5% CMC-Na溶液配制二至丸灌胃溶液使浓度为0.36 g·mL-1。同法, 根据得率, 按同等生药量配制不同部位灌胃溶液。SD雄性大鼠随机分成7组(空白组、二至丸组和不同极性部位组), 每组8只。各组按10 mL·kg-1给予灌胃溶液, 空白对照组给予相同剂量的0.9%生理盐水, 每日2次, 连续7天。于末次灌胃1 h后腹主动脉采血, 分离血清, 56 ℃水浴灭活30 min, 用0.22 μm滤膜过滤后分装, 储存-20 ℃备用。鉴于前期研究 [11, 15]基础, 本实验以20%的大鼠血清进行研究, 按照DMEM培养基∶大鼠血清∶双抗= 79∶20∶1比例混匀即得浓度为20%的空白血清或含药血清, 保存于4 ℃备用。
细胞培养及传代 购得的BRL细胞株经复苏后用含10% FBS和1%双抗的DMEM完全培养基于37 ℃、5% CO2恒温培养箱中培养。细胞每2天更换一次新鲜培养基, 当细胞密度达到80%~90%时, 用0.25%胰蛋白酶消化, 按照1∶4的比例传代, 均取对数生长期细胞进行实验。
MTT实验 取第6代对数生长期BRL细胞按3×103细胞/孔均匀地接种于96孔板中, 设置对照组和实验组, 每组复6孔。用完全培养基稀释H2O2至浓度为200、400、600、1 000和2 000 μmol·L-1。待细胞完全贴壁后, 实验组分别加入相应浓度的H2O2溶液100 μL处理48 h或72 h, 对照组加入等体积的新鲜培养基, 每24 h换液一次。结束后每孔避光加入MTT (5 mg·mL-1) 20 μL, 继续培养4 h。吸弃上清液后, 每孔加入DMSO 150 μL, 轻摇10 min, 用酶标仪在490 nm处测定各孔的吸光度值。细胞存活率计算公式为: 细胞存活率(%) = (A样品组/A对照组)×100%
H2O2干预浓度及时间筛选 将BRL细胞按5×104细胞/孔均匀地接种于6孔板中。根据MTT实验结果, 设置对照组和H2O2不同浓度组(200、400和600 μmol·L-1), 处理48 h或72 h, 每组复6孔。待培养结束后, 每组3孔按β-半乳糖苷酶染色试剂盒说明进行细胞染色, 于37 ℃无CO2培养箱中避光孵育24 h。第二天用倒置显微镜每孔随机取3个视野观测细胞, 计算细胞阳性染色率。另外各组3孔按照活性氧检测试剂盒说明先收集细胞再装载探针, 再在CO2培养箱中培养20 min, PBS洗涤细胞2次后, 用PBS重悬细胞。然后用流式细胞仪检测, 参数设置为FITC。相对荧光强度为样品组平均荧光强度与对照组平均荧光强度的比值。
二至丸含药血清对细胞增殖的影响 将BRL细胞按1×103细胞/孔均匀地接种于96孔板中, 每组复6孔。设置对照组(A组)、后造模组(B组)、预防组(C组)、先造模组(D组)、治疗组(E组)。待细胞贴壁后, B组和C组分别先用完全培养基或20%二至丸含药血清培养48 h, 后用600 μmol·L-1 H2O2处理72 h; 而D组和E组先用600 μmol·L-1 H2O2处理72 h, 后再用完全培养基或20%二至丸含药血清培养48 h。对照组(A组) 始终以完全培养基培养。结束后MTT法检测细胞增殖。
二至丸及不同极性部位含药血清抗衰老作用研究 将BRL细胞按5×104细胞/孔均匀地接种于6孔板中, 设置对照组、模型组和给药组(二至丸及不同极性部位含药血清组), 每组复6孔。模型组和给药组先分别用20%空白血清或含药血清培养48 h, 后用600 μmol·L-1 H2O2处理72 h。对照组始终以完全培养基培养。培养结束后各组3孔进行β-半乳糖苷酶染色, 另外3孔检测细胞内ROS水平。
LC-MS/MS样品处理 取二至丸粉末0.8 g, 精密称定, 置具塞锥形瓶中, 精密加入80%甲醇25 mL, 密塞, 称定重量。超声(功率600 W, 频率40 kHz) 30 min, 放冷, 再称定重量, 用80%甲醇补足减失重量, 摇匀。取适量14 000 r·min-1离心10 min, 上清进样分析。不同部位浸膏根据得率按与二至丸相同生药量称取, 同法制备。分别取齐墩果酸、熊果酸、木犀草素、芹菜素、特女贞苷和红景天苷对照品适量, 精密称定, 加80%甲醇制成浓度为100 μg·mL-1的混合溶液。
LC-MS/MS分析条件 色谱条件为Poroshell 120 EC-C18色谱柱(100 mm×2.1 mm, 2.7 μm), 流动相0.1%甲酸水(A)-0.1%甲酸乙腈溶液(B) 梯度洗脱(0~10 min, 2%~15% B; 10~30 min, 15%~25% B; 30~35 min, 25%~35% B; 35~40 min, 35%~75% B; 40~46 min, 75%~95% B; 46~48 min, 95%~2% B), 流速0.3 mL·min-1, 柱温30 ℃, 进样量4 μL。质谱条件为电喷雾离子源(electrospray ionization, ESI), 正负离子扫描方式, 扫描范围m/z 50~1 500。正离子检测方式为气帘气40 psi (1 psi ≈ 6.9 kPa), 雾化气55 psi, 辅助气55 psi, 电喷雾电压5.5 kV, 离子源温度550 ℃, 去簇电压100 V, 母离子碰撞电压10 V, 子离子碰撞电压40 V, 碰撞电压差20 V; 负离子检测方式除电喷雾电压为-4.5 kV, 其余参数同正离子检测仅电压值为负。
分子对接 将二至丸中鉴定到的化学成分保存为mol2格式文件, 然后将化合物导入Discovery Studio 4.0软件中加CHARMm力场进行能量优化, 保存作为配体分子集。参考文献[16], 选取靶蛋白mTOR (INSG) 为受体。利用Discovery Studio 4.0软件对蛋白晶体进行删除水分子和经Prepare Protein工具处理。然后定义蛋白为受体, 以原配体位置为中心修改sphere球半径为14.5, 以此作为结合口袋并保留蛋白质A链用于后续分子对接。从Drug Bank网站(https://www.drugbank.ca) 中搜索与mTOR靶点有关的已上市小分子药物, 将2个抑制剂坦西莫司和依维莫司以及原配体作为参考配体集, 处理方法同配体分子。利用CDOCKER模块进行对, 将对接参数Pose Cluster Radius设为0.5 Å (1 Å = 10-10 m), 其余均为默认值。以对照药的平均-Cdocker energy值的80%为阈值, 筛选配体分子集中的化合物。用Analyze Ligands Pose模块分析对照药和配体化合物与靶点的作用模式, 进一步根据配体与靶蛋白相互作用的残基至少有3个及以上与对照药相同原则筛选活性化合物。
统计学方法 采用Prism 8软件进行处理, 实验数据均以x±s表示。两组间数据若均符合正态分布采用非配对t-test检验; 若不都符合正态分布采用非配对Mann-Whitney U检验, P < 0.05为有显著性差异。
结果 1 肝细胞衰老模型的建立 1.1 H2O2细胞毒性考察由图 1可知, H2O2能够抑制BRL细胞增殖, 且随着H2O2浓度的升高抑制作用越强。对比作用时间48 h与72 h, 可以看出用200~600 μmol·L-1 H2O2处理细胞并没有使细胞停止增殖, 只是随着H2O2浓度和作用时间的增加, 细胞的增殖速率下降, 但当H2O2浓度大于1 000 μmol·L-1时, 细胞几乎停止增殖。因1 000 μmol·L-1以上的H2O2对细胞增殖的抑制作用太强, 所以本研究选择200~600 μmol·L-1的H2O2进行后续实验。

|
Figure 1 Cell viability of BRL cells incubated with different concentrations of H2O2 for 48 h and 72 h. n = 6, x±s. ***P < 0.001 vs control group (0 μmol·L-1) |
根据染色结果可知(图 2), 正常的BRL细胞经200~600 μmol·L-1 H2O2处理48 h或72 h后, β-半乳糖苷酶染色阳性率均有显著升高, 并且细胞染色阳性率与H2O2浓度和作用时间呈一定的正相关。

|
Figure 2 β-Galactosidase viability of BRL cells incubated with different concentrations of H2O2 for 48 h (A) and 72 h (B); and the quantitative results of β-galactosidase staining (C). n = 3, x±s. ***P < 0.001 vs control group (0 μmol·L-1) |
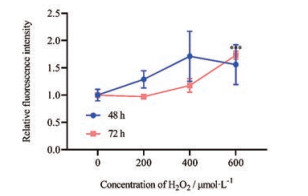
利用荧光探针DCFH-DA评估细胞内ROS水平是否受到干扰。DCFH-DA可以自由穿过细胞膜且本身没有荧光, 进入细胞后可被酯酶水解生成不能通透细胞膜的DCFH。而细胞内ROS可以氧化DCFH生成有荧光的DCF, 进而可通过检测荧光强度确定细胞内ROS水平。如图 3所示, H2O2作用于细胞后, 细胞内的ROS水平有所上升, 且表现出一定的剂量与时间依赖性。在各个组中, 仅当H2O2浓度为600 μmol·L-1, 作用时间为72 h时, 细胞内ROS水平与对照组相比具有统计学意义。故本实验选定用600 μmol·L-1 H2O2处理72 h来诱导BRL细胞衰老。
|
Figure 3 ROS levels in BRL cells incubated with different concentrations of H2O2 for 48 and 72 h. n = 3, x±s. ***P < 0.001 vs control group (0 μmol·L-1) |
由图 4可见, 与对照组(A组) 相比, 细胞经H2O2处理后(B和D组), 其生长被明显抑制。而若在H2O2干预细胞前, 先让细胞与二至丸含药血清作用48 h (C组), 细胞活力与对照组相比无明显差异。但在H2O2干预细胞后再与含药血清作用(E组), 没有改善H2O2对细胞的增殖抑制。故本实验选择在H2O2诱导细胞衰老前先用含药血清预处理48 h。

|
Figure 4 The difference of BRL cell viability between the administration of drug-containing serum of Erzhi Wan (EZW) before and after modeling. A group: Cell incubation with normal culture medium. B group: Cell incubation with normal culture medium for 48 h, subsequently incubated with 600 μmol·L-1 H2O2 for 72 h. C group: Cell incubation with drug-containing serum of EZW for 48 h, subsequently incubated with 600 μmol·L-1 H2O2 for 72 h. D group: Cell incubation with 600 μmol·L-1 H2O2 for 72 h, subsequently incubated with normal culture medium for 48 h. E group: Cell incubation with 600 μmol·L-1 H2O2 for 72 h, subsequently incubated with drug-containing serum of EZW for 48 h. n = 6, x±s. ***P < 0.001 vs A group |
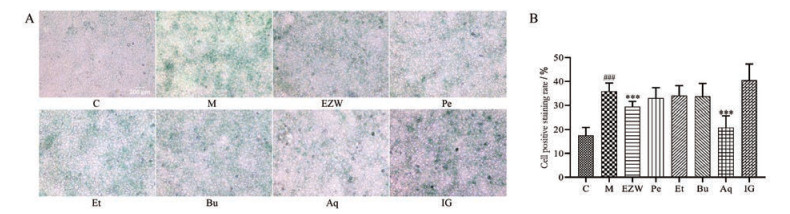
从图 5可以看出, 模型组的细胞染色较对照组更明显, 表明H2O2成功诱导了肝细胞衰老。根据染色的量化结果可见, 除环烯醚萜苷类组细胞染色阳性率较模型组没有下降外, 其余组均有不同程度的改善, 其中水提部位组效果最好, 且较模型组有显著差异。
|
Figure 5 Effects of drug-containing serums of EZW and different polar extracts on β-galactosidase viability in BRL cells (A) and the quantitative results of β-galactosidase staining (B). n = 3, x±s. C: Control group; M: Model group; EZW: Erzhi Wan group; Pe: Petroleum ether group; Et: Ethyl acetate group; Bu: Butanol group; Aq: Water group; IG: Iridoid glycosides group. ###P < 0.001 vs control group; ***P < 0.001 vs model group |
从图 6可知, 模型组较对照组荧光强度显著升高, 表明衰老细胞内ROS水平的上升。给药组中除了环烯醚萜苷类组的荧光强度与模型组相比没有显著差异外, 其余组均有显著降低, 表明不同部位含药血清均可降低衰老细胞内ROS水平。

|
Figure 6 Effects of drug-containing serums of EZW and different polar extracts on ROS levels in BRL cells. n = 3, x±s. ###P < 0.001 vs control group; ***P < 0.001 vs model group |
使用Peak View软件对正负离子模式下采集的质谱数据进行分析, 从二至丸中共鉴定到49个化合物, 包含5个苯乙醇类、10个环烯醚萜苷类、10个黄酮类、7个酚酸类、11个三萜类、2个香豆草醚类和4个其他成分。具体结果见表 1。
| Table 1 Constituents identified in EZW and different extracts by UFLC-Q-TOF-MS/MS in both negative and positive ion polarity modes. +: Identified compounds; E: Compounds from Eclipta prostrata; L: Compounds from Ligustri Lucidi Fructus; SCompounds identified by standards |
靶点活性口袋的半径为14.5 Å, 坐标为-9.48、26.884、36.385 Å。原配体对接回结合口袋, 对接构象与原配体结构之间的均方根偏差(RMSD) 值为0.582 7, RMSD ≤ 2 Å, 表明对接程序参数设置合理[17]。根据参考配体的-Cdocker energy值以及参考配体跟衰老靶点
mTOR相互作用的残基筛选二至丸中可能的活性成分, 共筛选到了4个三萜类, 3个黄酮类, 香豆草醚类和环烯醚萜苷类各2个, 苯乙醇类、酚酸和醛类各1个。表 2列出了筛选出的活性化合物, 以及它们与靶蛋白相互作用模式和相互作用的氨基酸残基。
| Table 2 Molecular docking scores and intermolecular interactions between the target and compounds |
越来越多的研究表明细胞衰老对于衰老进程的驱动作用, 衰老细胞在体内的逐渐积累直接引起器官的衰竭和衰老表型的出现[18, 19]。细胞衰老可以分为复制性衰老、癌源性衰老和应激性衰老等, 其中应激诱导的细胞衰老已经被广泛用于了解衰老过程和研究衰老的调控机制。H2O2是一种膜通透性的ROS, 它在细胞内能生成大量的羟自由基, 进而引起体内的氧化应激、炎症和免疫反应, 致使机体产生衰老相关的生理病理变化[20]。研究表明, 非致死性浓度的H2O2诱导的衰老与自然衰老的特征相似[21]。因此, 本研究选择利用H2O2去建立肝细胞衰老模型。许多研究表明, 线粒体ROS的产量与最大寿命呈负相关, 长寿动物的线粒体ROS产量低于短寿动物[22, 23]。而β-半乳糖苷酶活力是一种经典的细胞衰老表征[24]。因此本研究以β-半乳糖苷酶活力和ROS水平作为评价指标去建立肝细胞衰老模型以及研究二至丸及不同极性部位的抗衰老作用。
在本研究中确定了H2O2诱导肝细胞衰老的最佳浓度和时间。利用已建立的模型发现二至丸含药血清在造模前给药可以有效地预防H2O2导致的细胞增殖抑制, 但造模后给药这种效果不显著, 表明二至丸的预防作用强于治疗作用。本研究还评估了二至丸及不同部位含药血清的抗衰老作用, 结果显示除环烯醚萜苷类富集部位, 其余各部位均有一定的药效作用, 其中水提部位效果最好。Yan等[25]研究发现二至丸水提物对CCl4和H2O2诱导的肝细胞损伤具有保护作用。体内研究发现二至丸水提物对CCl4所致小鼠急性肝损伤也具有保护作用[26]。这些报道表明本研究利用衰老细胞模型筛选中药活性部位具有一定的可靠性。
利用LC-MS/MS技术比较分析了二至丸及各部位中的成分, 进一步根据分子对接结果以及各成分在二至丸中的含量, 推断黄酮、三萜以及苯乙醇类可能为抗衰老的有效成分。根据对接结果, 三萜类如旱莲苷III、熊果酸、2α-羟基齐墩果酸和旱莲苷B, 黄酮类如芦丁、木犀草素和芹菜素-7-O-吡喃葡萄糖苷, 苯乙醇类如毛蕊花糖苷, 可能是二至丸的有效成分。已有研究表明, 天然的三萜、黄酮类以及对羟基苯乙醇具有抗衰老作用。三萜类和苯乙醇类的抗衰老机制与它们影响了多种长寿以及抗衰老的蛋白和基因有关[27-30]。黄酮类化合物的抗衰老机制是其具有的多个酚羟基能与自由基反应生成较稳定的半醌式自由基, 从而终止自由基链式反应[31]。石油醚部位鉴定到的三萜类较多, 而乙酸乙酯、正丁醇和水提部位鉴定到的苯乙醇及黄酮类较多, 这揭示了各部位可能的抗衰老机制。此外, 有研究表明, 女贞子多糖能降低D-半乳糖诱导的小鼠心、肝和肾器官的衰老程度[32]。因此水提部位显著的抗衰老作用可能还与多糖有关。
为了更为全面地筛选二至丸可能的抗衰老活性组分, 作者将二至丸中鉴定到的所有成分均与近年来关注度较高的抗衰老靶蛋白mTOR进行了对接, 后期也将对二至丸及各部位含药血清中的入血原形成分及代谢产物进行鉴定, 并对虚拟筛选结果进行进一步的生物学验证。综上, 本研究借助细胞模型、分子对接技术和液质联用技术揭示了二至丸可能的抗衰老活性成分, 为进一步的二至丸抗衰老活性成分研究和机制研究提供了依据。
作者贡献: 冯丽负责资料调研、实验和写作论文; 王乙妃、高梦婷和李鑫参与实验; 姚卫峰和张丽提出想法、设计实验、指导并修改论文。
利益冲突: 本文作者声明无利益冲突。
| [1] |
Carmona JJ, Michan S. Biology of healthy aging and longevity[J]. Rev Invest Clin, 2016, 68: 7-16. |
| [2] |
Lopez-Otin C, Blasco MA, Partridge L, et al. The hallmarks of aging[J]. Cell, 2013, 153: 1194-1217. DOI:10.1016/j.cell.2013.05.039 |
| [3] |
Zhang LQ, Li CH, Jiang L, et al. ROS factors in aging hypothesis[J]. Prog Physiol Sci (生理科学进展), 2020, 51: 327-331. |
| [4] |
Sheng L, Wei BH, Yuan CB, et al. Study on the relationship between the signs of senile aging and TCM syndromes[J]. J Tradit Chin Med (中医杂志), 1997, 10: 621-622. |
| [5] |
Wang YF. Regulating Qi by the liver is the prerequisite for nourishing the kidney, strengthening the spleen and anti-aging[J]. Inf Tradit Chin Med (中医药信息), 2012, 29: 8-9. |
| [6] |
Liu ZY, Zhan XH, Zhao ZW, et al. Study on process of aging induced by oxidative stress in normal human body based on theory of liver[J]. Chin Arch Tradit Chin Med (中华中医药学刊), 2019, 37: 1352-1355. |
| [7] |
Guan XT, Gao P, Wang B, et al. Exploration on the relation of five internal organs and senility[J]. Acta Chin Med (中医学报), 2015, 30: 1433-1435. |
| [8] |
He JY, Liu F. mTOR signaling in aging and aging-associated diseases[J]. Prog Biochem Biophys (生物化学与生物物理进展), 2014, 41: 257-265. |
| [9] |
Johnson SC, Rabinovitch PS, Kaeberlein M. mTOR is a key modulator of ageing and age-related disease[J]. Nature, 2013, 493: 338-345. DOI:10.1038/nature11861 |
| [10] |
Kennedy BK, Lamming DW. The mechanistic target of rapamycin: the grand conducTOR of metabolism and aging[J]. Cell Metab, 2016, 23: 990-1003. DOI:10.1016/j.cmet.2016.05.009 |
| [11] |
Liu QN. The Protective Function and Cell Metabolomics Study of Erzhiwan on Ageing Kidney Cells (二至丸对衰老肾细胞的保护作用及细胞代谢组学研究)[D]. Nangjing: Nanjing University of Chinese Medicine, 2018.
|
| [12] |
Li H, Liu QN, Zhang L, et al. Optimization of processing technology of Ligustri Lucidi Fructus stewed with wine based on analytic[J]. Chin Tradit Herb Drugs (中草药), 2016, 47: 2832-2837. |
| [13] |
Shen Y, Ma L, Zhang QY, et al. Optimization of purification process of iridoid total glycosides from Ligustri Lucidi Fructus[J]. Chin Tradit Pat Med (中成药), 2018, 40: 1403-1406. |
| [14] |
Yang Y, Yi J, Ma L, et al. Optimization of extraction process for iridoid glycosides from Ligustrum lucidum by multi-index orthogonal test[J]. China Pharm (中国药房), 2016, 27: 3970-3973. |
| [15] |
Xu J. Protective Effect of Erzhiwan on Senescent Kidney Cells-based on "Homogeny of Liver and Kidney" and Cell Metabolomics (基于"肝肾同源"理论和细胞代谢组学研究二至丸对衰老肾细胞的保护作用)[D]. Nangjing: Nanjing University of Chinese Medicine, 2019.
|
| [16] |
Du RF, Zhang XH, Ye XT, et al. Screening of anti-aging active ingredients and mechanism analysis based on molecular docking technology[J]. China J Chin Mater Med (中国中药杂志), 2016, 41: 2522-2526. |
| [17] |
Lin CY, Li CZ, Li C, et al. Screening of active anti-myocardial ischemia components of Panax notoginseng based on molecular docking technology[J]. China J Chin Mater Med (中国中药杂志), 2020, 45: 2560-2567. |
| [18] |
Naina BD, Kanherkar RR, Stair SE, et al. Cellular senescence as the causal nexus of aging[J]. Front Genet, 2016, 7: 13. |
| [19] |
Baker D, Childs B, Durik M, et al. Naturally occurring p16Ink4a-positive cells shorten healthy lifespan[J]. Nature, 2016, 530: 184-189. DOI:10.1038/nature16932 |
| [20] |
Zhou YZ, Yan ML, Gao L, et al. Study on aging animal models and its application in activity screening of anti-aging drugs[J]. Chin Tradit Herb Drugs (中草药), 2017, 48: 1061-1071. |
| [21] |
Chen JH, Ozanne SE, Hales CN. Methods of cellular senescence induction using oxidative stress[J]. Methods Mol Biol, 2013, 1048: 135-144. |
| [22] |
Biala AK, Dhingra R, Kirshenbaum LA. Mitochondrial dynamics: orchestrating the journey to advanced age[J]. J Mol Cell Cardiol, 2015, 83: 37-43. DOI:10.1016/j.yjmcc.2015.04.015 |
| [23] |
Lopez-Lluch G, Hunt N, Jones B, et al. Calorie restriction induces mitochondrial biogenesis and bioen-ergetic efficiency[J]. Proc Natl Acad Sci U S A, 2006, 103: 1768-1773. DOI:10.1073/pnas.0510452103 |
| [24] |
Lee BY, Han JA, Im JS, et al. Senescence-associated beta-galactosidase is lysosomal beta-galactosidase[J]. Aging Cell, 2006, 5: 187-195. DOI:10.1111/j.1474-9726.2006.00199.x |
| [25] |
Yan B, Ding AW, Zhang L. Protective effects of aqueous extract of Erzhi pill on hepatocytes injured by CCl4 or H2O2[J]. J Pharm Pract (药学实践杂志), 2010, 28: 433-436. |
| [26] |
Yan B, Ding AW, Zhang L. Protective effect of aqueous extract of Erzhi pill against acute hepatic injury induced by xarbon tetrachloride[J]. Chin J Exp Tradit Med Form (中国实验方剂学杂志), 2010, 16: 131-134. |
| [27] |
Cañuelo A, Esteban FJ, Peragón J. Gene expression profiling to investigate tyrosol-induced lifespan extension in Caenorhabditis elegans[J]. Eur J Nutr, 2016, 55: 639-650. DOI:10.1007/s00394-015-0884-3 |
| [28] |
Mukherjee S, Lekli I, Gurusamy N, et al. Expression of the longevity proteins by both red and white wines and their cardioprotective components, resveratrol, tyrosol, and hydroxytyrosol[J]. Free Radic Biol Med, 2009, 46: 573-578. DOI:10.1016/j.freeradbiomed.2008.11.005 |
| [29] |
Staats S, Wagner AE, Lüersen K. Dietary ursolic acid improves health span and life span in male Drosophila melanogaster[J]. Biofactors, 2019, 45: 169-186. DOI:10.1002/biof.1467 |
| [30] |
Bahrami SA, Bakhtiari N. Ursolic acid regulates aging process through enhancing of metabolic sensor proteins level[J]. Biomed Pharmacother, 2016, 82: 8-14. DOI:10.1016/j.biopha.2016.04.047 |
| [31] |
Huang CB, Luo ZM, Bin LY. Study on the relation between structure and antioxygenic activity of flavonoid[J]. J Guangdong Univ Technol (广东工业大学学报), 2000, 2: 71-75. |
| [32] |
Zhang ZM, Ge B, Xu AX, et al. Antisenile effect of polysaccharides from Fructus Ligustri Lucidi[J]. Chin J Pharmacol Toxicol (中国药理学与毒理学杂志), 2006, 20: 108-111. |
 2021, Vol. 56
2021, Vol. 56


