2. 徐州医科大学药物分析教研室, 江苏 徐州 221004
2. Department of Pharmaceutical Analysis, Xuzhou Medical University, Xuzhou 221004, China
糖尿病(diabetes mellitus, DM) 是由环境及遗传因素共同引起的代谢紊乱性疾病, 已渐渐成为全球性的社会健康问题。据世界糖尿病协会报道, 2019年中国糖尿病患者为1.16亿, 发病率约为全国总人口的10%, 是全球糖尿病患者人数最多的国家。胰岛素抵抗、胰岛功能受损等因素导致胰岛素分泌的相对或绝对不足, 引发机体血糖代谢异常进而引发糖尿病[1]。持续高的血糖水平是驱动DM发生发展的使动因素, 空腹血糖也成为检测DM的重要标志物。但在DM的发生发展过程中, 易发生肾病、眼病、神经病变、冠状动脉病变和外周血管病变等并发症, 其隐藏的代谢通路异常仍未完全阐明。因此, 探究DM发生发展过程中的生物标志物, 对揭示其发生发展的潜在机制具有重要意义。
银杏叶提取物(Ginkgo biloba leaves extract, GBE) 是经现代工艺提取的活性物质群, 主要包括银杏黄酮类及萜内酯类化学成分, 具有抗氧化、扩血管、降血脂、改善血流动力学状态等广泛的药理作用。据文献报道, GBE可明显降低DM患者及动物的糖化血红蛋白、空腹血糖及胰岛素水平[2, 3], 保护DM大鼠胰岛细胞受损及凋亡[4], 高胰岛素诱导肝细胞对葡萄糖的耐受能力[5], 但GBE对DM发生发展过程中代谢通路异常是否影响及潜在的可能机制, 仍未完全阐明。
作为系统生物学的重要平台之一, 代谢组学关注的是生物体系受到外源性刺激或基因变异后, 体液或组织中的小分子代谢产物的整体变化。该整体反应性的特点与中药治疗疾病的多环节、多靶点、协同起效的整体观念十分吻合, 因而成为考察DM发病机制及中药治疗机制的重要手段[6-9]。但迄今为止, 尚未见针对DM发生发展过程及GBE干预过程中的代谢通路异常, 及其引起的生物标志物持续性变化的相关报道。本研究以链脲霉素(STZ) 诱导的DM大鼠为对象, 选取第6~9周大鼠血浆, 采用LC-MS技术进行非靶向代谢组学分析, 结合PCA及PLS-DA分析, 探寻DM发生发展及GBE干预过程中发生持续性变化的生物标志物及其涉及的代谢通路异常, 以揭示DM发生发展及GBE干预的潜在机制。
材料与方法仪器与试剂 Agilent 1290/6550超高效液相色谱-四级杆飞行时间质谱联用仪(美国Agilent公司); XW-80A型微型涡旋仪(上海沪西分析仪器厂有限公司); AB265-S型电子分析天平(瑞士METTLER TOLEDO公司); 5417R型台式高速冷冻离心机(德国Eppendorf公司); Forma 900 Series超低温冰箱和GenPure UV/UF超纯水机(美国Thermo公司); 色谱纯甲醇、乙腈、甲酸(美国MREDA公司); 分析纯丙酮(国药集团化学有限公司); N-芴甲氧羰基-甘氨酸(美国Sigma公司); GBE (批号: 201409) 购自江苏邳州富通生化科技有限公司, 采用本课题组建立的方法进行定量及化学成分分析[10, 11], 共鉴定出104个化合物(74个黄酮苷、14个黄酮苷元、9个萜内酯、5个酚酸、2个其他类), 芦丁、槲皮素、山柰酚及异鼠李素的含量分别为9.6、20.3、2.7和13.7 mg·g-1。
动物 成年雄性SD大鼠购自上海斯莱克实验动物有限责任公司, 体重190~235 g, 动物生产许可证号: SCXK (沪) 2008-0016。动物实验环境: SPF级动物实验室, 室内温度18~22 ℃, 相对湿度40%~50%, 标准饲料和饮用水, 室内保持12 h光照/12 h避光循环, 适应一周后开始实验。动物实验获得徐州医科大学伦理委员会批准(批准号: XZMULL201612024)。
动物分组、造模、给药及样本收集 雄性SD大鼠40只, 随机取16只设为正常组, 其余大鼠禁食禁水12 h后, 一次性腹腔注射60 mg·kg-1 STZ柠檬酸缓冲溶液; 正常组给予同等体积的柠檬酸缓冲液, 72 h后空腹血糖值大于13.88 mmol·L-1者为造模成功。造模成功当日为实验第1天, 将造模成功的大鼠随机分为DM模型对照组(DM)、DM模型GBE给药组(D-GBE, 200 mg·kg-1), 每组8只。正常组分为正常对照组(NC) 及正常对照GBE给药组(N-GBE, 200 mg·kg-1), 每组8只。各组大鼠在SPF环境下, GBE组按200 mg·kg-1·d-1给予GBE的1% CMC-Na溶液; 对照组给予同体积的溶媒。饲养9周。第2~5周采血, 用试剂盒测定空腹血糖; 第6~9周采血, 分别用于空腹血糖测定及代谢组学研究。血样分析前置-80 ℃冻存, 备用。
样品处理 取大鼠血浆50 μL, 加0.4 mg·mL-1 N-芴甲氧羰基-甘氨酸甲醇溶液(内标) 5 μL、甲醇200 μL, 涡旋30 s, -20 ℃冻存10 min, 12 000 r·min-1、4 ℃离心10 min, 取上清液200 μL, 再次12 000 r·min-1、4 ℃冷冻离心10 min, 取上清进LC-MS分析。
色谱质谱条件及样品分析
色谱条件 Fortis C18柱(100 mm×2.1 mm, 1.7 µm)。流动相A: 0.1%甲酸的水溶液; 流动相B: 0.1%甲酸的甲醇溶液; 流速: 0.3 mL·min-1。正离子模式梯度洗脱程序: 0~9 min, 25%~85% B; 9~13 min, 85% B; 13~22 min, 85%~95% B; 22~25 min, 95% B; 进样前平衡11 min。负离子模式梯度洗脱程序: 0~8 min, 20% B~95% B; 8~12 min, 95% B; 12~13 min, 95%~98% B; 13~18 min, 98% B; 进样前平衡12 min。柱温40 ℃; 自动进样器4 ℃; 进样量5 μL。
质谱条件 ESI源; 干燥器气流速12 L·min-1; 干燥气温度280 ℃; 喷雾压力28 psi (1 psi ≈ 6.9 kPa); 鞘气流速12 L·min-1; 鞘气温度400 ℃ (正离子) 和350 ℃ (负离子); 喷嘴电压500 V; 毛细管电压4 000 V; 扫描范围m/z 50~1 000。
样品分析 取各周所有大鼠个体的血浆样品少量, 等体积混合均匀后制得质控(QC) 样本, 预处理方法同样品。样品测定之前先检测6个QC样本, 调整仪器待重现性良好以后开始采集目标样品数据。每检测6个样品检测插入1个QC样本, 通过QC样品的重现性和稳定性以评估仪器状态及方法可靠性。
数据处理与统计分析 将LC-MS原始数据经Profinder 6.0软件进行分子特征提取、背景扣除及数据过滤后, 创建为*.CEF格式, 导入到美国安捷伦公司Mass Profiler Professional (MPP) 软件进行PCA和PLS-DA模式判别分析, 验证分析系统性能的稳定性和分析数据的质量, 并筛选出有统计学意义的代谢物。通过METLIN个人代谢数据库和MPP软件进行代谢物的鉴定。两组间比较采用t检验, 假设检验水准按α = 0.05判定, P < 0.05表示差异有统计学意义。最终相关代谢通路图通过KEGG进行搜索。
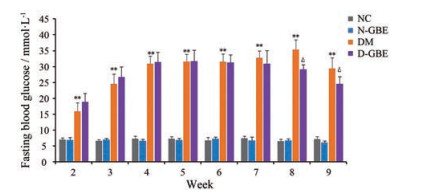
结果 1 大鼠血糖变化DM大鼠成模后的第2周开始, 每周一次测定大鼠空腹血糖。NC组与N-GBE组之间的大鼠空腹血糖无显著性差异, 提示GBE对正常大鼠空腹血糖无影响; DM组大鼠空腹血糖均显著高于NC组, 提示模型成功; 而给予GBE 7周后, 大鼠空腹血糖明显下降(第8周和第9周), 提示GBE可改善DM大鼠的血糖升高(图 1)。
|
Figure 1 The continuous changes of fasting blood glucose rat from the second to ninth week. GBE: Ginkgo biloba extract. **P < 0.01 vs NC group; ∆P < 0.05 vs DM group. n = 8, x±s. NC, N-GBE, DM, and D-GBE respectively mean the normal control group treated with drug-free solution, NC group treated with GBE, diabetes mellitus group treated with drug-free solution, and DM group treated with GBE |
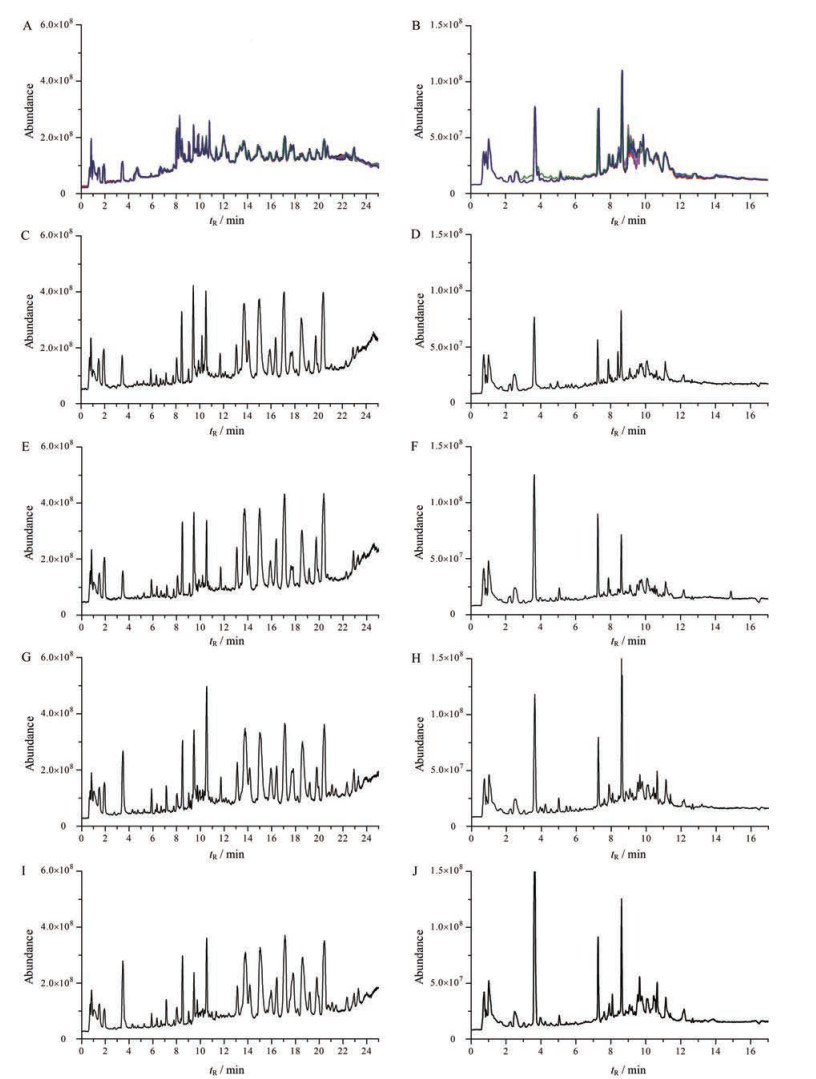
本研究通过研究QC样品中主要色谱峰(正离子: 胞嘧啶、牛磺酸和吡哆醇; 负离子: 脯氨酸、棕榈酸和山梨醇) 的保留时间和峰面积变异, 考察了代谢组学数据的可靠性及重现性。结果显示(图 2), 上述代谢物的保留时间RSD均小于1.0%, 峰面积RSD均小于2.9%, 表明该分析系统稳定。
|
Figure 2 Typical LC-MS chromatograms at positive or negative ion mode of 6 QC samples and rat real plasma from the ninth NC group, N-GBE group, DM group, and D-GBE group. A: QC(+); B: QC(-); C: NC (+); D: NC(-); E: N-GBE (+); F: N-GBE(-); G: DM(+); H: DM(-); I: D-GBE (+); J: D-GBE(-) |
采用LC-MS进行样本的分离、检测和数据采集。由图 2中可以看出, 无论正离子还是负离子检测模式下, NC组和N-GBE组大鼠血浆的代谢物差异较小; NC组和DM组、DM组和D-GBE组之间的大鼠血浆代谢物均存在差异。
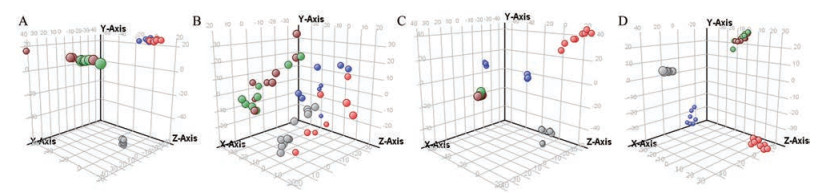
3 差异代谢物筛选利用MPP软件分别对四组数据建立PCA模型, 由PCA得分图(图 3) 可以看出, 第6~9周的N-GBE组和NC组样品均无法分离, 提示GBE对正常大鼠血浆的代谢轮廓无显著性影响; DM组样品和NC组样品均分别聚集在不同象限, 并随着时间的延长, 分离趋势明显加大, 提示DM改变了大鼠的代谢轮廓, 并随着病程的延长呈现加大趋势; DM组和D-GBE组样品分别集中, 在第6周和第7周的分离趋势不显著, 但随着时间延长, 两组样品分离趋势逐渐增大, 提示随着GBE干预时间的延长, 可明显改变大鼠代谢轮廓。
|
Figure 3 Representative 3D-PCA scores plots of the plasma metabolites in rats of QC samples (gray dot), NC group (green dot), N-GBE group (purple dot), DM group (red dot), and D-GBE group (blue dot) at positive ion mode. A, B, C, and D respectively mean the sixth, seventh, eighth, and ninth week; X, Y, and Z axis represent the space quadrant, and the numeric values in this coordinate system just mean the degree of separation among different samples |
为了找出DM组与NC组、D-GBE组与DM组之间对分类贡献最大的潜在生物标志物, 利用MPP软件对四组样品数据进行PLS-DA分析, 并对模型得分进行评价。由表 1中数据可以看出, DM和NC组、D-GBE组和DM组之间的PLS-DA模型的预测能力得分均超过85%, 提示所建立的PLS-DA模型稳定可靠。
| Table 1 The predictive ability scores of PLS-DA model of DM vs NC and D-GBE vs DM |
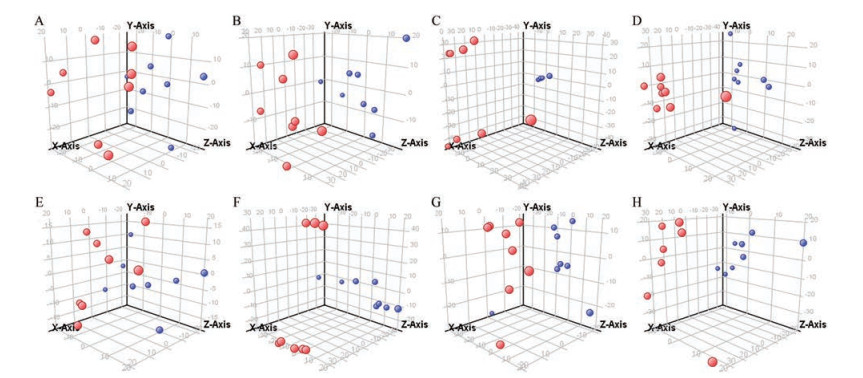
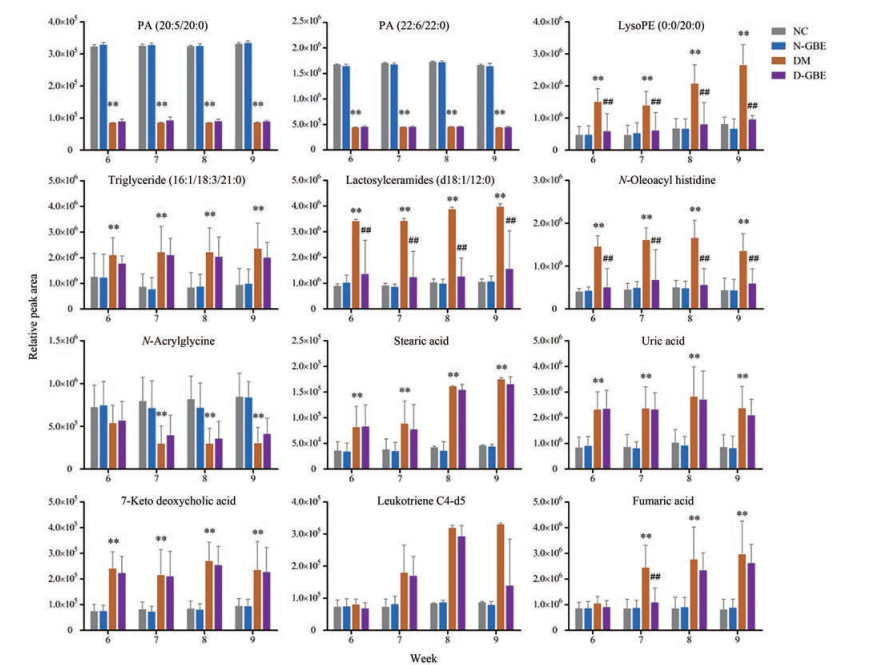
由PLS-DA得分图可见, NC组与DM组(图 4上)、DM组与D-GBE组(图 4下) 均可明显区分。根据模型中代谢离子响应值的变化倍数(fold change absolute, FC) > 2初步筛选差异性变量。对所得差异性变量进行t检验, 筛选出两组间相对含量存在显著性差异的变量(P < 0.05)。利用METLIN质谱数据库对同时满足FC > 2和P < 0.05的变量进行鉴定, 共检出40种差异代谢物(表 2、3)。其中, DM组大鼠血浆代谢物在第6~9周呈持续性出现变化异常有11种, 分布于磷脂、脂肪酸、氨基酸、嘌呤-嘧啶、胆汁酸等代谢通路中, 提示DM可能对以上通路造成影响, 使整体状态失调; 经GBE干预后, 可发生逆转的代谢物有5种(表 4), 分布于磷脂、氨基酸、三羧酸循环、脂肪酸等代谢通路, 提示GBE可能通过影响上述通路发挥其改善DM的作用(图 5)。
|
Figure 4 Representative 3D-PLS-DA scores plots of the plasma metabolites in rats of NC group and DM group at positive ion mode (A, B, C, and D respectively mean the sixth, seventh, eighth, and ninth week; NC: blue dot; DM: red dot), and DM group and D-GBE group (E, F, G, and H respectively mean the sixth, seventh, eighth, and ninth week; DM: blue dot; D-GBE: red dot). X, Y, and Z axis represent the space quadrant, and the numeric values in this coordinate system just mean the degree of separation among different samples |
| Table 2 The differential metabolites in rat plasma of DM group vs NC group from the sixth week to ninth week (n = 8). FC: Fold change; NS: No significant variation; TG: Triglyceride; LacCer: Lactosylceramide; LysoPE: Lyso-phosphatidylethanolamine; PA: Phosphatidic acid; PE: Phosphatidylethanolamine; PG: Phosphatidylglycerol; PI: Phosphatidylinositol; PS: Phosphatidylserine. *Metabolites with continuous variation |
| Table 3 Identification results of significant differential metabolites in rat plasma |
| Table 4 The differential metabolites in rat plasma of DM group vs D-GBE group from the sixth week to ninth week (n = 8) |
|
Figure 5 The differential expression of metabolites in rat plasma of NC, N-GBE, DM, and D-GBE group (n = 8). **P ˂ 0.01 vs NC group, ##P ˂ 0.01 vs DM group |
代谢组学自其诞生以来, 已在T2DM及肥胖的发病机制及药物防治机制的研究中发挥了重要的作用。本课题组前期的细胞动态非靶向代谢组学研究结果显示, 棕榈酸和亚油酸可作为揭示DM向糖尿病肾病(diabetic nephropathy, DN) 发生发展进程的潜在生物标志物; 针对18个氨基酸、25个脂肪酸、19个核酸核碱的靶向代谢组学研究表明, 16个差异代谢物可作为DM向DN发生发展进程的潜在生物标志物, 14个差异代谢物与GBE改善此进程密切相关[12, 13], 但针对DM发生发展的潜在机制仍需要进一步研究。因此, 本研究采用非靶向代谢组学方法, 针对DM发生发展及GBE干预过程中发生持续性变化的代谢通路紊乱及相应的潜在生物标志物进行研究, 以进一步揭示DM发生发展及GBE干预的潜在机制。
DM发生发展所导致的可能潜在并发症是DM对人类造成伤害的重要因素, 针对此过程进行研究对DM的防治可能具有重要的临床意义。本研究累计发现了40种差异代谢物, 但一些差异代谢物仅在某个检测周出现, 可能与DM的发生发展过程密切相关。如PS (20:5/21:0) 仅在第6周有变化而后期无变化, 可能与DM的相关并发症或实验结果的假阳性有关。因此, 本研究仅关注发生持续性变化的12个差异代谢物, 而不关注偶尔出现差异的代谢物。
磷脂(phospholipids, PLs) 代谢紊乱与DM密切相关, 显著改变的PLs分子被认为是2型DM的生物标志物[14]。PLs在磷脂酶A2 (phospholipase A2, PLA2) 的作用下, 可生成溶血磷脂1和游离脂肪酸, 如磷脂酰乙醇胺(phosphatidylethanolamine, PE) 在PLA2作用下降解成溶血磷脂酰乙醇胺(LysoPE)。DM状态下, 山梨醇、氧化应激和蛋白激酶C (PKC) 等通路激活, PLA2活性升高, 导致PLs水平降低、溶血磷脂水平增加[15]。本研究发现, 第6~9周DM大鼠血浆中PA水平降低, LysoPE和甘油三酯的水平升高, 与前文报道一致[16-18]; GBE干预后, DM大鼠血浆中LysoPE水平降低, 可能与其作用于氧化应激通路进而影响PLA2表达有关[19]。
乳糖神经酰胺有助于稳定质膜和激活特异性微结构域或筏中的受体分子。DM状态下, 去饱和酶神经酰胺合成酶和丝氨酸棕榈酰转移酶I的表达增加, 导致神经酰胺形成速率加快、水平显著提高; 升高的乳糖神经酰胺可以激活影响细胞增殖、黏附、迁移和血管生成的“氧敏感”信号通路, 且其具有神经毒性可引起胰岛素抵抗, 这些功能障碍可推动DM的发生发展[20]。本研究也发现了第6~9周DM大鼠血浆中乳糖神经酰胺水平显著提升; 经GBE干预后可显著降低其水平, 但GBE是否改善了神经酰胺合成酶或丝氨酸棕榈酰转移酶I的表达尚未见报道, 该潜在的机制有待进一步研究。
胆汁酸代谢通路异常与DM发生发展密切相关。如CYP7A1是胆汁酸合成的限速酶, DM状态下该酶活性被抑制导致胆汁酸水平升高, 升高的胆汁酸可以激活炎症信号通路从而促进DM的发生发展[21]。本研究发现第6~9周DM大鼠血浆中7-酮脱氧胆酸均显著高于正常组, 而7-酮脱氧胆酸由初级胆汁酸脱去7α-羟基生成, 因而, 该结果提示DM发生发展过程与胆汁酸代谢通路异常密切相关。
尿酸是嘌呤代谢的最终氧化产物, 由黄嘌呤氧化酶氧化黄嘌呤产生。DM状态下黄嘌呤氧化酶活性升高, 导致尿酸水平升高。因而, 升高的尿酸水平与DM密切相关, 并可能导致DM并发症如DN的发生[22]。本研究结果也证实了第6~9周DM大鼠血浆中尿酸水平显著高于正常组, 提示嘌呤代谢异常推动了DM大鼠病情的发生发展, 且可能发生肾脏损伤; 而GBE干预对尿酸代谢无显著性影响。
游离脂肪酸水平升高可引起胰岛素抵抗, 并影响糖原分解和葡萄糖的摄取。DM状态下, 参与脂肪酸β氧化过程的左旋肉碱和脂酰CoA水平降低, 可导致硬脂酸的β-氧化障碍、降解减少, 水平升高[23]。花生四烯酸在5-脂氧化酶作用下代谢生成白三烯, DM状态下5-脂氧化酶表达增加, 导致白三烯类化合物水平上升, 从而促进炎症因子释放和胰岛素抵抗[24]。本研究结果显示, 第6~9周大鼠DM血浆中硬脂酸及白三烯水平显著升高, GBE干预9周后可逆转白三烯水平的上升但对硬脂酸无影响, 提示GBE可能影响了花生四烯酸的代谢通路异常, 进而降低了DM大鼠血浆中白三烯水平。
尽管大量代谢组学的研究结果显示, DM患者血液中的组氨酸水平显著高或低于正常个体[25-28], 但作为组氨酸衍生物的N-油酰基组氨酸在DM患者血浆中的变化情况尚未见报道。本研究发现N-油酰基组氨酸在第6~9周DM大鼠血浆的水平持续性高于正常大鼠, 且GBE干预后可逆转此升高, 但其潜在的机制尚有待进一步研究。
三羧酸循环的代谢异常与DM发生发展密切相关, 而富马酸是三羧酸循环的中间产物。研究证实, 血浆中持续升高的富马酸水平, 有可能推动DM的发生发展并导致肾纤维化及视网膜病变[29, 30]。本研究结果也显示, DM大鼠血浆中富马酸水平持续升高可能推动了DM的发生发展; GBE干预后可逆转DM大鼠血浆中富马酸水平的上升, 提示GBE可能通过影响三羧酸循环代谢异常发挥其防治DM发生发展的作用, 但其潜在机制尚有待进一步研究。
综上所述, 磷脂、脂肪酸、氨基酸、胆汁酸、三羧酸循环、嘌呤等代谢通路的异常推动了DM的发生发展; GBE可通过影响脂肪酸、氨基酸、磷脂、三羧酸循环等代谢通路发挥其改善DM发生发展进程的作用。
作者贡献: 张帆负责动物实验和论文初稿的撰写; 胡勋秀负责实验样品的分析与数据处理; 李丁香、张染、赵琳琳参与实验和数据处理; 杜岩参与动物实验、代谢组学实验及实验数据处理; 汤道权负责研究思路的提出、实验总体设计、提供撰写思路及修改论文。所有作者阅读并认可终稿。
利益冲突: 本文的研究内容无任何利益冲突。
| [1] |
Prentki M, Nolan CJ. Islet β cell failure in type 2 diabetes[J]. J Clin Invest, 2006, 116: 1802-1812. DOI:10.1172/JCI29103 |
| [2] |
Aziz TA, Hussain SA, Mahwi TO, et al. The efficacy and safety of Ginkgo biloba extract as an adjuvant in type 2 diabetes mellitus patients ineffectively managed with metformin: a double-blind, randomized, placebo-controlled trial[J]. Drug Des Devel Ther, 2018, 12: 735-742. DOI:10.2147/DDDT.S157113 |
| [3] |
Rhee KJ, Lee CG, Kim SW, et al. Extract of Ginkgo biloba ameliorates streptozotocin-induced type 1 diabetes mellitus and high-fat diet-induced type 2 diabetes mellitus in mice[J]. Int J Med Sci, 2015, 12: 987-994. DOI:10.7150/ijms.13339 |
| [4] |
Saleh A, Anwar MM, Zayed AE, et al. Impact of Ginkgo biloba extract and magnetized water on the survival rate and functional capabilities of pancreatic β-cells in type 2 diabetic rat model[J]. Diabetes Metab Syndr Obes, 2019, 12: 1339-1347. DOI:10.2147/DMSO.S209856 |
| [5] |
Zhou L, Meng Q, Qian T, et al. Ginkgo biloba extract enhances glucose tolerance in hyperinsulinism-induced hepatic cells[J]. J Nat Med, 2011, 65: 50-56. DOI:10.1007/s11418-010-0456-z |
| [6] |
Zhang M, Du CH, Li J, et al. Comparative study of Chinese medicine Gegen Qinlian Decoction Piece and boiled powder for the treatment of diabetes based on serum metabolomics[J]. Acta Pharm Sin (药学学报), 2017, 52: 1444-1451. |
| [7] |
Ji T, Zhang LL, Huang XC, et al. The action mechanisms of Morus alba leaves extract for the treatment of diabetes based on plasma metabolomics[J]. Acta Pharm Sin (药学学报), 2015, 50: 830-835. |
| [8] |
Guo Q, Li XJ, Guo HR, et al. The urinary metabolomics of Astragalus Radix and Dioscoreae Rhizomacomes reveal possible therapeutic mechanisms in the treatment of type 2 diabetes[J]. Acta Pharm Sin (药学学报), 2020, 55: 83-90. |
| [9] |
Li X, Ma HY, Li LP, et al. Progress in metabolomics research of diabetes[J]. Acta Pharm Sin (药学学报), 2019, 54: 828-837. |
| [10] |
Ji S, He DD, Wang TY, et al. Separation and characterization of chemical constituents in Ginkgo biloba extract by off-line hydrophilic interaction×reversed-phase two-dimensional liquid chromatography coupled with quadrupole-time of flight mass spectrometry[J]. J Pharm Biomed Anal, 2017, 146: 68-78. DOI:10.1016/j.jpba.2017.07.057 |
| [11] |
Tang DQ, Yang DZ, Tang AB, et al. Simultaneous chemical fingerprint and quantitative analysis of Ginkgo biloba extract by HPLC-DAD[J]. Anal Bioanal Chem, 2010, 396: 3087-3095. DOI:10.1007/s00216-010-3536-8 |
| [12] |
Wang L, Du Y, Xu BJ, et al. Metabolomics study of metabolic changes in renal cells in response to high-glucose exposure based on liquid or gas chromatography coupled with mass spectrometry[J]. Front Pharmacol, 2019, 10: 928. DOI:10.3389/fphar.2019.00928 |
| [13] |
Du Y, Xu BJ, Deng X, et al. Predictive metabolic signatures for the occurrence and development of diabetic nephropathy and the intervention of Ginkgo biloba leaves extract based on gas or liquid chromatography with mass spectrometry[J]. J Pharm Biomed Anal, 2019, 166: 30-39. DOI:10.1016/j.jpba.2018.12.017 |
| [14] |
Hsu FF, Bohrer A, Wohltmann M, et al. Electrospray ionization mass spectrometric analyses of changes in tissue phospholipid molecular species during the evolution of hyperlipidemia and hyperglycemia in Zucker diabetic fatty rats[J]. Lipids, 2000, 35: 839-854. DOI:10.1007/S11745-000-0593-z |
| [15] |
Seyfarth J, Reinehr T, Hoyer A, et al. Lipoprotein-associated phospholipase A2 activity in obese adolescents with and without type 2 diabetes[J]. J Inherit Metab Dis, 2018, 41: 73-79. DOI:10.1007/s10545-017-0100-0 |
| [16] |
Zhu C, Liang QL, Hu P, et al. Phospholipidomic identification of potential plasma biomarkers associated with type 2 diabetes mellitus and diabetic nephropathy[J]. Talanta, 2011, 85: 1711-1720. DOI:10.1016/j.talanta.2011.05.036 |
| [17] |
Fall T, Salihovic S, Brandmaier S, et al. Non-targeted metabolomics combined with genetic analyses identifies bile acid synthesis and phospholipid metabolism as being associated with incident type 2 diabetes[J]. Diabetologia, 2016, 59: 2114-2124. DOI:10.1007/s00125-016-4041-1 |
| [18] |
Liu J, Semiz S, van der Lee SJ, et al. Metabolomics based markers predict type 2 diabetes in a 14-year follow-up study[J]. Metabolomics, 2017, 13: 104. DOI:10.1007/s11306-017-1239-2 |
| [19] |
Achete de Souza G, de Marqui SV, Matias JN, et al. Effects of Ginkgo biloba on diseases related to oxidative stress[J]. Planta Med, 2020, 86: 376-386. DOI:10.1055/a-1109-3405 |
| [20] |
Turpin-Nolan SM, Brüning JC. The role of ceramides in metabolic disorders: when size and localization matters[J]. Nat Rev Endocrinol, 2020, 16: 224-233. DOI:10.1038/s41574-020-0320-5 |
| [21] |
Chávez-Talavera O, Tailleux A, Lefebvre P, et al. Bile acid control of metabolism and inflammation in obesity, type 2 diabetes, dyslipidemia, and nonalcoholic fatty liver disease[J]. Gastroenterology, 2017, 152: 1679-1694. DOI:10.1053/j.gastro.2017.01.055 |
| [22] |
Xiong Q, Liu J, Xu Y. Effects of uric acid on diabetes mellitus and its chronic complications[J]. Int J Endocrinol, 2019, 2019: 9691345. |
| [23] |
Kampe K, Sieber J, Orellana JM, et al. Susceptibility of podocytes to palmitic acid is regulated by fatty acid oxidation and inversely depends on acetyl-CoA carboxylases 1 and 2[J]. Am J Physiol Renal Physiol, 2014, 306: F401-409. DOI:10.1152/ajprenal.00454.2013 |
| [24] |
Martínez-Clemente M, Clària J, Titos E. The 5-lipoxygenase/leukotriene pathway in obesity, insulin resistance, and fatty liver disease[J]. Curr Opin Clin Nutr Metab Care, 2011, 14: 347-353. DOI:10.1097/MCO.0b013e32834777fa |
| [25] |
Gogna N, Krishna M, Oommen AM, et al. Investigating correlations in the altered metabolic profiles of obese and diabetic subjects in a South Indian Asian population using an NMR based metabolomic approach[J]. Mol Biosyst, 2015, 11: 595-606. DOI:10.1039/C4MB00507D |
| [26] |
Mathew AV, Jaiswal M, Ang L, et al. Impaired amino acid and TCA metabolism and cardiovascular autonomic neuropathy progression in type 1 diabetes[J]. Diabetes, 2019, 68: 2035-2044. DOI:10.2337/db19-0145 |
| [27] |
Owei I, Umekwe N, Stentz F, et al. Amino acid signature predictive of incident prediabetes: a case-control study nested within the longitudinal pathobiology of prediabetes in a biracial cohort[J]. Metabolism, 2019, 98: 76-83. DOI:10.1016/j.metabol.2019.06.011 |
| [28] |
Welsh P, Rankin N, Li Q, et al. Circulating amino acids and the risk of macrovascular, microvascular and mortality outcomes in individuals with type 2 diabetes: results from the ADVANCE trial[J]. Diabetologia, 2018, 61: 1581-1591. DOI:10.1007/s00125-018-4619-x |
| [29] |
Miura Y, Hayakawa A, Kikuchi S, et al. Fumarate accumulation involved in renal diabetic fibrosis in Goto-Kakizaki rats[J]. Arch Biochem Biophys, 2019, 678: 108167. DOI:10.1016/j.abb.2019.108167 |
| [30] |
Zhu XR, Yang FY, Lu J, et al. Plasma metabolomic profiling of proliferative diabetic retinopathy[J]. Nutr Metab (Lond), 2019, 16: 37. DOI:10.1186/s12986-019-0358-3 |
 2021, Vol. 56
2021, Vol. 56


