2. 青海大学高原医学研究中心, 青海 西宁 810001;
3. 青海大学医学院, 青海 西宁 810001;
4. 青海大学三江源生态与高原农牧业国家重点实验室, 青海 西宁 810016
2. Research Center for High Altitude Medicine, Qinghai University, Xining 810001, China;
3. Medical College of Qinghai University, Xining 810001, China;
4. State Key Laboratory of Plateau Ecology and Agriculture, Qinghai University, Xining 810016, China
高原环境以低氧、低压、强辐射为主要特征, 其独特的环境使人类面临巨大的挑战。机体进入高原后, 神经系统、心血管系统、呼吸系统和消化系统会受到不同程度的损伤[1-4], 其中消化系统出现胃肠道黏膜通透性增高[5]、炎症反应[6]等, 导致胃肠道疾病的发生, 出现恶心、呕吐、反酸和腹泻等症状。肠道菌群是微生物组成的复杂生态系统, 通过调节新陈代谢、肠道屏障完整性和病原微生物的定植等, 参与营养不良、肥胖症、糖尿病等许多疾病的形成和发展及药物代谢, 环境变化、抗生素治疗、益生菌使用和昼夜节律等因素均会影响肠道菌群[7, 8]。研究表明, 疾病往往伴随肠道菌群组成和结构的变化, 如糖尿病患者肠道中变形杆菌、拟杆菌及肥胖症患者肠道中球形梭状芽孢杆菌、溶组织梭菌的相对丰度高于健康人群[9-11]。不同的病理生理条件使机体肠道微环境发生改变, 对微生物群落形成一定影响, 进而干扰微生物印记, 引发不同的肠功能障碍[12]。
肠道微环境的紊乱与低压性低氧息息相关, 然而在高原低氧环境下, 肠道微生物群落结构和多样性的变化目前尚未明确, 尤其是高原实地环境下探讨肠道菌群变化的研究鲜有报道。Zhang等[13]利用低压氧舱模拟5 km海拔, 初步探讨了小鼠肠道微生物群落的变化并对表型差异和基因功能进行预测。Sun等[14]分析了海拔4.1 km和1.5 km急性缺氧环境中大鼠肠道菌群物种组成和丰度变化, 表明高原急性缺氧是影响肠道菌群平衡的重要因素。上述研究没有考虑高原实地自然环境、海拔高度和缺氧时间的综合影响, 尚未全面阐明高原低氧环境对肠道菌群结构和多样性的影响。本实验利用实地高原环境, 通过16S rDNA高通量测序技术分析肠道菌群的变化, 探讨不同海拔环境及时间对肠道菌群结构和多样性的影响, 对明确肠道菌群与高原低氧的关系具有指导意义, 为进一步研究高原低氧条件下疾病的形成和发展及药物代谢提供理论依据。
材料与方法试剂 DNA提取试剂盒(广州美基生物科技有限公司, 批号: D3141), 琼脂糖(北京梦怡美商贸中心, 批号: A63882), KOD-Plus-系列高保真性聚合酶KOD-201 (日本Toyobo公司, 批号: 30050D5), Agencourt AMPure XP磁珠(美国Beckman Coulter公司, 批号: 14190330)。
仪器 pHS-25型酸度计(上海雷磁创益仪器有限公司), KQ-250DB型数控超声波清洗器(昆山市超声仪器有限公司), Nanodrop 2000c微量分光光度计(赛默飞世尔科技公司), DYCP-31A琼脂糖凝胶电泳仪(北京六一仪器厂公司), ABI StepOnePlus实时荧光定量PCR仪(赛默飞世尔科技公司), Qubit 3.0 (ThermoFischer Scientific公司), Illumina Hiseq 2500高通量测序仪(美国Illumina公司)。
实验动物 54只SPF级雄性SD大鼠, 6~8周龄, 体质量(180 ± 20) g, 由西安交通大学医学部实验动物中心提供, 许可证号: SCXK (陕) 2018-001。大鼠分别饲养于西安市、西宁市和玉树市称多县, 饲养室温度(22 ± 2) ℃, 湿度(55 ± 10) %, 日光光照明暗交替12 h, 自由饮食饮水, 保持垫料干燥。动物实验严格遵循青海大学医学院医学伦理委员会(批准号: 2017-15) 的规定。
动物分组及造模 大鼠随机分为平原对照组(P, 陕西省西安市, 海拔: 390 m, PaO2: 20 kPa)、中度海拔缺氧组(M, 平原大鼠运送至青海省西宁市, 海拔: 2 261 m, PaO2: 15.9 kPa) 和高度海拔缺氧组(H, 平原大鼠运送至青海省玉树市称多县, 海拔: 3 960 m, PaO2: 12.7 kPa) 3大组。中度、高度海拔缺氧组均分为3、7、15和30天4个小组, 大鼠分别在西宁市和称多县生活3、7、15和30天。
大鼠一般情况观察及粪便pH测定 观察大鼠的毛色、活动、饮食、粪便颜色、精神状态和死亡等情况, 无菌条件下收集新鲜粪便约0.5 g, 加入蒸馏水10 mL, 混匀后测定pH值。
小肠组织病理形态学测定 无菌环境下解剖大鼠, 观察小肠组织有无充血、渗血、肿胀等情况。取十二指肠下端3~5 cm处小肠组织, 用10%福尔马林溶液固定, 逐级酒精脱水、浸腊、包埋、切片, 常规HE染色, 光镜下观察组织病理学改变, 进行图像采集分析。
肠道菌群Illumina Miseq测序分析
大鼠粪便DNA的提取 无菌条件下收集大鼠粪便, 液氮保存。取粪便2 g至2 mL离心管中, 立即加入Buffer SSL溶液1.2 mL, 涡旋1 min。70 ℃水浴孵育10 min, 涡旋并离心, 取上清加入Proteinase K溶液20 μL和Buffer AL溶液250 μL, 颠倒混匀后再次置于70 ℃水浴孵育10 min, 加入无水乙醇250 μL, 将样品转移至DNA结合柱中过滤, 使DNA吸附于膜上, 加入Buffer GW1和Buffer GW2去除蛋白质和盐分等其他杂质, 10 000 ×g离心30 s后弃滤液, 加入Buffer AE至结合柱膜中央洗脱DNA, 随后使用Nanodrop 2000c微量分光光度计检测浓度和纯度。
PCR扩增 根据所选测序区域, 以稀释过的基因组DNA为模板, 粪便样本中获取的DNA用带有barcode的特异引物扩增16S rDNA的V3-V4区。341F序列: 5′-CCTACGGGNGGCWGCAG-3′; 806R序列: 5′-GGA CTACHVGGGTATCTAAT-3′, 然后进行PCR扩增, PCR反应体系30 μL, 第一轮扩增体系: KOD酶扩增体系50 μL; PCR反应条件: 94 ℃ 2 min, 98 ℃ 10 s, 62 ℃ 30 s, 68 ℃ 30 s (30个循环), 68 ℃ 5 min。第二轮扩增体系: KOD酶扩增体系50 μL; PCR反应条件: 94 ℃ 2 min, 98 ℃ 10 s, 65 ℃ 30 s, 68 ℃ 30 s (12个循环), 68 ℃ 5 min。PCR产物4 ℃保存, 用琼脂糖电泳检测PCR产物, 利用AMPure XP磁珠进行PCR产物纯化, 纯化后用Qubit 3.0进行定量分析。
文库定量及测序 AMPure XP磁珠对扩增产物进行纯化, qPCR进行定量, 利用高通量测序平台Illumina Miseq 2 500 bp的PE250模式“pooling”上机测定大鼠粪便中的肠道菌群。
生物信息学分析 利用Flash软件对原始数据进样质控, 得原始Tags数据, 过滤得到高质量的Tags数据, 去除嵌合体得有效数据, 采用Uparse软件对有效数据序列进行聚类, 序列以97%的一致性聚类成可操作分类单元(operational taxonomic unit, OTU)。利用Silva数据库对获得OTU的每个代表序列进行物种注释, 对大鼠肠道菌群的相对丰度、差异物种进行分析。采用Qiime软件和R语言Vegan包分析肠道菌群的Alpha多样性和Beta多样性, 利用Tax4Fun软件进行KEGG基因功能预测分析。
数据统计与分析 数据以均数±标准差(mean ± SD) 表示, 采用SPSS 13.0统计软件进行数据处理, 组间比较采用重复测量方差分析, 两两比较采用LSD法, P < 0.05表示差异具有统计学意义。
结果 1 大鼠一般情况观察及粪便pH值测定平原对照组和中度海拔缺氧组大鼠反应迅速、皮毛有光泽、未出现纳差, 但中度海拔缺氧组粪便变稀软。随低氧暴露时间延长, 高度海拔缺氧组大鼠出现反应迟钝、皮毛光泽减退、纳差和粪便较干等现象。
高原低氧环境下, 大鼠粪便pH值随低氧暴露时间延长总体呈降低趋势。与平原对照组相比, 中度海拔缺氧组大鼠粪便pH值在第3、7、15、30天分别显著降低了22.06%、9.09%、19.31%、16.24% (P < 0.01), 高度海拔缺氧组大鼠粪便pH值在第3、7、15、30天分别显著降低了21.25%、12.16%、19.82%、16.96% (P < 0.01), 见图 1。
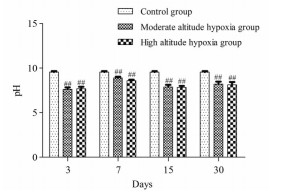
|
Figure 1 Effect of hypoxia on pH value of rat feces. ##P < 0.01 vs control group |
高原低氧环境对大鼠小肠组织具有一定的影响, 海拔越高对其损伤越明显。中度海拔缺氧组部分大鼠在第3、7天出现轻微肠胀气, 高度海拔缺氧组部分大鼠在第3、7、15天出现较严重的肠胀气。HE染色结果显示, 平原对照组大鼠小肠组织结构清晰, 上皮细胞排列整齐, 未见固有层及黏膜下层充血。中度海拔缺氧组大鼠小肠组织在第3天出现轻微损伤, 小肠组织固有层及黏膜下层毛细血管轻度扩张充血, 第7、15、30天基本恢复正常。高度海拔缺氧组大鼠小肠组织随低氧暴露时间延长在3、7、15、30天出现不同程度损伤, 其中以第7天损伤最为显著, 小肠固有层和黏膜下层毛细血管轻度扩张充血, 黏膜固有层轻度水肿, 淋巴管扩张, 如图 2。
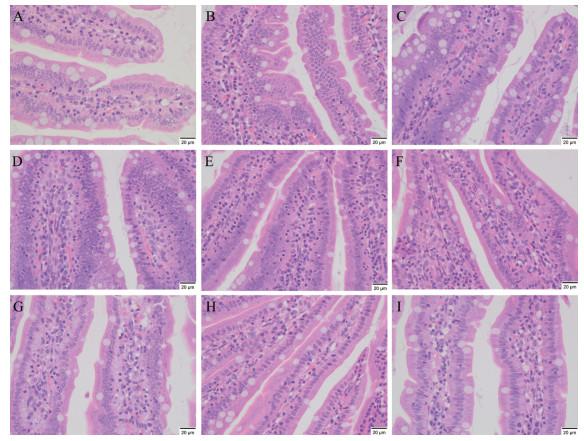
|
Figure 2 Effect of hypoxia on small intestine tissue of rats. A refers to the control group. B, C, D, E refer to the 3rd, 7th, 15th, 30th day of the moderate altitude hypoxia group, respectively. F, G, H, I refer to the 3rd, 7th, 15th, 30th day of the high altitude hypoxia group, respectively |
经过质控过滤得原始Tags数据共有6 649 340条序列, 平均每个样品有105 545 ± 5 155条序列, 高质量的Tags数据共有6 617 748条序列, 平均每个样品有105 044 ± 5 092条序列。去除嵌合体后得到有效数据共有6 207 346条序列, 平均每个样品有98 529 ± 6 082条序列。共聚类出103 532个OTU, 平均每个样品有1 643 ± 245个OTU。
在OTU水平对大鼠肠道菌群进行分析, 共注释出35个门、87个纲、205个目、337个科、638个属和256个种。随海拔升高, 肠道菌在各分类学层级的OTU水平的数量逐渐增加, 与平原对照组相比, 中度海拔缺氧组在门、纲、目、科、属和种水平分别高6、16、34、58、84和62个, 高度海拔缺氧组分别高9、40、89、121、257和113个, 提示肠道菌群在OTU水平数量的改变使高原低氧环境下大鼠肠道菌群丰富度和多样性发生变化, 见表 1。
| Table 1 Statistics of OTU annotations in three groups of rats |
高原低氧环境使大鼠肠道菌群群落结构及相对丰度发生显著改变。基于OTU注释结果分析大鼠肠道菌群相对丰度前十的物种, 在门分类水平相对丰度超过2%的菌门分别为厚壁菌门、拟杆菌门、疣微菌门。与平原对照组相比, 厚壁菌门相对丰度在中度海拔缺氧组第30天显著升高了47.07% (P < 0.05), 在高度海拔缺氧组第7天显著升高了41.31% (P < 0.05)。与平原对照组相比, 拟杆菌门相对丰度在中度海拔缺氧组第3天显著降低了36.69% (P < 0.05), 第15天显著升高了50.04% (P < 0.05)。与平原对照组相比, 疣微菌门相对丰度在中度海拔缺氧组第7、15、30天分别显著降低了90.57% (P < 0.01)、95.98% (P < 0.01)、98.79% (P < 0.01), 在高度海拔缺氧组第3、7、15、30天分别显著降低了98.92% (P < 0.01)、94.20% (P < 0.01)、68.89% (P < 0.05)、81.09% (P < 0.01), 如图 3A所示。
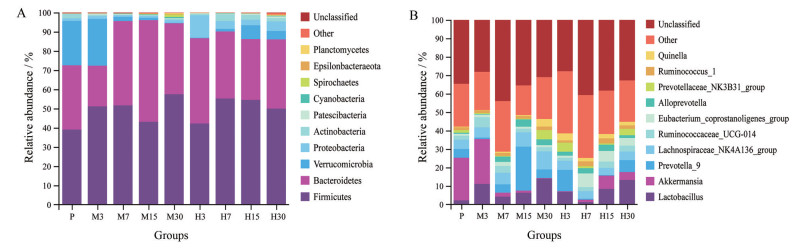
|
Figure 3 The histogram of community structure of intestinal flora in rats at the level of phylum (A) and genus (B). P refers to the control group. M3, M7, M15, M30 refer to the 3rd, 7th, 15th, 30th day of the moderate altitude hypoxia group, respectively. H3, H7, H15, H30 refer to the 3rd, 7th, 15th, 30th day of the high altitude hypoxia group, respectively |
在属分类水平肠道菌群相对丰度超过2%的菌属分别为阿克曼菌属、乳杆菌属、普氏菌属_9、毛螺菌属_NK4A136_group、瘤胃菌属_UCG_014。与平原对照组相比, 阿克曼菌属相对丰度在中度海拔缺氧组第7、15、30天分别显著降低了90.61% (P < 0.01)、95.97% (P < 0.01)、98.83% (P < 0.01), 在高度海拔缺氧组第3、7、15、30天分别显著降低了98.92% (P < 0.01)、94.20% (P < 0.01)、68.92% (P < 0.05)、81.47% (P < 0.01)。与平原对照组相比, 普氏菌属_9相对丰度在中度海拔缺氧组第15天显著升高了368.42% (P < 0.01), 在高度海拔缺氧组第7天显著降低了88.84% (P < 0.05)。与平原对照组相比, 乳杆菌属相对丰度在中度海拔缺氧组第3、7、30天分别显著升高了409.63% (P < 0.01)、90.83% (P < 0.01)、543.12% (P < 0.05), 在高度海拔缺氧组第30天显著升高了507.34% (P < 0.05), 如图 3B所示。
3.3 肠道菌群差异分析LEfSe分析显示, 平原对照组、中度海拔缺氧组和高度海拔缺氧组第15天的大鼠肠道差异菌相对丰度最高, 见图 4A、B。平原对照组有15个差异菌, 其中棒状杆菌目、棒状杆菌属_1、棒状杆菌科相对丰度较高。中度海拔缺氧组有9个差异菌, 其中理研菌科_RC9_ gut_group、拟杆菌目_RF16_group、瘤胃球菌属_2相对丰度较高。高度海拔缺氧组有19个差异菌, 其中瘤胃菌科、真细菌_coprostanoligenes_group、罗伊乳杆菌、Prevotellaceae_Ga6A1_group、红蝽菌目、红蝽菌纲、Eggerthellaceae、Atopobiaceae、另枝菌属、消化球菌科相对丰度较高。
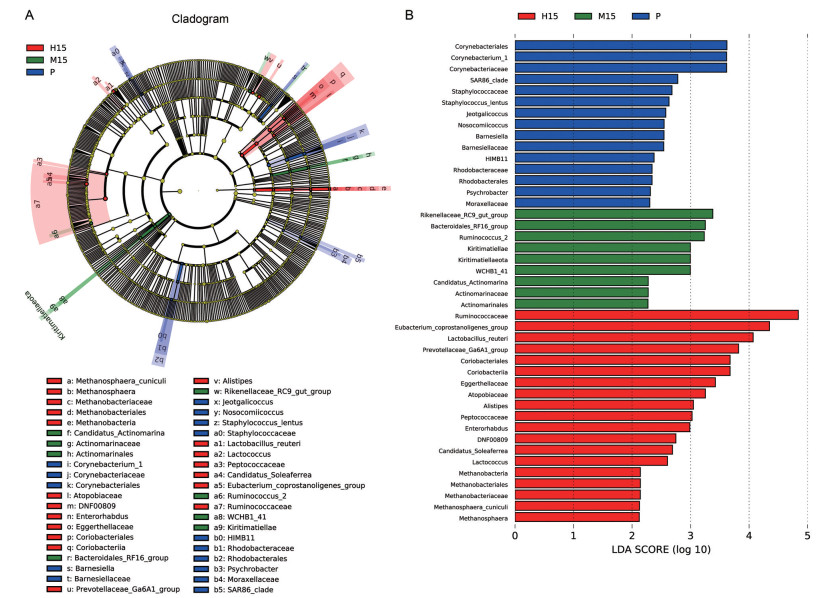
|
Figure 4 LefSe analysis of intestinal flora in the three groups of rats on the 15th day. P refers to the control group. M refers to the moderate altitude hypoxia group. H refers to the high altitude hypoxia group. Figure A shows the circle radiating from the inside to the outside represents the classification level from the boundary to the species, the diameter of the small circle is proportional to the relative abundance. Figure B shows the species with significant in rats intestinal flora. |
基于大鼠肠道菌群Alpha多样性指数绘制Shannon和Ace稀释曲线, 如图 5A、B所示。各组样本在第3、7、15、30天的稀释曲线趋于平缓, 表明测序量已达到饱和。曲线高度反应各组样本群落α多样性结构存在差异, 提示高度海拔缺氧组肠道菌群结构的均匀度和丰富度高于平原对照组和中度海拔缺氧组。
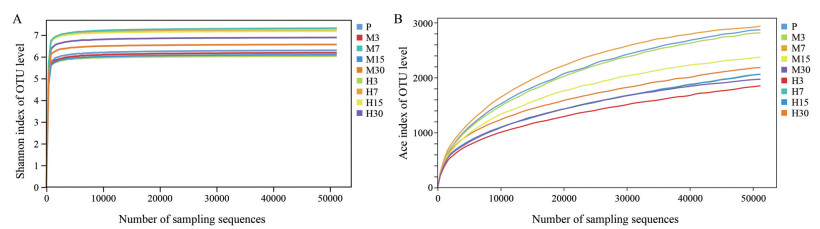
|
Figure 5 Dilution curve of Shannon index (A) and Ace index (B). P refers to the control group. M3, M7, M15, M30 refer to the 3rd, 7th, 15th, 30th day of the moderate altitude hypoxia group, respectively. H3, H7, H15, H30 refer to the 3rd, 7th, 15th, 30th day of the high altitude hypoxia group, respectively |
PCoA主坐标分析显示, 平原对照组和中度海拔缺氧组第3、7天样本相对聚集, 中度海拔缺氧组第15、30天样本呈聚集趋势, 高度海拔缺氧组第3、7、15、30天组样本相对聚集, 且三组大鼠肠道菌群组间差异较大, 见图 6。结果表明同组大鼠肠道菌群之间的相似性较高, 不同组大鼠肠道菌群之间的相似性较低, 提示高原低氧环境对大鼠肠道菌群的结构和丰度产生较大的影响。
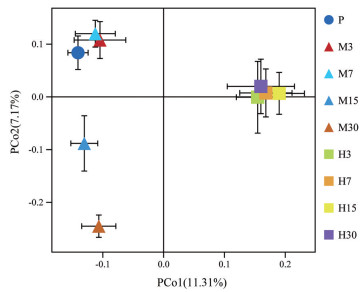
|
Figure 6 Principal component analysis of intestinal flora in three groups of rats. P refers to the control group. M3, M7, M15, M30 refer to the 3rd, 7th, 15th, 30th day of the moderate altitude hypoxia group, respectively. H3, H7, H15, H30 refer to the 3rd, 7th, 15th, 30th day of the high altitude hypoxia group, respectively. PCo1 and PCo2 represent the first and second principal components, respectively. The percentage of the principal component represents the contribution rate of this component to the sample difference. The closer the distance, the higher is the similarity |
通过KEGG功能丰度聚类分析, 各组大鼠肠道菌群的基因功能预测存在一定差异, 不同海拔及低氧暴露时间可能会影响与肠道菌群相关的某些代谢途径, 如图 7所示。平原对照组大鼠肠道菌群群落的预测功能主要为新陈代谢、细胞过程, 如次级胆汁酸生物合成、RNA聚合酶和DNA复制过程等。中度海拔缺氧组在第3、7、15、30天预测功能主要为细胞过程、药物相关代谢, 如基础转录因子调控、蛋白质运输和药物代谢酶调节等。高度海拔缺氧组大鼠在第3、7、15、30天预测功能主要为遗传信息处理、药物相关代谢, 如脂肪酸生物合成, 细胞色素P450对异生物素的代谢和磷酸戊糖途径等。本文分析揭示了在中度海拔缺氧环境中涉及MAPK信号通路表达、氧化磷酸化反应、泛酸和CoA生物合成和糖胺聚糖降解的基因功能表达升高。高度海拔缺氧环境中涉及MAPK信号通路表达、药物代谢-P450酶调节、磷酸戊糖途径的调控、脂肪酸生物合成和不饱和脂肪酸生物合成的基因功能表达升高, 这些代谢途径的变化可能有利于大鼠习服低氧环境, 从而使大鼠肠道菌群的某些生理代谢功能发生改变, 提示高原低氧环境下由肠道菌群介导的代谢途径的变化可能与机体健康息息相关。
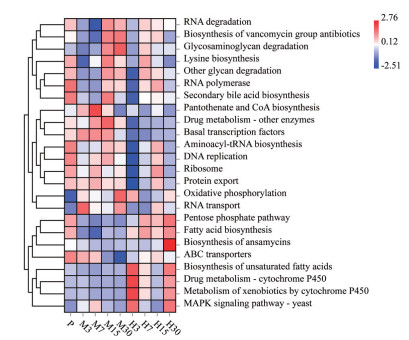
|
Figure 7 Prediction of gene function of intestinal flora of rats in hypoxia. P refers to the control group. M3, M7, M15, M30 refer to the 3rd, 7th, 15th, 30th day of the moderate altitude hypoxia group, respectively. H3, H7, H15, H30 refer to the 3rd, 7th, 15th, 30th day of the high altitude hypoxia group, respectively |
本研究以大鼠为实验动物模型, 严格控制实验条件, 有效地规避了遗传背景或饮食习惯[15, 16]等因素对研究结果的影响, 在高原实地环境通过对大鼠粪便pH值的测定、小肠组织形态学的观察以及16S rDNA高通量测序对大鼠粪便微生物群落的比较, 初步表明高原低氧环境对大鼠粪便微生物群有一定影响, 为进一步研究高原环境下疾病的形成机制和药物代谢提供参考依据。
大鼠进入高原后, 由于氧气稀薄、新陈代谢加快、体内瘦素增加[17]、抑制食欲的激素增多, 导致其食物摄入量减少、行动迟缓, 造成肠道蠕动减慢, 摄入食物营养吸收能力减弱, 使原本呈碱性的肠道内环境发生变化, 本研究发现高原环境下大鼠粪便pH值有所降低, 进一步证实高原低氧对肠道内环境的影响。van Welden等[18]报导高原低氧环境对大鼠小肠组织产生一定影响, 可引发肠黏膜层炎症和损伤, 为病原微生物的黏附和侵袭提供了机会, 本研究也发现高原低氧环境对大鼠小肠组织形态学造成一定损伤, 与前述研究结果一致。
大鼠肠道菌群测序结果表明, 在门和属分类水平以厚壁菌门和阿克曼菌属为第一优势菌群, 其中厚壁菌门中具有保护胃黏膜和改善肠道功能的鼠乳杆菌相对丰度较高, 表明低氧环境可能易于鼠乳杆菌的生存。研究[19]发现乳杆菌易于在低氧环境中定植, 本研究发现, 随低氧暴露时间延长, 大鼠肠道中的格氏乳杆菌和罗伊乳杆菌呈先降低后升高的趋势, 证实低氧条件下乳杆菌在肠道中容易存活, 提示高原低氧环境中大鼠肠道菌群可能通过调节益生菌来维持肠道内的相对平衡。Xu等[20]采用低压氧舱模拟7 000 m高原低氧环境, 发现大鼠低氧暴露5天后乳杆菌的相对丰度显著减少, 与本研究结果存在差异。本实验采用3 960 m和2 261 m的海拔高度, 有广泛的生物种群分布, 而低压氧舱主要模拟低氧, 不能真实体现高原实际环境, 且7 000 m为特高海拔, 机体生存的可能性很低, 上述原因可能导致与此研究结果不一致, 关于乳杆菌在不同海拔中如何变化还需进一步去证实。阿克曼菌属是疣微菌门的主要菌属之一, 与机体健康状况息息相关[21, 22], 可促进宿主天然和获得性免疫系统的发育, 调节肠道免疫, 控制肠道上皮细胞NKG2D配体的表达[23, 24]。本研究发现高原低氧环境阿克曼菌属相对丰度降低, Zhou[25]报道阿克曼菌属作为一种益生菌存在于机体, 但其相对丰度与炎症和代谢紊乱呈负相关, 与本研究的结果一致。由此, 推测高原低氧环境可能导致大鼠肠道屏障完整性受损以及肠道黏液减少, 进而减少阿克曼菌属的定植。
差异菌属的产生除了与环境相关外[26], 还可能与机体发育、生理状态、免疫力下降、肠损伤后产生的应激反应等有关[27, 28]。高原低氧环境使大鼠肠道差异菌明显增多, 益生菌、中性菌和致病菌的丰度也随之变化。肠道中的益生菌也可能与其他细菌混合成为中性菌或致病菌, 当致病菌数量多于益生菌时肠道微生态环境即会发生紊乱[29]。同时, 致病菌相对丰度的升高使益生菌难以发挥占位效应, 导致致病菌与肠道内黏膜结合, 加快生长和繁殖, 促进其向周围扩散[30], 从而引起肌肉、软组织感染和肠道疾病的发生。本研究发现高原低氧环境大鼠肠道致病菌如梭状芽孢杆菌_42_27、毛螺菌_28_4等相对丰度较高, 均大于1%, 这些差异菌可能会引发炎症, 加速高原疾病的进程。另枝菌属作为一种致病菌被认为与肠道炎症有关, 在慢性疲劳综合征、肠易激综合征中较为常见。Zhang等[13]探讨了低氧环境中小鼠粪便的菌群变化, 发现另枝菌属的相对丰度升高, 与本研究在大鼠体内的发现一致, 提示另枝菌属可能参与缺氧诱导的相关疾病形成与发展。
肠道微生态环境紊乱可产生诸多疾病[31-33], 而低氧环境下肠道菌群紊乱如何影响机体并进一步导致各种疾病尚不明确。肠道菌群基因功能预测分析结果表明, 肠道菌群结构和多样性的变化除受环境和时间影响外还受多种因素的影响, 如不同药物处理下群落功能类别及丰度发生很大变化, 还可能与膜运输、碳水化合物的代谢、氨基酸代谢和能量代谢等的变化有关[34, 35]。高原低氧环境使微生物群落的组成发生改变从而影响不同的代谢途径, 引起机体生理和代谢功能障碍。Westerterp[36]报道能量失衡与摄入量减少有关, 机体进入高原后需求量明显增加, 但摄入量供不应求, 导致能量进一步失衡。本研究结果显示, 高原低氧环境中参与碳水化合物消化、吸收以及能量代谢的肠道菌如乳杆菌的相对丰度增加, 表明肠道菌群可通过加快碳水化合物的消化吸收来提供人体的能量需求, 从而使因高原低氧导致的能量紊乱逐步趋于平衡。因此, 进一步明确高原低氧环境下肠道菌群的基因功能表征对探讨高原低氧与肠道菌群的关系具有指导意义。本研究还发现高原缺氧大鼠肠道菌群预测功能主要为遗传信息处理、细胞过程、药物相关代谢等, 作者前期研究已证实高原低氧影响药物代谢, 药物在高原环境中的代谢动力学特征发生显著改变, 体内代谢明显减慢, 药物代谢酶CYP450的活性和表达显著降低[37-42], 这为研究肠道菌群介导的高原低氧影响药物代谢的机制提供可能。本研究对象为实验大鼠, 人类与实验大鼠的肠道菌群的结构和多样性不尽相同, 因此低氧环境中人类肠道菌群的变化需要进一步探讨。此外, 低氧环境中大鼠肠道菌群的丰度差异导致不同的功能预测结果, 而肠道菌群如何参与不同代谢途径并发挥相应的作用, 其机制尚不明确, 应在分子生物学水平和细胞水平进一步研究。
作者贡献: 李向阳、刘贵琴、白雪参与实验的设计, 研究并收集了重要的背景信息, 撰写稿件并总结图表; 段雅彬、杨建鑫负责最终版本修订; 王倩、周杨为数据的获取、分析和统计提供了帮助; 朱俊博、顾文琦核对文献及数据。
利益冲突: 无任何利益冲突。
| [1] |
Bonkowsky JL, Son JH. Hypoxia and connectivity in the developing vertebrate nervous system[J]. Dis Model Mech, 2018, 11: dmm037127. DOI:10.1242/dmm.037127 |
| [2] |
Simon MC, Liu LP, Barnhart BC, et al. Hypoxia-induced signaling in the cardiovascular system[J]. Annu Rev Physiol, 2008, 70: 51-71. DOI:10.1146/annurev.physiol.70.113006.100526 |
| [3] |
Hocker AD, Stokes JA, Powell FL, et al. The impact of inflammation on respiratory plasticity[J]. Exp Neurol, 2017, 287: 243-253. DOI:10.1016/j.expneurol.2016.07.022 |
| [4] |
Hogberg N, Carlsson PO, Hillered L, et al. Intraluminal intestinal microdialysis detects markers of hypoxia and cell damage in experimental necrotizing enterocolitis[J]. J Pediatr Surg, 2012, 47: 1646-1651. DOI:10.1016/j.jpedsurg.2012.03.086 |
| [5] |
Longhi MS, Moss A, Jiang ZG, et al. Purinergic signaling during intestinal inflammation[J]. J Mol Med (Berl), 2017, 95: 915-925. DOI:10.1007/s00109-017-1545-1 |
| [6] |
Adak A, Maity C, Ghosh K, et al. Alteration of predominant gastrointestinal flora and oxidative damage of large intestine under simulated hypobaric hypoxia[J]. Z Gastroenterol, 2014, 52: 180-186. DOI:10.1055/s-0033-1336007 |
| [7] |
Shreiner AB, Kao JY, Young VB. The gut microbiome in health and in disease[J]. Curr Opin Gastroenterol, 2015, 31: 69-75. DOI:10.1097/MOG.0000000000000139 |
| [8] |
Willyard C. When drugs unintentionally affect gut bugs[J]. Nat Rev Drug Discov, 2018, 17: 383-384. DOI:10.1038/nrd.2018.88 |
| [9] |
Larsen N, Vogensen FK, van den Berg FW, et al. Gut microbiota in human adults with type 2 diabetes differs from non-diabetic adults[J]. PLoS One, 2010, 5: e9085. DOI:10.1371/journal.pone.0009085 |
| [10] |
Gomes AC, Hoffmann C, Mota JF. The human gut microbiota: metabolism and perspective in obesity[J]. Gut Microbes, 2018, 9: 308-325. |
| [11] |
Zhang FX, Wu WM, Deng ZY, et al. High altitude increases the expression of hypoxia-inducible factor 1α and inducible nitric oxide synthase with intestinal mucosal barrier failure in rats[J]. Int J Clin Exp Pathol, 2015, 8: 5189-5195. |
| [12] |
Possemiers S, Grootaert C, Vermeiren J, et al. The intestinal environment in health and disease: recent insights on the potential of intestinal bacteria to influence human health[J]. Curr Pharm Des, 2009, 15: 2051-2065. DOI:10.2174/138161209788489159 |
| [13] |
Zhang W, Jiao LF, Liu RX, et al. The effect of exposure to high altitude and low oxygen on intestinal microbial communities in mice[J]. PLoS One, 2018, 13: e0203701. DOI:10.1371/journal.pone.0203701 |
| [14] |
Sun YM, Zhang JH, Zhao AP, et al. Effects of intestinal flora on the pharmacokinetics and pharmacodynamics of aspirin in high-altitude hypoxia[J]. PLoS One, 2020, 15: e0230197. DOI:10.1371/journal.pone.0230197 |
| [15] |
Power SE, O'Toole PW, Stanton C, et al. Intestinal microbiota, diet and health[J]. Br J Nutr, 2014, 111: 387-402. DOI:10.1017/S0007114513002560 |
| [16] |
Li L, Zhao X. Comparative analyses of fecal microbiota in Tibetan and Chinese Han living at low or highaltitude by barcoded 454 pyrosequencing[J]. Sci Rep, 2015, 5: 14682-14692. DOI:10.1038/srep14682 |
| [17] |
Rausch LK, Hofer M, Pramsohler S, et al. Adiponectin, leptin and visfatin in hypoxia and its effect for weight loss in obesity[J]. Front Endocrinol (Lausanne), 2018, 9: 615-621. DOI:10.3389/fendo.2018.00615 |
| [18] |
van Welden S, Selfridge AC, Hindryckx P. Intestinal hypoxia and hypoxia-induced signalling as therapeutic targets for IBD[J]. Nat Rev Gastroenterol Hepatol, 2017, 14: 596-611. DOI:10.1038/nrgastro.2017.101 |
| [19] |
Xu H, Wang JQ, Cai J, et al. Protective effect of Lactobacillus rhamnosus GG and its supernatant against myocardial dysfunction in obese mice exposed to intermittent hypoxia is associated with the activation of Nrf2 pathway[J]. Int J Biol Sci, 2019, 1511: 2471-2483. |
| [20] |
Xu CL, Sun R, Qiao XJ, et al. Protective effect of glutamine on intestinal injury and bacterial community in rats exposed to hypobaric hypoxia environment[J]. World J Gastroenterol, 2014, 20: 4662-4674. DOI:10.3748/wjg.v20.i16.4662 |
| [21] |
Png CW, Linden SK, Gilshenan KS, et al. Mucolytic bacteria with increase prevalence in IBD mucosa augment in vitro utilization of mucin by other bacteria[J]. Am J Gastroenterol, 2010, 105: 2420-2428. DOI:10.1038/ajg.2010.281 |
| [22] |
Wang L, Christophersen CT, Sorich MJ, et al. Low relative abundances of the mucolytic bacterium Akkermansia muciniphila and Bifidobacterium spp. in feces of children with autism[J]. Appl Environ Microbiol, 2011, 77: 6718-6721. DOI:10.1128/AEM.05212-11 |
| [23] |
Everard A, Belzer C, Geurts L, et al. Cross-talk between Akkermansia muciniphila and intestinal epithelium controls diet-induced obesity[J]. Proc Natl Acad Sci U S A, 2013, 110: 9066-9071. DOI:10.1073/pnas.1219451110 |
| [24] |
Macchione IG, Lopetuso LR, Ianiro G, et al. Akkermansia muciniphila: key player in metabolic and gastrointestinal disorders[J]. Eur Rev Med Pharmacol Sci, 2019, 2318: 8075-8083. |
| [25] |
Zhou KQ. Strategies to promote abundance of Akkermansia muciniphila, an emerging probiotics in the gut, evidence from dietary intervention studies[J]. J Funct Foods, 2017, 33: 194-201. DOI:10.1016/j.jff.2017.03.045 |
| [26] |
Sommer F, Anderson JM, Bharti R, et al. The resilience of the intestinal microbiota influences health and disease[J]. Nat Rev Microbiol, 2017, 15: 630-638. DOI:10.1038/nrmicro.2017.58 |
| [27] |
Brown E, Taylor CT. Hypoxia-sensitive pathways in intestinal inflammation[J]. J Physiol, 2018, 596: 2985-2989. DOI:10.1113/JP274350 |
| [28] |
Vandenplas Y, Carnielli VP, Ksiazyk J, et al. Factors affecting early-life intestinal microbiota development[J]. Nutrition, 2020, 78: 110812. DOI:10.1016/j.nut.2020.110812 |
| [29] |
Wang H, Zhang W, Zuo L, et al. Intestinal dysbacteriosis contributes to decreased intestinal mucosal barrier function and increased bacterial translocation[J]. Lett Appl Microbiol, 2014, 58: 384-392. DOI:10.1111/lam.12201 |
| [30] |
Wu X, Vallance BA, Boyer L, et al. Saccharomyces boulardii ameliorates Citrobacter rodentium-induced colitis through actions on bacterial virulence factors[J]. Am J Physiol Gastrointest Liver Physiol, 2008, 294: G295-G306. DOI:10.1152/ajpgi.00173.2007 |
| [31] |
Gao XJ, Li T, Wei B, et al. Intestinal flora mediated changes and mechanisms of intestinal CYP3A and P-glycoprotein in rats with ulcerative colitis[J]. Acta Pharm Sin (药学学报), 2017, 52: 34-43. |
| [32] |
Li ZJ, Chen XG, Zhang S. The role of the intestinal microflora dysbiosis in chronic kidney disease[J]. Acta Pharm Sin (药学学报), 2020, 55: 2777-2784. |
| [33] |
Narula N, Kassam Z, Yuan Y, et al. Systematic review and meta-analysis: fecal microbiota transplantation for treatment of active ulcerative colitis[J]. Inflamm Bowel Dis, 2017, 23: 1702-1709. DOI:10.1097/MIB.0000000000001228 |
| [34] |
Roxas JL, Viswanathan VK. Modulation of intestinal paracellular transport by bacterial pathogens[J]. Compr Physiol, 2018, 82: 823-842. |
| [35] |
Wojtal KA, Cee A, Lang S, et al. Downregulation of duodenal SLC transporters and activation of proinflammatory signaling constitute the early response to high altitude in humans[J]. Am J Physiol Gastrointest Liver Physiol, 2014, 307: G673-G688. DOI:10.1152/ajpgi.00353.2013 |
| [36] |
Westerterp KR. Energy and water balance at high altitude[J]. News Physiol Sci, 2001, 16: 134-137. |
| [37] |
Li XY, Liu YN, Yuan M, et al. Effect of high altitude hypoxia on the activity and protein expression of drug metabolizing enzymes CYP2C9 and 2C19[J]. Acta Pharm Sin (药学学报), 2012, 47: 188-193. |
| [38] |
Li XY, Liu YN, Li YP, et al. Pharmacokinetics of sulfamethoxazole in healthy Han volunteers living at plain and in native Han and Tibetan healthy volunteers living at high altitude[J]. Acta Pharm Sin (药学学报), 2011, 46: 1117-1122. |
| [39] |
Zhang JL, Li XY. A review of drug metabolism under hypoxia environment at high altitude[J]. Acta Pharm Sin (药学学报), 2015, 50: 1073-1079. |
| [40] |
Li XY, Wang XJ, Li YP, et al. Effect of exposure to acute and chronic high-altitude hypoxia on the activity and expression of CYP1A2, CYP2D6, CYP2C9, CYP2C19 and NAT2 in rats[J]. Pharmacology, 2014, 93: 76-83. DOI:10.1159/000358128 |
| [41] |
Duan YB, Zhu JB, Yang JX, et al. Regulation of high-altitude hypoxia on the transcription of CYP450 and UGT1A1 mediated by PXR and CAR[J]. Front Pharmacol, 2020, 11: 574176. DOI:10.3389/fphar.2020.574176 |
| [42] |
Liu GQ, Li XY. Intestinal flora and drug metabolism under high altitude hypoxia conditions[J]. J Pharm Res (药学研究), 2019, 38: 714-718. |
 2021, Vol. 56
2021, Vol. 56


