2. 北京中医药大学东直门医院, 中医内科学教育部和北京市重点实验室, 北京 100700
2. Key Laboratory of Chinese Internal Medicine of Ministry of Education and Beijing, Dongzhimen Hospital, Beijing University of Chinese Medicine, Beijing 100700, China
中药延胡索为罂粟科Papaveraceae紫堇属Corydalis植物延胡索Corydalis yanhusuo W.T. Wang的干燥块茎, 生于低海拔的旷野草丛或缓坡林缘, 分布于河南南部、陕西南部、江苏、安徽、浙江、湖北等地[1]。其性温, 味辛、苦, 归肝、脾经, 具有活血散瘀, 理气止痛的功效[2]。延胡索常以醋制品入药, 在清代《药品辨义》中就有记载, 即“用醋炒治产后血晕, 暴血上冲, 胸膈胃气痛, 小腹肝气痛”。中医认为醋制能引药入肝, 增强疏肝、散瘀、止痛的功效[3]。现代药理研究表明醋制延胡索具有显著的镇痛、镇静、催眠作用, 以及对冠心病、心律失常、心肌缺血、肿瘤、高血压、胃溃疡等多种疾病有较好的临床效果[4, 5]。为了充分挖掘醋制延胡索中新型的活性成分, 本课题组对醋制延胡索水提取物的乙酸乙酯部位的化学成分进行了系统研究。在前期研究中, 发现了一系列新型异喹啉生物碱类化合物[6-8], 部分化合物具有选择性抑制羧酸酯酶2 (hCE2) 以及抑制PD-1/PD-L1结合的活性。本论文在前期研究基础上, 运用大孔吸附树脂、硅胶柱色谱、反相中压柱色谱、半制备高效液相色谱等分离纯化技术, 从乙酸乙酯部位剩余组分中分离获得1个新的通过亚甲二氧基方式连接的原小檗碱型对称二聚体生物碱, 通过UV、IR、HR-ESI-MS、1D NMR和2D NMR等多种波谱分析方法确定其结构, 并命名为双去氢紫堇碱A (bidehydrocorydaline A) (1)。化合物1可显著抑制LPS诱导小鼠巨噬细胞RAW 264.7释放NO, IC50值为2.33 ± 0.57 μmol·L-1, 强于阳性对照药吲哚美辛(IC50为34.9 ± 3.0 μmol·L-1)。此外, 对化合物1进行了肿瘤细胞毒活性测试, 发现化合物1对人肝癌细胞HepG2和宫颈癌细胞HeLa均未表现出明显的抑制活性(IC50 > 10 μmol·L-1); 在10 μmol·L-1浓度下, 化合物1对扑热息痛(APAP) 引起的肝细胞损伤未见明显保护活性。
结果与讨论 1 结构鉴定化合物1 黄色粉末。碘化铋钾显色后呈阳性, 初步判定化合物1属于生物碱类。UV λmax (CH3OH): 228、261、338和412 nm有吸收。IR光谱中显示含芳香环和双键结构片段(1 600、1 520、1 504和1 464 cm-1)。(+)-HR-ESI-MS除了给出准分子离子峰m/z [M-CF3COO-]+ (Calcd. for C43H44O8N2, 716.309 2), 还同时给出双电荷准分子离子峰m/z 358.155 1, 结合1H NMR和13C NMR数据确定其分子式为C43H44O8N2, 不饱和度为24。在1H NMR (600 MHz, DMSO-d6) 谱中, 显示出1组邻位偶合的芳环质子信号[δH 8.45 (d, J = 9.0 Hz) 和8.27 (d, J = 9.0 Hz)]、3个芳香或双键质子单峰信号(δH 9.89、7.40和7.18)、3个芳香甲氧基质子信号(δH 3.86、3.89和4.04)、1个与芳环相连的甲基单峰信号(δH 3.00)、1组邻位偶合的亚甲基质子信号[δH 3.14 (t, J = 6.0 Hz) 和4.83 (t, J = 6.0 Hz)] 以及1个与氧原子连接的亚甲基质子单峰信号(δH 6.48)。化合物1的13C NMR和DEPT谱, 只给出了22个碳信号, 其中芳香区有10个季碳信号(δC 150.9、147.2、146.7、145.5、144.1、137.1、134.8、132.0、129.9和128.1) 和5个叔碳信号(δC 121.4、121.0、119.0、114.4和111.0), 2个亚甲基碳信号(δC 26.8和56.8), 1个亚甲二氧基碳信号(δC 91.1), 3个甲氧基碳信号(δC 56.2、55.9和62.6) 和1个甲基碳信号(δC 17.8)。以上数据表明化合物1为一个高度对称的二聚体生物碱。进一步通过与从该植物中分离的去氢紫堇碱(dehydrocorydaline)[9]的NMR数据进行比较, 发现两个化合物的NMR数据非常相似, 主要差别是化合物1比去氢紫堇碱多了1个亚甲二氧基信号(δH 6.48; δC 91.1), 因此, 初步推断化合物1是通过亚甲二氧基连接的原小檗碱型对称二聚体生物碱(图 1)。
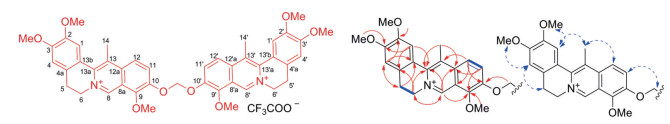
|
Figure 1 The structure (left), COSY (middle, blue bold lines), key HMBC (middle, red arrows), and key NOESY (right, blue double arrows) correlations of compound 1 |
为了准确确定化合物1结构, 特别是二聚体的连接位置, 对其进行了2D NMR实验, 并对其1H和13C信号进行了准确归属(表 1)。其中1H-1H COSY谱显示出H-5 (H-5') 和H-6 (H-6') 相关; H-11 (H-11') 和H-12 (H-12') 相关。在HMBC谱中H-1 (H-1') 与C-3 (C-3')、C-4a (C-4'a)、C-13a (C-13'a) 相关; H-4 (H-4') 与C-2 (C-2')、C-5 (C-5')、C-13b (C-13'b) 相关; H-5 (H-5') 与C-4 (C-4')、C-13b (C-13'b) 相关; H-6 (H-6') 与C-4a (C-4'a)、C-8 (C-8')、C-13a (C-13'a) 相关; H-11 (H-11') 与C-9 (C-9')、C-12a (C-12'a) 相关; H-12 (H-12') 与C-8a (C-8'a)、C-10 (C-10')、C-12a (C-12'a)、C-13 (C-13') 相关; H-8 (H-8') 与C-6 (C-6')、C-8 (C-8')、C-9 (C-9')、C-12a (C-12'a)、C-13a (C-13'a) 相关; H-14 (H-14') 与C-13 (C-13')、C-12a (C-12'a)、C-13a (C-13'a) 相关以及6个OMe分别与C-2 (C-2')、C-3 (C-3') 和C-9 (C-9') 相关, 确定了化合物1中去氢紫堇碱部分的结构片段, 并进一步得到化合物1的NOSEY谱的证实(图 1)。通过HSQC和DEPT谱, 确定C-15为-OCH2O-基团。在HMBC谱中, H-15只与C-10/10'相关, 因此确定了2个去氢紫堇碱片段通过C-15的亚甲二氧基相连。此外, 在NOESY谱中, H-15与H-11/11'相关也证实了上述推断(图 1)。由于在HPLC纯化过程中使用了三氟醋酸, 最后得到的是化合物1的三氟醋酸盐。综上所述, 确定化合物1为一个新的通过亚甲二氧基连接的原小檗碱型对称二聚体生物碱, 命名为双去氢紫堇碱A (bidehydrocorydaline A) (1)。
| Table 1 1H NMR and 13C NMR spectral data for compound 1. aNMR data (δ) were measured in DMSO-d6 at 600 MHz for 1H and 150 MHz for 13C. bNMR data (δ) were measured in CD3OD at 600 MHz for 1H and 150 MHz for 13C. Proton coupling constants (J) in Hz are given in parentheses. The assignments were based on 1H-1H COSY, HSQC, HMBC, and NOESY experiments |
采用Griess法考察化合物抑制LPS诱导小鼠巨噬细胞RAW 264.7释放NO能力, 结果表明, 化合物1可显著抑制LPS诱导小鼠巨噬细胞RAW 264.7释放NO, IC50值为2.33 ± 0.57 μmol·L-1, 强于阳性对照药吲哚美辛(IC50为34.9 ± 3.0 μmol·L-1)。同时, 化合物1对小鼠巨噬细胞RAW 264.7未表现出毒性作用(IC50 > 10 μmol·L-1)。此外, 对化合物1进行了肿瘤细胞毒活性测试, 发现化合物1对人肝癌细胞HepG2和宫颈癌细胞HeLa均未表现出明显的抑制活性(IC50 > 10 μmol·L-1); 在10 μmol·L-1浓度下, 化合物1对扑热息痛(APAP) 引起的肝细胞损伤未见明显保护活性。
实验部分紫外可见分光光度仪(JASCOJ-810型); 红外光谱仪(Nicolet impact 5700型傅里叶变换红外光谱仪); 核磁共振仪(Inova600核磁共振仪); 质谱仪(Agilent 1100 series LC/MSD-Trap-SL型); 100~200目硅胶(青岛胜海化工厂); 硅胶GF254薄层色谱板分析型(青岛海洋); 中压液相色谱仪(Büchi Gradient Former B-687, RpC18, 43-60 μm, Pharmacia); 制备液相色谱仪(创新通恒LC3000N高效液相色谱仪); 分析纯试剂(北京化工厂); 三氟醋酸(TFA, 购自安耐吉公司); 色谱纯试剂(乙腈、甲醇为美国Fisher公司生产); 四甲基偶氮唑盐(MTT, 购自Serva公司); 胎牛血清(购自Hyclone公司); 培养基DMEM (购自Gibco公司); 脂多糖(LPS, 购自Gibco公司); 吲哚美辛(购自MREDA公司); 双环醇(国家药品标准物质, 中国药品生物制品检定所); 五氟尿嘧啶(购自MCE公司); 4-乙酰基苯酚[APAP, 安耐吉化学, 萨恩化学技术(上海) 有限公司]; 青霉素-链霉素(PS双抗, 购自Coolaber公司); 二甲基亚砜[DMSO, 安耐吉化学, 萨恩化学技术(上海) 有限公司]; 康宁Corning-Costar 96孔细胞培养板(购自LUOBENDE公司); 酶标仪(BIORAD 550型)。
醋制延胡索药材于2015年购自浙江磐安药材市场, 经中国中医科学院许海玉研究员鉴定为延胡索Corydalis yanhusuo W. T. Wang的干燥块茎。
1 提取与分离醋制延胡索干燥块茎50 kg粉碎, 蒸馏水浸泡超声提取3次, 每次40 min, 水提后药渣用95%乙醇浸泡超声提取3次, 每次40 min。水提取液直接用大孔吸附树脂柱色谱分离, 用水、50%乙醇、95%乙醇依次洗脱, 洗脱液减压浓缩; 95%乙醇提取液浓缩至无醇, 加蒸馏水2 L, 用等体积乙酸乙酯萃取5次, 得乙酸乙酯相和水相。经减压回收有机溶剂后得乙酸乙酯部位YH-E (250.3 g)。YH-E进行硅胶柱色谱分离, 用二氯甲烷-甲醇体系梯度洗脱(200∶1, 150∶1, 100∶1, 50∶1, 25∶1, 10∶1), 流分经TLC检测合并, 最后得A~I组分。组分B (14.0 g) 进行分离, 经反相中压柱色谱, 甲醇-水(5∶95~95∶5) 梯度洗脱, 洗脱液经薄层色谱检测, 合并相同组分, 回收溶剂得到B1~B3组分。组分B1 (1.5 g) 经反相中压柱色谱, 甲醇-水(45∶55~50∶50~55∶45~60∶40~100∶0) 梯度洗脱, 洗脱液经薄层色谱检测, 合并相同组分, 回收溶剂得到B1-1~B1-4。组分B1-2 (750 mg) 经反相制备液相(Rp C18, 50%乙腈-水, 0.1% TFA, 254 nm, tR = 25.3 min) 得到化合物1 (5.5 mg)。
2 结构鉴定化合物1黄色粉末; UV (CH3OH) λmax (logε): 205 (4.32)、228 (4.31)、261 (4.41)、338 (4.32)、412 (3.75) nm; IR (cm-1): 3 423、3 095、2 947、2 848、1 685、1 600、1 520、1 504、1 464、1 412、1 374、1 277、1 204、1 133、1 104、1 022、957、830、803、721 cm-1; (+)-HR-ESI-MS m/z: 716.310 3 [M-CF3COO-]+ (Calcd. for C43H44O8N2, 716.309 2); 1H NMR (DMSO-d6和CD3OD, 600 MHz) 和13C NMR (DMSO-d6和CD3OD, 150 MHz) 数据见表 1。
3 活性测定 3.1 MTT法测定细胞活力采用MTT法[10]检测化合物1对RAW 264.7细胞的细胞活力。
3.2 抑制LPS诱导小鼠巨噬细胞RAW 264.7释放NO活性测定采用Griess法考察化合物抑制LPS诱导小鼠巨噬细胞RAW 264.7释放NO能力[11-13]。取生长状态良好且处于对数生长期的细胞, 将浓度为1×106 cell·mL-1的RAW 264.7细胞接种于96孔板内, 在37 ℃、5% CO2 培养箱中培养24 h。24 h后, 加入含有LPS (终浓度0.5 μg·mL-1) 不同药物浓度的培养基, 同时设空白组和LPS组, 于37 ℃、5% CO2培养36 h。36 h后, 取培养基上清, 加入Griess试剂, 测定540 nm处的吸光度。用浓度分别为0、2.5、5、10、25、50 μmol·L-1的NaNO2绘制标准曲线, 根据NaNO2标准曲线计算细胞培养上清液中NO2-的浓度以及对NO释放的抑制率, 抑制率I的计算公式为式1。
| $ {\rm{I}} = \frac{{{{\left[ {{\rm{NO}}_2^ - } \right]}_{{\rm{LPS}}}} - {{\left[ {{\rm{NO}}_2^ - } \right]}_{{\rm{LPS + 样品}}}}}}{{{{\left[ {{\rm{NO}}_2^ - } \right]}_{{\rm{LPS}}}} - {{\left[ {{\rm{NO}}_2^ - } \right]}_{\rm{空白}}}}} \times 100\% $ | (1) |
上述“3.2”实验中吸出上清液后剩余100 μL的培养板中, 去除培养基, 每孔加入0.5 g·L-1 MTT溶液100 μL, 继续培养2 h, 弃去上清液, 加入DMSO 100 μL充分溶解, 用酶标仪在检测波长570 nm测定吸光度, 细胞死亡率的计算公式按式2。
| $ 细胞死亡率\left( \% \right) = 1 - \frac{{给药组{\rm{OD}}平均值}}{{空白对照组{\rm{OD}}平均值}} \times 100\% $ | (2) |
采用MTT法检测化合物1对HepG2和HeLa细胞毒活性。
3.5 抗对乙酰氨基酚(APAP) 的肝癌HepG2细胞损伤的保肝活性[15]取对数生长期细胞HepG2, 消化后充分吹打成单细胞悬液, 计数后稀释成每毫升5×104个, 接种于96孔培养板中, 培养24 h后, 加入阳性药组、溶剂空白组及模型组(APAP终浓度12 mmol·L-1), 继续作用细胞48 h。用MTT法检测细胞存活率, 细胞存活率的计算按式3。
| $ 细胞存活率\left( \% \right) = \frac{{{\rm{O}}{{\rm{D}}_{\left( {{\rm{sample}}} \right)}} - {\rm{O}}{{\rm{D}}_{\left( {{\rm{control }}} \right)}}}}{{{\rm{O}}{{\rm{D}}_{\left( {{\rm{normal }}} \right)}} - {\rm{O}}{{\rm{D}}_{\left( {{\rm{control }}} \right)}}}} \times 100\% $ | (3) |
作者贡献: 林生负责提出研究选题和设计研究方案; 方冬杰负责实施过程和采集整理数据; 方冬杰、夏桂阳和夏欢负责设计论文框架、起草论文、修订论文; 王玲燕、孙彦斌负责调研整理文献; 林生负责获取研究经费、技术或材料支持、指导性支持。
利益冲突: 本研究不存在研究者、伦理委员会成员、受试者监护人以及公开研究成果有关的利益冲突。
| [1] |
Zhang XL, Qu Y, Wu LJ, et al. Chemical constituents from the bulb of Corydalis yanhusuo W.T. Wang[J]. J Shenyang Pharm Univ (沈阳药科大学学报), 2008, 25: 537-539. |
| [2] |
Han YQ, Xu J, Gong SX, et al. Chemical constituents and mechanism of Corydalis Rhizoma based on HPLC-QTOF/MS and G protein-coupled receptor analysis[J]. Acta Pharm Sin (药学学报), 2016, 51: 1302-1308. |
| [3] |
Li XF, Luo QH, Ren W. Comparative analysis of alkaloid content determinationand abirritation of Yanhusuo both before and after its preparation[J]. Hunan Guid J TCMP (湖南中医药导报), 2001, 7: 253-255. |
| [4] |
Yang XB, Liu Y, Yang X, et al. Study on chemical constituents from Corydalis Rhizoma in Pan'an[J]. Chin Tradit Herb Drugs (中草药), 2013, 44: 2200-2207. |
| [5] |
He K, Gao JL, Zhao GS. Advances in studies on chemistry, pharmacology, and quality control of Corydalis yanhusuo[J]. Chin Tradit Herb Drugs (中草药), 2007, 38: 1909-1912. |
| [6] |
Qiu BL, Wang LY, Xia GY, et al. Study on structural conversion of dihydrochelerythrine in different solvents[J]. China J Chin Mater Med (中国中药杂志), 2018, 43: 3315-3321. |
| [7] |
Xiao BB, Xia GY, Wang LY, et al. (±)-Bicoryanhunine A, dimeric benzylisoquinoline alkaloid atropo-enantiomers from Corydalis yanhusuo[J]. Tetrahedron Lett, 2020, 61: 151890. DOI:10.1016/j.tetlet.2020.151890 |
| [8] |
Wang LY, Qiu BL, Xia H, et al. Yanhusanines A-F, isoquinoline-derived alkaloid enantiomers from Corydalis yanhusuo and their biological activity[J]. J Nat Prod, 2020, 83: 489-496. DOI:10.1021/acs.jnatprod.9b01155 |
| [9] |
Shi JM, Han WL, Ye WC, et al. Phytochemical investigation of Corydalis yanhusuo[J]. Nat Prod Res Dev (天然产物研究与开发), 2011, 23: 647-651. |
| [10] |
Zheng YT, Ben KL. Use of MTT assay for the determination of cell viability and proliferation[J]. Immunol J (免疫学杂志), 1992, 8: 266-269. |
| [11] |
Xia L, Han ZZ, Tian T, et al. Study on chemical components of Forsythia suspense and their anti-inflammatory activities[J]. Shanghai J Tradit Chin Med (上海中医药杂志), 2019, 53: 85-92. |
| [12] |
Wu YQ, Huang YF, Luo D, et al. A new oleanane type triterpenoid from Viburnum taitoense Hayata[J]. Acta Pharm Sin (药学学报), 2019, 54: 1260-1264. |
| [13] |
Xia GY, Sun DJ, Ma JH, et al. (+)/(-)-Phaeocaulin A-D, four pairs of new enantiomeric germacrane-type sesquiterpenes from Curcuma phaeocaulis as natural nitric oxide inhibitors[J]. Sci Rep, 2017, 7: 43576. DOI:10.1038/srep43576 |
| [14] |
Lü XJ, Zhou SW. Effects of chaige shubiao granules on secretion of inflammatory factors from lipopolysaccharide-induced RAW264.7 cells[J]. Her Med (医药导报), 2018, 37: 1043-1047. |
| [15] |
Wang YJ, Wang DD, Zhang JH, et al. Isoquinolines from Corydalis tomentella from Tibet, China, possess hepatoprotective activities[J]. Phytochemisty, 2018, 155: 93-99. DOI:10.1016/j.phytochem.2018.07.010 |
 2021, Vol. 56
2021, Vol. 56


