2. 上海中药标准化研究中心, 上海 201203
2. Shanghai R & D Center for Standardization of Traditional Chinese Medicines, Shanghai 201203, China
吡咯里西啶生物碱(pyrrolizidine alkaloids, PAs) 是一类天然毒性物质, 广泛存在于菊科、豆科和紫草科等植物中, 可导致肝毒性、肺毒性和遗传毒性等[1]。近年来, 因服用菊科植物菊三七(Gynura japonica) 等含PAs的中草药所致肝窦阻塞综合征(hepatic sinusoidal obstruction syndrome, HSOS) 的报道逐年增多。菊三七含有多种PAs, 其中千里光碱(senecionine, SEN) 是菊三七中含量最高、毒性最强的一种PA, 其含量高达9.8 mg·g-1菊三七水提物[2]。研究表明, 大部分PAs需在肝脏经过细胞色素P450酶代谢活化, 产生活性中间体脱氢吡咯, 水解后与细胞蛋白非特异性结合形成吡咯蛋白加合物(pyrrole-protein adducts, PPAs), 继而诱发毒性[3]。
PAs致肝损伤的主要临床变化有: 腹胀、肝区疼痛、肝肿大、腹水和黄疸等。根据现有报道, 其机制可能与肝窦内皮细胞谷胱甘肽(glutathione, GSH) 的耗竭、一氧化氮损耗、基质金属蛋白酶(matrix metalloproteinases, MMPs) 表达上调、局部凝血系统激活及氧化应激等相关[4]。然而, 目前临床上主要采用对症支持治疗, 如多烯磷脂酰胆碱、异甘草酸镁和谷胱甘肽等, 或在有肝内胆汁淤积的情况下与熊去氧胆酸联用进行保肝治疗[5]。但重症患者死亡率高、预后不佳, 亟需寻找有效的治疗药物。
丹酚酸B (salvianolic acid B, Sal B) 是唇形科植物丹参(Salvia miltiorrhiza Bge.) 根和根茎中的主要水溶性活性物质, 具有抗凝血、抗氧化和抗炎等多种药理作用。有研究报道, 丹酚酸B可保护对乙酰氨基酚致小鼠急性肝损伤[6], 也能保护四氯化碳致大鼠肝纤维化[7]。亦有文献[8]报道了丹参对菊三七致小鼠实验性HSOS的保护作用。
因此, 本研究探讨丹酚酸B对千里光碱致小鼠肝损伤的保护作用, 并从抗凝血和抗炎等角度阐明其药效机制, 为临床治疗PAs致药源性肝损伤的治疗提供新的思路和理论依据。
材料与方法药品与试剂 千里光碱(批号: PRF8101624) 及丹酚酸B (批号: PRF10041802) 均购自成都普瑞法科技开发有限公司, 纯度均大于98%。RNA极速抽提试剂盒购于上海飞捷生物技术有限公司; 逆转录试剂盒及TB Green™预混液购自日本TAKARA公司; 引物购自上海冠泰生物科技有限公司; 还原型谷胱甘肽(GSH) 试剂盒和超氧化物歧化酶(superoxide dismutase, SOD) 试剂盒购自南京建成生物科技有限公司; 通用型组织固定液购于武汉赛维尔生物科技有限公司; RIPA及BCA蛋白定量试剂盒购自美国Thermo Fisher Scientific公司; 纤溶酶原激活物抑制因子1 (plasminogen activator inhibitor 1, PAI-1, 又称serpine1) 兔单克隆抗体(#ab222754)、MMP-9兔单克隆抗体(#ab228402) 和转化生长因子β1 (transforming growth factor-β1, TGF-β1) 兔单克隆抗体(#ab179695) 购自英国Abcam公司; 甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase, GAPDH) 兔单克隆抗体(#5174)、β-肌动蛋白(β-actin) 兔单克隆抗体(#4970)、信号转导和转录激活因子3 (signal transducer and activator of transcription 3, STAT3) 兔单克隆抗体(#30835)和705Tyr phospho-STAT3兔单克隆抗体(#9145) 购自美国Cell Signaling Technology公司; 辣根过氧化物酶标记山羊抗兔IgG购自美国Jackson ImmunoResearch公司。
实验仪器 QuantStudio 6 Flex型实时荧光定量PCR仪(Applied Biosystems, MA, USA), 低温高速离心机(HITACHI, Tokyo, Japan), 凝胶电泳仪及转印仪(Bio-Rad, CA, USA), 化学发光成像设备(GE, CT, USA), SparkTM多功能酶标仪(TECAN, Männedorf, CHE), 全自动生化分析仪(日和贸易有限公司, 上海, 中国), 光学数码显微镜(OLYMPUS, Tokyo, Japan), Shimadzu CBM-30 A高效液相色谱系统(Shimadzu, Kyoto, Japan) 连接ABSCIEX QTRAP6500质谱系统(AB SCIEX, CA, USA)。
实验动物 实验方案经上海中医药大学动物实验伦理委员会批准(伦理号: PZSHUTCM200717017), 所有程序均严格按照动物使用和护理的伦理原则进行。C57BL/6小鼠(雄性, 体重22 ± 2 g) 购自上海斯莱克实验动物有限责任公司[合格证号: SCXK (沪) 2017-0005], 饲养于上海中医药大学动物实验中心SPF级饲养室, 室温22 ± 1 ℃, 湿度60%~70%, 12 h昼夜交替, 可自由摄取食物和水。
药物配制 称取适量SEN, 用5%的盐酸水溶液溶解, 加入1 mol·L-1氢氧化钠调节至pH 6.5, 配制成浓度为5 g·L-1溶液。称取适量Sal B, 加生理盐水溶解, 配制成浓度为1 g·L-1溶液。
动物实验 适应性饲养1周后, 将30只小鼠随机分成空白对照组(control)、千里光碱模型组(SEN) 和丹酚酸B保护组(SEN + Sal B), 每组10只。模型组单次灌胃SEN (50 mg·kg-1); 丹酚酸B保护组每日1次灌胃Sal B (10 mg·kg-1), 连续给药第3天后2 h单次灌胃SEN (50 mg·kg-1), 并于第4天再次灌胃Sal B (10 mg·kg-1); 空白组小鼠每天灌胃相同体积生理盐水。SEN给药后48 h, 以异氟烷麻醉小鼠, 取血及肝脏用于后续实验分析, 造模前及取材前小鼠禁食不禁水过夜。
血清生化指标检测 全血室温静置2 h后于4 ℃下4 000 r·min-1离心15 min分离得到血清, 采用全自动生化分析仪检测血清中谷丙转氨酶(alanine aminotransferase, ALT) 和谷草转氨酶(aspartate aminotransferase, AST) 活力。
肝脏病理学检查 取小鼠肝脏最大叶中央区域肝脏(约0.5 cm×0.5 cm×0.5 cm) 于组织固定液中固定24 h, 进行脱水、石蜡包埋、切片、苏木精-伊红(hematoxylin and eosin, HE) 染色, 后将切片置于光学显微镜下观察肝脏损伤情况。
肝脏中GSH含量测定 称取小鼠肝脏约50 mg, 使用南京建成GSH含量测定试剂盒, 按照说明书操作, 测定小鼠肝脏中的GSH含量。
肝脏中超氧化物歧化酶SOD活力测定 称取小鼠肝脏约50 mg, 使用南京建成SOD测定试剂盒, 按照说明书操作, 测定小鼠肝脏中的SOD活力水平。
血清中PPAs含量的测定 参考课题组前期报道方法[9], 血清经硝酸银和Ehrlich试剂等进行衍生化前处理, 再以液相色谱-质谱联用技术进行检测。
逆转录-聚合酶链式反应分析 取小鼠肝脏约10 mg, 按照RNA极速抽提试剂盒说明书提取肝脏总RNA, 按照逆转录试剂盒步骤逆转录成cDNA, 使用实时定量基因扩增荧光检测系统(real-time quantitative PCR, RT-qPCR) 检测肝脏中相关mRNA的表达水平。以Gapdh为内参基因, 使用2-∆∆Ct法计算基因的相对表达量, 空白对照组设为1, 引物序列见表 1。
| Table 1 The primer sequences for real-time quantitative PCR. Gapdh: Glyceraldehyde-3-phosphate dehydrogenase; Hmox-1: Heme oxygenase 1; Stat3: Signal transducer and activator of transcription 3; Cxcl1: Chemokine (C-X-C motif) ligand 1; Gclc: Glutamate-cysteine ligase, catalytic subunit |
蛋白免疫印迹检测 取小鼠肝脏约50 mg, 用RIPA裂解液提取总蛋白, 采用BCA法测定蛋白浓度并调整至统一浓度, 并与上样缓冲液混合、高温变性。取30 μg总蛋白进行蛋白免疫印迹分析。使用Photoshop软件对蛋白条带图像进行灰度分析, 以目标蛋白与内参蛋白GAPDH或β-actin的比值作为蛋白的相对表达量, 空白对照组设为1。
统计学分析 实验结果均以均数±标准差(x±s) 表示, 采取GraphPad Prism 8.0统计软件中的学生t检验(student t test) 分析比较组间差异, P < 0.05表示差异具有统计学意义。
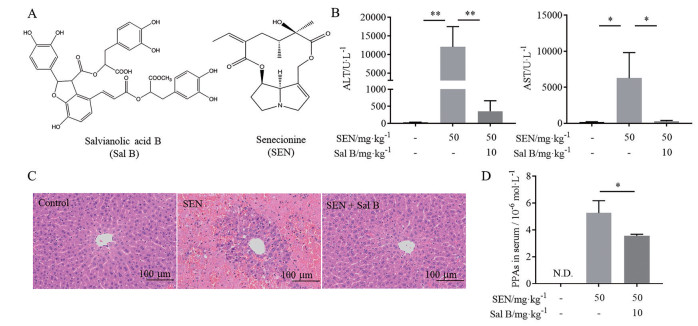
结果 1 丹酚酸B改善千里光碱致小鼠肝损伤SEN模型组小鼠给药24 h后活动减少, 精神畏缩, 毛发竖立; Sal B保护组小鼠精神状态良好, 无明显行为异常。由图 1可知, SEN模型组血清肝功能检测指标ALT和AST活力均显著升高(P < 0.01, P < 0.05), 而Sal B保护组中ALT和AST较模型组均明显下降(P < 0.01, P < 0.05)。空白对照组小鼠肝细胞排列整齐, 中央静脉及汇管区结构正常, 未出现病变现象; SEN组小鼠肝细胞大面积坏死, 细胞核固缩明显, 肝窦内有大量瘀血, 内皮细胞脱落; 而Sal B保护组小鼠肝脏未见明显的瘀血及肝细胞坏死。已有研究报道, PPAs在血清中的含量与肝损伤程度相关[10], Sal B能显著降低血清中PPAs含量(P < 0.05)。以上结果表明, Sal B能明显改善SEN致小鼠肝损伤。
|
Figure 1 Effect of salvianolic acid B (Sal B) on senecionine (SEN)-induced liver injury in mice. Mice were treated with Sal B (10 mg·kg-1) 3 days before and 1 day after the treatment of SEN (50 mg·kg-1), and sacrificed 48 h after SEN administration. A: Chemical structures of Sal B and SEN; B: Serum activities of alanine aminotransferase (ALT) and aspartate aminotransferase (AST); C: Hematoxylin and eosin staining of the liver; D: Concentration of pyrrole-protein adducts (PPAs) in serum. N.D.: Not detected. n = 10, x±s. *P < 0.05, **P < 0.01 |
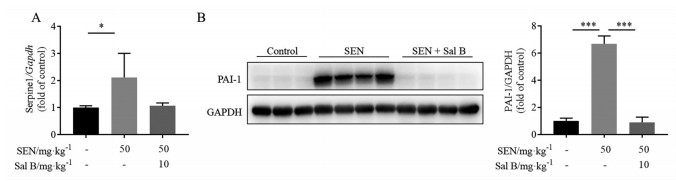
有文献[11]报道, PAI-1可以作为诊断HSOS及评价其预后的一个临床指标, 且相较于其他肝病患者, HSOS患者具有更高的PAI-1水平, 并与疾病严重程度相关。如图 2所示, SEN致损伤小鼠肝脏中PAI-1的mRNA及蛋白表达较空白组显著升高(P < 0.05, P < 0.001); 经Sal B干预后其蛋白表达显著下降(P < 0.001), mRNA水平也有下降趋势, 与空白对照组趋近一致, 提示Sal B可通过调节凝血系统改善SEN造成的小鼠肝损伤。
|
Figure 2 Sal B inhibited the activation of plasminogen activator inhibitor 1 (PAI-1). A: Hepatic mRNA expression of serpine1; B: Hepatic protein expression of PAI-1. n = 10, x±s. *P < 0.05, ***P < 0.001 |
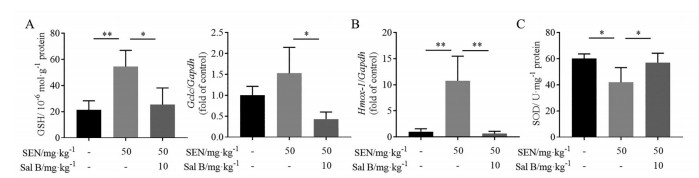
PAs经P450酶代谢后生成的活性中间体脱氢吡咯可与细胞内GSH结合, 生成GSH结合物从而快速排除。因此, 肝脏GSH抗氧化系统被认为是PAs肝毒性的一种防御机制[12]。研究表明, PAs肝损伤的动物肝脏内GSH含量升高, 是机体对抗外来毒物的自我调节[12]。如图 3A所示, 本研究中SEN模型组小鼠肝脏GSH较空白对照组显著上调, 其肝脏调节GSH合成的Gclc的mRNA表达水平也有上调趋势。Hmox-1是经典核因子E2相关因子2 (nuclear factor erythroid-2 related factor 2, Nrf2) 抗氧化通路中的一个重要的基因[13], 其表达在SEN模型组中也显著上调(图 3B)。Sal B保护组中, 肝脏GSH含量以及Gclc和Hmox-1的mRNA表达均较SEN模型组显著下调。超氧化物歧化酶SOD是机体内天然存在的超氧自由基清除因子, 如图 3C所示, Sal B保护组对SEN致肝损伤小鼠的肝SOD活力降低有显著逆转作用。这些结果提示, Sal B能通过调节氧化应激改善SEN致小鼠肝损伤。
|
Figure 3 Salvianolic acid B improved the oxidative stress. A: Glutathione (GSH) concentration and mRNA expression of glutamate-cysteine ligase, catalytic subunit (Gclc) in liver tissue; B: Hepatic mRNA expression of heme oxygenase 1 (Hmox-1); C: Superoxide dismutase (SOD) activity in liver tissue. n = 10, x±s. *P < 0.05, **P < 0.01 |
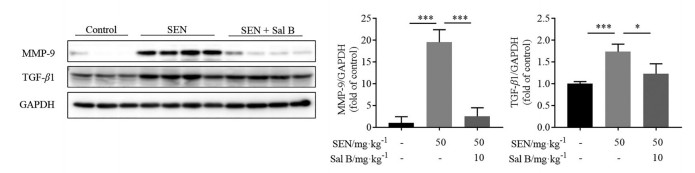
课题组前期研究[14]表明, TGF-β和炎症因子等肝纤维化相关因子的激活是菊三七致肝损伤的重要毒性机制。本研究中, SEN模型组肝脏MMP-9蛋白表达显著升高(图 4)。MMP-9的升高是PAs损伤的重要标志, Sal B保护组中其表达水平降低, 进一步证实其药效。此外, SEN组模型组小鼠肝脏中TGF-β1的蛋白表达升高(图 4)、STAT3的磷酸化显著增加(图 5A), Stat3及其下游靶基因Cxcl1的mRNA表达也显著上调(图 5B)。而Sal B保护组中以上变化均被逆转。以上数据表明, Sal B能够改善肝损伤, 并抑制SEN致肝纤维化相关因子的激活。
|
Figure 4 Sal B decreased the hepatic expression of matrix metalloproteinase 9 (MMP-9) and transforming growth factor-β1 (TGF-β1). n = 10, x±s. *P < 0.05, ***P < 0.001 |
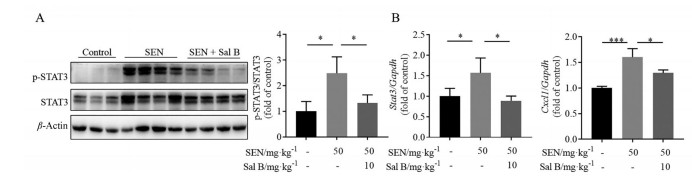
|
Figure 5 Sal B inhibited the activation of inflammation-related factors. A: Phosphorylation level of signal transducer and activator of transcription 3 (STAT3) in liver tissue; B: Hepatic mRNA expression of Stat3 and chemokine (C-X-C motif) ligand 1 (Cxcl1). n = 10, x±s. *P < 0.05, ***P < 0.001 |
近年来, 含千里光碱等PAs的中草药导致的药源性肝损伤事件引起了国内外的广泛关注。2017年中华医学会消化病学分会肝胆疾病协作组发布了针对PAs致临床HSOS的诊断和治疗指南[15], 极大地有利于该疾病的临床治疗; 然而, 目前临床尚无有效的治疗药物。有研究[16, 17]报道, 凝血系统的异常在HSOS病程中起重要作用。丹参是活血化瘀要药, 有文献[8]报道了丹参对菊三七致小鼠HSOS的保护作用, 但对其药效成分未有深入探讨。本研究表明, 丹酚酸B能显著降低千里光碱致肝损伤小鼠的血清ALT和AST活性, 并改善小鼠肝脏肝窦及内皮出血等病理状况。
HSOS患者由于肝窦内皮损伤后释放具有促凝活性的细胞因子如肿瘤坏死因子-α和白介素-1β, 刺激组织因子和PAI-1表达升高使机体处于高凝状态[16]。有文献[17]报道, 在HSOS模型小鼠中, PAI-1敲除的小鼠未表现出肝功能障碍或形成静脉血栓, 这表明PAI-1在肝静脉血栓中起到拮抗的作用, 可能成为治疗HSOS的一个靶标。有研究[18]指出, 丹酚酸B可以通过降低人脐静脉内皮细胞中PAI-1的表达来增加内皮细胞溶解纤维蛋白的能力。在本研究中, 丹酚酸B能显著降低千里光碱致肝损伤小鼠肝脏中PAI-1的表达, 提示丹酚酸B可调节抗凝系统而改善SEN致肝损伤。
此外, 丹参酸B还具有抗氧化、抗纤维化和抗炎等药理活性。大量文献[19]报道, PAs的毒性与谷胱甘肽的耗竭相关, Hmox-1的表达升高可能是一种细胞用来抑制炎症和减少细胞损伤的内源性防御机制。在本研究中, 千里光碱致肝损伤小鼠肝脏中GSH含量与Hmox-1的mRNA表达都显著升高, 与文献[13]报道相符; 而丹酚酸B调节机体抗氧化系统, 使其趋于正常。肝纤维化与细胞膜外基质(extracellular matrix, ECM) 的过度沉积、肝星状细胞的活化等密切相关。在本研究中, 丹酚酸B能通过下调MMP-9及TGF-β1在肝脏中的表达, 减少ECM的沉积并延缓肝纤维化进程。STAT3是调节机体免疫与炎症的一个重要的多功能因子, 可以被肝脏中的细胞因子、生长因子等激活。据报道, STAT3在不同类型的肝损伤中被激活从而导致机体的炎性反应。此外, 有研究称, 在由FOLFOX所导致的HSOS中, STAT3的激活与细胞衰老有关[20]。CXCL1能调控嗜中性粒细胞的释放, 有研究表明CXCL1能诱导中性粒细胞募集, 与血小板相互作用形成中性粒细胞胞外网状陷阱导致血栓, 从而促进门静脉高压的发生[21]。本研究表明, 丹酚酸B显著降低了小鼠肝脏中Stat3和Cxcl1的mRNA表达, 且抑制了STAT3的磷酸化, 说明丹酚酸B能够通过抑制机体的炎症反应, 从而减轻肝损伤。
综上所述, 中药丹参活性成分丹酚酸B对千里光碱致小鼠肝损伤有明显的保护作用, 其作用机制可能与调控凝血系统、调节氧化应激以及调控肝纤维化相关因子有关。本研究为临床上应用丹参和丹酚酸B治疗PAs肝损伤提供了理论依据。
作者贡献: 叶铉玲、杨莉和熊爱珍设计实验; 叶铉玲、姜凯元进行实验数据采集; 叶铉玲、熊爱珍和王峥涛撰写、修改论文。
利益冲突: 无利益冲突。
| [1] |
Li N, Xia QS, Ruan JQ, et al. Hepatotoxicity and tumorigenicity induced by metabolic activation of pyrrolizidine alkaloids in herbs[J]. Curr Drug Metab, 2011, 12: 823-834. DOI:10.2174/138920011797470119 |
| [2] |
Tang J, Hattori M. Pyrrolizidine alkaloids-containing Chinese medicines in the Chinese Pharmacopoeia and related safety concerns[J]. Acta Pharm Sin (药学学报), 2011, 46: 762-772. |
| [3] |
Ruan JQ, Yang MB, Fu P, et al. Metabolic activation of pyrrolizidine alkaloids: insights into the structural and enzymatic basis[J]. Chem Res Toxicol, 2014, 27: 1030-1039. |
| [4] |
Liu ZL, Fan ZP, Guo YS, et al. Clinical features, pathogenesis, and diagnosis and treatment of different types of hepatic sinusoidal obstruction syndrome[J]. J Clin Hepatol (临床肝胆病杂志), 2019, 35: 208-212. |
| [5] |
Zhuge YZ, Wang Y, Zhang F, et al. Clinical characteristics and treatment of pyrrolizidine alkaloid-related hepatic vein occlusive disease[J]. Liver Int, 2018, 38: 1867-1874. |
| [6] |
Lin M, Zhai XH, Wang GZ, et al. Salvianolic acid B protects against acetaminophen hepatotoxicity by inducing Nrf2 and phase Ⅱ detoxification gene expression via activation of the PI3K and PKC signaling pathways[J]. J Pharmacol Sci, 2015, 127: 203-210. |
| [7] |
Wang R, Yu XY, Guo ZY, et al. Inhibitory effects of salvianolic acid B on CCl4-induced hepatic fibrosis through regulating NF-κB/IκBα signaling[J]. J Ethnopharmacol, 2012, 144: 592-598. |
| [8] |
Yang L, Huo JR, Zhu HY, et al. Observation of Salvia miltiorrhiza on the prevention and treatment of Tusanqi-induced hepatic veno-occlusive disease in mice[J]. Chin Hepatol (肝脏), 2013, 18: 105-107. |
| [9] |
Chen Y, Xiong F, Wang WQ, et al. The long persistence of pyrrolizidine alkaloid-derived pyrrole-protein adducts in vivo: kinetic study following multiple exposures of a pyrrolizidine alkaloid containing extract of Gynura japonica[J]. Toxicol Lett, 2020, 323: 41-47. |
| [10] |
Chen Y, Wang XJ, Xiong F, et al. Kinetic study of pyrrolizidine alkaloid-derived pyrrole-protein adducts in rats after intragastric administration of Gynura japonica[J]. Acta Pharm Sin (药学学报), 2020, 55: 473-477. |
| [11] |
Lee JH, Lee KH, Lee JH, et al. Plasminogen activator inhibitor-1 is an independent diagnostic marker as well as severity predictor of hepatic veno-occlusive disease after allogeneic bone marrow transplantation in adults conditioned with busulphan and cyclophosphamide[J]. Br J Haematol, 2002, 4: 1087-1094. |
| [12] |
Liang QN, Sheng YC, Jiang P, et al. The gender-dependent difference of liver GSH antioxidant system in mice and its influence on isoline-induced liver injury[J]. Toxicology, 2011, 280: 61-69. |
| [13] |
Huang ZL, Jing XQ, Sheng YC, et al. (-)-Epicatechin attenuates hepatic sinusoidal obstruction syndrome by inhibiting liver oxidative and inflammatory injury[J]. Redox Biol, 2019, 22: 101117. |
| [14] |
Zhang F, Zhou Y, Yang X, et al. Gynura Rhizoma containing pyrrolizidine alkaloids induces the hepatic sinusoidal obstruction syndrome in mice via upregulating fibrosis-related factors[J]. Acta Pharmacol Sin, 2019, 40: 781-789. |
| [15] |
Expert consensus on diagnosis and treatment of pyrrolidine alkaloids-related sinusoidal obstruction syndrome (2017, Nanjing)[J]. J Clin Hepatol (临床肝胆病杂志), 2017, 33: 1627-1637.
|
| [16] |
Pihusch V, Pihusch M, Penovici M, et al. Transforming growth factor beta-1 released from platelets contributes to hypercoagulability in veno-occlusive disease following hematopoetic stem cell transplantation[J]. Thromb Res, 2005, 116: 233-240. |
| [17] |
Smith LH, Dixon JD, Stringham JR, et al. Pivotal role of PAI-1 in a murine model of hepatic vein thrombosis[J]. Blood, 2006, 107: 132-134. |
| [18] |
Shi CS, Huang HC, Wu HL, et al. Salvianolic acid B modulates hemostasis properties of human umbilical vein endothelial cells[J]. Thromb Res, 2007, 119: 769-775. |
| [19] |
Origassa CS, Camara NO. Cytoprotective role of heme oxygenase-1 and heme degradation derived end products in liver injury[J]. World J Hepatol, 2013, 5: 541-549. |
| [20] |
Robinson SM, Mann J, Vasilaki A, et al. Pathogenesis of FOLFOX induced sinusoidal obstruction syndrome in a murine chemotherapy model[J]. J Hepatol, 2013, 59: 318-326. |
| [21] |
Hilscher MB, Sehrawat T, Arab JP, et al. Mechanical stretch increases expression of CXCL1 in liver sinusoidal endothelial cells to recruit neutrophils, generate sinusoidal microthombi, and promote portal hypertension[J]. Gastroenterology, 2019, 157: 193-209. |
 2021, Vol. 56
2021, Vol. 56


