2. 延边大学药学院, 吉林 延吉 133002
2. College of Pharmacy, Yanbian University, Yanji 133002, China
淀粉样蛋白的错误折叠和异常沉积会诱发多种疾病[1]。例如, 阿尔茨海默症(Alzheimer's disease, AD)、帕金森病和2型糖尿病分别是由淀粉样β蛋白(amyloid-β protein, Aβ)、α-突触核蛋白和人胰岛淀粉样多肽的错误折叠和聚集所引起[2-4]。其中Aβ是淀粉样β前体蛋白在β分泌酶和γ分泌酶错误切割下产生的[5]。由于γ分泌酶的酶切位点不确定, 所以会产生多种类型的Aβ变异体。其中, Aβ40和Aβ42是两种最常见的变异体。Aβ在病理条件下易自聚形成纤维, 这种聚集的纤维沉积在大脑中可导致神经细胞损伤和死亡, 进而导致AD[6, 7]。因此, 开发可抑制Aβ聚集和解聚Aβ聚集物的药物是治疗AD的潜在手段之一。
目前, 已发现的抑制剂种类主要为小分子化合物[8-11]、短肽[12, 13]、蛋白[14]和纳米材料[15-17]等。由于小分子抑制剂具有结构简单、易于修饰等优势被广泛研究。目前已开发出姜黄素[18]、利福平[19]和茶多酚[(-)-epigallocatechin gallate, EGCG)][20]等。其中, 托卡朋是一种含有硝基苯酚基团的化合物, 能穿过血脑屏障, 前期研究发现它能够抑制淀粉样蛋白的纤维化[21], 并降低Aβ42诱导的细胞毒性, 但是托卡朋具有肝毒性等缺点[22]。进一步研究发现, 托卡朋的肝毒性主要由其侧链在代谢过程中产生的一种亚醌类化合物所引起, 这种化合物能破坏线粒体内的电子传递, 进而破坏细胞, 因此, 对其侧链结构的改造可能达到降低其肝毒性的作用。例如, Silva等[23]经过结构改造发现了一种与托卡朋结构类似的化合物苯乙基(E)-2-氰基-3-(3, 4二羟基-5-硝基苯)-丙烯酸酯[phenethyl (E)-2-cyano-3-(3, 4 dihydroxy-5-nitrobenzene)-acrylate, PCDNA]。结果表明, PCDNA不仅具有托卡朋类似的药理作用[24], 且毒性较低, 但是关于PCDNA对Aβ42的抑制作用尚未见报道。
本研究采用硫磺素T (thioflavin T, ThT) 和原子力显微镜(atomic force microscopy, AFM) 实验研究了PCDNA对Aβ42纤维化过程的抑制作用, 并检测了PCDNA对Aβ42诱导的细胞毒性的抑制作用。随后研究了PCDNA对成熟Aβ42纤维的解聚作用。最后, 运用分子对接技术研究了PCDNA与Aβ42五聚体相互作用的分子机制。
材料与方法材料 人源Aβ42 (纯度为95%) 购于上海吉尔生化公司; 苯乙基(E)-2-氰基-3-(3, 4二羟基-5-硝基苯)-丙烯酸酯(PCDNA, 纯度99%) 由延边大学利用有机合成方法获得; 氢氧化钠(NaOH)、[3-(4, 5-二甲基-2-噻唑基)-2, 5-二苯基-2H-溴化四唑] (MTT)、ThT、六氟异丙醇(hexafluoroisopropanol, HFIP) 和DMSO购于Sigma公司; RPMI1640培养基、胎牛血清及一些细胞培养用品购自Gibco公司。
仪器 SpectraMax M2型酶标仪(奥地利Molecular Devices公司); BX53荧光显微镜(日本奥利巴斯公司); 多模8AFM (美国Bruker公司)。
蛋白预处理 Aβ42具有非常强的疏水性, 存储过程极易发生聚集沉淀, 因此使用六氟异丙醇打散已有聚集体。具体方法: 称取一定量Aβ42溶于六氟异丙醇使其终浓度为1 mg·mL-1, 4 ℃静置2 h, 超声20 min, 1.6×104 r·min-1离心20 min, 除去已形成的聚集物, 离心后取上清分装于1.5 mL EP管中, -80 ℃冻实, 冻干机冻干后于-20 ℃储存。
溶液配制 称取PCDNA溶于磷酸盐缓冲液(phosphate buffer saline, PBS), 配成4 mmol·L-1储液, 吸取适量储液, 用PBS稀释成500 μmol·L-1溶液备用; 称取NaOH溶于去离子水, 配为20 mmol·L-1储液; 称取ThT溶于100 mmol·L-1 PBS, 配为275 μmol·L-1储液。
Aβ42聚集动力学实验 取冻干蛋白加入20 mmol·L-1 NaOH溶解, 超声20 min, 1.6×104 r·min-1离心20 min。为进一步去掉已形成的聚集体, 仅取75%上清, 用Nano Drop2000检测蛋白浓度, 用20 mmol·L-1 NaOH制备成浓度为275 μmol·L-1储液。将蛋白和ThT用PBS稀释为25 μmol·L-1终浓度, PCDNA终浓度为1、3、10和30 μmol·L-1, 置于96孔全黑板中, 每孔体积为200 μL, 37 ℃、250 r·min-1培养, 激发波长440 nm, 发射波长480 nm, 每隔1 h检测荧光强度的变化。每个浓度设置3个平行, 重复3次。
AFM实验 将ThT实验获得的相同实验样品滴加到云母片中孵育10 min。用双蒸馏水冲洗云母片, 过夜晾干。用多模8AFM、硅探针进行测试。测试参数: Model Scanasyst-Air: 115 m悬臂; 齿尖圆角半径: 2 nm; 弹簧常数: 0.4 N·m-1; 共振频率: 70 Hz。在AFM扫描过程中, 设置扫描大小为2 μm×2 μm, 分辨率为512行。所有AFM图像使用Nanoscope analysis 1.8软件(Bruker公司) 进行分析。
MTT实验 使用PC12细胞检测Aβ42聚集体的细胞毒性。PC12细胞于RPMI1640培养基(含10%胎牛血清) 在37 ℃、5% CO2条件培养。将PC12细胞以每毫升5×104个的密度接种到96孔细胞培养板培养24 h后, 将与不同浓度PCDNA (1、3、10和30 μmol·L-1) 培养24 h的Aβ42或单纯培养的Aβ42吸取10 μL加入细胞中, 孵育48 h, 加入10 μL 5 mg·mL-1 MTT培养4 h, 去除培养基, 每孔加入100 μL DMSO, 于570 nm处测吸光度。每个浓度设4个平行, 重复3次。
FDA/PI (fluorescien diacetate/propidium iqdide) 染色实验 将2 mL PC12细胞以每毫升5×104个的密度接种于6孔板, 培养24 h, 加入预培养好的蛋白共孵育48 h, FDA/PI染色1 min, 吸出染色液并加入PBS, 用BX53显微镜观察并拍照。用软件Image J分析PI染色后荧光强度来定量细胞毒性。
解聚实验 取冻干蛋白进行与聚集动力学实验相同的处理, 首先将Aβ42与ThT (终浓度均为25 μmol·L-1) 于37 ℃、250 r·min-1培养24 h至纤维成熟, 再加入不同浓度PCDNA (1、3、10和30 μmol·L-1), 每小时检测荧光强度变化。每个浓度设3个平行, 重复3次。
分子对接实验 应用Vina[25]软件研究抑制剂PCDNA与Aβ42五聚体(PDB ID: 5OQV[26]) 之间的相互作用。分子对接的格点间距被设为1 Å, 同时使其格点中心位于x = 39.632, y = 58.128, z = 52.583。此外, 格点参数设为40 Å×50 Å×35 Å, 对接所得构象数为20。使用软件VMD[27]和Discovery Studio Visualizer-2018分析PCDNA与Aβ42五聚体之间的相互作用。
数据分析 数据采用GraphPad Prism 6统计软件进行统计分析及作图, 计量资料用x±s表示, 显著性差异比较采用t检验法进行, 以P < 0.05为差异具有统计学意义。
结果与讨论 1 PCDNA抑制Aβ42纤维化ThT荧光分子能特异性与淀粉样蛋白中的β-折叠结构结合, 并在440 nm激发波长下, 于480 nm处发射较强的荧光[28, 29]。与之相反, ThT在自由状态下基本不发荧光。因此, 本研究用ThT荧光检测方法研究PCDNA对Aβ42纤维化的抑制作用。在不存在PCDNA时(图 1), Aβ42聚集过程基本没有延迟期, 可在10 h内迅速聚集而到达平台期, 该结果与前期研究结果类似[30]。当溶液中存在低浓度(如1和3 μmol·L-1) 的PCDNA时, PCDNA对Aβ42的快速增长期和平台期并没有明显抑制作用。当PCDNA浓度继续增加, 每时刻的ThT荧光值均比不含抑制剂的溶液的荧光值低, 说明PCDNA对Aβ42纤维化的抑制作用呈浓度依赖性。例如, 10和30 μmol·L-1 PCDNA分别会使其荧光强度降低至纯Aβ42荧光强度的45%和10%。上述研究结果表明, PCDNA可以抑制Aβ42的纤维化过程。
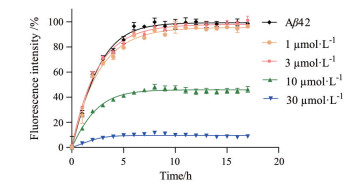
|
Figure 1 Phenethyl (E)-2-cyano-3-(3, 4-dihydroxy-5-nitrobenzene)-acrylate (PCDNA) inhibits amyloid-β protein (Aβ)42 fibrillogenesis was tested by using thioflavin T (ThT) fluorescence assay. The concentration of Aβ42 is 25 μmol·L-1 |
为了研究PCDNA对Aβ42聚集形态的影响, 利用AFM法观察了单纯Aβ42和PCDNA与Aβ42共培养时的Aβ42的聚集形态(图 2)。EGCG是一种已知Aβ42抑制剂, 可有效抑制Aβ42形成纤维, 因此本研究选择EGCG作为阳性对照药物。从图 2A可以看出, 单纯Aβ42培养24 h后会聚集形成长短不一的纤维, 这与前期结果一致[30]。但当与30 μmol·L-1 PCDNA共孵育时, Aβ42聚集形态发生显著变化(图 2B)。将30 μmol·L-1 EGCG与Aβ42共孵育24 h, 观察Aβ42的聚集形态(图 2C)。对比30 μmol·L-1 EGCG与30 μmol·L-1 PCDNA处理后的Aβ42聚集状态, 发现这两种药物都能使Aβ42的聚集形态发生显著变化, 不仅没有形成纤维, 而是形成一种不规则的低聚物, 这表明PCDNA能够抑制Aβ42纤维的形成。结合ThT和AFM实验结果, 进一步说明PCDNA可以抑制Aβ42的纤维化。

|
Figure 2 Inhibitory effect of PCDNA validated using atomic force microscopy (AFM) assay. A: Pure Aβ42; B: Aβ42 was co-cultured with 30 μmol·L-1 PCDNA; C: Aβ42 was co-cultured with 30 μmol·L-1 (-)-epigallocatechin gallate (EGCG). Scale bar: 400 nm |
脑内异常聚集的Aβ42聚集体会诱导神经细胞的死亡, 进而引起AD[2]。为了检测PCDNA对Aβ42聚集体诱导的PC12细胞毒性的影响, 本研究同时采用MTT实验(图 3) 和FDA/PI双染色实验(图 4) 两种方法检测。PBS对照组细胞活性设定为100%。由图 3可知, 与Aβ42聚集体共孵育的细胞存活率仅为55%, 表明Aβ42聚集体有显著细胞毒性。而与1、3、10和30 μmol·L-1 PCDNA共培养的Aβ42聚集物共孵育时, PC12细胞存活率分别为64%、66%、72%和75%, 表明PCDNA对Aβ42聚集体细胞毒性的抑制作用呈浓度依赖性, 即PCDNA抑制Aβ42聚集体对细胞毒性的能力随着其浓度的增加而增加。

|
Figure 3 PCDNA greatly protects PC12 cells from Aβ42-induced cytotoxicity which examined by the MTT assay. Phosphate buffer saline (PBS) was used as control (ctrl), and 0, 1, 2, 3, 4 represent PC12 cells co-incubation with mature Aβ42, Aβ42 co-cultured with 1, 3, 10, and 30 μmol·L-1 PCDNA, respectively. n = 4, x±s. ###P < 0.001 vs ctrl; **P < 0.01, ***P < 0.001 vs group 0 |
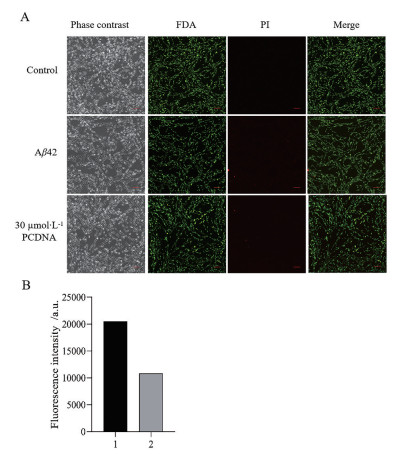
|
Figure 4 Fluorescien diacetate/propidium iqdide (FDA/PI) staining analysis of the effect of Aβ42 on PC12 cells. A: Cell viability of PC12 cells induced by Aβ42 aggregation species with or without 30 μmol·L-1 PCDNA as characterized by the FDA/PI staining assay, control was PBS buffer. Scale bar: 100 μm; B: The fluorescence quantification of PI staining in A. The number 1 and 2 represent the fluorescence intensities of Aβ42 alone and Aβ42 treated with 30 μmol·L-1 PCDNA, respectively |
为进一步验证PCDNA对Aβ42聚集体诱导的细胞毒性的抑制作用, 随后进行了FDA/PI双染色法检测实验(图 4)。FDA染料可进入活细胞内, 并在内酯酶催化下水解二乙酸酯基团, 从而产生高强度荧光; PI是一种可对DNA染色的细胞核染色试剂, 用于检测细胞凋亡。因此, 常用FDA和PI染料分别检测活细胞和死细胞含量。由图 4A可知, PBS组细胞生长状态较好, 且绿色荧光较强, 基本没有红色荧光。纯Aβ42组细胞的绿色荧光减弱, 同时出现较多红色荧光。这表明Aβ42聚集体有较强的细胞毒性, 与前期研究结果一致。而与30 μmol·L-1 PCDNA共培养的Aβ42组的细胞的绿色荧光较强, 同时红色荧光信号变弱。为了进一步研究PCDNA抑制Aβ42聚集体诱导的细胞凋亡情况, 对图 4A中PI处理后的荧光进行了定量分析(图 4B)。加入30 μmol·L-1 PCDNA, PI染色的荧光强度降低。综上所述, PCDNA可以有效降低Aβ42聚集体诱导的细胞毒性。
3 PCDNA解聚成熟的Aβ42为低毒聚集物Aβ42在脑内的沉积是一种较漫长的过程, 其沉积早于AD发病, 因此药物能有效解聚成熟Aβ42纤维也是一种必不可少的功能[31, 32]。培养初期荧光强度很低, 表明培养初始时Aβ42主要以单体形式存在(group 0, 图 5A)。然后将Aβ42培养至平台期, 分别加入PBS (作为阴性对照)、1、3、10和30 μmol·L-1的PCDNA共孵育10 h, 检测最终荧光强度(图 5A)。为了方便比较, 将PBS组荧光设定为100%。结果显示, 随着PCDNA浓度的增加, 荧光强度显著降低。例如, 与30 μmol·L-1 PCDNA共培养的Aβ42的荧光强度低于10%, 表明30 μmol·L-1 PCDNA可将Aβ42聚集物降解为一种无法结合ThT的聚集物。随后, 用MTT实验验证了这种被解聚的聚集物的毒性(图 5B), 随着PCDNA浓度的增加, 细胞存活率增加, 说明Aβ42被解聚为一种低毒聚集物, 表明PCDNA具有降解Aβ42纤维的作用, 并且降解的聚集物毒性较低。应用AFM观察加入30 μmol·L-1 PCDNA后Aβ42的聚集状态(图 5C)。结果显示, 成熟Aβ42纤维与30 μmol·L-1 PCDNA共孵育10 h后, 基本不存在较大纤维, 说明PCDNA可有效解聚Aβ42成熟纤维。上述实验表明, PCDNA具有解聚Aβ42纤维的能力, 且解聚产物为一种低毒的寡聚物。

|
Figure 5 PCDNA depolymerizes mature Aβ42 fibrils into non-toxic aggregates. A: Effect of PCDNA on the fluorescence intensity of mature fibrils of Aβ42. The group 0, 1, 2, 3, 4, and 5 represent 0 h Aβ42, Aβ42 co-incubation with PBS, 1, 3, 10, and 30 μmol·L-1 PCDNA for 10 h, respectively. ***P < 0.001 vs group 1; B: Cytotoxicity of Aβ42 species depolymerized by PCDNA was determined using the MTT assay. The group 0, 1, 2, 3, and 4 represent pure Aβ42 fibrils, Aβ42 co-incubation with 1, 3, 10, and 30 μmol·L-1 PCDNA, respectively. n = 4, x±s. ###P < 0.001 vs ctrl (PBS); **P < 0.01, ***P < 0.001 vs group 0; C: Aβ42 species were co-incubated with 30 μmol·L-1 PCDNA for 10 h and observed by AFM assay. Scale bar: 400 nm |
使用分子对接方法研究了PCDNA与纤维化形态Aβ42五聚体的相互作用(图 6)。结果显示, PCDNA与Aβ42五聚体之间有较低结合能(-9.5 kcal·mol-1), 表明PCDNA与Aβ42五聚体可通过直接相互作用解聚Aβ42五聚体。图 6展示了PCDNA与Aβ42五聚体之间具有最低结合能的3种不同结合方式及其相互作用二维图。

|
Figure 6 Analysis of the direct interaction between PCDNA and Aβ42 pentamer. A, B: The typical conformation of PCDNA embedded in the Aβ42 pentamer (A) and its corresponding two-dimensional analysis (B); C, D: The representative conformation of PCDNA bound to the outside of Aβ42 pentamer (C) and the corresponding two-dimensional analysis (D); E, F: The typical conformation (E) of the PCDNA embedded in the groove at the bottom of the Aβ42 pentamer and the corresponding two-dimensional analysis (F). The interaction diagram between PCDNA and Aβ42 pentamer was drawn using VMD software and Discovery Studio Visualizer-2018 software, respectively. The Aβ42 pentamer is represented by "NewCartoon", and PCDNA molecules are represented by "Licorice". Carbon, nitrogen, oxygen, and hydrogen atoms are colored by gray, blue, red, and white, respectively |
如图 6A、B所示, PCDNA嵌入由残基F19FAEDVGSNKGAI31形成的Aβ42五聚体内部, 与Aβ42五聚体上A~E链的残基F19、N27、K28、G29、A30以及I31产生较强的相互作用。此时, PCDNA与Aβ42五聚体之间拥有最低结合能, 约为-9.5 kcal·mol-1, 表明PCDNA优先结合到Aβ42五聚体的内部。此外, 如图 6C、D所示, PCDNA结合到Aβ42五聚体的外侧, 主要与Aβ42五聚体上D和E链上的残基F19、F20、A21、E22、V24、N27、K28、G29、A30以及I31结合, 此时其结合能为-8.0 kcal·mol-1。值得注意的是, 不论PCDNA嵌入Aβ42五聚体内部还是外侧, 都主要与Aβ42五聚体上残基F19、N27、K28、G29以及I31相互作用, 这也说明了这些残基是Aβ42五聚体与PCDNA结合的热点残基。在图 6E、F中, PCDNA嵌入由残基H14QK16形成的凹槽中, 主要与Aβ42五聚体上A~E链的残基H14、Q15以及K16形成较强的相互作用, 其结合能达到-8.0 kcal·mol-1。
综上所述, PCDNA与Aβ42五聚体之间拥有较强的疏水相互作用、π-烷基相互作用、π-sigma相互作用、酰胺-π堆积作用以及氢键相互作用。这些相互作用有助于PCDNA结合到Aβ42五聚体上, 同时这也是PCDNA与Aβ42五聚体之间结合能较低的原因。
结论本文利用ThT和AFM实验研究了PCDNA对Aβ42纤维化的抑制作用, 结果表明, PCDNA可显著抑制Aβ42的纤维化过程, 改变Aβ42的聚集状态。MTT和FDA/PI实验结果表明, 30 μmol·L-1 PCDNA可显著降低Aβ42聚集诱导的细胞毒性作用。上述实验方法研究PCDNA对已聚集的Aβ42纤维的解聚作用, 发现PCDNA可解聚已聚集的Aβ42纤维, 并且解聚产生的聚集物具有较低细胞毒性。分子对接结果表明, PCDNA与Aβ42五聚体的相互作用主要是疏水相互作用、π-烷基相互作用、π-sigma相互作用、酰胺-π堆积作用以及氢键相互作用, 这些相互作用有助于两者的结合, 同时这也是PCDNA与Aβ42五聚体之间结合能较低的原因。综上所述, PCDNA可以作为抑制Aβ42聚集的潜在化合物, 有望成为治疗AD的潜在药物。
作者贡献: 陈贝贝负责论文写作、ThT实验、细胞毒性实验、FDA/PI染色实验和AFM实验; 蒋露莹负责分子对接实验; 金成华和郭芳妍负责PCDNA分子合成; 屈莉莉和汪文倩负责部分ThT实验和细胞毒性实验操作; 刘夫锋负责实验设计、论文写作与把关。
利益冲突: 所有作者均声明不存在利益冲突。
| [1] |
Chuang E, Hori AM, Hesketh CD, et al. Amyloid assembly and disassembly[J]. J Cell Sci, 2018, 131: 89928-89945. |
| [2] |
Reiss AB, Arain HA, Stecker MM, et al. Amyloid toxicity in Alzheimer's disease[J]. Rev Neurosci, 2018, 29: 613-627. DOI:10.1515/revneuro-2017-0063 |
| [3] |
Mehra S, Sahay S, Maji SK. α-Synuclein misfolding and aggregation: implications in Parkinson's disease pathogenesis[J]. Biochim Biophys Acta Proteins Proteom, 2019, 1867: 890-908. DOI:10.1016/j.bbapap.2019.03.001 |
| [4] |
Bishoyi AK, Roham PH, Rachineni K, et al. Human islet amyloid polypeptide (hIAPP)-a curse in type Ⅱ diabetes mellitus: insights from structure and toxicity studies[J]. Biol Chem, 2020, 402: 133-153. |
| [5] |
Chakraborty S, Basu S. Structural insight into the mechanism of amyloid precursor protein recognition by β-secretase 1:a molecular dynamics study[J]. Biophys Chem, 2015, 202: 1-12. DOI:10.1016/j.bpc.2015.03.006 |
| [6] |
Cheignon C, Tomas M, Bonnefont-Rousselot D, et al. Oxidative stress and the amyloid beta peptide in Alzheimer's disease[J]. Redox Biol, 2018, 14: 450-464. DOI:10.1016/j.redox.2017.10.014 |
| [7] |
Hardy JA, Higgins GA. Alzheimer's disease: the amyloid cascade hypothesis[J]. Science, 1992, 256: 184-185. DOI:10.1126/science.1566067 |
| [8] |
Du WJ, Guo JJ, Gao MT, et al. Brazilin inhibits amyloid β-protein fibrillogenesis, remodels amyloid fibrils and reduces amyloid cytotoxicity[J]. Sci Rep, 2015, 5: 7992-7801. DOI:10.1038/srep07992 |
| [9] |
Huang L, Zhao C, Feng X, et al. Exploration of nonclinical pharmacodynamics evaluation system of Alzheimer's disease[J]. Acta Pharm Sin (药学学报), 2020, 55: 789-805. |
| [10] |
Peng Y, Li P, Li L, et al. Progress of clinical trials in Alzheimer's disease drugs[J]. Acta Pharm Sin (药学学报), 2016, 51: 1185-1195. |
| [11] |
Zhang B, Pang X, Jia H, et al. Repositioning drug discovery for Alzheimer's disease based on global marketed drug data[J]. Acta Pharm Sin (药学学报), 2020, 54: 1214-1224. |
| [12] |
Honcharenko D, Juneja A, Roshan F. Amyloid-β peptide targeting peptidomimetics for prevention of neurotoxicity[J]. ACS Chem Neurosci, 2019, 10: 1462-1477. DOI:10.1021/acschemneuro.8b00485 |
| [13] |
Gosztyla ML, Brothers HM, Robinson SR. Alzheimer's amyloid-β is an antimicrobial peptide: a review of the evidence[J]. J Alzheimers Dis, 2018, 62: 1495-1506. DOI:10.3233/JAD-171133 |
| [14] |
Bode DC, Stanyon HF, Hirani T, et al. Serum albumin's protective inhibition of amyloid-β fiber formation is suppressed by cholesterol, fatty acids and warfarin[J]. J Mol Biol, 2018, 430: 919-934. DOI:10.1016/j.jmb.2018.01.008 |
| [15] |
Xiong N, Dong XY, Zheng J, et al. Design of LVFFARK and LVFFARK-functionalized nanoparticles for inhibiting amyloid β-protein fibrillation and cytotoxicity[J]. ACS Appl Mater Interfaces, 2015, 7: 5650-5662. DOI:10.1021/acsami.5b00915 |
| [16] |
Han Q, Wang X, Cai S, et al. Quercetin nanoparticles with enhanced bioavailability as multifunctional agents toward amyloid induced neurotoxicity[J]. J Mater Chem B, 2018, 6: 1387-1393. DOI:10.1039/C7TB03053C |
| [17] |
Guan Y, Gao N, Ren J, et al. Rationally designed CeNP@MnMoS4 core-shell nanoparticles for modulating multiple facets of Alzheimer's disease[J]. Chemistry, 2016, 22: 14523-14526. DOI:10.1002/chem.201603233 |
| [18] |
Reddy PH, Mancza, M, Yin X, et al. Protective effects of indian spice curcumin against amyloid-β in Alzheimer's disease[J]. J Alzheimers Dis, 2018, 61: 843-866. DOI:10.3233/JAD-170512 |
| [19] |
Umeda T, Ono K, Sakai A, et al. Rifampicin is a candidate preventive medicine against amyloid-β and tau oligomers[J]. Brain, 2016, 139: 1568-1586. DOI:10.1093/brain/aww042 |
| [20] |
Park G, Xue C, Wang H, et al. Distinguishing the effect on the rate and yield of Aβ42 aggregation by green tea polyphenol EGCG[J]. ACS Omega, 2020, 5: 21497-21505. DOI:10.1021/acsomega.0c02063 |
| [21] |
Mo J, Chen T, Yang H, et al. Design, synthesis, in vitro and in vivo evaluation of benzylpiperidine-linked 1, 3-dimethylbenzimidazolinones as cholinesterase inhibitors against Alzheimer's disease[J]. J Enzyme Inhib Med Chem, 2020, 35: 330-343. DOI:10.1080/14756366.2019.1699553 |
| [22] |
Borges N. Tolcapone in Parkinson's disease: liver toxicity and clinical efficacy[J]. Expert Opin Drug Saf, 2005, 4: 69-73. DOI:10.1517/14740338.4.1.69 |
| [23] |
Silva T, Mohamed T, Shakeri A, et al. Development of blood-brain barrier permeable nitrocatechol-based catechol O-methyltransferase inhibitors with reduced potential for hepatotoxicity[J]. J Med Chem, 2016, 59: 7584-7597. DOI:10.1021/acs.jmedchem.6b00666 |
| [24] |
Pinheiro SD, Serrão MP, Silva T, et al. Pharmacodynamic evaluation of novel catechol-O-methyltransferase inhibitors[J]. Eur J Pharmacol, 2019, 847: 53-60. DOI:10.1016/j.ejphar.2019.01.027 |
| [25] |
Trott O, Olson AJ. AutoDock Vina: improving the speed and accuracy of docking with a new scoring function, efficient optimization, and multithreading[J]. J Comput Chem, 2010, 31: 455-461. |
| [26] |
Gremer L, Schölzel D, Schenk C, et al. Fibril structure of amyloid-β(1-42) by cryo-electron microscopy[J]. Science, 2017, 358: 116-119. DOI:10.1126/science.aao2825 |
| [27] |
Humphrey W, Dalke A, Schulten K. VMD: visual molecular dynamics[J]. J Mol Graph, 1996, 14: 33-8, 27-8. DOI:10.1016/0263-7855(96)00018-5 |
| [28] |
Biancalana M, Koide S. Molecular mechanism of thioflavin-T binding to amyloid fibrils[J]. Biochim Biophys Acta, 2010, 1804: 1405-1412. DOI:10.1016/j.bbapap.2010.04.001 |
| [29] |
Groenning M. Binding mode of thioflavin T and other molecular probes in the context of amyloid fibrils-current status[J]. J Chem Biol, 2010, 3: 1-18. DOI:10.1007/s12154-009-0027-5 |
| [30] |
Liu F, Wang W, Sang J, et al. Hydroxylated single-walled carbon nanotubes inhibit Aβ(42) fibrillogenesis, disaggregate mature fibrils, and protect against Aβ(42)-induced cytotoxicity[J]. ACS Chem Neurosci, 2019, 10: 588-598. DOI:10.1021/acschemneuro.8b00441 |
| [31] |
Selkoe DJ, Hardy J. The amyloid hypothesis of Alzheimer's disease at 25 years[J]. EMBO Mol Med, 2016, 8: 595-608. DOI:10.15252/emmm.201606210 |
| [32] |
Lane CA, Hardy J, Schott JM. Alzheimer's disease[J]. Eur J Neurol, 2018, 25: 59-70. DOI:10.1111/ene.13439 |
 2021, Vol. 56
2021, Vol. 56


