2. 桂林医学院, 广西系统医学重点实验室, 广西 桂林 541100;
3. 吕梁学院生命科学学院, 山西 吕梁 033000
2. Guangxi Key Laboratory of Systematic Medicine, Guilin Medical University, Guilin 541100, China;
3. College of Life Sciences, Lüliang University, Lüliang 033000, China
非酒精性脂肪性肝病(non-alcoholic fatty liver disease, NAFLD) 是指除了长期大量饮酒和其他明确的损肝因素所引起的, 以甘油三酯为主的脂质在肝细胞中的蓄积为病理改变的肝脏代谢性疾病。近20年来, 全世界NAFLD的患病率为6%~35% (中位数为20%), 亚洲国家NAFLD发生率逐年升高且呈低龄化趋势[1]。NAFLD通常合并2型糖尿病、高脂血症及其相关的心脑血管疾病, 并可能进一步发展为肝硬化、原发性肝癌和肝功能衰竭[2]。银杏内酯B (ginkgolide B) 是从银杏中提取的一种内酯类化合物, 在临床中主要用于神经系统疾病和心脑血管病的治疗, 其也是目前自然界发现的最强的血小板活性抑制剂, 可用于抑制血小板聚集以及血栓形成, 广泛应用于脑卒中等病的治疗[3, 4]。关于银杏内酯B在脂代谢相关疾病中的治疗已有文献报道, 如Luo等[5]研究发现银杏内酯B可减轻肥胖小鼠的体重和血清甘油三酯水平, 并改善肝脂肪变性, 但深入作用机制还缺少相关研究证实。本研究采用高脂高糖饮食构建了NAFLD大鼠模型, 观察经银杏内酯B治疗后的大鼠的长链脂肪酸代谢相关蛋白的变化特点, 以揭示银杏内酯B对NAFLD脂质代谢的分子机制。
材料与方法实验动物 雄性清洁级SD大鼠70只, 购于昆明医科大学呈贡校区实验动物学部, 动物生产许可证号[SCXK (滇) K2015-0002], 购买后饲养于云南中医药大学动物实验楼, 饲养温度22~27 ℃, 湿度40%~60%, 采光为日照, 每天12 h。日常由其自由饮食。动物福利和实验过程均遵循云南中医药大学动物伦理委员会的规定。
试剂 辛伐他汀胶囊(厦门福满药业有限公司, 批号20180807); 胆固醇和银杏内酯B (98%) (成都德思特生物技术有限公司); 高密度脂蛋白胆固醇(high-density lipoprotein cholesterol, HDL-C)、低密度脂蛋白胆固醇(low-density lipoprotein cholesterol, LDL-C)、总胆固醇(total cholesterol, TC)、甘油三酯(triglycerides, TG)、谷丙转氨酶(alanine transaminase, ALT)、谷草转氨酶(aspartate transaminase, AST)、丙二醛(malondialdehyde, MDA)、超氧化物歧化酶(superoxide dismutase, SOD) 和谷胱甘肽(glutathione, GSH) 试剂盒(南京建成生物工程研究所); 过氧化物酶体增殖剂激活受体α (peroxisome proliferators-activated receptors α, PPARα)、长链特异性酰基辅酶A脱氢酶(long-chain specific acyl-CoA dehydrogenase, LCAD)、肉毒碱棕榈酰转移酶-1 (carnitine palmitoyl transterase-1, CPT-1) 和脂酰辅酶A氧化酶1 (acyl coenzyme A oxidase 1, ACOX1)、抗体GAPDH (glyceraldehyde-3-phosphate dehydrogenase) (美国Santa-cruz公司); 羊抗兔二抗(北京中杉金桥生物科技公司); RNA提取试剂盒(北京天根生物公司)。
动物分组、造模以及治疗方法 大鼠适应性喂养结束后, 70只SD大鼠随机选取10只以普通饲料喂养12周作为正常组(normal, N), 其余60只采用高脂饲料(88%普通饲料+ 10%猪油+ 2%胆固醇, 碳水化合物、脂肪和蛋白质分别占总热量的53%、27.4%和19.6%) + 10%红糖水喂养12周, 随机选取10只验证造模是否成功。造模成功标准为肝脏组织HE (hematoxylin-eosin) 染色有明显脂肪空泡, 同时肝功能指标AST、ALT以及血脂4项指标明显升高。成功建立非酒精性脂肪性肝病大鼠模型后, 剩余50只随机分为5组, 每组10只, 分别为模型组(model, M)、辛伐他汀组(simvastatin, S)、银杏内酯B低剂量组(low-dose, LD)、中剂量组(middle-dose, MD) 和高剂量组(high-dose, HD), 给予相应药物治疗4周。正常组和模型组给予1 mL·kg-1·d-1生理盐水灌胃、辛伐他汀组给予辛伐他汀2 mg·kg-1·d-1灌胃治疗, 银杏内酯B低、中和高剂量组给予银杏内酯B 0.5、1和2 mg·kg-1·d-1灌胃治疗, 治疗时间为4周, 4周后进行后续实验。其中银杏内酯B高剂量组(2 mg·kg-1·d-1) 给药剂量根据参考文献[6], 中剂量组为高剂量组的1/2 (1 mg·kg-1·d-1), 低剂量组为中剂量组的1/2 (0.5 mg·kg-1·d-1)。
组织及血液收集方法 治疗期结束后, 大鼠分批次隔夜禁食不禁水12 h, 次日取出称重。用1%戊巴比妥钠麻醉, 麻醉后将其固定于解剖板, 腹主动脉取血法收集大鼠血液, 血液收集后离心, 提取上清液后将其分装于1.5 mL离心管中, 之后取出肝脏, 称重后切取1/2肝小叶置于4%甲醛溶液中固定, 其余组织放入-80 ℃冰箱中备用。
相关生化指标的测定 所有生化指标TG、TC、LDL-C、HDL-C、ALT、AST、MDA、SOD和GSH等的检测均采用试剂盒提供的说明书进行。除SOD采用ELISA法外, 其余都采用分光光度计检测。
肝脏组织病理学检测 肝脏组织病理学的检测采用HE染色法, 具体操作参照文献进行[7, 8], 依次经石蜡包埋、切片、脱蜡、脱水、苏木精染色、伊红复染、脱水、透明以及中性树脂封片即完成, 随后采用光学显微镜照片收集图像。
蛋白表达检测方法 蛋白表达的检测根据文献报道采用Western blot法[9, 10]。取每组内每只大鼠等量肝组织样品混合, 每组各100 mg。在肝组织中加入RIPA裂解液, 匀浆后离心(4 ℃、13 000 r·min-1, 30 min), 得到全蛋白提取液, 用总蛋白提取试剂盒提取总蛋白, 提取后将其定量并调平, 然后每组各取50 μg行SDS-PAGE凝胶电泳, 电泳完成后转模、脱脂牛奶封闭、一抗(PPARα为1∶2 000、ACOX1为1∶2 000、CPT-1为1∶1 000、LCAD为1∶1 000、GAPDH为1∶3 000) 过夜孵育, 二抗(1∶2 000) 孵育30 min, 暗室曝光洗片。结果以所测蛋白的灰度值/GAPDH的灰度值作为所测蛋白的相对表达量。
PCR (polymerase chain reaction) 检测方法 用总RNA提取试剂盒提取肝脏总RNA, 提取后将其逆转录为cDNA, 逆转录条件: 42 ℃、20 min, 95 ℃、5 min, 5 ℃、5 min; 逆转录完成后进行PCR反应, 反应条件为: 94 ℃、2 min, 94 ℃、30 s, 56 ℃、30 s, 72 ℃、2 min, 共34个循环。结果采用2-ΔΔCt法表示mRNA相对表达量。引物设计如表 1。
| Table 1 Primer sequences. PPARα: Peroxisome proliferators-activated receptors α; ACOX1: Acyl coenzyme A oxidase 1; CPT-1: Carnitine palmitoyl transterase-1; LCAD: Long-chain specific acyl-CoA dehydrogenase; GAPDH: Glyceraldehyde-3-phosphate dehydrogenase |
统计学分析 数据统计采用SPSS23.0统计学软件进行, 采用均数±标准差(x±s) 表示, 二组间比较采用LSD法, 多组间比较采用one-way ANOVA单因素方差分析, P < 0.05为差异具有统计学显著意义。
结果 1 治疗组大鼠肝脏病理学结果和肝功能指标明显好转造模成功后各组大鼠给予相应药物治疗4周, 收集肝脏检测肝脏病理学和肝功能指标。肝脏病理学结果可见: 正常组肝脏表面光滑、细胞大小均一; 模型组出现大量脂肪空泡, 细胞核受到明显挤压; 相较于模型组, 各治疗组明显好转, 且辛伐他汀组与银杏内酯B各剂量组几乎没有差异(图 1A)。此外, 与正常组相比, 模型组大鼠血清中AST和ALT均明显升高(P < 0.05), 相较于模型组, 各治疗组均明显降低(P < 0.05), 且各治疗组之间未见明显差异(图 1B、C)。

|
Figure 1 The pathological results and liver function indexes of rats in each treatment group were significantly improved. Rats in each treatment group were given simvastatin or different doses of ginkgolide B for 4 weeks, and liver pathology and liver function indexes were detected. A: Hematoxylin-eosin (HE) staining. The red arrow indicated that a large number of fat vacuoles appeared in the model group, and the treatment groups were significantly improved. Scale bar: 50 μm; B: Aspartate transaminase (AST); C: Alanine transaminase (ALT). N: Normal group; M: Model group; S: Simvastatin group; LD: Low-dose group; MD: Medium-dose group; HD: High-dose group. n = 10, ± s. *P < 0.05 vs N; #P < 0.05 vs M |
各组大鼠给予相应药物治疗4周后, 用腹主动脉取血法收集大鼠血液, 检测血脂指标和抗氧化指标。与正常组相比, 模型组大鼠血脂指标TG、TC、LDL-C和HDL-C均明显升高(P < 0.05); 相较于模型组, 各治疗组TG、TC、LDL-C均明显降低(P < 0.05), 且各治疗组之间未见明显差异, 但HDL-C并没有明显变化(图 2A~D); 相较于正常组, 模型组大鼠血清SOD和GSH均明显降低(P < 0.05), MDA明显升高(P < 0.05), 各治疗组相较于模型组SOD和GSH明显升高(P < 0.05), MDA明显降低(P < 0.05), 且各治疗组之间未见明显差异(图 2E~G)。
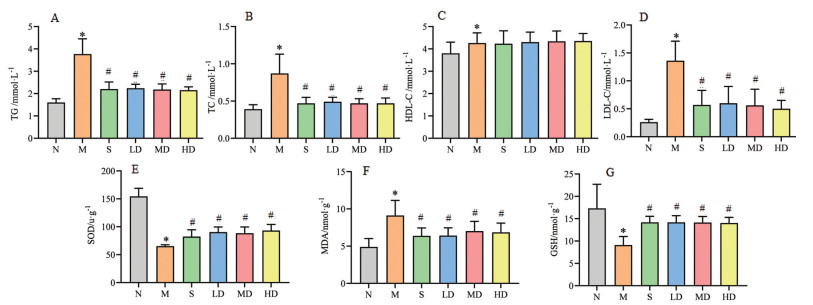
|
Figure 2 The blood lipid and anti-oxidation indexes of rats in each treatment group were significantly improved. A: Triglycerides (TG); B: Total cholesterol (TC); C: High-density lipoprotein cholesterol (HDL-C); D: low-density lipoprotein cholesterol (LDL-C); E: Superoxide dismutase (SOD); F: Malondialdehyde (MDA); G: Glutathione (GSH). n = 10, ± s. *P < 0.05 vs N; #P < 0.05 vs M |
各组大鼠给予相应药物治疗4周后, 采用Western blot和RT-PCR法检测肝脏PPARα、LCAD、CPT-1和ACOX1的蛋白及mRNA水平。与正常组相比, 模型组大鼠肝脏组织中PPARα、ACOX1、CPT-1和LCAD蛋白及mRNA表达均明显降低(P < 0.05), 相较于模型组, 各治疗组均明显上调(P < 0.05), 且各治疗组之间未见明显差异(图 3)。
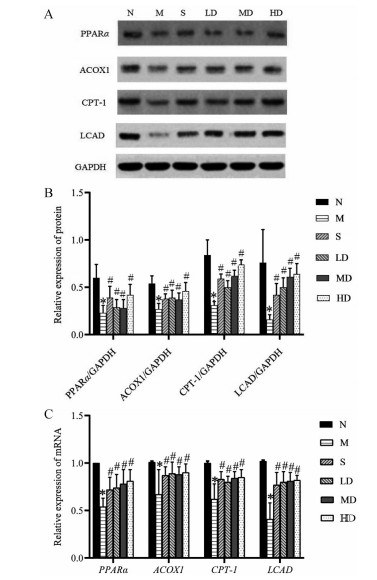
|
Figure 3 Comparison of protein and mRNA expression of long-chain fatty acid metabolism after treatment in rats with nonalcoholic fatty liver disease. After 4 weeks treatment with corresponding drugs in each group, Western blot and RT-PCR assays were used to detect the protein and mRNA expression levels of the liver PPARα, LCAD, CPT-1, and ACOX1. A: Western blot results of PPARα, LCAD, CPT-1, and ACOX1 protein expression in livers of rats in each group were indicated; B: The relative protein expression of PPARα, ACOX1, CPT-1, and LCAD in the livers of rats in each group after treatment. C: The relative mRNA expression of PPARα, ACOX1, CPT-1, and LCAD in the livers of rats in each group after treatment. n = 10, ± s. *P < 0.05 vs N; #P < 0.05 vs M |
长链脂肪酸与非酒精性脂肪肝病密切相关。一般而言, 脂肪酸可根据碳链的长度分为短链、中链和长链3种, 长链脂肪酸则主要位于食物油中, 正常情况下, 人体在摄入长链脂肪酸后可通过肠道吸收, 进而进入肝脏、脂肪细胞以及肌肉中存储。当人体需要能量时长链脂肪酸被转化, 此过程一直维持动态平衡。但当人体过量摄入油脂后, 长链脂肪酸不能及时消耗, 就可以一直存储于相关组织中, 最终导致脂肪肝、肥胖以及高血脂病的发生。上述只是一方面, 在生活中, 有些人“吃不胖”, 吃得多也不会患脂肪肝, 而有些人吃的少, 反而患脂肪肝病和肥胖的概率却很高, 这与长链脂肪酸的代谢密切相关。长链脂肪酸主要通过脂肪酸β-氧化分解进行代谢, 当代谢不足或发生阻遏时就可造成脂肪肝病的发生[11]。作者采用银杏内酯B治疗非酒精性脂肪肝病大鼠, 研究结果发现, 与正常组相比, 模型组肝功能指标AST和ALT, 以及血脂指标TG、TC、LDL-C和HDL-C均明显升高, 而与模型组相比, 各治疗组上述指标均明显降低, 结合肝脏病理学结果证实, 银杏内酯B对非酒精性脂肪肝病具有明显治疗作用。
脂肪酸β-氧化主要发生于线粒体, 是体内氧化的主要方式之一, 其可以分解中链和长链脂肪酸。但这两种脂肪酸的代谢过程稍有不同, 中链脂肪酸可以不借助任何酶直接进入线粒体基质, 而长链脂酰CoA则必须借助于载体转运[12, 13]。这个载体即是肉毒碱, 长链脂肪酸的脂肪酰基在经过CPT-1的催化后和肉毒碱3-羟基结合, 进入线粒体进行β-氧化反应[13, 14]。在线粒体中, 一个完整的β-氧化过程包括4步, 分别为脱氢、加水、再脱氢和硫解, 最终生成1分子乙酰CoA和1个少2个碳的新的脂酰CoA, 以供机体能量。上述过程中, LCAD主要负责长链脂肪酸的加氢反应, 使脂酰CoA的α和β碳原子分别脱去1个氢, 最终生成含有反式双键的α, β-烯脂肪酰辅酶A。但由于线粒体缺乏氧化极长链脂肪酸的能力, 这些脂肪酸会优先通过过氧化物酶体β-氧化进行代谢。CPT-1和ACOX1分别是线粒体途径和过氧化物酶体途径脂肪酸β-氧化的限速酶[15]。本研究发现, 相较于模型组, 各治疗组ACOX1、CPT-1和LCAD蛋白及mRNA表达均明显上调, 提示银杏内酯B对长链脂肪酸β-氧化具有明显的调节作用。
PPARα是细胞核激素受体超家族成员之一, 属于常见配体活化转录因子, 其在肝脏等脂肪酸代谢相对活化的组织中有高表达的特点。PPARα主要在饥饿情况下高表达, 以负责长链脂肪酸相关酶系β-氧化以供能。此外也有研究发现, PPARα与氧化应激密切相关[16]。有报道称氯贝特通过激活PPARα可抑制左冠状动脉前降支结扎后急性心肌缺血大鼠心肌活性氧(ROS) 生成和脂质过氧化, 其作用机制与心肌组织中抗氧化酶如Cu/Zn-SOD (SOD1)、Mn-SOD (SOD2) 和过氧化氢酶的转录和活性的上调有关[17]。长期大量的高脂高糖饮食摄入首先会造成肝脏堆积有大量的脂肪颗粒, 肝脏脂肪酸过多也可能促进ROS生成, 进而促进脂质过氧化。ROS和脂质过氧化则破坏氧化还原平衡, 引起氧化应激, 进一步导致肝细胞功能障碍。相关动物实验证实[18-20], 激活PPARα可明显改善非酒精性脂肪肝病症状。另有体外实验研究证实[21], 激活PPARα可明显促进SOD和GSH活性增加, 同时可降低细胞内MDA含量。这些发现表明, PPARα的活化可能会降低肝脂质的积累, 抑制氧化应激。本研究以抗氧化剂GSH、抗氧化酶SOD和稳定的脂质过氧化终末代谢产物MDA作为抗氧化指标, 与模型组相比, 银杏内酯B各治疗组PPARα均明显上调, SOD和GSH明显升高, MDA明显降低, 提示银杏内酯B对提高机体抗氧化能力也具有明显作用, 这可能与其上调PPARα的表达有关。
综合提示, 银杏内酯B对非酒精性脂肪肝病具有明显的治疗作用, 其作用机制可能是通过调节长链脂肪酸代谢相关蛋白表达及提高机体抗氧化能力实现的。
作者贡献: 杨婧完成相关实验以及论文撰写工作; 范晓明、张巧仙和冯柯鑫负责数据采集和分析工作; 杨榆青负责指导实验与修改论文工作; 宋波和武俊紫负责对本课题实验思路进行指导。
利益冲突: 所有作者声明不存在利益冲突。
| [1] |
Friedman SL, Neuschwander-Tetri BA, Rinella M, et al. Mechanisms of NAFLD development and therapeutic strategies[J]. Nat Med, 2018, 24: 908-922. DOI:10.1038/s41591-018-0104-9 |
| [2] |
Younossi ZM. Non-alcoholic fatty liver disease-a global public health perspective[J]. J Hepatol, 2019, 70: 531-544. DOI:10.1016/j.jhep.2018.10.033 |
| [3] |
Shu ZM, Shu XD, Li HQ, et al. Ginkgolide B protects against ischemic stroke via modulating microglia polarization in mice[J]. CNS Neurosci Ther, 2016, 22: 729-739. DOI:10.1111/cns.12577 |
| [4] |
Chen A, Xu Y, Yuan J. Ginkgolide B ameliorates NLRP3 inflammasome activation after hypoxic-ischemic brain injury in the neonatal male rat[J]. Int J Dev Neurosci, 2018, 69: 106-111. DOI:10.1016/j.ijdevneu.2018.07.004 |
| [5] |
Luo L, Li Y, Wang D, et al. Ginkgolide B lowers body weight and ameliorates hepatic steatosis in high-fat diet-induced obese mice correlated with pregnane X receptor activation[J]. Rsc Adv, 2017, 7: 37858-37866. DOI:10.1039/C7RA05621D |
| [6] |
Lou HJ, Wu Q, Guo W, et al. Effects of ginkgolide injection on biological characteristics of erythrocyte membrane in hyperlipidemia rats[J]. Chin J Tradit Med Sci Technol (中国中医药科技), 2015, 22: 393-394. |
| [7] |
Alwahaibi NY, Alkhatri AS, Kumar JS. Hematoxylin and eosin stain shows a high sensitivity but sub-optimal specificity in demonstrating iron pigment in liver biopsies[J]. Int J Appl Basic Med Res, 2015, 5: 169-171. DOI:10.4103/2229-516X.165365 |
| [8] |
Weng DF, Tang JQ, Li SY. Comparison of hematoxylin and eosin staining in the preparation of small pathological specimens[J]. J Clin Exp Pathol (临床与实验病理学杂志), 2019, 35: 610-611, 613. |
| [9] |
Mishra M, Tiwari S, Gomes AV. Protein purification and analysis: next generation Western blotting techniques[J]. Expert Rev Proteomics, 2017, 14: 1037-1053. DOI:10.1080/14789450.2017.1388167 |
| [10] |
Taylor SC, Posch A. The design of a quantitative Western blot experiment[J]. Biomed Res Int, 2014, 2014: 361590. |
| [11] |
Xiong J. Fatty acid oxidation in cell fate determination[J]. Trends Biochem Sci, 2018, 43: 854-857. DOI:10.1016/j.tibs.2018.04.006 |
| [12] |
Yamada K, Taketani T. Management and diagnosis of mitochondrial fatty acid oxidation disorders: focus on very-long-chain acyl-CoA dehydrogenase deficiency[J]. J Hum Genet, 2019, 64: 73-85. DOI:10.1038/s10038-018-0527-7 |
| [13] |
Houten SM, Violante S, Ventura FV, et al. The biochemistry and physiology of mitochondrial fatty acid beta-oxidation and its genetic disorders[J]. Annu Rev Physiol, 2016, 78: 23-44. DOI:10.1146/annurev-physiol-021115-105045 |
| [14] |
Sakamoto M, Tsujikawa H, Effendi K, et al. Pathological findings of nonalcoholic steatohepatitis and nonalcoholic fatty liver disease[J]. Pathol Int, 2017, 67: 1-7. DOI:10.1111/pin.12485 |
| [15] |
Guo J, Zhao L, Mao YD, et al. Effect of green onion extract on the expression of PGC-1α and fatty acid β-oxidation rate-limiting enzyme CPT-1 in rats with non-alcoholic fatty liver[J]. Lishizhen Med Mater Med Res (时珍国医国药), 2016, 27: 1581-1583. |
| [16] |
Zhang Y, Bharathi SS, Beck ME, et al. The fatty acid oxidation enzyme long-chain acyl-CoA dehydrogenase can be a source of mitochondrial hydrogen peroxide[J]. Redox Biol, 2019, 26: 101253. DOI:10.1016/j.redox.2019.101253 |
| [17] |
Li S, Yang B, Du Y, et al. Targeting PPARα for the treatment and understanding of cardiovascular diseases[J]. Cell Physiol Biochem, 2018, 51: 2760-2775. DOI:10.1159/000495969 |
| [18] |
Bougarne N, Weyers B, Desmet SJ, et al. Molecular actions of PPARα in lipid metabolism and inflammation[J]. Endocr Rev, 2018, 39: 760-802. DOI:10.1210/er.2018-00064 |
| [19] |
Kersten S, Stienstra R. The role and regulation of the peroxisome proliferator activated receptor alpha in human liver[J]. Biochimie, 2017, 136: 75-84. DOI:10.1016/j.biochi.2016.12.019 |
| [20] |
Zhao XW, Pan FW, Lu WY, et al. Effect of Jiawei Linggui Zhugan decoction on the expression of AdipoR-2 and PPARα in rats with non-alcoholic fatty liver[J]. Chin J Gerontol (中国老年学杂志), 2019, 39: 3759-3761. |
| [21] |
Zhang Y, Cui Y, Wang XL, et al. PPARα/γ agonists and antagonists differently affect hepatic lipid metabolism, oxidative stress and inflammatory cytokine production in steatohepatitic rats[J]. Cytokine, 2015, 75: 127-135. DOI:10.1016/j.cyto.2015.05.031 |
 2021, Vol. 56
2021, Vol. 56


