2. 南京中医药大学, 中药资源产业化与方剂创新药物国家地方联合工程研究中心, 江苏 南京 210023
2. Jiangsu Key Laboratory for High Technology Research of TCM Formulae, Nanjing University of Chinese Medicine, Nanjing 210023, China
胰岛素抵抗是指胰岛素调控外周靶器官代谢葡萄糖的作用降低, 主要表现为胰岛素促进肌肉和脂肪组织摄取葡萄糖, 以及抑制肝脏产生葡萄糖的能力受损。胰岛素抵抗是2型糖尿病的关键起始病因[1-3], 还会增加代谢综合征[4]、缺血性脑卒中[5]、精神分裂症[6, 7]和认知功能障碍[3]等多种疾病的患病风险。
传统中医药理论指出“血瘀证”是导致糖尿病发生发展的重要病因, 且贯穿于糖尿病进程的各个时期。叶天士《临证指南医案·三消》云: “三消之证, 虽有上中下之分, 其实不越阴亏阳抗, 津枯血竭, 而湿浊内滞, 血行迟缓, 瘀于脉络”。消渴之初期, 脾失健运, 阴津生化不足, 阴虚燥热而成血瘀; 中期脾肺气虚, 推动无力或气机阻滞而成血瘀; 后期久病及肾, 脾肾亏虚, 温煦推动无力而成血瘀[8]。“活血化瘀”对于改善糖尿病各个时期(包括胰岛素抵抗时期) 的“血瘀证”具有重要意义, 已经成为现代中医学家防治糖尿病的创新性策略[9, 10]。
丹参是唇形科植物丹参Salvia miltiorrhiza Bge.的干燥根和根茎, 功效为活血祛瘀、调经止痛、清心除烦和凉血消痈。红花是菊科植物红花Carthamus tinctorius L.的干燥花, 功效为活血通经和祛瘀止痛。丹参与红花是临床上常用的经典活血化瘀中药, 丹参性寒主降, 行而不伤, 有利于营血新生; 红花性温主升, 补而兼行、补而兼通。丹参-红花配伍一寒一温, 一升一降, 相辅相成, 共奏活血通络、祛瘀生新之功[11]。本论文将探讨丹参-红花配伍改善胰岛素抵抗的作用及机制, 为防治胰岛素抵抗及糖尿病提供实验基础。
材料与方法实验动物 雄性C57BL/6J小鼠(体重20~25 g) 购自中国北京生命河实验动物技术公司, 饲养在南京中医药大学药物安全性评价中心。动物实验由南京中医药大学动物伦理委员会批准(批准号20191A020), 动物福利和实验过程均遵循南京中医药大学动物伦理委员会的规定。
药品与试剂 高脂饲料(Research Diets D12492 60 kcal% Fat, 批号1902702HS2.5, 美国Research Diets股份有限公司); Trizol Reagent (批号191012, 美国ThermoFisher Scientific股份有限公司); 甘油三酯测定试剂盒(批号A110-2-1) 和总胆固醇测定试剂盒(批号A111-2-1) (南京建成生物工程研究所); 胰岛素(来源于牛胰腺, 批号K1815025, 上海阿拉丁生化科技股份有限公司); 葡萄糖测定试剂盒(批号20180402137, 上海荣盛生物药业有限公司); EasyScript One-Step gDNA Removal and cDNA Synthesis SuperMix (批号M20906) 和TransStart Top Green qPCR SuperMix (批号M40831) (北京全式金生物技术有限公司); 胰岛素受体β (4B8) 抗体(批号3025, 美国Cell Signaling Technology股份有限公司); 丹参(Salviae Miltiorrhizae Radix et Rhizoma) 和红花(Carthami Flos) 购自江苏省中医院。
丹参-红花配伍水提物的制备 丹参和红花按照3∶1的比例配伍(丹参7.5 kg, 红花2.5 kg), 加水煎煮两次, 每次煎煮1 h, 滤过, 将两次滤液合并, 在65 ℃条件下浓缩至相对密度为1.20~1.30的清膏, 加乙醇至含醇量为75%~80%, 冷藏, 取上清液, 回收乙醇并浓缩至相对密度为1.20~1.30的清膏, 加乙醇至含醇量为80%~85%, 冷藏, 取上清液, 回收乙醇至无醇味, 加超纯水至10 L, 充分混匀, 得到丹参-红花配伍水提物, 其中丹酚酸A、丹酚酸B、迷迭香酸、原儿茶醛和丹参素的含量分别约为39.71~42.32、405.51~415.33、20.48~21.09、26.93~28.11和165.34~168.79 μg·mL-1。为了便于保存以及防止有效成分降解, 将丹参-红花配伍水提物冷冻干燥, 以固体粉末形式保存于-80 ℃条件下。1 mL丹参-红花配伍水提物冷冻干燥后可以得到约29 mg冻干粉, 给药前每29 mg冻干粉用1 mL超纯水充分溶解, 即配即用。
动物实验设计 将32只C57BL/6J小鼠随机分为4组: 空白组(control, CTL), 胰岛素抵抗组(high fat diet, HFD), 丹参-红花配伍组(high fat diet-compatibility of Salviae Miltiorrhizae Radix et Rhizoma and Carthami Flos, HFD-DH) 和二甲双胍组(high fat diet-metformin, HFD-Met)。空白组小鼠喂食普通饲料10周; 胰岛素抵抗组小鼠喂食高脂饲料10周; 丹参-红花配伍组小鼠在喂食高脂饲料的同时进行预防性给药, 每天根据体重灌胃丹参-红花配伍水提物(小鼠每天的给药剂量按照生药量计算为4.16 g·kg-1); 二甲双胍组小鼠在喂食高脂饲料的同时, 每天根据体重灌胃盐酸二甲双胍水溶液(250 mg·kg-1)。给药时间为10周, 每周监测小鼠的体重和摄食量, 每隔2~3周监测小鼠的血糖水平和胰岛素水平。
口服糖耐量实验(oral glucose tolerance test, OGTT) 第10周给药结束后, 将所有小鼠禁食14 h, 根据小鼠体重灌胃20%葡萄糖溶液(1 g·kg-1), 在灌胃葡萄糖溶液后的不同时间点进行尾尖取血(0、15、30、60和90 min), 测定血糖水平。
胰岛素耐量实验(insulin tolerance test, ITT) OGTT实验后小鼠休息1周(休息时小鼠仍按照实验设计喂食给药), 禁食4 h后称重, 根据体重腹腔注射胰岛素溶液(0.75 U·kg-1), 在腹腔注射胰岛素溶液后的不同时间点进行尾尖取血(0、15、30、60和90 min), 测定血糖水平。
血浆甘油三酯和总胆固醇水平测定实验 ITT实验完成后, 所有小鼠眼眶取血, 将新鲜血液置于装有枸橼酸钠溶液(3.8%, w/v) 的离心管中, 将血液样品离心后(13 000 r·min-1, 10 min), 取上清液, 获得血浆样品, 按照试剂盒说明书测定血浆甘油三酯和总胆固醇水平。
分子生物学实验 眼眶取血实验完成后, 将所有小鼠处死, 取小鼠的心、肝、肾和骨骼肌, 保存于-80 ℃备用。采用实时定量荧光聚合酶链式反应(polymerase chain reaction, PCR) 方法测定胰岛素通路上关键信号分子的转录水平, 包括: 胰岛素受体底物1 (insulin receptor substrate 1, IRS1), 蛋白激酶B (protein kinase B, AKT3), 磷脂酰环己六醇3激酶(phosphatidylinositol 3 kinase, PI3K) p85α、p85β和p110δ, 分裂素激活蛋白激酶(mitogen activated protein kinase, MAPK), 胞外信号调节激酶(extracellular signal-regulated kinase, ERK) 1、2、3和5, 葡萄糖转运体(glucose transporter, GLUT) 1、3和4。采用免疫印迹(Western blot, WB) 方法测定胰岛素受体β (insulin receptor β, IR-β) 的蛋白表达水平。
数据处理 所有数据均用x±s (n = 8) 表示。采用Nonparametric Mann-Whitney Test分析组间差异性, P < 0.05为显著性差异, P < 0.01为极显著性差异。
结果 1 丹参-红花配伍改善胰岛素抵抗小鼠的能量摄取过量和体重增长过速实验所用标准普通饲料每克含3.30 kcal能量, 高脂饲料每克含5.24 kcal能量。高脂饲料主要营养成分为脂肪(60 kcal%)、碳水化合物(20 kcal%) 和蛋白质(20 kcal%)。与正常小鼠相比, 胰岛素抵抗小鼠每周摄取的能量显著增加, 大概稳定维持在92.12~112.03 kcal。丹参-红花配伍预防性给药可以显著降低胰岛素抵抗小鼠每周的摄食量, 摄取的能量降至72.73~98.93 kcal。整个实验过程中, 丹参-红花配伍组小鼠的能量摄取均低于胰岛素抵抗组小鼠, 其中4~8周时, 丹参-红花配伍对胰岛素抵抗小鼠能量摄取过量的改善作用最为显著(P < 0.01, 图 1A)。大量进食高脂饲料伴随着体重的快速增加, 结果显示, 胰岛素抵抗小鼠的体重增长速率显著高于正常小鼠, 而丹参-红花配伍预防性给药可以显著改善胰岛素抵抗小鼠的体重增长过速(P < 0.01, 图 1B)。
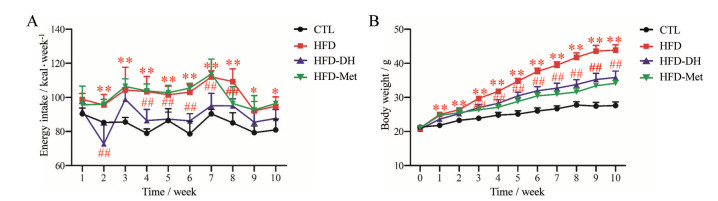
|
Figure 1 Compatibility of Salviae Miltiorrhizae Radix et Rhizoma and Carthami Flos (DH) reduced energy intake and body weight of insulin resistance mice. A: Energy intake; B: Body weight. n = 8, x±s. *P < 0.05, **P < 0.01 vs CTL; ##P < 0.01 vs HFD. CTL: Mice in control group were supplied with standard food regularly for 10 weeks; HFD: Mice in insulin resistance group were treated with high fat food for 10 weeks; HFD-DH: Mice in treatment group were administrated with high fat diet and aqueous extracts of DH for 10 weeks; HFD-Met: Mice in positive control group were administrated with high fat diet and metformin for 10 weeks |
二甲双胍给药10周可以显著降低胰岛素抵抗小鼠的体重(P < 0.01, 图 1B), 但是对小鼠每周的能量摄取无显著影响(图 1A)。丹参-红花配伍水提物的给药方式是灌胃, 在正式实验之前, 本文设计预实验考察了灌胃操作对小鼠摄食量和体重的影响。结果显示, 连续12周每天灌胃生理盐水, 对小鼠的摄食量和体重无显著影响。
2 丹参-红花配伍改善胰岛素抵抗小鼠的高胰岛素血症胰岛素抵抗组小鼠由于长期进食高脂饲料, 机体需要分泌更多的胰岛素来调控血糖水平。因此, 胰岛素抵抗组小鼠的血浆胰岛素水平从第3周开始显著升高, 第3、5、8和10周时, 分别是正常小鼠的2.23、13.14、6.23和8.98倍(P < 0.01, 图 2A)。丹参-红花配伍预防性给药可以持续显著改善胰岛素抵抗小鼠的高胰岛素血症, 第5、8和10周时, 血浆胰岛素含量分别下降33.19%、41.15%和46.43% (P < 0.01, 图 2A)。二甲双胍给药10周对高脂饲料诱导的胰岛素抵抗小鼠的胰岛素水平无显著影响(图 2A)。
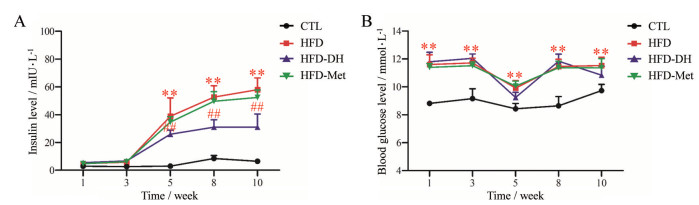
|
Figure 2 Compatibility of DH alleviated hyperinsulinemia of insulin resistance mice. A: Level of insulin in plasma; B: Level of glucose in plasma. n = 8, x±s. **P < 0.01 vs CTL; ##P < 0.01 vs HFD |
在胰岛素抵抗阶段, 由于机体的胰岛细胞功能尚未被完全破坏, 可以代偿性分泌更多的胰岛素来降低血糖水平。因此, 胰岛素抵抗组小鼠的血糖水平虽然显著升高, 但升高幅度并不大, 与正常小鼠相比, 血糖含量仅增加17.64%~32.57%, 且血糖水平都维持在9.91~11.61 mmol·L-1内(P < 0.01, 图 2B)。如果机体从胰岛素抵抗阶段进入糖尿病阶段, 血糖水平则会急剧升高, 超过16.67 mmol·L-1。丹参-红花配伍对胰岛素抵抗小鼠的血糖水平无显著影响(图 2B), 但是结合胰岛素水平结果可以发现, 丹参-红花配伍组小鼠在分泌较少量胰岛素的情况下, 即可将机体的血糖含量维持在较低的水平, 提示丹参-红花配伍预防性给药可以改善胰岛素抵抗小鼠的高胰岛素血症, 恢复机体调控血糖水平的能力(图 2)。二甲双胍给药10周对胰岛素抵抗小鼠的血糖水平也无显著影响(图 2B)。
3 丹参-红花配伍改善胰岛素抵抗小鼠代谢葡萄糖的能力OGTT和ITT是评价机体葡萄糖代谢能力的经典方法。OGTT结果显示, 正常小鼠口服葡萄糖15 min后血糖水平达到峰值(13.76 mmol·L-1), 机体通过分泌胰岛素来调控外周靶器官利用葡萄糖, 因此口服吸收的葡萄糖会被逐渐代谢, 大概60 min左右血糖水平即可恢复到正常水平。胰岛素抵抗小鼠口服葡萄糖15 min后的血糖峰值是正常小鼠的1.49倍(20.46 mmol·L-1, P < 0.01), 90 min后的血糖水平仍显著高于正常水平(P < 0.05)。丹参-红花配伍组小鼠口服葡萄糖15 min后, 血糖峰值与胰岛素抵抗小鼠相比下降了11.73% (图 3A), OGTT曲线下面积也有降低的趋势(表 1)。二甲双胍给药10周对胰岛素抵抗小鼠的OGTT无显著影响(图 3A、表 1)。
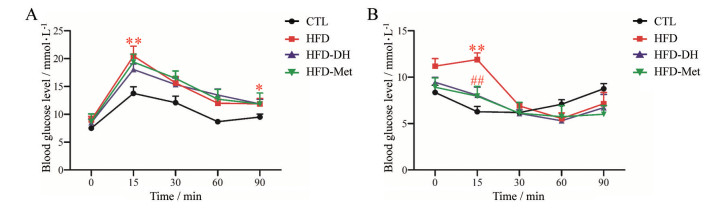
|
Figure 3 Compatibility of DH recovered the ability of glucose metabolism of insulin resistance mice. A: OGTT; B: ITT. n = 8, x±s. *P < 0.05, **P < 0.01 vs CTL; ##P < 0.01 vs HFD |
| Table 1 Compatibility of DH slightly reduced the area under curve of oral glucose tolerance test (OGTT). n = 8, x±s. **P < 0.01 vs CTL |
ITT结果显示, 正常小鼠注射胰岛素后, 机体的血糖水平会迅速下降, 15 min左右血糖水平达到峰谷(6.28 mmol·L-1), 随后血糖水平逐渐恢复至正常水平。胰岛素抵抗小鼠注射胰岛素后血糖水平不会立即下降, 15 min后血糖水平才开始变化, 60 min左右血糖水平达到峰谷(5.54 mmol·L-1)。丹参-红花配伍组小鼠注射胰岛素后, 机体的血糖水平会立即下降, 虽然下降速率没有正常小鼠快, 但仍显著优于胰岛素抵抗小鼠(P < 0.01, 图 3B)。ITT曲线下面积显示, 胰岛素抵抗组与空白组相比显著增加了19.17%, 丹参-红花配伍组与胰岛素抵抗组相比显著降低了17.84% (P < 0.01, 表 2), 提示丹参-红花配伍可改善胰岛素抵抗小鼠代谢葡萄糖的能力。二甲双胍给药10周显著影响胰岛素抵抗小鼠的ITT (P < 0.01, 图 3B), 显著降低ITT曲线下面积(P < 0.01, 表 2)。
| Table 2 Compatibility of DH reduced the area under curve of insulin tolerance test (ITT). n = 8, x±s. **P < 0.01 vs CTL; ##P < 0.01 vs HFD |
OGTT和ITT结果提示, 丹参-红花配伍可以提高胰岛素抵抗小鼠对胰岛素的敏感性, 增强对葡萄糖的代谢能力, 具有改善胰岛素抵抗的作用。二甲双胍对胰岛素抵抗小鼠的葡萄糖代谢能力也有显著的改善作用(图 3)。
4 丹参-红花配伍降低胰岛素抵抗小鼠血浆甘油三酯和总胆固醇水平胰岛素抵抗小鼠的血浆甘油三酯和总胆固醇水平显著升高(P < 0.01), 丹参-红花配伍预防性给药可以将胰岛素抵抗小鼠的血浆甘油三酯和总胆固醇水平分别显著下调19.29%和17.46% (P < 0.05)。二甲双胍给药10周对胰岛素抵抗小鼠的血浆甘油三酯和总胆固醇水平也具有显著的改善作用(P < 0.01) (图 4)。
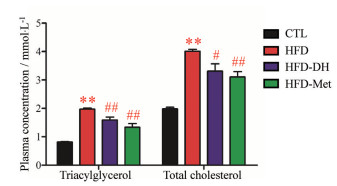
|
Figure 4 Compatibility of DH reduced the plasma levels of triacylglycerol and total cholesterol of insulin resistance mice. n = 8, x±s. **P < 0.01 vs CTL; #P < 0.05, ##P < 0.01 vs HFD |
在胰岛素抵抗小鼠肝脏中, 胰岛素信号通路的葡萄糖代谢调控途径被显著抑制, 主要表现为IRS1、PI3K p85α、PI3K p110δ和AKT3的基因转录水平显著下调, IR-β的蛋白表达水平显著下调(图 5)。丹参-红花配伍预防性给药可以显著缓解上述基因转录水平和蛋白表达水平的下调程度(P < 0.01)。葡萄糖转运体(GLUT1、GLUT3和GLUT4) 的基因转录水平在肝脏中无显著变化。
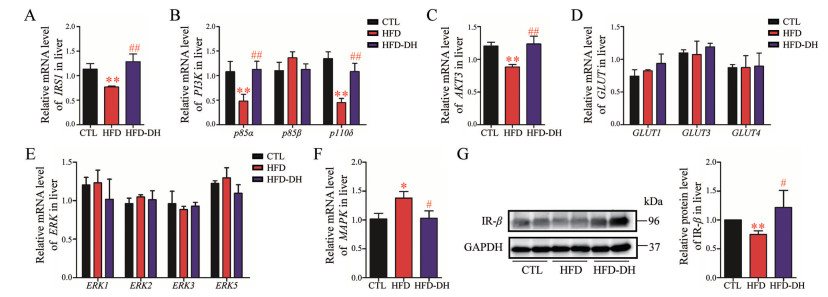
|
Figure 5 Compatibility of DH regulated insulin signaling pathway in the livers of insulin resistance mice. Relative mRNA level of (A) IRS1; (B) PI3K: p85α, p85β, and p110δ; (C) AKT3; (D) GLUT1, GULT3, and GLUT4; (E) ERK1, ERK2, ERK3, and ERK5; (F) MAPK; (G) Relative protein level of IR-β. n = 8, x±s. *P < 0.05, **P < 0.01 vs CTL; #P < 0.05, ##P < 0.01 vs HFD. IRS: Insulin receptor substrate; PI3K: Phosphatidylinositol 3 kinase; AKT3: Protein kinase B; GLUT: Glucose transporter; ERK: Extracellular signal-regulated kinase; MAPK: Mitogen activated protein kinase; IR-β: Insulin receptor β; GAPDH: Glyceraldehyde-3-phosphate dehydrogenase |
在胰岛素抵抗小鼠肝脏中, 胰岛素信号通路的有丝分裂调控途径异常增强, 主要表现为MAPK的基因转录水平显著增加, 丹参-红花配伍预防性给药可以显著缓解MAPK基因转录水平的异常增强(P < 0.05)。胞外信号调节激酶(ERK1、ERK2、ERK3和ERK5) 的基因转录水平在肝脏中无显著变化。
6 丹参-红花配伍调控胰岛素抵抗小鼠心脏中的胰岛素信号通路在胰岛素抵抗小鼠心脏中, 胰岛素信号通路的葡萄糖代谢调控途径被显著抑制, 主要表现为IRS1、PI3K p110δ、AKT3、GLUT1和GLUT4的基因转录水平显著下调, IR-β的蛋白表达水平显著下调(图 6)。丹参-红花配伍预防性给药对IRS1无显著调控作用, 但可以显著缓解PI3K p110δ、AKT3、GLUT1和GLUT4基因转录水平以及IR-β蛋白表达水平的下调程度(P < 0.05)。
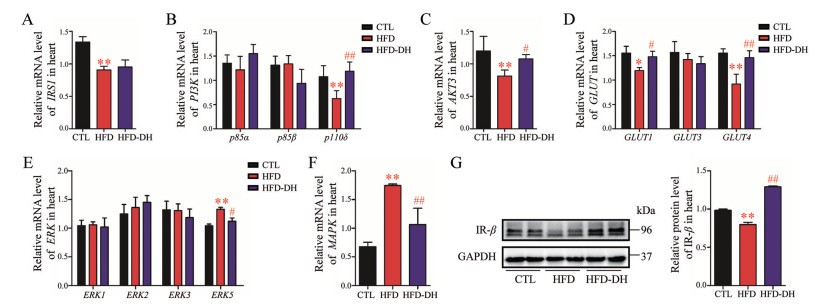
|
Figure 6 Compatibility of DH regulated insulin signaling pathway in the heart of insulin resistance mice. Relative mRNA level of (A) IRS1; (B) PI3K: p85α, p85β, and p110δ; (C) AKT3; (D) GLUT1, GULT3, and GLUT4; (E) ERK1, ERK2, ERK3, and ERK5; (F) MAPK; (G) Relative protein level of IR-β. n = 8, x±s. *P < 0.05, **P < 0.01 vs CTL; #P < 0.05, ##P < 0.01 vs HFD |
在胰岛素抵抗小鼠心脏中, 胰岛素信号通路的有丝分裂调控途径异常增强, 主要表现为ERK5和MAPK的基因转录水平显著增加, 丹参-红花配伍预防性给药可以显著缓解ERK5和MAPK基因转录水平的异常增强(P < 0.05)。
7 丹参-红花配伍调控胰岛素抵抗小鼠肾脏中的胰岛素信号通路胰岛素抵抗小鼠肾脏中, 胰岛素信号通路的葡萄糖代谢调控途径被显著抑制, 主要表现为IRS1、PI3K p85α、PI3K p85β、AKT3、GLUT3和GLUT4的基因转录水平显著下调, 但是丹参-红花配伍预防性给药仅对GLUT3和GLUT4的基因转录有显著调控作用(P < 0.01), 对IR-β的蛋白表达水平无显著影响(图 7)。
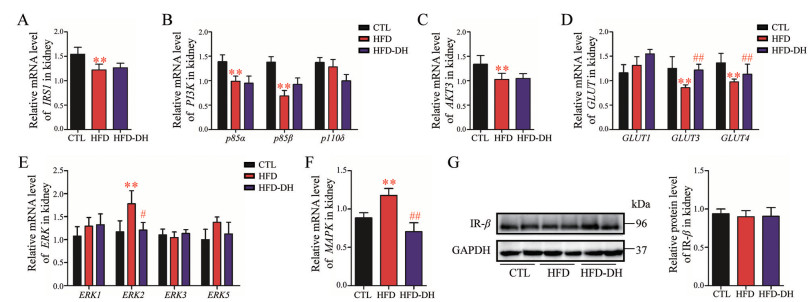
|
Figure 7 Compatibility of DH regulated insulin signaling pathway in the kidney of insulin resistance mice. Relative mRNA level of (A) IRS1; (B) PI3K: p85α, p85β, and p110δ; (C) AKT3; (D) GLUT1, GULT3, and GLUT4; (E) ERK1, ERK2, ERK3, and ERK5; (F) MAPK; (G) Relative protein level of IR-β. n = 8, x±s. **P < 0.01 vs CTL; #P < 0.05, ##P < 0.01 vs HFD |
胰岛素抵抗小鼠肾脏中, 胰岛素信号通路的有丝分裂调控途径异常增强, 主要表现为ERK2和MAPK的基因转录水平显著增加, 丹参-红花配伍预防性给药可以显著缓解ERK2和MAPK基因转录水平的异常增强(P < 0.05)。
8 丹参-红花配伍调控胰岛素抵抗小鼠骨骼肌中的胰岛素信号通路胰岛素抵抗小鼠骨骼肌中, 胰岛素信号通路的葡萄糖代谢调控途径被显著抑制, 主要表现为PI3K p85α、GLUT1、GLUT3和GLUT4的基因转录水平显著下调, IR-β的蛋白表达水平显著下调(图 8)。丹参-红花配伍预防性给药可以显著缓解上述基因转录水平和蛋白表达水平的下调程度(P < 0.05)。
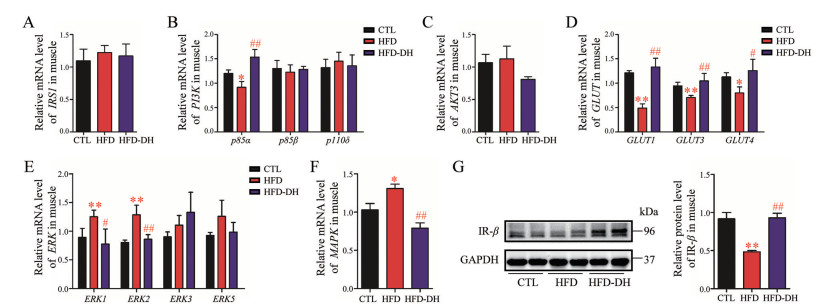
|
Figure 8 Compatibility of DH regulated insulin signaling pathway in the skeletal muscle of insulin resistance mice. Relative mRNA level of (A) IRS1; (B) PI3K: p85α, p85β, and p110δ; (C) AKT3; (D) GLUT1, GULT3, and GLUT4; (E) ERK1, ERK2, ERK3, and ERK5; (F) MAPK; (G) Relative protein level of IR-β. n = 8, x±s. *P < 0.05, **P < 0.01 vs CTL; #P < 0.05, ##P < 0.01 vs HFD |
胰岛素抵抗小鼠骨骼肌中, 胰岛素信号通路的有丝分裂调控途径异常增强, 主要表现为ERK1、ERK2和MAPK的基因转录水平显著增加, 丹参-红花配伍预防性给药可以显著缓解这些基因异常转录的程度(P < 0.05)。
讨论胰岛素信号通路主要包括PI3K-AKT和ERK-MAPK这两条关键途径。PI3K-AKT途径被认为是代谢调控途径: 胰岛素受体(IR) 与胰岛素受体底物(IRS) 结合, 激活PI3K-AKT信号转导通路, AKT活化后促进葡萄糖转运体(GLUT) 向肝、心、肾和骨骼肌等外周靶器官的细胞膜易位, 增加外周靶器官对葡萄糖的摄取。PI3K-AKT途径可以对抗细胞凋亡、炎症反应、氧化应激以及脂肪分解, 同时可以调控葡萄糖代谢、糖原合成以及蛋白质合成[12]。丹参-红花配伍预防性给药对长期进食高脂饲料引起的胰岛素抵抗小鼠, 肝、心、肾和骨骼肌中被异常抑制的PI3K-AKT途径具有显著的调控作用, 提示丹参-红花配伍可能是通过调控胰岛素信号通路中的PI3K-AKT途径, 改善胰岛素抵抗小鼠对葡萄糖的代谢能力, 提高口服糖耐量和胰岛素耐量测试成绩。
ERK-MAPK途径被认为是有丝分裂调控途径, 主要包括胞外信号调节激酶(ERK) 和分裂素激活蛋白激酶(MAPK) 等关键信号转录因子, 可以调控细胞的生长、增殖和分化, 与心肌肥大和动脉粥样硬化等病理进程密切相关[13]。丹参-红花配伍预防性给药对于长期进食高脂饲料引起的胰岛素抵抗小鼠, 肝、心、肾和骨骼肌中异常增强的ERK-MAPK途径具有显著的调控作用, 提示丹参-红花配伍对于胰岛素抵抗后期的糖尿病以及糖尿病心肌病等可能具有改善作用, 这些均值得进一步探索和验证。
本论文基于传统中医药理论, 探索“活血化瘀法”防治胰岛素抵抗的创新性策略, 初步发现丹参和红花这两味经典的活血化瘀中药配伍可以显著提高胰岛素抵抗小鼠代谢葡萄糖的能力, 具有改善胰岛素抵抗的作用。同时, 通过胰岛素信号通路机制研究, 初步发现丹参-红花配伍对于胰岛素信号通路中代谢调控途径和有丝分裂调控途径的稳态失衡具有显著的调控作用。本论文为活血化瘀中药更广泛的新药理作用研究, 为糖尿病等复杂疾病的创新性药物探索提供了初步的实验基础。但是, 本论文仍存在一定的局限性, 在后续的研究过程中需进一步深入探索丹参-红花配伍改善胰岛素抵抗的作用机制, 例如丹参-红花配伍对胰岛素信号通路活化状态的影响等, 为丹参-红花配伍防治胰岛素抵抗和糖尿病提供更加充实的实验基础。
作者贡献: 李建萍和徐雪君负责实验研究, 李建萍、徐雪君和张沁瑜负责数据处理, 李建萍、郭建明和段金廒负责提出研究思路、设计实验方案、撰写和修改论文。
利益冲突: 全体作者声明不存在任何利益冲突。
| [1] |
Lee WL, Klip A. Endothelial transcytosis of insulin: does it contribute to insulin resistance?[J]. Physiology (Bethesda), 2016, 31: 336-345. |
| [2] |
Deer J, Koska J, Oziams M, et al. Dietary models of insulin resistance[J]. Metabolism, 2015, 64: 163-171. DOI:10.1016/j.metabol.2014.08.013 |
| [3] |
Smith U. 12th key symposium introduction: insulin resistance in common diseases[J]. J Intern Med, 2016, 280: 426-429. DOI:10.1111/joim.12561 |
| [4] |
Koren D, Taveras EM. Association of sleep disturbances with obesity, insulin resistance and the metabolic syndrome[J]. Metabolism, 2018, 84: 67-75. DOI:10.1016/j.metabol.2018.04.001 |
| [5] |
Deng XL, Liu Z, Wang CL, et al. Insulin resistance in ischemic stroke[J]. Metab Brain Dis, 2017, 32: 1323-1334. DOI:10.1007/s11011-017-0050-0 |
| [6] |
Gurst PC. Insulin resistance in schizophrenia[J]. Adv Exp Med Biol, 2019, 1134: 1-16. |
| [7] |
Tomasik J, Lago SG, Vazquez-bourgon J, et al. Association of insulin resistance with schizophrenia polygenic risk score and response to antipsychotic treatment[J]. JAMA Psychiatry, 2019, 76: 864-867. DOI:10.1001/jamapsychiatry.2019.0304 |
| [8] |
Ge FY, Li ZX, Miao JY. Type 2 diabetes treatment based on reducing blood stasis[J]. World Latest Med (世界最新医学信息文摘), 2018, 18: 133-135. |
| [9] |
Wang J, Chang B. Theoretical analysis of type 2 diabetes treatment based on reducing blood stasis[J]. Tianjin J Tradit Chin Med (天津中医药), 2017, 34: 537-540. |
| [10] |
Qiu LM. Analysis of relationship between diabetes and blood stasis[J]. Beijing J Tradit Chin Med (北京中医药), 2018, 37: 248-250. |
| [11] |
Cui YR, Liu X, Shen D, et al. Data mining analysis of regularity of formulas containing Salviae Miltiorrhizae Radix et Rhizoma-Carthami Flos medicine pair in Dictionary of Chinese Medicine Prescription[J]. China J Chin Mater Med (中国中药杂志), 2016, 41: 528-531. |
| [12] |
Jia GH, Demarco VG, Sowers JR. Insulin resistance and hyper insulinaemia in diabetic cardiomyopathy[J]. Nat Rev Endocrinol, 2016, 12: 144-153. |
| [13] |
Jia GH, Habibi J, Bostick BP, et al. Uric acid promotes left ventricular diastolic dysfunction in mice fed a western diet[J]. Hypertension, 2015, 65: 531-539. DOI:10.1161/HYPERTENSIONAHA.114.04737 |
 2021, Vol. 56
2021, Vol. 56


