2. 中国科学院上海药物研究所, 上海 201203
2. Shanghai Institute of Materia Medica, Chinese Academy of Sciences, Shanghai 201203, China
随着人们饮食结构和生产生活方式的改变以及全球人口老龄化的加剧, 糖尿病及其并发症的发生率及致死率呈现逐年升高的趋势[1], 已成为威胁人类健康的主要疾病。糖尿病患者体内长期高血糖水平会进一步导致大血管和微血管受损, 从而危及心、肝、肾和周围神经等组织, 导致一系列并发症[2]。我国糖尿病患者并发糖尿病肾病的比例较高, 约为20%~40%, 目前已成为终末期肾病的第二位原因, 仅次于各种肾小球肾炎。肠道菌群是机体的重要组成部分, 具有维持肠上皮稳态、促进药物代谢和参与机体内免疫调节等功能, 影响人类健康[3, 4]。肠道菌群的构成发生改变后会导致机体内肠道菌群的失衡, 从而进一步影响人体的正常代谢, 引发机体内代谢紊乱。目前已有许多研究表明肠道菌群结构及其多样性的改变会影响血脂异常、肥胖症、慢性炎症、炎症性肠病、过敏性疾病、心血管疾病和癌症等疾病的病程发展[5]。亦有研究显示, 肠道菌群失调在糖尿病及糖尿病肾病的发生和发展中起着重要作用, 可导致胰岛素抵抗、肠源性尿毒症毒素的积累、脂多糖的高循环水平以及免疫失调等[6]。短链脂肪酸通常认为是由未消化完全的碳水化合物在肠道内发酵而成的产物, 一般认为这类产物是指6个碳以下的脂肪酸[7]。由于肠道菌群与短链脂肪酸有着十分紧密的联系, 因此两者常常同时在各种疾病的研究中被讨论, 包括炎症性肠病、慢性肾病、结肠癌、肥胖和糖尿病等[7-10]。
丹参为唇形科鼠尾草属植物丹参Salvia miltiorrhiza Bge.的干燥根及根茎, 味苦, 微寒, 归心、肝经。丹参作为传统大宗药材, 在我国已有近两千年的使用历史。现丹参在世界上的消耗量已超过了每年2 000万公斤[11], 随着药材需求量的不断增长, 在采收其药用部位的同时也产生了大量丹参茎叶等非药用部位, 对其进行综合开发利用可减少药用资源的浪费, 提高丹参植株的资源利用率。近年来, 丹参及丹参茎叶应用于糖尿病及其并发症的研究越来越被重视, 其含有大量具有抗氧化和清除自由基作用的丹酚酸类化合物, 如丹酚酸B和迷迭香酸等, 其中丹酚酸B的抗氧化作用强度高于维生素E、维生素C和甘露醇, 是目前已知的抗氧化作用最强的天然产物之一[12]。
本实验在前期研究基础上[13-16], 以自发性2型糖尿病肾病小鼠为实验模型, 采用16S rDNA高通量测序技术分析db/db糖尿病肾病小鼠粪便及盲肠内容物样本中肠道菌群多样性和短链脂肪酸含量, 研究丹参茎叶总酚酸对糖尿病肾病小鼠肠道菌多样性和短链脂肪酸的干预作用, 并平行比较丹参根中总酚酸组分, 以期从肠道微环境的角度揭示丹参茎叶总酚酸改善糖尿病肾病的作用机制, 并为丹参茎叶中酚酸类成分的合理开发利用提供科学依据。
材料与方法仪器 RS232G紫外分光光度计(Eppendorf公司); PCR仪(ABI GeneAmp® 9700型); DYY 6C电泳仪(北京市六一仪器厂); Illumina Miseq高通量测序仪(Illumina公司); Agilent 2100生物分析仪(FLx800Promega, QuantiFluorTBS380, BioTek公司); 三诺血糖仪GA-3型及血糖试纸(三诺公司); 气相色谱仪(Perkin Elmer Clarus® 680)、Flame Ionization Detector (FID) 检测器和HP-5 MS气相色谱柱(30 m×0.250 mm×0.25 μm); XH-D涡旋振荡仪(上海沪西分析仪器厂有限公司); Sartorius BT125D电子分析天平(德国塞利多斯公司); EPED超纯水系统(南京易普达易科技发展有限公司); Anke LXJ-IIB型离心机(上海安亭科学仪器厂); LABCONCO离心浓缩仪(北京照生行仪器设备有限公司); Tissuelyer-48组织研磨机(上海净信科技公司)。
药品与试剂 盐酸二甲双胍(metformin hydrochloride, 批号AAN6777, 中美上海施贵宝制药有限公司); 原儿茶酸(批号YECS20170411)、原儿茶醛(批号YECQ20160819)、咖啡酸(批号KFS20170710)、迷迭香酸(批号MDXS20170407)、丹参素(批号DSS20170321)、紫草酸(批号ZCS20170222)、丹酚酸B (批号DFSB20170215)、丹酚酸A (批号DFSA20170411) 和丹酚酸C (批号DFSC20170103) (南京春秋生物工程有限公司), 纯度均大于98%; 短链脂肪酸标准品冰乙酸(acetic acid, AA)、丙酸(propionic acid, PA)、丁酸(butyric acid, BA)、异丁酸(isobutyrlc acid, IBA)、戊酸(valerlc acid, VA) 和异戊酸(isovalerlc acid, IVA) (德国Aladdin公司), 纯度均大于99.5%; 甲醇(色谱纯, 德国默克公司)。尿素氮(blood urea nitrogen, BUN)、肌酐(serum creatinine, SCr)、甘油三酯(triglyceride, TG) 和血清总胆固醇(total cholesterol, TC) 试剂盒(南京建成生物工程研究所)。丹参茎叶药材样品于2016年7月采自山东省济南市长清区马山镇, 植物基原经南京中医药大学段金廒教授鉴定为唇形科鼠尾草属植物丹参Salvia miltiorrhiza Bge.的地上茎叶部分。丹参茎叶样品于50 ℃热风烘干, 干燥后粉碎过40目筛, 常温密封干燥保存备用。
供试药物的制备与成分分析 结合本课题组前期提取和纯化工艺优化实验结果[16], 确定丹参茎叶总酚酸组分制备过程为: 取丹参茎叶适量, 以10倍量60%乙醇回流提取2次, 每次提取2 h; 然后以1.0 g·mL-1药液上样AB-8型大孔吸附树脂, 上样量为每10 g干树脂上样5 g生药, 以5倍树脂床体积(bed volume, BV) 的35%乙醇洗脱初步纯化; 采用2倍体积的乙酸乙酯萃取3次对其进一步纯化富集: 萃取底物浓度为0.1 g·mL-1, 底物pH值为2; 冷冻干燥后即得丹参茎叶总酚酸。取适量丹参茎叶总酚酸用甲醇溶解后离心(13 000 r·min-1, 10 min), 取上清液, 经0.22 μm微孔滤膜过滤, 即得丹参茎叶酚酸供试品溶液。丹参根总酚酸组分(DFS) 购自南京泽郎生物科技有限公司, 取适量甲醇溶解后制备丹参根酚酸供试品溶液。采用高效液相色谱仪对上述供试品溶液进行成分分析。高效液相色谱检测条件: 丹酚酸类成分检测采用GRACE Apollo C18 (4.6 mm×250 mm, 5 μm) 色谱柱; 流动相: 乙腈(A)-0.1%甲酸水溶液(B), 梯度洗脱(0~5 min, 10% A; 5~10 min, 10%~12% A; 10~20 min, 12%~14% A; 20~25 min, 14%~20% A; 25~60 min, 20%~30% A; 60~65 min, 30%~40% A; 65~70 min; 40%~10% A); 流速1.0 mL·min-1, 柱温35 ℃, 进样量10 μL; 检测波长: 280 nm。
实验动物 选取7周龄雄性自发性2型糖尿病及肥胖db/db小鼠, 体重(40±5) g; 同遗传背景db/m正常小鼠, 体重(21±2) g, 均为BKS.Cg-Dock7m+/+Leprdb/Nju品系。以上动物购自南京大学模型动物研究所, 动物许可证号: SCXK (苏) 2015-0001。所有小鼠饲养于南京中医药大学SPF级实验动物中心屏障环境, 温度(22±2) ℃, 相对湿度(55±10)%, 光照12 h明暗交替, 自由饮水和进食, 普通饲料饲喂, 定期更换垫料。所有动物实验方案均经过南京中医药大学药物安全性评价研究中心动物伦理委员会审核批准, 所有实验操作均严格按照实验动物伦理相关规定进行。
动物分组、给药及样品的采集 db/db小鼠为一种先天性的基因缺陷型2型糖尿病模型, 随着血糖的升高, 逐渐出现大量的蛋白尿, 最终发展为肾小球硬化和肾小管间质纤维化[17]。所有小鼠适应性喂养2周后称重并尾静脉针刺采血测定空腹血糖值(禁食8~12 h), 平均血糖值≥ 11.0 mmol·L-1为血糖合格小鼠。选用10只健康db/m小鼠为正常对照组(Con); 选择血糖合格db/db小鼠, 采用完全随机方法分为6组: 模型组(MDL)、阳性药二甲双胍组(250 mg·kg-1·d-1, MH)、丹参茎叶酚酸高剂量组(270 mg·kg-1·d-1, JH)、丹参茎叶酚酸低剂量组(135 mg·kg-1·d-1, JL)、丹参根酚酸高剂量组(250 mg·kg-1·d-1, GH) 和丹参根酚酸低剂量组(125 mg·kg-1·d-1, GL), 每组10只。每天给予相应药物灌胃1次, 灌胃体积为10 mL·kg-1, 模型组和正常组小鼠灌胃给予等量药物溶媒。连续灌胃给药8周后, 采集各组小鼠新鲜粪便及盲肠内容物于-80 ℃保存, 每组取5只用于16S rDNA测序分析和短链脂肪酸含量测定。
粪便基因组DNA的提取与检测 取各组小鼠粪便及盲肠内容物适量, 使用E.Z.N.A.®soil试剂盒(美国Omega BioTek公司) 进行总DNA抽提, 操作步骤参照说明书进行, DNA浓度和纯度利用NanoDrop2000进行检测, DNA质量利用1%琼脂糖凝胶电泳进行检测并储存于-80 ℃用于PCR扩增。
PCR扩增及高通量测序 粪便及盲肠内容物中微生物总DNA经琼脂糖凝胶电泳检验后合格即进行PCR扩增反应, 扩增出16S RNA基因V3-V4片段。用引物338F (5'-ACTCCTACGGGAGGCAGCAG-3')和806R (5'-GGACTACHVGGGTWTCTAAT-3') 对高变体V3-V4区域进行PCR扩增。PCR反应条件为: 95 ℃预变性3 min, 27个循环(95 ℃变性30 s, 55 ℃退火30 s, 72 ℃延伸30 s), 最后72 ℃延伸10 min。采用2%琼脂糖凝胶回收PCR产物, AxyPrep DNA Gel Extraction Kit进行纯化, Tris-HCl洗脱并进行2%琼脂糖电泳检测。利用QuantiFluor™-ST进行检测定量。PCR产物经过纯化、定量和均一化后, 根据Illumina MiSeq平台标准操作规程将纯化后的扩增片段构建PE 2×300的文库, 原始数据上传至NCBI数据库中。
数据分析与处理 原始测序序列使用Trimmomatic软件质控, 使用FLASH软件对通过质量筛选的双端序列根据重叠碱基进行配对连接。使用UPARSE软件根据97%相似度对序列进行OTU (operational taxonomic units) 聚类, 丰度阈值0.005%; 使用UCHIME软件剔除嵌合体; 利用RDP classifier对每条序列进行物种分类注释, 比对Silva数据库, 保留至少在6个样本中序列数都大于5的OTU, 按最小序列数抽平, 鉴定出界、门、纲、目、科和属等生物信息, 比对阈值为70%。
肠道菌群功能预测 采用PICRUSt对OTU丰度表进行标准化, 即去除16S marker gene在物种基因组中的拷贝数目的影响; 然后通过每个OTU对应的green gene id, 获得OTU对应的COG (cluster of orthologous groups) 家族信息和KEGG ortholog (KO) 信息; 并计算各COG的丰度和KO丰度。根据COG数据库的信息可以从eggNOG数据库中解析到各个COG的描述信息以及其功能信息, 从而得到功能丰度谱; 根据KEGG数据库的信息获得KO、pathway和EC信息, 并能根据OTU丰度计算各功能类别的丰度。
粪便和肠道内容物中短链脂肪酸的测定 ①标准品溶液的制备: 精密称取标准品物质冰乙酸、丙酸、丁酸、异丁酸、戊酸和异戊酸适量, 用甲醇配制成混合标准品储液, 按梯度稀释得到不同浓度的混合工作液。储液中乙酸52.25 mg·mL-1, 丙酸50.34 mg·mL-1, 丁酸45.84 mg·mL-1, 异丁酸47.24 mg·mL-1, 戊酸44.37 mg·mL-1, 异戊酸45.19 mg·mL-1; ②供试品溶液的制备: 称取粪便和肠道内容物样品约50 mg于1.5 mL离心管内, 加入4倍量甲醇, 放入组织匀浆机中匀浆5次, 每次60 s, 匀浆后取出离心(13 000 r·min-1, 4 ℃, 10 min), 取上清液转移至新的1.5 mL离心管内, 离心浓缩至干, 用甲醇复溶后进样; ③气相条件: 气相色谱仪关联FID检测器, HP-5 MS气相色谱柱(30 m×0.250 mm×0.25 μm)。检测器温度250 ℃, 进样口温度250 ℃, 分流比100∶1, 进样量1 μL。升温程序: 初始温度100 ℃, 保持2.5 min后, 以50 ℃·min-1的速度上升至230 ℃, 保持2 min; ④方法学考察: 精密度: 精密吸取对照品溶液, 在“气相条件”项条件下, 连续进样6次, 记录各成分的峰面积, 计算相对标准偏差(relative standard deviation, RSD%); 重复性: 随机取一样品, 按照“供试品溶液的制备”项下方法平行制备6份供试品溶液, 在“气相条件”项条件下分析, 记录各成分的峰面积, 计算RSD%; 稳定性: 随机取一份供试品溶液, 分别于0、2、4、6、8和12 h时进样, 在“气相条件”项条件下分析, 记录各成分的峰面积, 计算RSD%; 加样回收率: 精密称取样品, 分别按已知质量分数的100%加入6种短链脂肪酸对照品, 按“供试品溶液的制备”项下方法制备供试品溶液, 平行制备6份, 在“气相条件”项条件下分析, 记录各成分的峰面积, 计算加样回收率平均值及加样回收率RSD%。
统计学分析 应用GraphPad Prism 8软件对各实验组数据进行t-检验、one-way ANOVA、非参数检验、Brown-Forsythe和Welch ANOVA检验分析, P < 0.05时认为数据具有统计学意义。
结果 1 供试药品成分分析采用标准曲线法测定丹参茎叶总酚酸及丹参根总酚酸中各酚酸类成分含量并计算其纯度。实验结果发现, 丹参茎叶总酚酸纯度可达71.92%, 丹酚酸B和迷迭香酸分别占比40.87%和23.09%; 丹参根总酚酸组分纯度可达80.71%, 丹酚酸B和迷迭香酸分别占比77.26%和2.42%。二者间各成分组成比例差异较大。
2 生化指标检测给药8周后检测各组小鼠空腹血糖(fasting blood glucose, FBG)、血清肌酐(SCr)、血清尿素氮(BUN)、甘油三酯(TG) 和血清总胆固醇(TC) 水平, 结果见表 1。
| Table 1 Determination of fasting blood glucose (FBG), blood urea nitrogen (BUN), and serum creatinine (SCr) among control (Con), model (MDL), and administration groups. n = 10, x±s. #P < 0.05, ##P < 0.01, ###P < 0.001 vs Con; *P < 0.05, **P < 0.01, ***P < 0.001 vs MDL. TC: Total cholesterol; TG: Triglyceride; MH: Metformin group; JH and JL: The high-dose and low-dose groups of total phenolic acids from the stems and leaves of Salvia miltiorrhiza Bge.; GH and GL: The high-dose and low-dose groups of total phenolic acids from the roots of Salvia miltiorrhiza Bge. |
与空白组相比, 模型组FBG (P < 0.001)、SCr (P < 0.01)、BUN (P < 0.05)、TG (P < 0.001) 和TC (P < 0.001) 水平均发生显著改变, 该结果可表明糖尿病肾病模型成功。药物干预后, 各给药组均能不同程度地回调模型小鼠FBG、SCr、BUN、TG和TC水平。与模型组相比, 阳性药组、丹参茎叶酚酸高剂量组和丹参根酚酸高剂量组可显著降低模型小鼠体内高血糖水平; 各给药组均可显著性降低体内SCr、BUN和TG水平, 且高剂量组治疗效果略优于低剂量组。
3 序列长度粪便及盲肠内容物中菌群序列均分布在400~500 bp内, 与16S r DNA V3-V4区序列长度大致吻合, 表明该样本可用于后续分析。
4 OTU划分和分类地位鉴定OTU是在系统发生学或群体遗传学研究中, 为了便于进行分析, 人为给某一个分类单元(品系、属、种和分组等) 设置的统一标志[18]。本实验采用RDP classifier贝叶斯算法对97%相似水平的OTU代表序列进行分类学分析, 后比对Silva数据库, 并分别在各个分类水平: 域(domain)、界(kingdom)、门(phylum)、纲(class)、目(order)、科(family)、属(genus)、种(species) 统计各样本的群落组成。
小鼠粪便样本共获得域: 1个; 界: 1个; 门: 10个; 纲: 17个; 目: 18个; 科: 31个; 属: 74个; 种: 133个; OTU: 572个。小鼠盲肠内容物样本共获得域: 1个; 界: 1个; 门: 11个; 纲: 17个; 目: 20个; 科: 34个; 属: 81个; 种: 145个; OTU: 639个。
5 肠道微生物16S rRNA基因测序深度评估小鼠粪便样品和盲肠内容物样品的稀释曲线(rarefaction curve) 见图 1。稀释曲线主要利用各样本的测序量在不同测序深度时的微生物alpha多样性指数构建曲线, 可反映各样本在不同测序数量时的微生物多样性, 并可比较测序数据量不同的样本中物种的丰富度、均一性或多样性, 说明样本的测序数据量是否合理。本实验中样品稀释曲线趋向平坦, 说明测序数据量合理, 测样深度可靠。
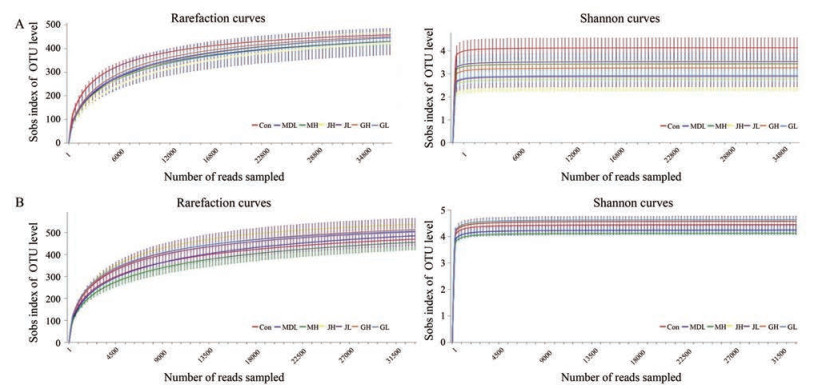
|
Figure 1 The rarefaction curves and shannon curves operational taxonomic units (OTUs) clustered at 97% sequence identity of all samples. A: Faeces; B: Cecal content |
研究环境中微生物的多样性可以通过单样本的多样性(alpha多样性) 分析反映微生物群落的丰富度和多样性, 包括一系列统计学分析指数估计环境群落的物种丰度和多样性。常用的度量标准有chao、shannon、ace、simpson和coverage。Sobs、ace和chao指数可反映群落丰富度(community richness); shannon和simpson指数反映群落多样性(community diversity); coverage指数可反映群落覆盖度(community coverage)。粪便样本多样性指数统计和盲肠内容物样本多样性指数统计见表 2。结果显示, 小鼠粪便样本中coverage指数在空白组与模型组比较时具有显著性差异(P < 0.001), 其余指数均有一定程度改变, 但并无显著性差异, 部分给药组多样性指数趋向空白组。
| Table 2 Alpha diversity indices in fecal sample and cecal content samples. n = 5, x±s. ###P < 0.001 vs Con |
小鼠粪便样本菌群群落结构门、属水平分析见图 2A。门水平上, 粪便各组样本中主要的门分类水平有: 厚壁菌门(Firmicutes)、拟杆菌门(Bacteroidetes)、疣微菌门(Verrucomicrobia) 和变形菌门(Proteobacteria)。厚壁菌门占据门水平中的主要比例, 拟杆菌门次之。属水平上, 按所占比例依次为乳酸杆菌属(Lactobacillus)、拟杆菌属(Bacteroidales) 和毛螺菌属(Lachnospiraceae) 等。空白组与模型组在属水平的构成上差异较大。

|
Figure 2 The differences in the community composition between the phylum units and the genus units. A: Faeces; B: Cecal content |
小鼠盲肠内容物样本菌群群落结构门、属水平分析见图 2B。门水平上, 盲肠内容物各组样本中主要的门分类水平有: 厚壁菌门(Firmicutes)、拟杆菌门(Bacteroidetes)、变形菌门(Proteobacteria)、脱铁杆菌门(Deferribacteres)、疣微菌门(Verrucomicrobia) 和放线菌门(Actinobacteria)。其中, 脱铁杆菌门(Deferribacteres) 及放线菌门(Actinobacteria) 在盲肠内容物样品中出现, 粪便样本中未检测出或含量较少。属水平上, 按所占比例依次为拟杆菌属(Bacteroidales)、毛螺菌属(Lachnospiraceae) 和乳酸杆菌属(Lactobacillus) 等。与新鲜粪便样本相比, 二者肠道菌群虽构成相似, 但不同门、属之间的组成比例差异较大。
8 差异菌属筛选及药物调节作用采用LEfSe软件找出对样本划分产生显著性差异影响的群落或物种。LEfSe是一种用于发现高维生物标识和揭示基因组特征的软件, 其可根据分类学组成对样本按照不同的分组条件进行线性判别分析(linear discriminant analysis, Lda), 并估算每个物种丰度对差异效果影响的大小[6]。比较空白组及模型组菌群, 粪便样本分析结果见图 3A, 盲肠内容物样本分析结果见图 3B。
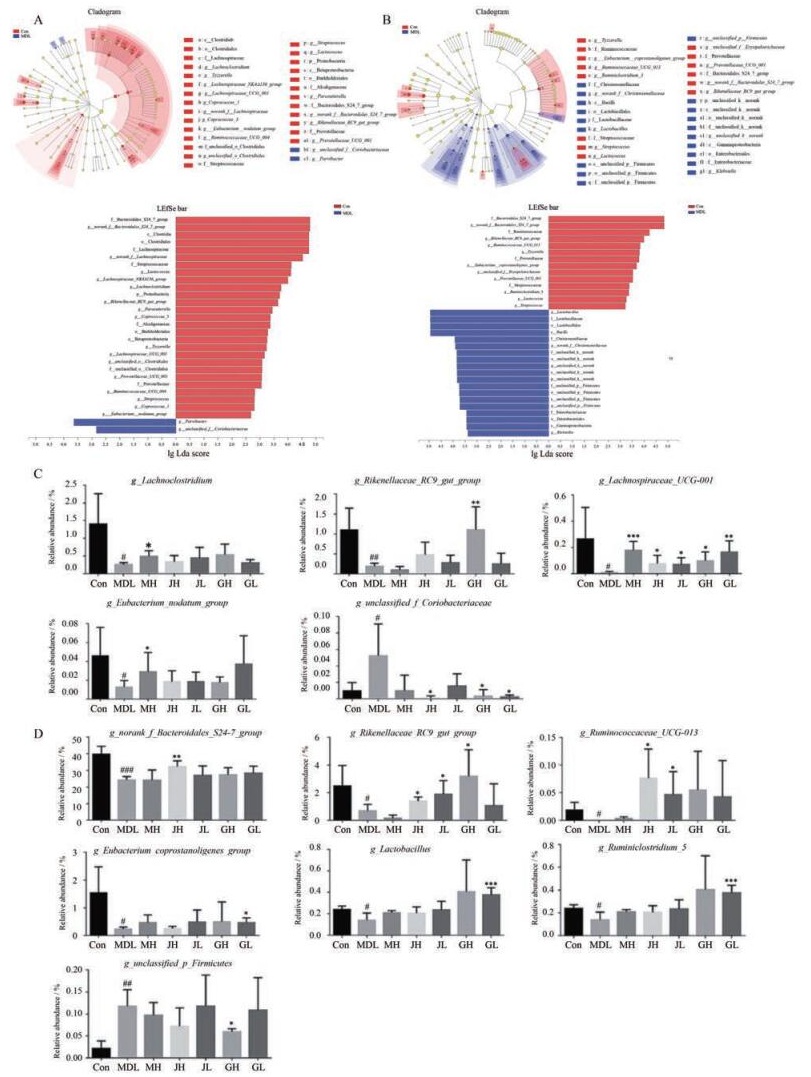
|
Figure 3 LEfSe hierarchical tree map of multistage species in faeces (A) and cecal content (B). Average relative abundance of difference features flora of different groups in faeces (C) and cecal content (D). n = 5, x±s. #P < 0.05, ##P < 0.01, ###P < 0.001 vs control; *P < 0.05, **P < 0.01, ***P < 0.001 vs model. Lda: Linear discriminant analysis |
在各给药组样本中, 对在空白与模型组中有差异的菌群进行统计学分析。粪便样本各组差异菌群的相对丰度分析结果见图 3C。与空白组相比, 模型组中g_Lachnoclostridium (P < 0.05)、g_Rikenellaceae_RC9_ gut_group (P < 0.01)、g_Eubacterium_nodatum_group (P < 0.05) 和g_Lachnospiraceae_UCG-001 (P < 0.05) 均呈显著性下降; g_unclassified_f__Coriobacteriaceae (P < 0.05) 呈显著性上升, 各给药组有不同程度的回调作用, 其中各给药组均能对g_Lachnospiraceae_UCG-001产生显著的上调作用。
盲肠内容物样本各组差异菌群的相对丰度分析结果见图 3D。与空白组相比, 模型组中g_Bacteroidales_ S24-7_group (P < 0.001)、g_Rikenellaceae_RC9_gut_group (P < 0.05)、g_Ruminococcaceae_UCG-013 (P < 0.05)、g_Eubacterium_coprostanoligenes_group (P < 0.05)、g_ Ruminiclostridium_5 (P < 0.05) 和g_Lactobacillus (P < 0.05) 呈显著性下降; g_unclassified_p__Firmicutes (P < 0.01) 呈显著性上升, 各给药组有不同程度的回调作用。
综合粪便及盲肠内容物样本实验, 结果表明, 各组药物能不同程度改善肠道菌群在模型组中的相对丰度, 部分组别对其具有显著调节作用, 回调其菌群结构的紊乱, 其中g_Rikenellaceae_RC9_gut_group在两类样本中均呈显著下降趋势。
9 肠道菌群功能性预测在粪便与盲肠内容物数据中发现多个相同功能预测结果(图 4), 其中糖转运与代谢(carbohydrate transport and metabolism) 途径在两组样本中丰度较高, 占主要地位, 另外, 二者还共同涉及氨基酸转运与代谢(amino acid transport and metabolism)、翻译及核糖体结构和生物合成(translation, ribosomal structure, and biogenesis)、细胞壁/膜/包体生物合成(cell wall/membrane/envelope biogenesis) 转录(transcription) 等代谢途径。
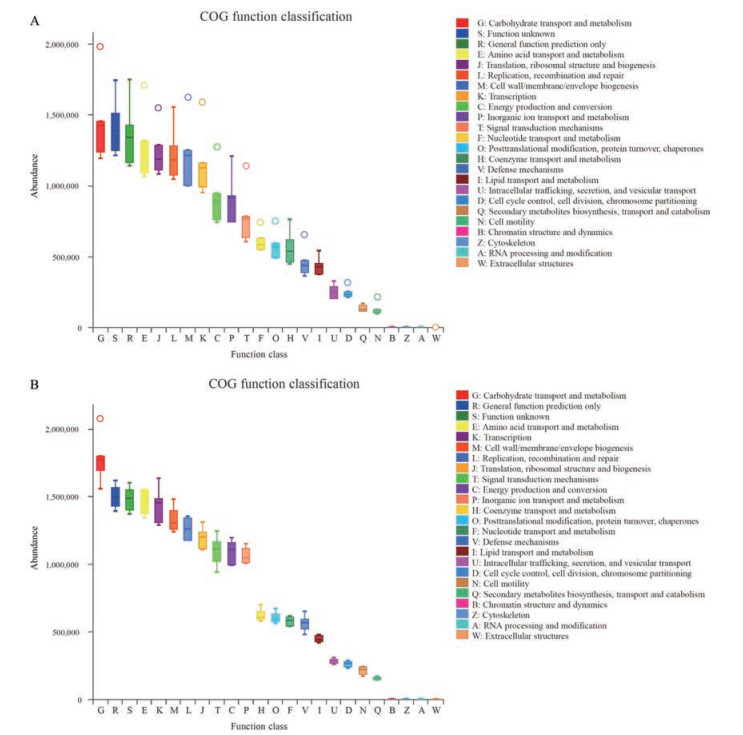
|
Figure 4 Metabolic function prediction of community samples. A: Faeces; B: Cecal content. COG: Cluster of orthologous groups |
结果显示(表 3), 该方法具有较好精密度和重复性, 样品在12 h内具有较好稳定性。
| Table 3 Linear regression equations, correlation coefficients, linear ranges, accuracy, repeatability, stability, and recovery of six short-chain fatty acids. n = 5, x±s. RSD: Relative standard deviation |
标准品和样品中的6种短链脂肪酸的气相色谱图以及其含量结果见图 5。在两类样本中, 各组含量占比最高的短链脂肪酸均为乙酸, 而异戊酸和戊酸含量相对较少。与空白组相比, 模型组小鼠新鲜粪便中的异戊酸和戊酸以及盲肠内容物中的6种短链脂肪酸含量发生显著减少(P < 0.01)。药物干预后发现, JL和GL组对新鲜粪便中的6种短链脂肪酸均具有显著回调作用(P < 0.01), 丹参总酚酸组均优于阳性药组; GH组除了对粪便中的丁酸无显著增加作用外, 对其他5种短链脂肪酸也具有广泛的回调作用(P < 0.01); JH组对乙酸、丁酸、异戊酸和戊酸具有显著上调作用(P < 0.01), 尤其是在丁酸中, 显著优于其他各给药组。盲肠内容物中的丙酸、异丁酸和异戊酸均能被各给药组调节, 含量显著增加(P < 0.01)。GH和GL组还能显著回调盲肠内容物中的丁酸和戊酸, 对后者的作用较其他各给药组更好; JH和JL组回调盲肠内容中乙酸的作用强于其他各给药组。虽然样本中各短链脂肪酸受各给药组调节的范围和强度略有不同, 但各给药组对两样本中的异戊酸均有显著上调作用(P < 0.001)。总之, 丹参茎叶总酚酸对两样本中乙酸的调节作用优于丹参根总酚酸, 而后者对两样本中丙酸和异丁酸的调节作用更佳。

|
Figure 5 Chromatogram of standard and sample, and contents of 6 short-chain fatty acids. A: Standard; B: Sample (1. Acetic acid; 2. Propionic acid; 3. Isobutyric acid; 4. Butyrate acid; 5. Isovaleric acid; 6. Valeric acid); C: Faeces; D: Cecal contents. n = 5, x±s. ##P < 0.01, ###P < 0.001 vs control; *P < 0.05, **P < 0.01, ***P < 0.001 vs model |
应用R语言对不同差异菌群(门水平和属水平) 与短链脂肪酸含量绘制相关性分析热图(图 6)。本实验中, Spearman相关系数r > 0.4和r < -0.4分别表示中度正相关与中度负相关。
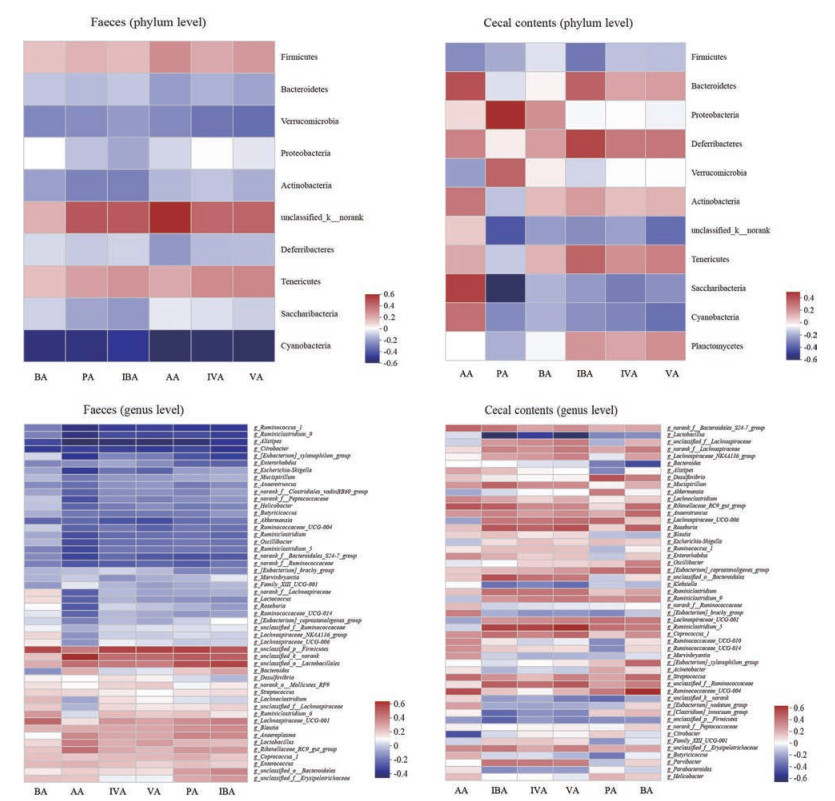
|
Figure 6 Heat map of correlation analysis between different intestinal flora and short-chain fatty acid content in fresh feces and cecal contents. AA: Acetic acid; PA: Propionic acid; BA: Butyric acid; IBA: Isobutyrlc acid; VA: Valerlc acid; IVA: Isovalerlc acid |
新鲜粪便检测结果表明, 在门水平上, 蓝细菌门(Cyanobacteria) 与6种短链脂肪酸均呈中度负相关。在属水平上, g_unclassified_p__Firmicute与丙酸、异丁酸、丁酸、异戊酸和戊酸均呈中度正相关, g_unclassified_ o__Lactobacillales与丙酸和异丁酸均呈中度正相关; 另枝菌属(g_Alistipes) 与乙酸、丙酸、异戊酸和戊酸呈中度负相关。
盲肠内容物检测结果表明, 在门水平上, 变形菌门(Proteobacteria) 与丙酸和丁酸呈中度正相关; 糖化细菌门(Saccharibacteria) 与乙酸呈中度正相关, 而与丙酸呈中度负相关。在属水平上, 与乙酸呈中度正相关的是理研菌科_RC9组(g_Rikenellaceae_RC9_gut_group) 和瘤胃菌科_UCG-004 (g_Ruminococcaceae_ UCG-004); 与丙酸呈中度正相关的是脱硫弧菌属(g_Desulfovibrio); 与异丁酸呈中度正相关的是理研菌科_RC9组(g_Rikenellaceae_RC9_gut_group)、罗氏菌属(g_Roseburia)、g_unclassified_o__Bacteroidales、瘤胃梭菌属_5 (g_Ruminiclostridium_5) 和g_unclassified_ f__Ruminococcaceae; 与丁酸呈中度正相关的是罗氏菌属(g_Roseburia) 和瘤胃菌科_UCG-004 (g_Ruminococcaceae_UCG-004); 与异戊酸呈中度正相关的是瘤胃梭菌属_5 (g_Ruminiclostridium_5); 与戊酸呈中度正相关的是罗氏菌属(g_Roseburia)、瘤胃梭菌属_5 (g_ Ruminiclostridium_5) 和g_unclassified_f__Ruminococcaceae。与乙酸呈中度负相关的是柠檬酸杆菌属(g_ Citrobacter); 与异丁酸呈中度负相关的是乳杆菌属(g_ Lactobacillus)、克雷伯氏菌属(g_Klebsiella)、无害梭菌属组(g_[Clostridium]_innocuum_group) 和g_unclassified_p__Firmicutes; 与丁酸呈中度负相关的是拟杆菌属(g_Bacteroides); 与异戊酸呈中度负相关的是乳杆菌属(g_Lactobacillus); 与戊酸呈中度负相关的是乳杆菌属(g_Lactobacillus) 和拟杆菌属(g_Bacteroides)。
讨论2型糖尿病是最常见的糖尿病类型, 约占所有糖尿病病例的90%[19], 临床患者多会发生大血管和微血管并发症。db/db小鼠是4号染色体瘦素受体缺陷型小鼠, 也是FDA推荐的用于研发治疗2型糖尿病药物常用的动物模型之一[20], db/db小鼠模型后期可发生明显的肾病[21], 故本研究以自发性2型糖尿病肾病小鼠为实验模型, 采用16S rDNA高通量测序技术分析db/db糖尿病肾病小鼠粪便及盲肠内容物样本中肠道菌群多样性, 并检测其FBG、SCr、BUN、TG和TC水平。SCr和BUN均为临床上评价肾脏损伤程度的重要指标。SCr可通过肾小球滤过, 在肾小管内少量吸收, 血清肌酐水平的升高意味着肾功能损害。临床上常将BUN作为判断肾小球滤过功能的指标, 在肾功能不全时, BUN将升高。TG和TC是评价体内血脂水平的重要指标, 也是糖尿病肾病研究中的常用检测指标[22, 23]。结果显示模型组小鼠FBG、SCr、BUN、TG和TC水平均较空白组呈显著性上升趋势, 表明其糖尿病肾病模型成功。与模型组相比, 丹参茎叶酚酸和丹参根酚酸均可不同程度改善模型小鼠体内血糖和血脂水平紊乱以及肾脏损伤的情况, 且总体而言高剂量组治疗效果优于相应的低剂量组。
肠道菌群多样性检测结果表明, 与正常组相比, 糖尿病肾病小鼠粪便及盲肠内容物样本中的菌群从门水平到属水平均发生了显著变化; 粪便及盲肠内容物样本肠道菌群虽构成相似, 但不同门、属之间的组成比例差异较大。粪便样本中, 厚壁菌门占据门水平中主要比例, 拟杆菌门次之, 其余还包括疣微菌门和变形菌门; 属水平上, 按所占比例依次为乳酸杆菌属、拟杆菌属和毛螺菌属等。盲肠内容物样本中主要的门分类水平有厚壁菌门、拟杆菌门、变形菌门、脱铁杆菌门、疣微菌门和放线菌门, 其中, 脱铁杆菌门及放线菌门在盲肠内容物样品中检出, 粪便样本中未检测出或含量较少; 属水平上, 按所占比例依次为拟杆菌属、毛螺菌属和乳酸杆菌属等。
在小鼠和人体内, 厚壁菌门和拟杆菌门是肠道菌群门分类水平的主要组成部分。已有研究表明肠道菌群的失衡可引起肥胖[24], 且与厚壁菌门和拟杆菌门的比例相关, 比例越高, 肥胖症状越明显[25, 26]; 亦有研究发现其比值的降低与体内葡萄糖水平的改善、脂肪积累的减轻和体重的降低相关[27, 28]。本实验粪便及盲肠内容物样本中, 与空白组相比, 模型组厚壁菌门丰度上升, 拟杆菌门丰度下降, 其比值呈上升趋势。乳酸杆菌是生活在机体内益于宿主健康的微生物, 可参与调节免疫及胰岛素抵抗, 从而进一步调节脂质和葡萄糖代谢[29]; 亦有研究表明增加乳酸杆菌比例可降低2型糖尿病患者感染的风险并具有血糖保护作用[30]。本实验盲肠内容物样本中, 模型组乳酸杆菌呈下降趋势。
短链脂肪酸是肠道菌群影响机体的主要方式之一, 不仅可以保持肠道的酸性环境, 抑制肠道内有害菌的生长, 还可以与GPR43受体(G protein-coupled receptor 43) 结合刺激L细胞从而调节能量利用[31, 32]。肠道内通过碳水化合物发酵而成的短链脂肪酸多数由乙酸、丙酸和丁酸组成, 而支链脂肪酸一般是蛋白质发酵的产物, 如异丁酸和异戊酸等[33-35], 上述发现可以解释本实验中乙酸、丙酸和丁酸含量较高的现象。与空白组相比, 两类样本中各种短链脂肪酸的含量均有下调, 但盲肠内容物下调短链脂肪酸的种类较新鲜粪便更多, 提示2型糖尿病肾病会降低小鼠体内短链脂肪酸的含量, 且该作用对盲肠内容物的影响更大。给药后, 丹参总酚酸给药组的调节作用普遍要优于阳性药组, 说明丹参根和茎叶中的总酚酸均具有较好的提高小鼠体内短链脂肪酸含量的效果。
有研究表明, 当机体发生糖脂代谢紊乱时, 相关肠道菌群的稳态就会遭到破坏, 从而降低短链脂肪酸的产量[36]。文献[37, 38]显示, 蓝细菌门几乎无处不在, 它产生的毒素可导致肠胃炎和肌萎缩侧索硬化症等多种急慢性疾病; 但也有研究表明蓝细菌门对链脲佐菌素诱导的糖尿病大鼠具有抗氧化和抗糖尿病保护作用。本实验结果显示, 蓝细菌门与6种短链脂肪酸产生中度负相关性, 推测在本实验中该菌门对被测短链脂肪酸主要产生不利影响, 但尚不能由此推测其与2型糖尿病之间的关系, 需要后续开展相关研究。乳酸杆菌是肠道中的益生菌, 对抑制有害菌的生长和维护肠道健康具有重要作用[39]。本实验中g_Lactobacillus和g_ unclassified_o__Lactobacillales均属于乳酸杆菌目, 但两者对于短链脂肪酸的相关性具有很大的差异性, 提示在2型糖尿病小鼠体内相同菌目对短链脂肪酸的影响并不存在一致性。本研究发现, 瘤胃梭菌属_5 (g_Ruminiclostridium_5) 和g_unclassified_f__Ruminococcaceae均与不同短链脂肪酸产生不同程度的中度正相关性, 这与瘤胃菌科(Ruminococcaceae) 是产生短链脂肪酸的主要菌之一的报道相吻合[40]。资料显示, 虽然丁酸在肠道内含量不高, 但是其对结肠黏膜上皮细胞功能及维护宿主胃肠道健康具有不容忽视的重要性[41, 42]。瘤胃菌科_UCG-004 (g_Ruminococcaceae_ UCG-004) 和罗氏菌属(g_Roseburia) 都属于丁酸盐的产生菌, 可以解释其与丁酸表现出中度正相关的现象。与空白组相比, 模型组小鼠两类样本中理研菌科_RC9组(g_Rikenellaceae_RC9_gut_group) 都发生了显著下降, 且给药后两者都发生了不同程度的回调, 且对盲肠内容物中该菌属的回调效果更甚。相关性分析结果显示, 理研菌科_RC9组(g_Rikenellaceae_RC9_gut_group) 与盲肠内容物中的乙酸和异丁酸具有中度相关性。结合两者结果, 可以推测理研菌科_RC9组(g_Rikenellaceae_ RC9_gut_group) 可能是2型糖尿病肾病小鼠体内肠道菌群与短链脂肪酸相互影响的一个重要菌属, 丹参总酚酸对2型糖尿病肾病小鼠的调节作用可能与之有关。
结合各给药组差异菌群结果可发现, 糖尿病肾病小鼠体内肠道菌群结构发生改变; 丹参茎叶总酚酸及丹参根总酚酸药物干预后可调节模型小鼠体内的肠道菌群紊乱; 两类药物可以通过调节部分短链脂肪酸产生菌的含量提高肠道内短链脂肪酸的含量, 发挥为机体供能的作用, 利于健康的恢复。丹参茎叶总酚酸及丹参根总酚酸调节糖尿病肾病小鼠体内生化指标的药效结果相似, 丹参茎叶总酚酸在调节部分差异菌种和上调部分短链脂肪酸的作用略优于丹参根总酚酸。本实验结果可为后期丹参茎叶中酚酸类成分的合理开发利用提供科学依据。
作者贡献: 宿树兰和段金廒设计实验并提供资金; 徐卓和项想参与实验、分析数据和撰写及修改论文; 尚尔鑫、郭建明和钱大玮提供实验技术支持。
利益冲突: 所有作者均声明不存在利益冲突。
| [1] |
Chapman A, Yang H, Thomas SA, et al. Barriers and enablers to the delivery of psychological care in the management of patients with type 2 diabetes mellitus in China: a qualitative study using the theoretical domains framework[J]. BMC Health Serv Res, 2016, 16: 106. DOI:10.1186/s12913-016-1358-x |
| [2] |
Chen L, Guan FY, Yu Y. Mitochondrial dynamics in type 2 diabetes mellitus and diabetes complications[J]. Chin J Pharmacol Toxicol (中国药理学与毒理学杂志), 2015, 29: 339-347. |
| [3] |
Sender R, Fuchs S, Milo R. Revised estimates for the number of human and bacteria cells in the body[J]. PLoS Biol, 2016, 14: e1002533. DOI:10.1371/journal.pbio.1002533 |
| [4] |
Nicholson J K, Holmes E, Kinross J, et al. Host-gut microbiota metabolic interactions[J]. Science, 2012, 336: 1262-1267. DOI:10.1126/science.1223813 |
| [5] |
Dai XX, Cai HD, Su SL, et al. Regulatory effect of the leaves of Rehmannia glutinosa Libosch on intestinal microflora in diabetic nephropathy rats[J]. Acta Pharm Sin (药学学报), 2017, 52: 1683-1691. |
| [6] |
Meijers B, Jouret F, Evenepoel P. Linking gut microbiota to cardiovascular disease and hypertension: lessons from chronic kidney disease[J]. Pharmacoll Res, 2018, 133: 101-107. DOI:10.1016/j.phrs.2018.04.023 |
| [7] |
Sun M, Wu W, Liu Z, et al. Microbiota metabolite short chain fatty acids, GPCR, and inflammatory bowel diseases[J]. J Gastroenterol, 2017, 52: 1-8. DOI:10.1007/s00535-016-1242-9 |
| [8] |
Shen B, Hu JJ, Song H, et al. Antibiotics exacerbated colitis by affecting the microbiota, treg cells and SCFAs in IL10-deficient mice[J]. Biomed Pharmacother, 2019, 114: 108849. DOI:10.1016/j.biopha.2019.108849 |
| [9] |
Wang SQ, Lv D, Jiang SH, et al. Quantitative reduction in short-chain fatty acids, especially butyrate, contributes to the progression of chronic kidney disease[J]. Clin Sci, 2019, 133: 1857-1870. DOI:10.1042/CS20190171 |
| [10] |
Palomo-Buitrago ME, Sabater-Masdeu M, Moreno-Navarrete JM, et al. Glutamate interactions with obesity, insulin resistance, cognition and gut microbiota composition[J]. Acta Diabetol, 2019, 56: 569-579. DOI:10.1007/s00592-019-01313-w |
| [11] |
Pang HQ, Wu L, Tang YP, et al. Chemical analysis of the herbal medicine Salviae Miltiorrhizae Radix et Rhizoma (Danshen)[J]. Molecules, 2016, 21: 51-67. DOI:10.3390/molecules21010051 |
| [12] |
Liu M, Xia XH, Zhang ZM, et al. Comparative study on antioxidant activities of salvianolic acid B, caffeic acid, protocatechuic aldehyde and salvianolic acid B in vitro[J]. Chin Med Mat (中药材), 2009, 32: 265-267. |
| [13] |
Gu JF, Su SL, Guo JM, et al. The aerial parts of Salvia miltorrhiza Bge. strengthen intestinal barrier and modulate gut microbiota imbalance in diabetic mice[J]. J Funct Foods, 2017, 36: 362-374. DOI:10.1016/j.jff.2017.06.010 |
| [14] |
Cai HD, Su SL, Li Y, et al. Protective effects of Salvia miltiorrhiza on adenine-induced chronic renal failure by regulating the metabolic profiling and modulating the NADPH oxidase/ROS/ERK and TGF-β/Smad signaling pathways[J]. J Ethnopharmacol, 2017, 212: 153-165. |
| [15] |
Xiang X, Cai HD, Su SL, et al. Salvia miltiorrhiza protects against diabetic nephropathy through metabolome regulation and wnt/β-catenin and TGF-β signaling inhibition[J]. Pharmacol Res, 2019, 139: 26-40. DOI:10.1016/j.phrs.2018.10.030 |
| [16] |
Xiang X, Sun CJ, Su SL, et al. Optimization of extraction and purification technology for phenolic acids and flavonoids in stems and leaves of Salvia miltiorrhiza[J]. Chin Tradit Herbal Drugs (中草药), 2018, 49: 120-127. |
| [17] |
Lu MM, Tao LJ, Mei WJ, et al. Effect of curcumin on the expression of p-STAT3 and IκB in db/db mice[J]. J Cent South Univ (Med Sci) (中南大学学报医学版), 2014, 39: 591-597. |
| [18] |
Rong XR, He YS, Wang Y. Effect of berberine hydrochloride on intestinal flora structure in diabetic rats[J]. Chin J Integr Med Cardio (中西医结合心脑血管病杂志), 2016, 14: 1221-1223. |
| [19] |
Evans JM, Newton RW, Ruta DA, et al. Socio-economic status, obesity and prevalence of type 1 and type 2 diabetes mellitus[J]. Diabet Med, 2010, 17: 478-480. |
| [20] |
Lu J, Liu J, Pei TX, et al. Study on biological characteristics of spontaneous type 2 diabetic model db/db mice[J]. Drug Eval Res (药物评价研究), 2013, 36: 341-345. |
| [21] |
Niu MM, Chen H. Research progress of laboratory animal models of diabetic neuropathy[J]. Lab Anim Sci (实验动物科学), 2018, 35: 86-92. |
| [22] |
Chen DD, Xu R, Zhou JY, et al. Cordyceps militaris polysaccharides exerted protective effects on diabetic nephropathy in mice via regulation of autophagy[J]. Food Funct, 2019, 10: 5102-5114. DOI:10.1039/C9FO00957D |
| [23] |
Zhang CX, Li Q, Lai SS, et al. Attenuation of diabetic nephropathy by Sanziguben Granule inhibiting EMT through Nrf2-mediated anti-oxidative effects in streptozotocin (STZ)-induced diabetic rats[J]. J Ethnopharmacol, 2017, 205: 207-216. DOI:10.1016/j.jep.2017.05.009 |
| [24] |
Park JH, Schaller M, Crandall CS. Pathogen-avoidance mechanisms and the stigmatization of obese people[J]. Evol Hum Behav, 2007, 28: 410-414. DOI:10.1016/j.evolhumbehav.2007.05.008 |
| [25] |
Abdallah Ismail N, Ragab SH, Abd Elbaky A, et al. Frequency of Firmicutes and Bacteroidetes in gut microbiota in obese and normal weight Egyptian children and adults[J]. Arch Med Sci, 2011, 7: 501-507. |
| [26] |
Koliada A, Syzenko G, Moseiko V, et al. Association between body mass index and Firmicutes/Bacteroidetes ratio in an adult Ukrainian population[J]. BMC Microbiol, 2017, 17: 120. DOI:10.1186/s12866-017-1027-1 |
| [27] |
Ley RE, Bäckhed F, Turnbaugh P, et al. Obesity alters gut microbial ecology[J]. Proc Natl Acad Sci U S A, 2005, 102: 11070-11075. DOI:10.1073/pnas.0504978102 |
| [28] |
Turnbaugh PJ, Bäckhed F, Fulton L, et al. Marked alterations in the distal gut microbiome linked to diet-induced obesity[J]. Cell Host Microbe, 2008, 3: 213-223. DOI:10.1016/j.chom.2008.02.015 |
| [29] |
Lê KA, Li Y, Xu X, et al. Alterations in fecal Lactobacillus and Bifidobacterium species in type 2 diabetic patients in Southern China population[J]. Front Physiol, 2013, 3: 496. |
| [30] |
Tremaroli V, Bäckhed F. Functional interactions between the gut microbiota and host metabolism[J]. Nature, 2012, 489: 242-249. DOI:10.1038/nature11552 |
| [31] |
Zhang YC. Study on the Improvement of Consitipation in Hemodialysis Patients by Oral Probiotics (口服益生菌对血液透析病人便秘症状的改善研究)[D]. Handan: Hebei University of Engineering (河北工程大学), 2018.
|
| [32] |
Fei J, Luo JT, Zhang XY, et al. The role of short-chain fatty acids in regulating human energy metabolism by intestinal flora[J]. Chin J Diabetes Mellitus (中华糖尿病杂志), 2018, 10: 370-373. |
| [33] |
Yang J, Wang JY, Chen L, et al. Advance in studying the effect of gut microflora on glycolipid metabolism[J]. Microbiol China (微生物学通报), 2019, 46: 179-187. |
| [34] |
Cummings JH, Pomare EW, Branch WJ, et al. Short chain fatty acids in human large intestine, portal, hepatic and venous blood[J]. Gut, 1987, 28: 1221-1227. DOI:10.1136/gut.28.10.1221 |
| [35] |
Smith EA, Macfarlane GT. Dissimilatory amino acid metabolism in human colonic bacteria[J]. Anaerobe, 1997, 3: 327-337. DOI:10.1006/anae.1997.0121 |
| [36] |
Canfora EE, Jocken JW, Blaak EE. Short-chain fatty acids in control of body weight and insulin sensitivity[J]. Nat Rev Endocrinol, 2015, 11: 577-591. DOI:10.1038/nrendo.2015.128 |
| [37] |
Facciponte DN, Bough MW, Seidler D, et al. Identifying aerosolized cyanobacteria in the human respiratory tract: a proposed mechanism for cyanotoxin-associated diseases[J]. Sci Total Environ, 2018, 645: 1003-1013. DOI:10.1016/j.scitotenv.2018.07.226 |
| [38] |
Pandurangan M, Kim DH. Therapeutic potential of cyanobacteria against streptozotocin-induced diabetic rats[J]. 3 Biotech, 2016, 6: 94. |
| [39] |
Pace F, Pace M, Quartarone G. Probiotics in digestive diseases: focus on Lactobacillus GG[J]. Minerva Gastroenterol Dietol, 2015, 61: 273-292. |
| [40] |
Ohira H, Tsutsui W, Fujioka Y. Are short chain fatty acids in gut microbiota defensive players for inflammation and atherosclerosis?[J]. J Atheroscler Thromb, 2017, 24: 660-672. DOI:10.5551/jat.RV17006 |
| [41] |
Liu H, Wang J, He T, et al. Butyrate: a double-edged sword for health?[J]. Adv Nutr, 2018, 9: 21-29. DOI:10.1093/advances/nmx009 |
| [42] |
Takahashi K, Nishida A, Fujimoto T, et al. Reduced abundance of butyrate-producing bacteria species in the fecal microbial community in Crohn's disease[J]. Digestion, 2016, 93: 59-65. DOI:10.1159/000441768 |
 2020, Vol. 56
2020, Vol. 56


