濒危植物黄瑞香Daphne giraldii Nitsche属于瑞香科瑞香属, 其干燥根皮入药, 药材名为祖师麻; 性温, 味辛、苦, 有小毒[1], 具有祛风湿、活血止痛之功效; 用于治疗胃痛、风湿疼痛、腰痛、跌打损伤及骨折等症, 民间所言: “疼得满地爬, 就用祖师麻”; 其主要活性成分是祖师麻甲素。以黄瑞香为主要原料的中成药祖师麻片、祖师麻贴膏等在治疗关节炎、类风湿性关节炎疗效显著, 是临床常用成药。目前黄瑞香均为野生资源, 但因其地理位置和生长环境的特殊性及人为因素[2, 3], 其资源蕴藏量正急剧下降, 药材市场供不应求。因此, 除了宏观角度(种植技术) 以外, 从植物微观角度(内生菌) 层面研究黄瑞香、探究内生菌对黄瑞香生长过程是否有影响, 能否提高祖师麻甲素的含量对解决黄瑞香资源匮乏问题具有十分重要的意义, 那么第一步就是对黄瑞香内生菌进行整体的分析, 为后续的研究工作铺垫。
内生菌(主要包括真菌、细菌等) 广泛存在于植物组织或器官, 参与植物体内营养物质的合成, 影响药用植物的生长和发育[4-6], 并产生与药用植物有效成分相近的次生代谢产物。如Wu等[7]发现三七内生菌的丰富度大小对植株正常发育产生影响; Zhou等[8]在丹参中筛选的1株内生真菌对丹参生长发育以及丹参中的活性成分都有显著提高。因此, 可以类比推测, 黄瑞香在生长过程中, 其主要成分祖师麻甲素也可能会受到内生真菌的影响, 只有明确黄瑞香植物内生菌的分布以及多样性, 后续个体菌的筛选以及探究含量与菌种的关系才更有说服力, 所以探究黄瑞香内生真菌多样性的是很重要的一个环节。
高通量测序技术是新一代测序方式, 具有测序速度快、信息量大、准确率高的优点, 将此技术应用于揭示微生物的物种和群落多样性具有很强的优势[9]。如Wang等[10]采用高通量测序技术对重楼根际土及不同部位的真菌研究发现, 根内生菌多样性大于叶, 各个群落间的多样性差异显著。因而, 高通量测序技术也可能是研究黄瑞香内生真菌多样性的首选方法。
本论文采用高通量测序技术, 分析了黄瑞香根部内生真菌物种组成、优势属及内生真菌多样性, 以期为濒危植物黄瑞香真菌库的建立及筛选促进黄瑞香生长和提高祖师麻甲素含量的内生真菌提供科学依据。
材料与方法材料 在甘肃宕昌县、甘谷县和山西五台县分别采集野生黄瑞香植株(表 1)。每个样地各选择3株黄瑞香植株, 采样时除去表土, 挖取黄瑞香根部, 保证黄瑞香根完整。将黄瑞香样品装入无菌袋中并编号记录采样时间、地点、环境条件等。样品带回实验室后, 立即流水冲洗掉表面粘连的土壤, 无菌吸水纸吸干水分。将根在超净工作台内用5%次氯酸钠表面消毒15 min, 样品-80 ℃超低温冰箱保存。经北京中医药大学刘春生教授鉴定为黄瑞香Daphne giraldii Nitsche。
| Table 1 Sample information |
仪器 超微量分光光度计(NanoDrop2000, ThermoFisher Scientific公司); PCR仪(ABI GeneAmp® 9700型, ABI公司); MISEQ测序仪(Illumina Miseq, Illumina公司); 移液器(EppendorfN13462C, Eppendorf公司)。
样品处理方法 取鲜黄瑞香根样品, 置于无菌超净工作台中进行表面灭菌处理, 后将3个产地的黄瑞香根用无菌水冲洗外表至干净, 滤纸吸干表面的水分, 后在75%乙醇溶液中浸泡30 s, 用无菌镊子及解剖刀轻轻刮去表皮层, 再用无菌水冲洗样品表面3次, 无菌滤纸吸干, 最后用无菌小刀将黄瑞香根皮切成小块, 将每个产地的样品置于无菌2 mL离心管中冰盒保存, 样本号分别为甘肃宕昌样本(TC)、甘肃甘谷样本(GG)、山西五台样本(WT)。
DNA提取及PCR扩增方法 取样品1 g, 用无菌水5 mL均质30 min, 进行DNA提取。参照E.Z.N.A.®soil试剂盒(Omega Bio-tek, Norcross, GA, US) 说明书提取总DNA, 并利用NanoDrop2000检测纯度与浓度, 再采用1%琼脂糖凝胶电泳检测DNA完整性。电泳条件: 5 V·cm-1, 时间: 20 min。PCR反应体系20 μL: 正反引物各0.8 μL、10×Buffer 2 μL、2.5 mmol·L-1 dNTPs 2 mL、rTaq Poly‐merase 0.2 μL、BSA 0.2 μL、Template DNA 10 ng, 补ddH2O至20 μL, ITS1F: 5'-CTTGGTCATTT AGAGGAAGTAA-3', ITS2R: 5'-GCTGCGTTCTTCAT CGATGC-3'。PCR反应条件: 95 ℃ 3 min; 95 ℃ 30 s, 55 ℃ 30 s, 72 ℃ 60 s, 31个循环; 72 ℃ 10 min, 10 ℃停止。每个样本3个重复, 将同一样品的PCR产物混合, 经2%琼脂糖凝胶电泳检测。参照电泳初步定量结果, PCR产物用QuantiFluorTM-ST蓝色荧光定量系统定量检测, 之后按照样本测序要求进行混合。使用2%琼脂糖凝胶回收PCR产物, 利用AxyPrep DNA Gel Extraction Kit (Axygen Biosciences, USA) 进行纯化, Tris-HCI缓冲液洗脱, 2%琼脂糖电泳检测。之后进行Miseq测序。
MiSeq文库构建及测序方法 采用TruSeq TM DNA Sample Prep Kit制备测序文库, 并进行Illumina测序[11]。
生物信息学分析 将Miseq测序得到的PE读长序列(paired-end reads) 根据重叠关系进行拼接, 根据软件对序列进行筛选, 删去低质量序列。根据97%的相似性水平, 将获得的高质量序列合并、过滤成不同的操作单元(OTU)。对OTU进行生物信息学统计分析, 并分别在各个分类学水平: 域(domain), 界(kingdom), 门(phylum), 纲(class), 目(order), 科(family), 属(genus), 种(species) 进行每个样本群落组成的统计。采用Alpha多样性来反映微生物群落的丰度和多样性, 其中Chao、Ace指数反映群落的丰富度; Shannon、Simpson指数反映群落的多样性。
结果与分析 1 质量分析2个地区的9份黄瑞香样品条带浓度正确, 大小合适。通过Miseq测序3个产地9份黄瑞香根皮样本[甘肃宕昌样本(TC1-3)、甘肃甘谷样本(GG4-6)、山西五台样本(WT7-9)], 具体信息如表 2所示。共获得有效序列632 766条, 序列长度在141~521 bp, 平均长度在227 bp, 其中7号山西五台县样本的序列数为最多, 达到72 805条, 1号甘肃宕昌县样本的序列数最少为45 303条。
| Table 2 Sample test sequence information |
从Venn图结果可以看出, 三种不同产地黄瑞香根样品含有的共有和各自特有的菌种数目, 同时展示出不同样品间菌种的重叠情况。从GG (甘谷县) 黄瑞香样品中分析出内生真菌132个种, 从WT (五台县) 黄瑞香样品中分析出内生真菌153个种, 从TC (宕昌县) 黄瑞香样品中分析出内生真菌46个种。其中, GG和WT共有80个菌种, 占比38.46%。GG与TC共有35个菌种, 占比16.83%; TC和WT共有40个菌种, 占比19.23%。GG、WT和TC共有32个菌种, 三者共有菌种占比15.38% (图 1)。
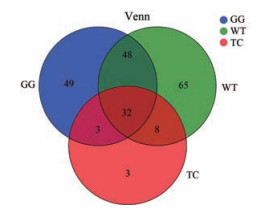
|
Figure 1 Venn diagram of endophytic fungi species of different samples in different origins |
利用高通量测序技术分析不同产黄瑞香根皮的9份样品, 结果划分为348个OTU, 4门, 20纲, 48目, 108科, 154属, 208种。统计每个样本中每个OTU所含的序列数, 将所含有的序列条数由大到小等级排序, 以OTU的排序等级为横坐标, OTU中序列数的相对百分含量为纵坐标作排列分布-丰度曲线图, 排列分布-丰度曲线是用来解释物种丰度和物种均匀度。由图 2可知, GG组与WT组的曲线较宽, 曲线较平缓即说明这两组物种丰度越高, 物种分布越均匀。相比这两组, TC组曲线开始急剧下降, 说明其存在着优势菌群占有一定优势, 而后曲线平缓, 说明物种分布比较均匀。

|
Figure 2 The curves of rank-abundance |
采用Shannon、Simpson、Chao、Ace等指数揭示黄瑞香样品根皮内生真菌的α多样性。其中Shannon以及Simpson指数用于衡量物种多样性, Shannon指数越大, 群落多样性越高, 而Simpson指数越大, 群落多样性越低; Chao指数以及Ace指数代表物种的数量, 数值越大, 表示菌群物种的数量越多。由表 3可知, 1号样品的Ace以及Chao指数最低, 说明其真菌物种数量较其他组少。9号样品的Ace以及Chao指数最高, 说明其真菌物种数量较其他组多。4号样品Shannon指数最高, 1号样品Simpson指数最高, 说明4号样品真菌的物种多样性程度较高, 1号样品真菌的物种多样性程度较低。
| Table 3 The Alpha diversity table of samples |
9份黄瑞香样品得到4门, 20纲, 48目, 108科, 154属, 共208种真菌。在属水平上, 被鉴定出来的有链格孢属(Alternaria)、瓶霉菌属(Phialophora)、茎点霉属(Phoma)、附球菌属(Epicoccum)、线黑粉酵母属(Filobasidium)、轮枝孢属(Verticillium)、枝孢属(Cladosporium)、担孢酵母属(Erythrobasidium)、壳月孢属(Selenophoma)、核盘菌属(Sclerotinia)、掷孢酵母属(Sporobolomyces)、镰刀菌属(Fusarium) 等。其中链格孢属丰度占比最高(图 3)。在属水平上还发现, 宕昌县黄瑞香内生真菌种类较少, 优势菌种为链格孢属, 与OTU等级丰度图和Alpha多样性显示的结果相吻合。在种水平上被鉴定出的种有黑附球菌(Epicoccum nigrum)、大线黑粉酵母菌(Filobasidium magnum)、云状轮枝菌(Verticillium nubilum)、熟食枝孢霉(Cladosporium delicatulum)、核盘菌(Sclerotinia sclerotiorum)、茄病镰刀菌(Fusarium solani)、大蒜叶枯病菌 (Stemphylium vesicarium) 等(图 4)。未被鉴定出的有链格孢属真菌(unclassfied_ g__Alternaria), 亚隔孢壳科中的一种真菌(unclassfied_ f__Didymellaceae); 一种泡质盘菌 (unclassfied_g__ Peziza), 一种子囊菌 (unclassfied_P__Ascomycota), 瓶霉菌属一种真菌(unclassfied_g__Phialophora) 等。
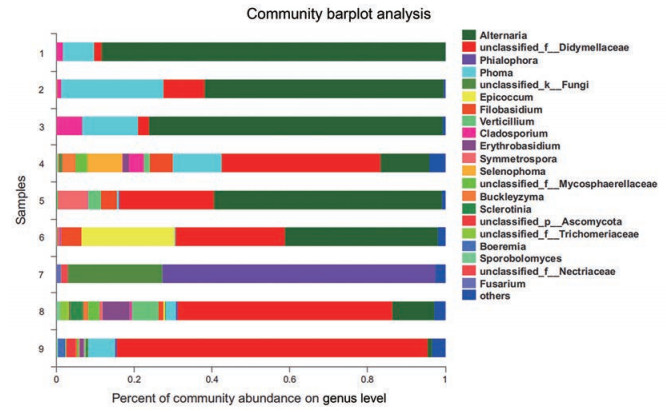
|
Figure 3 Species composition at genus level in 9 samples (Different colors represent different genus, and the length of the patch indicates the relative abundance ratio of the genus; the genus with low abundance merge into others, and the unclassified indicates the species that are not taxonomically annotated) |
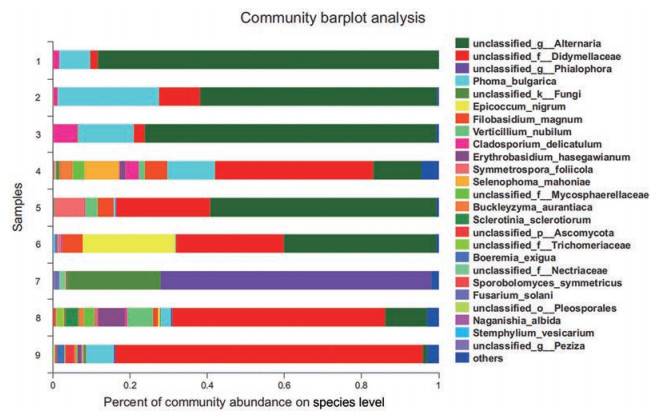
|
Figure 4 Species composition at species level in 9 samples (Different colors represent different species, and the length of the patch indicates the relative abundance ratio of the species; the species with low abundance merge into others, and the unclassified indicates the species that are not taxonomically annotated) |
9份样品中, 瓶霉菌属(Phialophora) 是7号样品五台县特有的, 丰度占比达到70.20%, 推测原因有可能为个体土壤的差异或者与其他植物处于共生环境中, 或有可能是瓶霉菌属菌株污染所导致, 结果还需要后续加大样本量和重复实验做进一步验证。其余8份样品丰度占比前3的真菌属为链格孢属、茎点霉属以及亚隔孢壳科中未鉴定出的真菌属(unclassified_f__ Didymellaceae), 丰度占比如表 4所示, 排名前3的真菌属之和能够占到总丰度的65%以上, 最高可以达到98.4%, 体现了黄瑞香植物内生的核心菌属。
| Table 4 Eight samples abundance accounted for a relatively high pro-portion of colonies |
为呈现不同环境样本之间相似性, 根据beta多样性距离矩阵对9份样品进行层级聚类分析, 使用UPGMA算法构建树状结构, 如图 5所示, 由图可知, 甘谷、宕昌2地的黄瑞香样品能够聚为一支, 五台中的样品8、9也能聚为1支, 说明样品在个体在同一环境上具有高相似度。
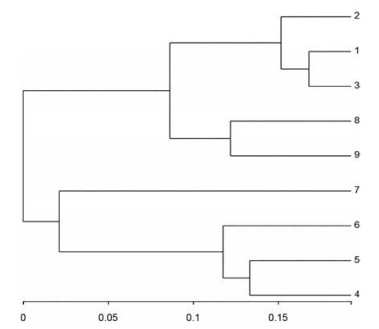
|
Figure 5 Hierarchical clustering tree on species level of 9 samples (The length of the branches represents the distance between the samples) |
植物内生菌群落的多样性在最近是植物微生物研究领域中的一个热点, 研究植物内生菌, 其目的有生产寄主本身的有效成分, 或转化新的化学成分, 如有报道从秦艽中分离出来的内生真菌可以产生龙胆苦苷[11]; 紫草根中分离并筛选出的内生真菌可以产生紫草素, 成为紫草素的新型来源[12]; 有同时增加生长特性指标和关键化学成分, 如有研究说明铁皮石斛中内生菌显著增加了其中茎厚度, 醇提取物含量以及药用化学成分[13]; 也有将内生真菌与土壤的根际真菌联合分析并且研究其对植物生长的影响[14, 15], 从而提高植物的种植效率。
黄瑞香作为常用民间中药祖师麻的来源植物, 目前未有关于其微生物多样性的报道。本研究采用高通量测序技术明确了黄瑞香根内生真菌群落组成和优势菌群, 分析了菌群多样性。从图 3结果可以看出, 内生真菌群落多样性十分丰富, 链格孢属(Altemaria) 为其优势属, 同属植物仅有对甘肃瑞香内生真菌的多样性进行了研究[16], 该种多样性同样丰富, 但优势种群为青霉属, 与黄瑞香的优势种区别明显。青霉属广泛存在于植物体内, 对环境条件具有很强的耐受能力, 且其种群丰富。因此, 这种内生真菌和不同植物自身基因调控的相互作用有可能是黄瑞香难移栽难种植, 成为濒危植物, 而甘肃瑞香相对容易移栽成功、没有成为濒危植物的原因之一。
在属水平中, 除优势属链格孢属之外, 核心菌属还有亚隔孢壳科中未鉴定出的真菌属以及茎点霉属, 茎点霉属真菌是一种重要的病原菌, 有强烈的纤维素酶活性, 会引起植物的茎腐, 枝枯[17]; 另一核心菌所属亚隔孢壳科(Didymellaceae) 2009年才被建立, 目前对其研究很少, 根据研究, 亚隔孢壳属(Didymella) 是唯一与茎点霉属真菌正确关联的有性型属[18], 这种在植物水平功能的相似性以及危害, 有可能是本课题组前期进行黄瑞香扦插实验失败的重要原因之一。五台地区样本中亚隔孢壳科的菌属丰度占比比甘肃两地的占比要高, 而根据课题组前期资源调查, 甘肃两地的黄瑞香资源蕴含量则比五台地区要高, 推测此菌属会对黄瑞香生长分布产生一定影响。
在种水平中, 有较多的菌种未能被鉴定, 一方面体现了黄瑞香植物中内生真菌具有多样性, 一方面说明黄瑞香植物的内生真菌还有很多未被研究, 值得深入挖掘以及微生物分类学鉴定。6号样品中黑附球菌占比为23.86%, 远高于其他样品中的黑附球菌, 黑附球菌为非致病菌, 并且能够产生以生物碱为主的次生代谢产物[19], 因此后续在加大样本验证实验结论的同时探究各菌属的分布大小是否会对植物的有效成分产生影响也很有意义。
综上所述, 本文首次利用高通量测序技术对濒危药材黄瑞香的内生真菌多样性进行了研究, 此研究结果为后续祖师麻药材真菌库的建立, 筛选促进黄瑞香生长的内生真菌以及生物防治提供科学依据。
作者贡献: 贺元负责实验设计、实施研究、数据采集与分析和文章起草、撰写、修改; 慕祺瑞负责材料采取、实施研究; 白贞芳负责实验设计; 姜丹负责实验设计和文章起草、撰写、修改; 任广喜负责实验设计、数据采集与分析; 刘春生负责实验构想、研究经费、技术/材料/行政支持和文章审阅。
利益冲突: 本文没有任何相关利益冲突。
| [1] |
Institute of Traditional Chinese Medicine, Shaanxi Branch of Chinese Academy of Medical Sciences. Shaanxi Journal of Traditional Chinese Medicine (陕西中药志)[M]. Xi'an: Shaanxi People's Publishing House, 1961: 342.
|
| [2] |
Geng L, Yang XH, Li ST, et al. Resource situation investigation and analysis about endangered Chinese herbal medicine Daphnes Cortex[J]. China J Chin Mater Med (中国中药杂志), 2016, 41: 3323-3328. |
| [3] |
Mu QR, Jiang D, He Y, et al. Correlation between chemical composition, ecological factors and soil factors of Chinese herbal medicine Daphnes Cortex[J]. China J Chin Mater Med (中国中药杂志), 2020, 45: 1059-1063. |
| [4] |
Herre EA, Mejia LC, Kyllo DA, et al. Ecological implications of anti-pathogen effects of tropical fungal endophytes and mycorrhizae[J]. Ecology, 2007, 88: 550-558. DOI:10.1890/05-1606 |
| [5] |
Santoyo G, Moreno-Hagelsieb G, Orozco-Mosqueda MDC, et al. Plant growth-promoting bacterial endophytes[J]. Microbiol Res, 2016, 183: 92-99. DOI:10.1016/j.micres.2015.11.008 |
| [6] |
Tian Y, Amand S, Buisson D, et al. The fungal leaf endophyte Paraconiothyrium variabile specifically metabolizes the host-plant metabolome for its own benefit[J]. Phytochemistry, 2014, 108: 95-101. DOI:10.1016/j.phytochem.2014.09.021 |
| [7] |
Wu ZX, Hao ZP, Zeng Y, et al. Molecular characterization of microbial communities in the rhizosphere soils and roots of diseased and healthy Panax notoginseng[J]. Antonie van Leeuwenhoek, 2015, 108: 1059-1074. DOI:10.1007/s10482-015-0560-x |
| [8] |
Zhou LS, Tang K, Guo SX, et al. Active endophytic fungus Cladosporium sp. promoting growth and increasing salvianolic acid content of Salvia miltiorrhiza[J]. Mycosystema (菌物学报), 2018, 37: 95-101. |
| [9] |
Sultan M, Schulz MH, Richard H, et al. A global view of gene activity and alternative splicing by deep sequencing of the human transcriptome[J]. Science, 2008, 321: 956-960. DOI:10.1126/science.1160342 |
| [10] |
Wang Y, Wang HP, Chen HY, et al. Diversity and biomarker exploration of endophytic fungi communities in different varieties of Paridis Rhizoma[J]. Chin Tradit Herb Drugs (中草药), 2020, 51: 4531-4537. |
| [11] |
Gweon HS, Oliver A, Taylor J, et al. PIPITS: an automated pipe-line for analyses of fungal internal transcribed spacer sequences from the illumina sequencing platform[J]. Methods Ecol Evol, 2015, 6: 973-980. DOI:10.1111/2041-210X.12399 |
| [12] |
Yin H, Zhao Q, Sun FM, et al. Gentiopicrin-producing endophytic fungus isolated from Gentiana macrophylla[J]. Phytomedicine, 2009, 16: 793-797. DOI:10.1016/j.phymed.2008.12.009 |
| [13] |
Mollaei S, Khanehbarndaz O, Gerami-Khashal Z, et al. Molecular identification and phytochemical screening of endophytic fungi isolated from Lithospermum officinale L. roots: a new source of shikonin[J]. Phytochemistry, 2019, 168: 112116-112116. DOI:10.1016/j.phytochem.2019.112116 |
| [14] |
Wu LS, Dong WG, Si JP, et al. Endophytic fungi, host genotype, and their interaction influence the growth and production of key chemical components of Dendrobium catenatum[J]. Fungal Biol, 2020, 124: 864-876. DOI:10.1016/j.funbio.2020.07.002 |
| [15] |
Wang YB, Zhang WX, Ding CJ, et al. Community structure and niche differentiation of endophytic microbiome in Populus alba×P. berolinensis under different ecological environment[J]. Sci Silv Sin (林业科学), 2020, 56: 48-60. |
| [16] |
Liang XF, Tang MJ, Lv LX, et al. Effects of three arbuscular mycorrhizal fungi (AMF) species on the growth, physiology, and major components of essential oil of Atractylodes lancea[J]. Chin J Ecol (生态学杂志), 2018, 37: 1871-1879. |
| [17] |
Yu L, Bai JK. Advance of classification in Phoma and Phyllosticta[J]. J Jilin Agric Univ (吉林农业大学学报), 1995, 17: 102-107. |
| [18] |
Chen Q. Phylogenetic and Taxonomic Studies on Didymellaceae (亚隔孢壳科的系统演化及分类学研究)[D]. Beijing: China Agricultural University, 2015.
|
| [19] |
Yuan C, Guo YH, Zhang YB, et al. Secondary metabolites from Epicoccum nigrum 14 one, an endophytic fungus isolated from plant Leptogium masiaticum[J]. China J Chin Mater Med (中国中药杂志), 2019, 44: 4021-4025. |
 2021, Vol. 56
2021, Vol. 56


