2. 山东中医药大学药学院, 山东 济南 250355
2. Department of Pharmacy, Shandong University of Traditional Chinese Medicine, Jinan 250355, China
基底细胞癌(basal cell carcinoma, BCC) 是常见皮肤肿瘤[1], 是一种生长缓慢、具有基底分化性能的局部破坏性上皮肿瘤[2], 多发于老年。近年来, 40岁以下人群患病率逐年增加。BCC会使抑制肿瘤生长的基因功能丧失或促进G蛋白偶联受体(G protein coupled receptor) 发生突变, 使肿瘤细胞增殖失去控制[3]。目前BCC主要治疗方法包括手术切除、液氮冷冻、激光治疗、新型免疫疗法、化学治疗和光动力疗法等(图 1)。目前临床常用治疗方法是手术切除病变组织, 但如果初次切除不完全极易导致BCC复发; 而复发性BCC相较于原发性BCC肿瘤组织变大, 治疗难度增加。显微外科手术可提高肿瘤完全切除率, 3 mm手术切缘可安全地用于非形态BCC[4], 对于2 cm及更小病变, 治愈率可达95%, 且复发率低; 但显微外科手术对设备要求较高, 并未在全世界内通行[5]。液氮冷冻疗法是将液氮涂抹于肿瘤及其周围5 mm以内正常皮肤上以达到杀死肿瘤细胞的目的, 但不适用于直径较大的肿瘤, 且会导致皮肤萎缩、出现疤痕。辐射疗法可能对皮肤及机体产生严重不良反应; 而化疗方案中局部乳膏涂抹的药物穿透性能一般较差[6]。因此, 有必要探讨一种新型BCC治疗方案。

|
Figure 1 Techniques for the treatment of basal cell carcinoma (BCC) and the therapeutical principles of photodynamic therapy |
光动力学疗法(photodynamic therapy, PDT) 是基于光敏剂在局部病理组织中积累, 在吸收适当波长的光后破坏肿瘤细胞从而达到抑制其生长的目的[7]。其主要机制是光敏剂接受适当波长的光照射后, 会激活特定物质产生活性氧(主要是单线态氧); 当单线态氧达到一定浓度时, 会选择性促使肿瘤细胞凋亡[8]。PDT治疗有三要素, 即光敏剂、光和组织内氧含量, 可作为一种现代无创疗法用于治疗浅表性BCC (图 1)。
5-氨基酮戊酸(5-aminolevulinic acid, 5-ALA) 是一种天然的血红蛋白生化前体, 经一系列酶促反应后可在各种上皮和肿瘤组织中生成光敏物质-荧光卟啉(主要是原卟啉IX)[9]; 卟啉与氧、光结合可产生高活性单线态氧, 选择性导致肿瘤细胞死亡。5-ALA也可通过激活外源性凋亡机制(如JAK-STAT信号通路) 达到促进肿瘤细胞凋亡的目的[10]。
立方液晶是溶致液晶中的一种, 是两亲性分子在水或其他极性溶剂中形成的液晶。该剂型包容能力强, 水溶性药物可存在于立方液晶水道中、脂溶性药物可存在于双分子层膜中、两亲性药物位于界面处。因此, 立方液晶作为一种生物黏附性制剂是理想的经皮给药新剂型[11], 比软膏渗透性更强[12]。
CO2点阵激光作用于皮肤后可形成微小孔洞, 促进药物渗透扩散, 该机制类似于经皮微针。因此, 作者首次提出“光针(light needles)”的概念(图 2)。由于BCC表层有一层硬痂会阻挡药物进入, 而光针则可利用光损伤作用穿透硬痂促进药物渗透。此种光损伤由光热效应引起, 灼伤区域直接扩展并深入真皮层[13], 可开放药物渗透途径, 之后胶原凝固, 可在几周内愈合, 是治疗皮肤和浅表皮下转移瘤的有效方法[14, 15]。光针通过调节能量可控制致孔深浅以调控药物渗透能力。

|
Figure 2 Principle of light needles |
基于上述分析, 本研究将光针与光动力学结合, 首先制备5-ALA立方液晶, 通过光针促渗透作用, 使药物穿透BCC硬痂进入肿瘤内部, 最大限度发挥细胞毒作用。本研究为临床BCC治疗提供了一种高效、便捷和可防止转移的新思路。
材料与方法材料 5-ALA (批号: 20170228, 南京康满林生物医药科技有限公司); 单硬脂酸甘油酯(glyceryl monostearate, GMO, 批号: 116703, DANISCO公司); 无水乙醇(40021292, 国药集团化学试剂有限公司); DMEM培养基(批号: 8117162)、0.25% trypsin-EDTA (批号: 1868583)、磷酸盐缓冲液(phosphate buffer, PBS, 批号: 8117157) (Gibco公司); 胎牛血清(南京贝瑞吉生物科技有限公司); 罗丹明B (批号: 13656, 上海晶纯试剂有限公司); 氯化钠注射液(批号: 1703193102, 石家庄四药有限公司); 10%甲醛溶液(批号: 20170712, 自制); 细胞计数试剂(Cell Counting Kit-8, CCK-8, 批号: 7802010130, Genview公司)。人皮肤鳞癌细胞A431 (货号: CBP60330, 南京科佰生物科技有限公司)。
动物 SPF级雌性裸鼠购自北京维通利华实验动物技术有限公司, 动物合格证号: SCXK-(京) 2016-0006。本动物实验经军事科学院军事医学研究院伦理委员会批准, 且操作均按相关指导原则和规定进行。
仪器 射频管超脉冲CO2点阵激光治疗仪[LS-X6, 雷斯光电(中国) 科技发展有限公司]; 美国微雕点阵激光(AcuPulse, Lumenis公司); 激光共聚焦显微镜(Carl Zeiss LSM 510 META, 德国蔡司公司); 激光器(750 nm, 660 nm, 宁波远明激光技术有限公司); 酶标仪(EL×800, 美国伯腾仪器有限公司)。
光针设备对裸鼠皮肤致孔及药物渗透测定 取4只裸鼠平均分为2组: AcuPulse微雕点阵激光组和射频管超脉冲CO2点阵激光组。两种设备设置相同能量密度在裸鼠背部左、右侧皮肤进行激光致孔, 皮肤镜观测致孔情况。两组各取1只裸鼠涂抹1 mg·mL-1罗丹明水溶液于右侧背部, 30 min后处死裸鼠, 右侧皮肤制备冷冻切片, 倒置荧光显微镜下观察罗丹明B渗透量及渗透深度; 左侧皮肤于10%甲醛溶液中保存, 石蜡包埋, 苏木精-伊红(H.E.) 染色, 制作病理切片, 于显微镜下观察。
5-ALA立方液晶的制备与表征 精密称取无水乙醇0.15 g与GMO 1.6 g于60 ℃中水浴加热, 作为油相; 精密称取5-ALA 0.625 g加入0.75 mL超纯水溶解, 作为水相。将水相缓慢加入涡旋混合的油相中制得20% (w/v) 5-ALA立方液晶。将制得样品分别于偏光显微镜和小角X射线衍射仪下观察。
5-ALA联合光针体外癌细胞毒性实验 将A431细胞培养至80%左右, 胰酶消化, 计数, 稀释细胞数至105个/mL, 加入96孔板中, 每孔加入细胞混悬液100 μL, 放入CO2培养箱中培养24 h, 分为5组: 低能量光针组(53 mJ·cm-2)、高能量光针组(238 mJ·cm-2)、5-ALA组、5-ALA/低能量光针组和5-ALA/高能量光针组。含5-ALA组每孔加入10% 5-ALA 20 μL混匀, 4 h后用660 nm激光器照射。5-ALA/低能量光针组和5-ALA/高能量光针组分别用53和238 mJ·cm-2光针处理, 之后放入CO2培养箱培养12 h, 每孔再加入CCK-8 10 μL, 继续培养1 h, 用酶标仪测定吸光度A值, 按公式(1) 计算细胞存活率(cell survival rate, CSR)。
| $ \operatorname{CSR}(\%)=\left(A_{\text {实验 }}-A_{\text {空白 }}\right) /\left(A_{\text {对照 }}-A_{\text {空白 }}\right) \times 100 \% $ | (1) |
5 -ALA立方液晶结合不同能量光针治疗BCC的药效学评价 将所培养A431细胞加入1 mL胰酶消化2 min, 待细胞消化至80%时停止, 100×g离心5 min后, 弃除上清液, 用0.2 mL培养液吹打分散均匀, 进行裸鼠皮下注射[13]。待裸鼠皮下肿瘤生长至2 cm3左右时, 取下瘤块, 置于PBS中将瘤块剪至5 mm3左右, 采用瘤块接种装置将其接种于裸鼠背部[16]。当背部肿瘤体积至50~100 mm3时开始治疗[17]。实验分为5组: 模型组、低/高能量光针组、5-ALA立方液晶联合低/高能量光针组, 每组5只裸鼠。模型组除接种瘤块外不进行任何干预; 低、高能量光针组分别用53和238 mJ·cm-2光针处理局部肿瘤; 5-ALA立方液晶结合低/高能量光针组先于肿瘤处施加5-ALA立方液晶(0.2 g·cm-2), 暗孵育4 h后, 分别用53和238 mJ·cm-2照射局部肿瘤5 min。记录裸鼠生活状态; 于0、1、5、10和25天拍照肿瘤局部外观; 于35天处死裸鼠后, 取肝、肺、脾和肿瘤部位皮肤于10%甲醛中固定, 石蜡包埋, H.E.染色后于显微镜下观察主要病变; 取肿瘤部位皮肤, 采用免疫组化测定血管内皮生长因子(vascular endothelial growth factor, VEGF) 表达情况。对死亡裸鼠进行解剖, 取主要脏器观察肿瘤转移情况, 按公式(2) 计算转移率(%)。
| $ \text { 转移率 }(\%)=\frac{\text { 肿瘤转移裸鼠只数 }}{\text { 裸 鼠总数 }} \times 100 \% $ | (2) |
数据分析 实验数据以x ± s表示, 采用单因素方差及t检验进行统计学分析, 采用SPSS16.0软件进行统计分析, P < 0.05认为具有统计学差异。
结果 1 光针致孔及促药物渗透经光针处理的大鼠背部皮肤出现排列整齐、大小均匀的孔道(图 3), 表明点阵激光作为“光针”, 具有良好致孔性, 与微针类似。H.E.切片表明两组裸鼠皮肤致孔直径分别为105.7 ± 2.67 μm和103.5 ± 1.93 μm, 且光致孔均能到达皮肤真皮层; 荧光照片也证明光针致孔作用明显, 罗丹明B能进入皮肤表皮层和真皮层, 并向周围组织扩散(图 3)。

|
Figure 3 Two instruments of light needles on the back skin of naked mice. H.E. section (100 ×); fluorescence section (100 ×) |
小角度X射线散射可获取特大晶胞物质的结构信息及材料内部缺陷的数量和尺寸分布信息, 也可检测极小物质结构信息。5-ALA立方液晶的峰位比为
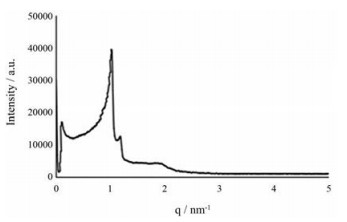
|
Figure 4 The small angle X-ray graph of 5-ALA cubic liquid crystal |
偏光显微镜可用于均质体与非均质体的定性分析, 通过实时观测光学效应表征非均质体(如液晶) 的结构。如果各个方向物理性质测量结果相同, 称为各向同性, 相反则为各向异性。结果表明偏光显微镜视野内图像均一、无明显片层状结构, 说明呈各向同性, 证明5-ALA立方液晶制备成功。
3 5-ALA立方液晶联合光针具有显著细胞毒性5-ALA主要通过特定波长光激发后产生活性氧而发挥细胞毒作用。各组A431细胞存活率顺序为: 低能量光针组 > 高能量光针组 > 5-ALA组 > 5-ALA立方液晶/低能量光针组 > 5-ALA立方液晶/高能量光针组。其中单纯低能量光针组细胞存活率为100%, 没有明显细胞毒性作用; 而5-ALA立方液晶联合高能量光针组细胞存活率不到20%, 其细胞毒性最强(图 5)。

|
图 5 The survival rate of A431 cells treated with different treatments. n = 3, x± s. **P < 0.01 vs low energy light needle; ##P < 0.01 vs high energy light needle |
模型组裸鼠肿瘤处于持续生长状态; 低能量光针组肿瘤体积在第10天后迅速增长最终超过模型组, 并处于持续快速生长状态; 5-ALA立方液晶结合低能量光针组肿瘤体积变化不明显, 说明此种方法能显著抑制肿瘤增长。实验中观察到BCC局部有结痂现象, 可暂时保护肿瘤周围局部环境, 有利于最终恢复(图 6A)。

|
Figure 6 The effects of 5-ALA cubic liquid crystal combined with the light needles of low and high energy on the macroscopic changes (A), H.E. pathological changes (B, 100×) and vascular endothelial growth factor (VEGF) expression by immunohistochemistry (C, 100×) and quantification (D). IOD: Integral optical density. n = 5, x± s. **P < 0.01 vs normal; ##P < 0.01 vs model |
从H.E.病理切片看, 模型组裸鼠肝组织出现大量肿瘤癌细胞浸润; 肺出现黑色区域, 肺泡萎缩, 间隔增大, 证明肝、肺是基底细胞癌转移最易侵袭组织; 肿瘤局部皮肤正常结构消失, 瘤块由一层膜包被。低能量光针组肺泡出现部分萎缩, 正常结构消失。5-ALA立方液晶联合低能量光针组肝、肺组织均与正常组织接近(图 6B)。
VEGF是一种具有促血管生成活性的活性因子, 可促进内皮细胞有丝分裂, 还可抗凋亡、增加血管通透性、促进细胞迁移[18]。VEGF高表达表明肿瘤增长迅速, 可反映肿瘤本身生长状况。本研究中模型组和低能量光针组裸鼠肿瘤部位出现VEGF高表达, 5-ALA立方液晶联合低能量光针组肿瘤局部仅有少量VEGF表达(图 6C、D), 表明二者联用能有效抑制肿瘤快速增长。
5 5-ALA立方液晶联合高能量光针能抑制BCC转移模型组肿瘤随时间延长一直快速增长。单纯高能量光针组后期出现个别肿瘤转移现象, 但相较于低能量光针组, 转移率已大大降低, 且主要转移组织为肝和肺。5-ALA立方液晶联合高能量光针组未出现BCC转移至肝和肺的现象, 且15天后肉眼观察肿瘤已不明显(图 6A)。
从H.E.病理切片看, 模型组和高能量光针组均出现肿瘤细胞浸润。模型组肺泡萎缩、间隔增大和正常肺结构消失, 说明肿瘤细胞已转移至肺部; 高能量光针组相较于模型组表现减轻, 但仍有部分正常肺结构消失。5-ALA立方液晶联合高能量光针组肝、肺组织接近于正常(图 6B)。这说明高能量光针本身具有杀灭肿瘤细胞和抑制肿瘤生长的作用[19, 20], 与5-ALA联用可能是一种协同作用: 光针高能量进一步激发光敏剂细胞毒性, 强强联手, 达到彻底杀灭细胞和抑制肿瘤转移的目的, 但这种治疗方式安全范围还需进一步研究。
VEGF高表达说明肿瘤快速增长。本研究中, 高能量光针抑制了VEGF高表达从而抑制了肿瘤生长; 5-ALA立方液晶联合高能量光针组VEGF表达和正常组织相近, 说明肿瘤快速增长被有效抑制(图 6C、D)。模型组和高能量光针组BCC转移率为60%; 高能量光针组肿瘤转移率为40%, 明显低于模型组和高能量光针组; 而5-ALA立方液晶联合高能量光针组未出现肿瘤转移现象。
讨论光动力学用于肿瘤治疗研究较多, 如基于生物配位化合物和仿生金属蛋白的概念, 将组氨酸修饰的光敏剂功能化序列与锌离子配位, 形成仿生金属纳米粒, 在高谷胱甘肽和低pH值肿瘤微环境条件下可被降解释放, 进而实现肿瘤光动力学治疗[21]。藻蓝蛋白亚基制备成脂质体后, 可很好地保持藻蓝蛋白亚基的生物活性, 在相同蛋白浓度时藻蓝蛋白亚基脂质体比藻蓝蛋白亚基更快地转染, 进入肿瘤细胞; 在相同浓度及光照剂量的情况下, 藻蓝蛋白亚基脂质体对肿瘤细胞的光动力学作用略强于藻蓝蛋白亚基[22]。
近年来, BCC发病率逐年递增, 其发病率占所有角蛋白细胞癌的70%~80%。现有治疗方法存在不良反应多、易复发和治疗费用较高等缺点[23], 但有关光动力学治疗BCC的系统研究较少, 且BCC表面硬痂也严重影响药物渗透。而不同能量光针则可直接影响致孔深度, 进而决定了药物到达皮肤层的具体部位。本研究巧妙地结合了激光致孔和光敏剂产生活性氧发挥细胞毒作用两种机制, 实现治疗BCC并防止其转移的目的。作者发现光针能量不同直接影响其效果不同: 高能量光针(238 mJ·cm-2) 与光敏剂联用可直接消除肿瘤, 并抑制进一步肝和肺部转移; 而低能量光针(53 mJ·cm-2) 主要穿透硬痂促进药物高效渗透, 具体二者应用时机、场合还需进一步探讨。本研究为临床BCC治疗提供了一种高效、便捷和可防止转移的新思路。
作者贡献: 麻培培负责具体实验; 李祺、欧歌负责数据整理和统计分析; 张圆圆、李倩负责部分实验、论文撰写; 杜丽娜负责实验设计和总结分析。
利益冲突: 本文不存在任何利益冲突。
| [1] |
Tay EY, Teoh YL, Yeo MS. Hedgehog pathway inhibitors and their utility in basal cell carcinoma: a comprehensive review of current evidence[J]. Derm Ther, 2018, 9: 33-49. |
| [2] |
Alter M, Hillen U, Leiter U. Current diagnosis and treatment of basal cell carcinoma[J]. J Dtsch Dermatol Ges, 2015, 13: 863-874. |
| [3] |
Ligtenberg KG, Hu JK, Damsky W. Neoadjuvant anti-programmed cell death 1 therapy for locally advanced basal cell carcinoma in treatment-naive patients: a case series[J]. JAAD Case Rep, 2020, 6: 628-633. DOI:10.1016/j.jdcr.2020.05.010 |
| [4] |
Gulleth Y, Goldberg N, Silverman RP. What is the best surgical margin for a basal cell carcinoma: a meta-analysis of the literature[J]. Plast Reconstr Surg, 2010, 126: 1222-1231. DOI:10.1097/PRS.0b013e3181ea450d |
| [5] |
Luz FB, Ferron C, Cardoso GP. Surgical treatment of basal cell carcinoma: an algorithm based on the literature[J]. An Bras Dermatol, 2015, 90: 377-383. DOI:10.1590/abd1806-4841.20153304 |
| [6] |
Kim DP, Kusk JB, Ruiz E. Basal cell carcinoma review[J]. Hematol Oncol Clin North Am, 2019, 33: 13-24. DOI:10.1016/j.hoc.2018.09.004 |
| [7] |
Kwiatkowcki S, Knap B, Przystupsk D. Photodynamic therapy-mechanisms, photosensitizers and combinations[J]. Biomed Pharmacother, 2018, 106: 1098-1107. DOI:10.1016/j.biopha.2018.07.049 |
| [8] |
Meng LJ, Li SL, Du EM. Applications of Ru(Ⅱ)-polypyridyl complexes in two-photon photodynamic therapy[J]. Acta Pharm Sin (药学学报), 2018, 53: 336-344. |
| [9] |
Nemes A, Fortmann T, Poeschke S. 5-ALA fluorescence in native pituitary adenoma cell lines: resection control and basis for photodynamic therapy (PDT)[J]. PLoS One, 2016, 11: e0161364. DOI:10.1371/journal.pone.0161364 |
| [10] |
Qiao L, Li Q, Cai H. The role of exogenous signaling pathway JAK/STAT in the apoptosis of human SCC cells induced by ALA-photodynamics[J]. Chin J Lepr Skin Dis (中国麻风皮肤病杂志), 2020, 36: 473-478. |
| [11] |
Wang QQ, Chen ML, Hu X. Preparation and characterization of timolol maleate cubic nanoparticles for ocular administration[J]. Acta Pharm Sin (药学学报), 2018, 53: 1894-1900. |
| [12] |
Chen Y, Ma P, Gui S. Cubic and hexagonal liquid crystals as drug delivery systems[J]. Biomed Res Int, 2014, 2014: 815981. |
| [13] |
Van JA, Wessels R, Nieweg OE. CO2 laser treatment for regional cutaneous malignant melanoma metastases[J]. Derma Surg, 2015, 41: 78-82. DOI:10.1097/DSS.0000000000000251 |
| [14] |
Baleg SM, Bidin N, Suan LP. The effect of CO2 laser treatment on skin tissue[J]. J Cosmet Dermatol, 2015, 14: 246-253. DOI:10.1111/jocd.12142 |
| [15] |
Gibson SC, Byrne DS, Mckay AJ. Ten-year experience of carbon dioxide laser ablation as treatment for cutaneous recurrence of malignant melanoma[J]. Br J Surg, 2004, 91: 893-895. DOI:10.1002/bjs.4558 |
| [16] |
Ishida K, Tomita H, Nakashima T. Current mouse models of oral squamous cell carcinoma: genetic and chemically induced models[J]. Oral Oncol, 2017, 73: 16-20. DOI:10.1016/j.oraloncology.2017.07.028 |
| [17] |
Sung JM, Kim YC. Photodynamic therapy with epidermal ablation using fractional CO2 laser for treating superficial basal cell carcinoma: a case series[J]. Photodiag Photodyn Ther, 2017, 19: 202-204. DOI:10.1016/j.pdpdt.2017.06.009 |
| [18] |
Melincovicil CS, Bosca AB, Susman S. Vascular endothelial growth factor (VEGF)-key factor in normal and pathological angiogenesis[J]. Rom J Morphol Embryol, 2018, 59: 455-467. |
| [19] |
Luo M, Shi L, Zhang FH, et al. Study on the anti-tumor effect of laser immunotherapy on mice with multiple skin squamous cell carcinoma[J]. Chin J Dermatol (中华皮肤科杂志), 2016, 49: 621-625. |
| [20] |
Wenande E, Tam J, Bhayana B, et al. Laser-assisted delivery of synergistic combination chemotherapy in in vivo skin[J]. J Control Release, 2018, 275: 242-253. DOI:10.1016/j.jconrel.2018.02.019 |
| [21] |
Zheng RR, Zhao LP, Chen HQ, et al. Tumor microenvironment responsive biomimetic nanoparticles for photodynamic tumor therapy[J]. Acta Pharm Sin (药学学报), 2020, 55: 1672-1679. |
| [22] |
Guo RY, Huang B, Zuo MM, et al. Preparation of phycocyanin subunit liposomes and the photodynamic experiment on cancer cells[J]. Acta Pharma Sin (药学学报), 2008, 43: 1060-1065. |
| [23] |
Morgan H, Olivero C, Patel GK. Identification of human cutaneous basal cell carcinoma cancer stem cells[J]. Methods Mol Biol, 2019, 187: 435-450. |
 2021, Vol. 56
2021, Vol. 56


