2. 解放军医学院, 北京 100853;
3. 锦州医科大学, 辽宁 锦州 121001;
4. 军事科学院军事医学研究院辐射医学研究所, 北京 100850;
5. 湖州市中心医院, 浙江 湖州 313000
2. Medical School of Chinese PLA, Beijing 100853, China;
3. Jinzhou Medical University, Jinzhou 121001, China;
4. Institute of Radiation Medicine, Academy of Military Medicine Sciences, Academy of Military Sciences, Beijing 100850, China;
5. Huzhou Central Hospital, Huzhou 313000, China
眼部局部用药是治疗眼科疾病的重要手段。眼用药物剂型常采用液体或半固体剂型, 如滴眼液或眼膏, 但因结膜囊体积有限(20~30 μL)、泪液分泌和角膜屏障作用等因素, 生物利用度低(< 5%), 难以达到并维持有效药物浓度, 需多次给药。眼内注射, 如腔内和玻璃体注射, 虽然可穿透角膜屏障, 但存在感染、出血等并发症风险, 并且患者常因疼痛而拒绝治疗。因此亟需一种高安全性和高效角膜渗透性的眼用药物剂型[1]。
可溶性微针(dissolving microneedles) 是以水溶性或可快速生物降解聚合物为基质的微针, 可突破机体屏障将药物直接递送于治疗部位, 且形成的组织微创能够快速修复[2]。目前, 可溶性微针已广泛应用于经皮或黏膜给药, 治疗的疾病包括黑色素瘤[3]、乙肝[4]和疱疹病毒感染[5]等。可溶性微针高效渗透和微创的特点使其在眼部给药中受到关注, 如抗角膜新生血管生成单克隆抗体的透明质酸微针[6], 治疗青光眼的毛果芸香碱多孔速溶聚乙烯醇微针[7]。眼用可溶性微针常采用水溶性聚合物(如透明质酸、壳聚糖、右旋糖苷) 的水溶液溶解水溶性药物后制备, 而疏水性药物采用纳米粒[8]、包合物[9]和固体分散体[10]等技术得到水中溶解或高度分散的中间体后, 再制备成微针。该制备工艺复杂, 且单片微针载药量低, 如两性霉素B聚乙烯醇可溶性微针, 微针贴片中仅含51.02 μg·cm-2的药物[11], 并不能满足临床用药的实际需求量。
高选择性和高亲和性的碳酸酐酶抑制剂布林佐胺(brinzolamide, BLZ) 是目前临床治疗青光眼的一线药物(图 1)。BLZ易溶于乙醇, 难溶于水, 临床常用剂型是混悬型滴眼剂, 但该制剂在结膜囊内滞留时间短、药物流失多、药物角膜渗透性差和生物利用度低。因此该制剂需1日内多次给药, 但药效仍不理想。本文以疏水性药物BLZ为模型药物, 溶于乙醇后, 加入聚乙烯吡咯烷酮(polyvinylpyrrolidone, PVP) K90, 通过模具灌注法制备了一种载药量大、机械强度高的BLZ可溶性微针。本文详细考察了BLZ可溶性微针(brinzolamide dissolving microneedles, BMN) 的处方和性质, 包括角膜穿透性、角膜修复和药物渗透等, 为可溶性微针的研究提供了借鉴, 为眼部疾病的治疗提供了新方法。
|
Figure 1 Chemical structure of brinzolamide (BLZ) |
药物与试剂 BLZ (青岛君之道生物技术有限公司); 布林佐胺滴眼液(BLZ eyedrops, BED, 美国爱尔康公司); PVP K90 (分子质量1 300 kDa)、PVP K30 (分子质量54 kDa) 均购自上海阿拉丁试剂有限公司。其余试剂均为分析纯, 实验用水为去离子水。
仪器 Agilent 1260型高效液相色谱仪[安捷伦科技(中国) 有限公司]; WDW型万能拉力测试仪(济南旺特贝仪器设备有限公司); 扫描电镜(SEM, S4800, 日本日立公司); S6D体视镜(德国Leica公司); YB-P6智能透皮试验仪(天津天光光学仪器有限公司); 精密手术显微镜(北京众实迪创新科技发展有限责任公司); 聚二甲硅氧烷(PDMS) 微针模具(10×10阵列, 微针基底面积1 cm2, 锥状针体, 锥体底面直径为300 μm, 针尖距为500 μm, 针尖高度为800 μm, 广州莱客模具有限公司)。
动物 SD大鼠, SPF级, 雄性, 体重200 ± 20 g, 许可证号: SCXK (京) 2019-0010, 斯贝福(北京) 生物技术有限公司。实验期间动物自由取食、饮水。所有动物实验经军事医学研究院辐射医学研究所伦理委员会批准且实验均按照相关指导原则和规定进行。
BMN的制备 取0.73 g BLZ溶于10 mL乙醇, 加入1.5 g PVP K90搅匀, 放置12 h后充分溶胀, 得到微针基质溶液。取100 mg基质溶液加入PDMS微针模具中, 室温下置于真空干燥箱中(-100 kPa), 1 min后取出, 载液模具在室温下晾干12 h左右, 得到BMN, 于干燥器中保存。
BLZ含量测定 用手术刀片分离BMN针体与基底, 分别溶于乙醇, 用HPLC分别测定基底和针体中的BLZ含量。色谱条件[12]为色谱柱: Agilent C18色谱柱(250 mm×4.6 mm, 5 μm); 流动相: 甲醇-水(60∶40); 流速: 1.0 mL·min-1; 进样量: 20 μL; 柱温: 25 ℃; 检测波长: 254 nm。
BMN乙醇残留量测定 用气相色谱法测定BMN中乙醇残留量[13]。色谱条件为色谱柱: DB-624, 程序升温, 进样口温度为200 ℃, 检测温度为250 ℃, 检测器为氢火焰离子化检测器(FID), 载气为氮气, 载气流速为5 mL·min-1, 分流比为10︰1, 柱温: 35 ℃保持3 min, 然后以15 ℃·min-1的速率升温至200 ℃, 并保持5 min, 顶空进样量为1 mL。
BMN的形貌表征 用导电胶带将BMN固定, 在体视镜下观察微针基本形貌特点。在5 kV的加速电压下, 用扫描电镜观察微针形貌。
BMN溶解时间考察 腹腔注射异戊巴比妥麻醉SD大鼠3只, 固定四肢, 操作者左手持眼科镊固定大鼠结膜囊, 充分暴露右眼球, 将BMN针尖端对准角膜中央; 右手拇指垂直按压微针基底层, 至针体插入角膜。在不同时间点(30 s和1、2 min), 用眼科镊小心移除微针, 在体视镜下观察微针形态, 评估微针在角膜中的溶解时间。
BMN的力学强度表征 用双面胶将BMN固定在万能拉力测试仪水平载物台中央, 设置机器的触发力为0.05 N, 最大为50 N, 压缩速率为0.5 mm·min-1, 当探针接触到微针针尖后, 记录压力随位移的变化曲线。
BMN体外释药行为考察 取氯化钠0.678 g、碳酸氢钠0.218 g、水合氯化钙0.008 4 g和氯化钾0.138 g, 溶于100 g水中配制成人工泪液[14]。取单片BMN放入盛有50 mL人工泪液的锥形瓶, 密闭, 在恒温空气振荡器中做往复运动, 温度37 ± 0.5 ℃, 转速100 r·min-1, 分别在5、15、30 min和1、2、4、6 h取样1 mL, 同时补充等量37 ℃人工泪液。样品液经0.22 μm微孔滤膜过滤, 续滤液用上述HPLC法测定药物含量, 以时间(t, h) 为横坐标, 释放百分率(F, %) 为纵坐标, 绘制BMN的释放曲线, 并用以下公式(1~4) 考察BMN体外释药机制。
| $ \text { 零级释放: } F_{\mathrm{t}}=F_{0}+K_{0} t $ | (1) |
| $ \text { 一级释放: } \ln F_{\mathrm{t}}=\ln F_{0}+K_{1} $ | (2) |
| $ {{\rm{ Higuchi: }}{F_{\rm{t}}} = {K_{\rm{H}}}\sqrt t } $ | (3) |
| $ {{\rm{ Ritger - Peppas: }}\ln {F_{\rm{t}}} = n\ln t + \ln {K_{\rm{p}}}} $ | (4) |
其中, Ft (%) 为t时间点药物释放的百分含量; F0为Ft的初始值; n为药物扩散系数; K0、K1、KH和Kp为各个释放模型的药物释放系数。
角膜渗透实验 颈椎脱位法处死SD大鼠3只, 分离角膜(带有少量巩膜, 宽约1 mm), 用生理盐水冲洗3次, 固定于Franz扩散池供给池和接收池间, 角膜上皮层面向供给池。为保证角膜活性, 角膜渗透实验须在离体后30 min内开始。人工泪液作为接收介质充满接收池, 角膜内皮层完全接触介质, 控制水浴温度37 ± 0.5 ℃, 磁力搅拌转速100 r·min-1。将1片BMN贴片(含BLZ 7.3 mg) 插入角膜上皮层; 取BED 0.73 mL (含BLZ 7.3 mg) 滴入另一个供给池中, 作为对照。在15、30 min和1、2和4 h分别取样1 mL, 同时补充等量37 ℃接收介质。样品液经0.22 μm微孔滤膜过滤, 续滤液用上述HPLC法测定药物含量, 累积渗透量(Qn, μg) 根据公式(5) 计算。
| $ {Q_{\rm{n}}} = {C_n} \cdot V + {V_0}\sum\limits_{i = 1}^{n - 1} {{C_i}} $ | (5) |
其中, V (mL) 是接收池中的接收介质体积; Cn (μg·mL-1) 是样品n的浓度; Ci (μg·mL-1) 是样品i的浓度; V0 (mL) 为每次取出接收介质的体积; Qn被绘制成时间的函数曲线。药物渗透曲线的斜率代表累积角膜渗透速率(Jss, μg·h-1)。BMN的渗透增强比(enhanced rate, ER) 是BMN组和BED组Q4 h之比。
组织中药物残留量考察 角膜渗透24 h后, 移除角膜, 用接收介质冲洗3次, 用吸水纸除去残留介质后称重。将每个角膜剪成小块(约2 mm×2 mm), 浸入1 mL接收介质中, 超声30 min后静置12 h, 取上清液经0.22 μm微孔滤膜过滤后, 续滤液依照上述HPLC法测定药物含量。
角膜恢复及微针插入能力的考察 SD大鼠3只麻醉后固定, 将BMN按压于角膜, 停留30 s后移除, 分别在0、0.5、1、3和24 h后用手术显微镜观察角膜状态, 并拍摄照片。分别在移除BMN后0、1和3天处死1只大鼠, 剥离角膜, 进行冷冻切片和苏木精-伊红(H & E) 染色, 在倒置显微镜下观察。
统计学分析 采用SPSS 19.0软件, 通过方差分析的方法对数据进行统计学分析, P < 0.05被认为具有统计学意义。
结果与讨论 1 微针的最优处方可溶性微针常用基质材料主要是生物可降解聚合物, 如透明质酸、壳聚糖和聚乙烯醇[15, 16]。但这些材料在乙醇中溶解性差, 对于疏水性药物难以制备成高载药微针。目前报道的眼用微针采用聚乙烯醇, 但存在载药量小、药物释放率低等缺陷。本文采用能快速溶于水的PVP作为微针基质材料, 更重要的是, 与上述聚合物相比, PVP在水和乙醇中溶解度均较好, 有利于脂溶性药物如BLZ溶解于PVP乙醇溶液中, 并且形成的微针也能快速溶于水, 有利于药物释放。本文选择了两种常用PVP, 包括PVP K30和PVP K90, 作为BLZ微针基质材料进行了制备和性质比较。10%、15%和30% (w/v) PVP K30乙醇溶液制备得到的微针质地脆性大、机械强度小, 无法完整脱离模具, 强行剥离后均破碎; 相同浓度的PVP K90乙醇溶液均能形成高强度微针, 并能完整脱模(图 2)。10% PVP K90乙醇溶液得到的微针机械强度低, 易被弯曲; 15%和30% PVP K90乙醇溶液得到的微针机械强度较大, 但后者制备的干燥过程消耗时间过长, 可达数日。因此, 选择15% PVP K90乙醇溶液作为微针基质材料溶液。

|
Figure 2 Effects of polyvinylpyrrolidone (PVP) types and contents on the mechanical strength of microneedles |
BLZ作为疏水性药物(0.4 mg·mL-1) 在乙醇中有较高溶解度(73 mg·mL-1)。本文选择BLZ饱和PVP乙醇溶液作为微针的处方溶液, 最大程度提高了BLZ的载药量, 并且不影响最后得到微针的机械强度(图 3)。因此, 含BLZ (73 mg·mL-1) 的15% PVP K90乙醇溶液为BMN的最优化处方溶液。单片BMN所有针尖药物总含量为612 ± 27 μg, 基底座药物含量为6901 ± 162 μg。同时通过气相法检测出15% PVP K90乙醇溶液风干后的乙醇残余量为0.59%, 该浓度不会对角膜产生明显的损伤和刺激[17, 18], 制备的微针具有良好的生物安全性。

|
Figure 3 Force-displacement profiles of brinzolamide dissolving microneedles (BMN) |
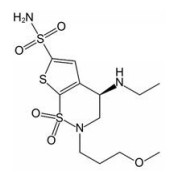
体视镜和扫描电镜下显示BMN针体呈圆锥形, 针尖完整尖锐, 阵列排列整齐(图 4A)。已有报道证明圆锥形微针在同等尺寸下比棱锥形或柱形微针的皮肤损伤小[19]。因此, 本文基于尽量减小角膜损伤的目的选择圆锥形作为微针针体。BMN针尖宽度约10 μm, 针体长度约750 μm (图 4B)。人眼角膜中央部位厚度约为500~600 μm, 并且针尖宽度小于30 μm的微针易于刺破角膜[20]。棱锥形可溶性微针(针尖宽度10 μm) 插入角膜需要0.05 N的压力, 而圆锥形微针所需的压力更小[6, 21]。BMN单针承载力约为0.32 N (图 3), 所以施压后易于穿透角膜。因此可推测BMN易插入角膜, 并可插入角膜一定深度, 为微针针体溶解和药物释放提供了基础。
|
Figure 4 Scanning electron microscopic (A) and stereoscopic (B) images of BMN. The scale bars indicate 100 μm. C: Stereoscopic images of the BMN patch inserting into the cornea at different time points. The scale bars indicate 400 μm |
BMN插入在体大鼠角膜后, 发现30 s内针体几乎完全溶解, 1 min后基底开始溶解, 2 min后基底溶解更多, 甚至出现穿透现象(图 4C)。因此, BMN在插入角膜后能快速溶解, 可促进药物释放, 易从角膜移除, 满足眼用微针快速、高效和微创的特点。
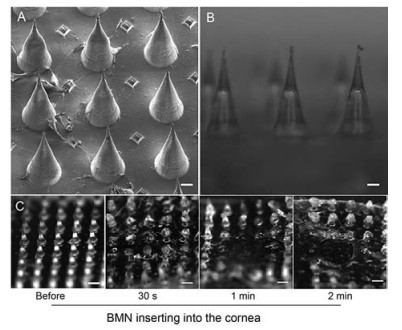
4 BMN的药物释放BMN的药物释放曲线显示在0.5 h时, 已有50%的药物从BMN中释放, 2 h时药物释放超过90% (图 5)。Ritger-Peppas模型对BMN的释放具有最优拟合程度(表 1), 提示药物释放主要依照溶蚀释放机制[22]。已证明BMN能在角膜中快速溶解, 因此药物可通过微针溶蚀快速释放于角膜中。
|
Figure 5 In vitro release profile of BMN at 37 ℃ in the simulated tear fluid (n = 3, x± s) |
| Table 1 Simulations of drug release from BMN |
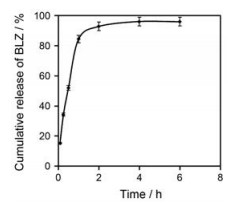
在15 min时, BMN的药物累积渗透量(251 ± 43 μg) 显著大于BED的药物累积渗透量(6 ± 1 μg, 图 6A), 同时BMN的药物透角膜速率(Jss= 146 ± 29 μg·h-1)也远高于BED (Jss= 9 ± 2 μg·h-1)。因此, BMN通过插入角膜并在角膜内快速释放药物, 显著提高药物的角膜渗透量和速率; 在4 h时, 与BED相比, BMN的药物渗透增强比高达13。BMN的角膜内药物储库量显著高于BED (P < 0.01) (图 6B), 说明微针给药可显著延长药物在角膜表面的滞留时间, 提高药物的生物利用度。
|
Figure 6 In vitro corneal permeation profiles of BMN and BLZ eyedrops (BED) (A). BLZ in cornea after administration with BMN and BED (B). n = 3, x ± s. **P < 0.01 vs BED |
微针插入角膜的能力对药物递送和治疗效果有着至关重要的作用[23]。大鼠的角膜中央厚度与人体相似(约550 μm)。因此, 本文选用SD大鼠作为模型动物。在手术显微镜下观察到插过微针的角膜具有与微针阵列一致的点分布, 照相后微创部位具有不均匀反光现象(图 7A), 说明BMN能很好插入角膜。插过微针的角膜在微针取出1 h时, 角膜表面的微孔不再清晰, 说明角膜正在快速修复; 3 h后微孔几乎不可见; 24 h后角膜已恢复至正常外观(图 7A)。因此, BMN给药后造成的角膜微创伤可自身快速修复。角膜病理切片显示刚刚插入微针后的角膜表面上皮层和部分中间的基质层出现孔洞, 深度约200 μm。该孔洞的形成是眼用微针消除角膜屏障, 促进药物渗透的主要原因。BMN给药1天后角膜上的孔洞已基本消失; 3天后角膜已完全恢复正常(图 7B)。因此, BMN眼部给药具有良好的安全性。

|
Figure 7 A: Appearance of rat cornea following the corneal insertion of BMN; B: H & E images of cornea following the corneal insertion of BMN. The scale bars indicate 100 μm |
角膜屏障及药物的疏水性质是眼用制剂开发的主要限制因素[24]。本文制备了一种疏水性药物的眼用微针, 制备中充分利用PVP K90易溶于乙醇和水的性质, 不仅获得高载药量, 还可在插入角膜后快速溶解释放药物。该微针选择圆锥形针体结构、合适的针体长度和针尖宽度, 适合插入角膜。在短时间插入角膜并取出微针后, 角膜可在3日内完全修复。因此, 以PVP K90制备的疏水性药物眼用微针是一种新型眼用给药系统, 为眼部疾病的治疗提供一种新方式。
作者贡献: 李敏姝负责实验设计、实验操作、数据分析和论文初稿撰写; 于翔负责实验设计和结果分析; 金义光和吴志鸿负责课题设计、实验指导、数据分析、论文写作与修改。
利益冲突: 本文不与任何个人或集体存在利益冲突。
| [1] |
Gote V, Sikder S, Sicotte J, et al. Ocular drug delivery: present innovations and future challenges[J]. J Pharmacol Exp Ther, 2019, 370: 602-624. DOI:10.1124/jpet.119.256933 |
| [2] |
Waghule T, Singhvi G, Dubey SK, et al. Microneedles: a smart approach and increasing potential for transdermal drug delivery system[J]. Biomed Pharmacother, 2019, 109: 1249-1258. DOI:10.1016/j.biopha.2018.10.078 |
| [3] |
Pan J, Ruan W, Qin M, et al. Intradermal delivery of STAT3 siRNA to treat melanoma via dissolving microneedles[J]. Sci Rep, 2018, 8: 1117. DOI:10.1038/s41598-018-19463-2 |
| [4] |
Wang T, Zhen Y, Ma X, et al. Mannosylated and lipid A-incorporating cationic liposomes constituting microneedle arrays as an effective oral mucosal HBV vaccine applicable in the controlled temperature chain[J]. Colloids Surf B, 2015, 126: 520-530. DOI:10.1016/j.colsurfb.2015.01.005 |
| [5] |
Wang N, Zhen Y, Jin Y, et al. Combining different types of multifunctional liposomes loaded with ammonium bicarbonate to fabricate microneedle arrays as a vaginal mucosal vaccine adjuvant-dual delivery system (VADDS)[J]. J Control Release, 2017, 246: 12-29. DOI:10.1016/j.jconrel.2016.12.009 |
| [6] |
Than A, Liu C, Chang H, et al. Self-implantable double-layered micro-drug-reservoirs for efficient and controlled ocular drug delivery[J]. Nat Commun, 2018, 9: 4433. DOI:10.1038/s41467-018-06981-w |
| [7] |
Lee YJ, Park SH, Kim SI, et al. Rapidly detachable microneedles using porous water-soluble layer for ocular drug delivery[J]. Adv Mater Technol, 2019, 5: 1901145. |
| [8] |
Vora L, Donnelly RF, Larraneta E, et al. Novel bilayer dissolving microneedle arrays with concentrated PLGA nano-microparticles for targeted intradermal delivery: proof of concept[J]. J Control Release, 2017, 147: 93-101. |
| [9] |
Chen W, Wang C, Yan L, et al. Improved polyvinylpyrrolidone microneedle arrays with non-stoichiometric cyclodextrin[J]. J Mater Chem B, 2014, 2: 1699-1712. DOI:10.1039/C3TB21698E |
| [10] |
Ma Y, Gill HS. Coating solid dispersions on microneedles via a molten dip-coating method: development and in vitro evaluation for transdermal delivery of a water-insoluble drug[J]. J Pharm Sci, 2015, 103: 3621-3630. |
| [11] |
Girdhari R, Rohini DG, Veda ST, et al. Amphotericin B containing microneedle ocular patch for effective treatment of fungal keratitis[J]. Int J Pharm, 2019, 572: 118808. DOI:10.1016/j.ijpharm.2019.118808 |
| [12] |
Zhang MD, Jia HL, Jiang RY, et al. Synthesis and HPLC analysis of brinzolamide (S)-isomer[J]. Chem Res Appl (化学研究与应用), 2010, 22: 1075-1078. |
| [13] |
Yu X, Jin Y, Du L, et al. Transdermal cubic phases of metformin hydrochloride: in silico and in vitro studies of delivery mechanisms[J]. Mol Pharm, 2018, 15: 3121-3132. DOI:10.1021/acs.molpharmaceut.8b00209 |
| [14] |
Yadav MK, Chuck RS, Park CY. Composition of artificial tear solution affects in vitro pseudomonas aeruginosa biofilm formation on silicone hydrogel lens[J]. J Ocul Pharmacol Ther, 2013, 29: 591. DOI:10.1089/jop.2012.0078 |
| [15] |
Liu R, Zhang M. In vivo and in situ imaging of controlled-release dissolving silk microneedles into the skin by optical coherence tomography[J]. J Biophotonics, 2017, 10: 870-877. DOI:10.1002/jbio.201500230 |
| [16] |
Ling MH, Chen MC. Dissolving polymer microneedle patches for rapid and efficient transdermal delivery of insulin to diabetic rats[J]. Acta Biomater, 2013, 9: 8952-8961. DOI:10.1016/j.actbio.2013.06.029 |
| [17] |
Ohan JY, Yu JM, Ko JH. Analysis of ethanol effects on corneal epithelium[J]. Invest Ophthalmol Vis, 2013, 54: 3852-3856. DOI:10.1167/iovs.13-11717 |
| [18] |
Yu X, Li MS, Zhu L, et al. Amifostine-loaded armored dissolving microneedles for long-term prevention of ionizing radiation-induced injury[J]. Acta Biomater, 2020, 112: 87-100. DOI:10.1016/j.actbio.2020.05.025 |
| [19] |
Suzanne MB, Annelieke CK, Rapha Z, et al. Influence of microneedle shape on the transport of a fluorescent dye into human skin in vivo[J]. J Control Release, 2010, 147: 218-224. DOI:10.1016/j.jconrel.2010.07.104 |
| [20] |
Lee KJ, Song HB, Cho W, et al. Intracorneal injection of a detachable hybrid microneedle for sustained drug delivery[J]. Acta Biomater, 2018, 15: 48-57. |
| [21] |
Zhan HH, Huang YC, Ma FS. Quality evaluation of lidocaine hydrochloride rapid onset local anesthesia preparation based on microneedles technology[J]. Acta Pharm Sin (药学学报), 2018, 53: 1371-1376. |
| [22] |
Le J, Zhang X, Lu WY, et al. Using double zero-order model to test the release of dexamethasone implants[J]. Acta Pharm Sin (药学学报), 2020, 55: 1306-1311. |
| [23] |
Matthews A, Hutnik C. Indentation and needle insertion properties of the human eye[J]. Eye, 2014, 28: 880-887. DOI:10.1038/eye.2014.99 |
| [24] |
Mukesh C, Taneja A. Innovative bulls eye drop applicator for self-instillation of eye drops[J]. Cont Lens Anterior Eye, 2020, 43: 256-260. DOI:10.1016/j.clae.2019.11.010 |
 2021, Vol. 56
2021, Vol. 56


