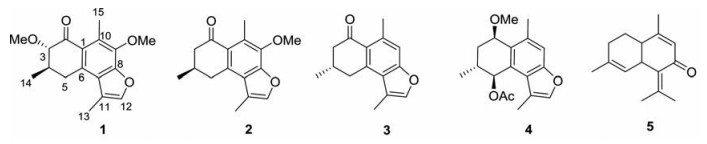
橄榄科没药属植物全球约有150多种, 主要分布于索马里、埃塞俄比亚及阿拉伯南部半岛等热带和亚热带地区, 我国云南、天津、广东等地也有引种栽培。《中国药典》2020年版一部记载没药为橄榄科植物地丁树Commiphora myrrha Engl.或哈地丁树Commiphora molmol Engl.的干燥树脂, 分为天然没药和胶质没药[1]。没药药用历史悠久, 其性平, 味辛、苦, 具有散瘀定痛、消肿生肌功效, 用于胸痹心痛、胃脘疼痛、痛经经闭、产后瘀阻、癥瘕腹痛、风湿痹痛、跌打损伤、痈肿疮疡[1, 2]。近年来, 国内外学者对没药的化学成分和药理活性进行了大量研究, 其化学成分包括萜类[3-6]、甾体类[7]、木脂素[8]等, 药理研究表明没药具有抗炎镇痛[9-11]、抗菌[12]、抗氧化[11, 13]、抗肿瘤[14]等多种药理活性。为进一步阐明没药的化学成分, 本文从其正己烷提取物中分离鉴定了5个杜松烷型倍半萜(图 1), 包括(3S, 4R)-3, 9-二甲氧基没药酮(1)、9-甲氧基没药酮(2)、没药酮(3)、commiterpene B (4) 和comosone Ⅱ (5), 其中化合物1为新化合物, 化合物5为首次从该属植物中内分离得到。
|
Figure 1 Chemical structures of compounds 1-5 |
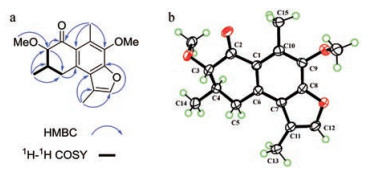
化合物1 无色针状结晶(二氯甲烷-甲醇), [α] -90 (c 0.1, MeOH), HR-ESI-MS给出准分子离子峰289.143 4 [M+H]+ (计算值289.143 0), 结合13C NMR数据推测该化合物的分子式为C17H20O4, 计算其不饱和度为8。红外光谱显示该化合物含有羰基(1 688 cm-1) 和苯环(1 473和1 455 cm-1) 官能团。在化合物1的1H NMR中, 观察到2个甲氧基氢信号[δH 3.99 (3H, s, 9-OCH3), δH 3.56 (3H, s, 3-OCH3)]、3个甲基氢信号[δH 2.58 (3H, s, H-15), δH 2.39 (3H, d, J = 1.5 Hz, H-13), δH 1.22 (3H, d, J = 6.5 Hz, H-14)]、1个亚甲基氢信号[δH 3.61 (1H, dd, J = 17.5, 9.5 Hz, H-5a), δH 2.99 (1H, dd, J = 17.5, 9.5 Hz, H-5b)] 和2个次甲基氢信号[δH 3.60 (1H, d, J = 10.5 Hz, H-3), δH 2.43 (1H, m, H-4)]。通过分析化合物1的13C NMR和HSQC数据可知, 该化合物包括3个甲基碳、1个亚甲基碳、2个次甲基碳、8个芳碳或烯碳、2个甲氧基碳和1个羰基碳(表 1), 根据以上信息推测化合物1为杜松烷型倍半萜类化合物。化合物1与已知化合物9-甲氧基没药酮(2) 的NMR数据相似[15], 不同之处在于化合物1多出了一个甲氧基信号, 且化合物1的C-3 (δC 88.1; ΔδC +39.2) 的化学位移向低场移动, 因此推断化合物1中甲氧基连接在C-3位, HMBC图谱中观察到3-OCH3氢质子和C-3, H-3和C-2/C-5, H3-14和C-3/C-4/C-5的氢-碳远程相关信号(图 2a), 同时在1H-1H COSY谱中也观察到H-3/H-4、H-4/H-5和H-4/H3-14的相关信号(图 2a), 进一步证实了上述推断。通过X-ray单晶衍射(图 2b) 进一步确定(CCDC: 2035517) 该化合物的绝对构型为3S, 4R。因此, 化合物1的结构鉴定为(3S, 4R)-3, 9-二甲氧基没药酮。
| Table 1 1H (500 MHz) and 13C (125 MHz) NMR data of compound 1 (CDCl3) |
|
Figure 2 Key HMBC, 1H-1H COSY correlations (a) and ORTEP drawing (b) of compound 1 |
Milli Q超纯水机(Millipore公司); 高效液相-离子阱-飞行时间质谱仪(日本岛津公司); Varian 500核磁共振仪(美国Varian公司); 半制备型高效液相色谱仪(日本岛津公司); X-ray单晶衍射仪(美国安捷伦公司); ZF-1型三用紫外分析仪(江苏海门市其林贝耳仪器制造有限公司); UH5300型分光光度计; YMC-pack-A半制备HPLC色谱柱(250 mm×10 mm, 5 μm); 旋转蒸发仪(瑞士Buchi公司); ODS (40~63 μm, 德国Merck); 柱色谱用硅胶(200~300目) 及薄层色谱用GF254硅胶预制板均为青岛海洋化工厂生产。提取分离所用石油醚、正己烷、二氯甲烷、乙酸乙酯、无水乙醇、甲醇等试剂为西陇科学股份有限公司生产, 均为分析纯。高效液相所用溶剂(甲醇、乙腈) 为色谱纯, 水为超纯水。
没药于2018年12月购自北京市华邈药业有限公司, 由北京中医药大学中药学院中药现代研究中心屠鹏飞教授鉴定为地丁树Commiphora myrrha Engl.的干燥树脂, 样品标本(No.DD4271) 存放于北京中医药大学中药学院中药现代研究中心。
1 提取分离没药干燥树脂3.0 kg, 粉碎后依次用正己烷、二氯甲烷、95%乙醇回流提取(2×10 L, 每次2 h), 合并提取液, 减压回收溶剂依次得到正己烷提取物651.0 g, 二氯甲烷提取物511.0 g, 95%乙醇提取物90.0 g。
正己烷提取物525.0 g经硅胶柱色谱分离, 正己烷-乙酸乙酯(100∶0→0∶2) 梯度洗脱, 得到21个流分(Fr.A~U)。Fr.D (7.0 g) 采用硅胶柱色谱分离, 正己烷-二氯甲烷(2∶1→0∶1) 梯度洗脱, 得到5个流分(Fr.D1~D5), Fr.D1 (1.5 g) 经硅胶柱色谱分离, 用正己烷-二氯甲烷(5∶1→0∶2) 梯度洗脱, 得到5个流分(Fr.D1a~D1e)。Fr.D1c经二氯甲烷-甲醇重结晶得到化合物3 (17.0 mg)。Fr.E (25.0 g) 采用硅胶柱色谱分离, 石油醚-二氯甲烷(5∶1→0∶4) 梯度洗脱, 得到6个流分(Fr.E1~E6), Fr.E1 (4.0 g) 经反相ODS柱色谱分离, 用甲醇-水体系(70%~100%) 梯度洗脱, 得到6个流分Fr.E1a~E1f。Fr.E1b经二氯甲烷-甲醇重结晶得到化合物2 (5.0 mg)。Fr.E2 (10.0 g) 经反相ODS柱色谱分离, 用甲醇-水体系(70%~100%) 梯度洗脱, 得到20个流分Fr.E2a~E2t。Fr.E2g经半制备HPLC纯化(乙腈-水, 65∶35) 得到化合物5 (4.0 mg, tR = 18.0 min)。Fr.F (15.0 g) 经硅胶柱色谱分离, 石油醚-二氯甲烷(2∶1→0∶1) 梯度洗脱, 得到11个流分(Fr.F1~F11), Fr.F3 (4.0 g) 经反相ODS柱色谱分离, 用甲醇-水体系(70%~100%) 梯度洗脱, 得到19个流分Fr.F3a~F3s。Fr.F3c经二氯甲烷-甲醇重结晶得到化合物1 (3.5 mg)。Fr.F8 (1.5 g) 经反相ODS柱色谱分离, 用甲醇-水体系(60%~100%) 梯度洗脱, 得到24个流分Fr.F8a~F8x。Fr.F8i经半制备HPLC纯化(乙腈-水, 80∶20) 得到化合物4 (5.0 mg, tR = 10.0 min)。
2 结构鉴定化合物1 无色针状结晶(二氯甲烷-甲醇), mp 84~86 ℃, [α] -90 (c 0.1, MeOH); UV (MeOH) λmax (log ε): 320 (3.20), 240 (4.32) nm; IR (KBr) νmax: 2 926, 2 849, 1 688, 1 472, 1 326, 1 310, 1 225, 1 121, 1 034, 1 001, 900, 797 cm–1; 正离子HR-ESI-MS m/z: 289.1434 [M+H]+ (计算值为289.143 0)。1H NMR (CDCl3, 500 MHz) 和13C NMR (CDCl3, 125 MHz) 数据见表 1。
晶体数据: 分子式C17H20O4, M = 288.33, 三斜晶系, 晶胞参数为a = 8.353 2 (3) nm, b = 10.007 4 (4) nm, c = 10.388 0 (5) nm, α = 101.745 (4)°, β = 109.189 (4)°, γ = 108.711 (4)°, U = 728.97 (6) Å3, T = 112.8 (2), 空间群为P1 (no. 1), Z = 2, μ (Cu Kα) = 0.757 mm-1, 收集衍射点数为9656, 独立衍射点数为4837 (Rint = 0.022 7), wR (F2) 为0.109 5, Flack系数0.01 (10)。
化合物2 无色针状结晶(二氯甲烷-甲醇), mp 74~76 ℃, ESI-MS m/z: 259.13 [M+H]+, 分子式为C16H18O3。1H NMR (CDCl3, 500 MHz) δ: 1.17 (3H, d, J = 6.0 Hz, H3-14), 2.34 (1H, m, H-3b), 2.35 (1H, m, H-4), 2.40 (3H, d, J = 1.0 Hz, H3-13), 2.61 (3H, br s, H3-15), 2.72 (1H, m, H-3a), 2.82 (1H, dd, J = 16.5, 10.0 Hz, H-5b), 3.49 (1H, m, H-5a), 3.98 (3H, s, 9-OCH3), 7.37 (1H, q, J = 1.5 Hz, H-12); 13C NMR (CDCl3, 125 MHz) δ: 127.7 (C-1), 200.2 (C-2), 49.0 (C-3), 30.2 (C-4), 35.5 (C-5), 135.6 (C-6), 125.8 (C-7), 150.2 (C-8), 142.4 (C-9), 129.1 (C-10), 117.3 (C-11), 142.2 (C-12), 11.4 (C-13), 21.7 (C-14), 14.0 (C-15), 61.0 (9-OCH3)。以上数据与文献[15]报道基本一致, 故鉴定化合物为9-甲氧基没药酮。
化合物3 无色棱状结晶(二氯甲烷-甲醇), mp 108~110 ℃, ESI-MS m/z: 229.12 [M+H]+, 分子式为C15H16O2。1H NMR (CDCl3, 500 MHz) δ: 1.18 (1H, d, J = 6.0 Hz, H3-14), 2.34 (1H, m, H-3a), 2.36 (1H, m, H-4), 2.40 (3H, d, J = 1.5 Hz, H3-13), 2.71 (1H, br s, H3-15), 2.72 (1H, m, H-3b), 2.87 (1H, dd, J = 16.5, 10.5 Hz, H-5a), 3.53 (1H, dd, J = 16.5, 4.0 Hz, H-5b), 7.26 (1H, br s, H-9), 7.33 (1H, q, J = 1.5 Hz, H-12); 13C NMR (CDCl3, 125 MHz) δ: 138.7 (C-1), 199.9 (C-2), 49.0 (C-3), 30.0 (C-4), 35.8 (C-5), 140.8 (C-6), 124.4 (C-7), 157.3 (C-8), 113.3 (C-9), 126.6 (C-10), 116.8 (C-11), 142.2 (C-12), 11.4 (C-13), 21.7 (C-14), 24.3 (C-15)。以上数据与文献[16]报道基本一致, 故鉴定化合物为没药酮。
化合物4 无色油状, ESI-MS m/z: 325.14 [M+Na]+, 分子式为C18H22O4。1H NMR (CDCl3, 500 MHz) δ: 0.99 (3H, d, J = 7.5 Hz, H3-14), 2.06 (1H, m, H-3α), 2.09 (3H, s, 5-OCOCH3), 2.23 (3H, s, H3-13), 2.25 (1H, m, H-3β), 2.47 (3H, s, H3-15), 2.52 (1H, m, H-4β), 3.36 (3H, s, 2-OCH3), 4.65 (1H, t, J = 7.0 Hz, H-2α), 6.04 (1H, d, J = 3.0 Hz, H-5α), 7.30 (1H, s, H-9), 7.32 (1H, s, H-12); 13C NMR (CDCl3, 125 MHz) δ: 130.4 (C-1), 72.8 (C-2), 29.8 (C-3), 31.2 (C-4), 73.0 (C-5), 126.5 (C-6), 125.4 (C-7), 155.7 (C-8), 114.5 (C-9), 135.6 (C-10), 115.8 (C-11), 142.1 (C-12), 10.5 (C-13), 17.4 (C-14), 20.8 (C-15), 54.5 (2-OCH3), 170.9 (5-OCOCH3), 21.9 (5-OCOCH3)。以上数据与文献[17]报道基本一致, 故鉴定化合物为commiterpene B。
化合物5 无色油状, ESI-MS m/z: 217.15 [M+H]+, 分子式为C15H20O。1H NMR (CDCl3, 500 MHz) δ: 1.57 (3H, s, H3-15), 1.81 (2H, m, H2-3), 1.83 (1H, m, H-2b), 1.86 (3H, s, H3-13), 1.93 (3H, s, H3-14), 2.06 (3H, s, H3-12), 2.20 (1H, m, H-2a), 2.74 (1H, m, H-1), 3.75 (1H, br s, H-6), 4.92 (1H, br s, H-5), 5.89 (1H, s, H-9); 13C NMR (CDCl3, 125 MHz) δ: 38.4 (C-1), 25.5 (C-2), 26.2 (C-3), 135.2 (C-4), 122.1 (C-5), 39.9 (C-6), 133.7 (C-7), 191.9 (C-8), 130.9 (C-9), 158.6 (C-10), 141.8 (C-11), 23.2 (C-12), 22.0 (C-13), 21.0 (C-14), 23.6 (C-15)。以上数据与文献[18]报道基本一致, 故鉴定化合物为comosone II。
作者贡献: 屠鹏飞和李军负责实验设计, 王超超负责实验实施以及文章的撰写, 夏晖参与实验实施, 梁乃允、王嵘晔、王鑫玉和姚会娜完成数据分析, 霍会霞、屠鹏飞和李军负责文章的审阅和提出论文写作的建议, 并最终定稿。
利益冲突: 作者声明无利益冲突。
| [1] |
Chinese Pharmacopoeia Commission. Pharmacopoeia of the People's Republic of China (中华人民共和国药典)[S]. Part 1. Beijing: China Medical Science Press, 2020: 193-194.
|
| [2] |
Abdul-Ghani RA, Loutfy N, Hassan A. Myrrh and trematodoses in Egypt: an overview of safety, efficacy and effectiveness profiles[J]. Parasitol Int, 2009, 58: 210-214. DOI:10.1016/j.parint.2009.04.006 |
| [3] |
Dong L, Luo Q, Cheng LZ, et al. New terpenoids from Resina Commiphora[J]. Fitoterapia, 2017, 117: 147-153. DOI:10.1016/j.fitote.2017.01.013 |
| [4] |
Xu J, Guo Y, Zhao P, et al. Four new sesquiterpenes from Commiphora myrrha and their neuroprotective effects[J]. Fitoterapia, 2012, 83: 801-805. DOI:10.1016/j.fitote.2012.03.016 |
| [5] |
Shen T, Yuan HQ, Wan WZ, et al. Cycloartane-type triterpenoids from the resinous exudates of Commiphora opobalsamum[J]. J Nat Prod, 2008, 71: 81-86. DOI:10.1021/np070442p |
| [6] |
Zhu SS, Liu JW, Yan YM, et al. Terpenoids from Resina Commiphora regulating lipid metabolism via activating PPARα and CPT1 expression[J]. Org Lett, 2020, 22: 3428-3432. DOI:10.1021/acs.orglett.0c00898 |
| [7] |
Shen T, Zhang L, Wang YY, et al. Steroids from Commiphora mukul display antiproliferative effect against human prostate cancer PC3 cells via induction of apoptosis[J]. Bioorg Med Chem Lett, 2012, 22: 4801-4806. DOI:10.1016/j.bmcl.2012.05.052 |
| [8] |
Dekebo A, Lang M, Polborn K, et al. Four lignans from Commiphora erlangeriana[J]. J Nat Prod, 2002, 65: 1252-1257. DOI:10.1021/np020028j |
| [9] |
Mehta AK, Tripathi CD. Commiphora mukul attenuates peripheral neuropathic pain induced by chronic constriction injury of sciatic nerve in rats[J]. Nutr Neurosci, 2015, 18: 97-102. DOI:10.1179/1476830513Y.0000000104 |
| [10] |
Huang C, Wang JL, Lu X, et al. Z-Guggulsterone negatively controls microglia-mediated neuroinflammation via blocking IκB-α-NF-κB signals[J]. Neurosci Lett, 2016, 619: 34-42. DOI:10.1016/j.neulet.2016.02.021 |
| [11] |
Fatani AJ, Alrojayee FS, Parmar MY, et al. Myrrh attenuates oxidative and inflammatory processes in acetic acid-induced ulcerative colitis[J]. Exp Ther Med, 2016, 12: 730-738. DOI:10.3892/etm.2016.3398 |
| [12] |
de Souza Pereira JJ, Pereira AP, Jandú JJ, et al. Commiphora leptophloeos phytochemical and antimicrobial characterization[J]. Front Microbiol, 2017, 8: 52. |
| [13] |
Fraternale D, Sosa S, Ricci D, et al. Anti-inflammatory, antioxidant and antifungal furanosesquiterpenoids isolated from Commiphora erythraea (Ehrenb.) Engl. Resin[J]. Fitoterapia, 2011, 82: 654-661. DOI:10.1016/j.fitote.2011.02.002 |
| [14] |
Mahmoud AM, Zaki AR, Hassan ME, et al. Commiphora molmol resin attenuates diethylnitrosamine/phenobarbital-induced hepatocarcinogenesis by modulating oxidative stress, inflammation, angiogenesis and Nrf2/ARE/HO-1 signaling[J]. Chem-Biol Interact, 2017, 270: 41-50. DOI:10.1016/j.cbi.2017.04.012 |
| [15] |
Zhao N, Yang GC, Li DH, et al. Two new sesquiterpenes from Myrrh[J]. Helv Chim Acta, 2015, 98: 1332-1336. DOI:10.1002/hlca.201500094 |
| [16] |
Zhao N, Yang GC, Li DH, et al. Isolation and identification of terpenoids from Myrrh[J]. Chin J Med Chem (中国药物化学杂志), 2015, 25: 466-469. |
| [17] |
Xu J, Guo Y, Zhao P, et al. Neuroprotective cadinane sesquiterpenes from the resinous exudates of Commiphora myrrha[J]. Fitoterapia, 2011, 82: 1198-1201. DOI:10.1016/j.fitote.2011.08.001 |
| [18] |
Xu F, Nakamura S, Qu Y, et al. Structures of new sesquiterpenes from Curcuma comosa[J]. Chem Pharm Bull, 2008, 56: 1710-1716. DOI:10.1248/cpb.56.1710 |
 2021, Vol. 56
2021, Vol. 56


