2. 福建中医药大学, 生物医药研发中心, 福建 福州 350122
2. Biomedical Research and Development Center, Fujian University of Traditional Chinese Medicine, Fuzhou 350122, China
神经胶质瘤占恶性脑肿瘤的75%, 其中一半以上为胶质母细胞瘤, 平均5年生存率为35%[1], 具有高发病率、高复发率、高病死率和低治愈率的特点[2]。尽管过去十年在揭示原发性脑肿瘤的分子基础方面取得了重大进展, 但由于神经胶质瘤患病区域特殊性及瘤体强侵袭性, 其有效的治疗方法仍面临巨大挑战[1]。手术、放疗和化疗依然是治疗脑胶质瘤的重要手段, 然而放化疗常缺乏选择性, 药物难以透过血脑屏障, 肿瘤部位药物浓度较低, 难以达到消除脑胶质瘤细胞的效果[3]。现在治疗胶质瘤的化疗药物主要有亚硝脲类烷化剂, 如卡莫司汀、洛莫司汀和福莫司汀等, 这类药物脂溶性高, 可以透过血脑屏障, 但其毒副作用大[4], 易引起脑损伤和系统性的免疫抑制[5], 潜在不良反应严重; 替莫唑胺作为新型烷化剂已在临床上用于治疗胶质瘤, 但Johnson等[6]发现替莫唑胺能在异柠檬酸脱氢酶(isocitrate dehydrogenase, IDH) 突变的胶质瘤亚群中诱发超突变; 脑胶质瘤靶向治疗药物如贝伐单抗等可以通过抑制脑胶质瘤的血管新生发挥独特疗效, 但也存在抑制正常血管的形成, 导致高血压等不良反应[5]。因此, 研发疗效显著、不良反应小的抗神经胶质瘤药物十分迫切。
钩吻(Gelsemiurm elegans Benth.), 胡蔓藤属植物, 是世界著名的有毒植物, 主要分布在中国福建、云南、贵州、广西等省, 亚洲东南部和美国南部[7]。《中药大辞典》中描述: 钩吻又名胡蔓藤、断肠草, 性温, 味辛、苦, 有大毒, 具有祛风攻毒、散结、止痛作用, 主治风湿痹痛和神经痛。国内早在上世纪80年代就将钩吻应用于临床治疗肿瘤, 并取得一定疗效[8], 但是, 由于钩吻毒性极大, 导致其临床应用受到限制。而钩吻中微量的yohimbane型钩吻生物碱常绿钩吻碱(sempervirine, SPV, 图 1)[9-11], 由于其良好的抗精神疾病和镇静[12, 13]等中枢系统作用和低毒安全性[14, 15]而被广泛关注, 然而其抗神经胶质瘤的研究未见报道。本研究以人胶质瘤细胞系U251为研究对象, 从体外细胞增殖抑制和相关蛋白的检测及裸鼠体内移植瘤抑瘤作用的研究, 探讨常绿钩吻碱抑制人神经胶质瘤的作用, 为常绿钩吻碱抗神经胶质瘤研究与开发提供实验依据。
|
Figure 1 Chemical structure of sempervirine (SPV) |
细胞 人源胶质瘤细胞U251购自中国科学院典型培养物保藏委员会细胞库。
试剂 常绿钩吻碱(由福建中医药大学药学院3408实验室提供, 纯度≥ 98%); DMSO (美国Sigma公司); DMEM培养基、胰蛋白酶、胎牛血清(美国Gibco公司); PBS缓冲液(美国Hyclone公司); 青、链霉素(北京Solarbio公司); 结晶紫染料(北京索莱宝公司); Annexin V-FITC/PI细胞凋亡检测试剂盒(大连美仑公司); Hoechst 33342染色液、ECL化学发光试剂盒(上海碧云天公司); PI3K、p-AKT、AKT、Bax、Bcl-2、caspase-3、cleaved caspase-3、β-actin抗体、HRP标记山羊抗兔IgG (美国Proteintech公司)。
仪器 CO2恒温细胞培养箱(香港力康公司); TDZ4A-WS低速水平离心机(湖南湘仪实验室仪器开发有限公司); IX70型倒置荧光显微镜(日本OLYMPUS公司); Multiskan FC型酶标仪[赛默飞世尔(上海) 仪器有限公司]; FACS Calibur流式细胞仪(美国BD公司)。
细胞培养 人胶质瘤细胞U251细胞用含10%胎牛血清、100 μg·mL-1青霉素和100 μg·mL-1链霉素的DMEM高糖培养基, 于37 ℃、5% CO2恒温培养。细胞生长达到对数生长期(70%~80%) 后, 用0.25%胰酶消化贴壁细胞, 按照1∶2~1∶3的比例传代培养。
MTT法检测细胞毒性和细胞增殖 将处于对数生长期的U251细胞消化后, 用含血清的培养基重悬计数, 调整细胞密度以5 000个/孔接种于96孔板中, 37 ℃过夜培养。次日吸弃培养基后, 加入含有不同浓度常绿钩吻碱(0、1、2、4、8、16 μmol·L-1, 折算成质量浓度为0、0.273、0.546、1.093、2.186、4.373 μg·mL-1) 的培养基100 μL, 每组设置5个复孔, 对照组加入0.1% DMSO培养基100 μL, 另设调零组(不含细胞只加培养基)。分别培养24、48和72 h后, 移除各孔中原有的培养基, 加入MTT (10 mg·mL-1) 的工作液10 μL; 将96孔板重新放回37 ℃、5% CO2细胞培养箱中避光孵育4 h; 加入二甲基亚砜(DMSO) 100 μL溶解线粒体中的蓝紫色结晶甲瓒, 避光下将96孔板放在水平震荡仪上低速震荡5 min; 在紫外酶标仪540 nm波长处测定吸光值(A值), 计算细胞生长抑制率。
倒置相差显微镜观察细胞形态学变化 选择处于对数生长期的U251细胞消化后, 以3×105个/孔接种至6孔板, 每孔加入2 mL培养基培养, 细胞贴壁后, 0、1、4和8 μmol·L-1常绿钩吻碱分别干预细胞48 h后, 倒置相差显微镜下观察细胞形态学变化。
集落形成实验 选择处于对数生长时期的U251细胞, 用胰蛋白酶消化3 min, 1 000 r·min-1离心5 min后, 收集细胞后, 细胞计数仪上计数, 调整细胞浓度为每毫升3×105个, 并接种到6孔板中, 于37 ℃、5% CO2的饱和湿度培养箱培养。培养至50%~60%时, 加入不同浓度常绿钩吻碱干预48 h, 吸弃上清液, 用PBS润洗3次, 胰酶消化细胞, 1 000 r·min-1离心5 min吸弃上清液收集细胞, 计数后按500个/孔接种至6孔板中, 每3天换液1次, 培养14天后, 以结晶紫染色观察集落形成情况, 用Image Quant TL 7.0软件对克隆团进行计数。相对克隆数(%) = 100×给药组克隆数目/空白对照组克隆数目。实验重复3次。
Annexin V-FITC/PI染色检测细胞凋亡 收集对数生长期的U251细胞, 以3×105个/孔的密度接种于6孔板, 37 ℃、5% CO2培养箱过夜, 次日吸弃培养基, 加入含有不同浓度常绿钩吻碱(0、1、4和8 μmol·L-1) 的培养基2 mL, 对照组加入含0.1% DMSO的培养基, 处理48 h后, 收集细胞和培养上清液, 按照Annexin V-FITC/PI凋亡检测试剂盒说明书操作, 流式细胞仪检测细胞凋亡, 重复3次独立实验。
Hoechst 33342染色检测细胞凋亡 收集对数生长期的U251细胞, 以3×105个/孔的密度接种于6孔板, 细胞贴壁后吸弃培养基, 加入含有不同浓度常绿钩吻碱(0、1、4、8 μmol·L-1) 的培养基2 mL, 对照组加入含0.1% DMSO的培养基, 处理48 h后弃上清液, PBS洗3次后加入Hoechst 33342染色液, 染色15 min后弃上清液, PBS洗3次, 荧光显微镜观察细胞凋亡情况。
Western blot实验 不同浓度常绿钩吻碱(0、1、4和8 μmol·L-1) 干预U251细胞48 h后, 加RIPA提取细胞总蛋白, BCA试剂盒检测蛋白样本浓度。取20 μg总蛋白, 进行SDS-PAGE凝胶电泳、切胶、转膜、封闭后, 加入一抗, 4 ℃过夜孵育, TBST洗膜3次, 每次10 min, 加入二抗孵育1 h, TBST洗膜3次, 每次10 min, 条带浸于超敏ECL化学发光反应液(A液∶B液= 1∶1) 中3 min, 室温下置于化学发光成像仪上曝光, 以β-actin作为内参, 测蛋白条带灰度值。
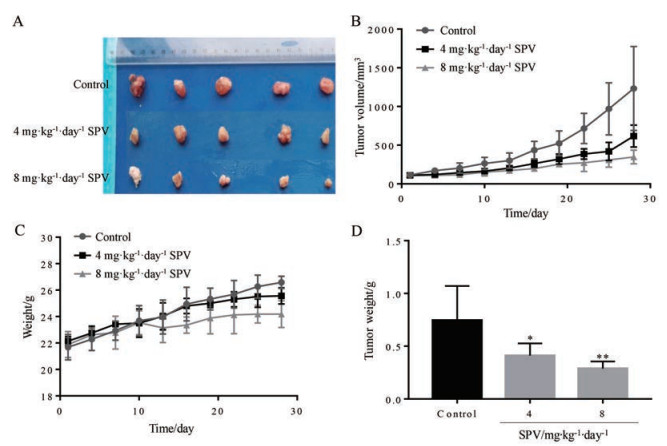
常绿钩吻碱对裸鼠异体种植U251细胞胶质瘤的影响 6周龄SPF级雄性BALB/c裸鼠由上海斯莱克实验动物有限责任公司提供[实验动物使用许可证编号SCXK (沪) 2017-0005], 并饲养于独立通风笼盒。笼内温度控制为22~25 ℃, 湿度控制为50%~60%, 12 h光照/12 h黑暗交替, 自由饮水进食。所有动物实验操作均严格遵守福建医科大学生物医学伦理委员会相关规定。裸鼠BALB/c小鼠共15只, 随机分为对照组(PBS)、常绿钩吻碱低剂量组和高剂量组(通过腹腔注射4和8 mg·kg-1·day-1, 每周进行5次)。U251细胞(5×106个细胞) 悬浮在1 mL PBS中, 皮下种植裸鼠的右侧腋下。当肿瘤达到100 mm3, 开始药物治疗。每3天测量肿瘤大小, 肿瘤体积根据以下公式计算: V (mm3) = a×b2/2, a是肿瘤最长轴, b是肿瘤最短的轴。所有的小鼠都在治疗28天后处死。收集肿瘤组织, 测量固定。
统计学方法 采用SPSS 25.0统计软件进行分析, 所得数据以x±s表示, 组间比较采用t检验, P < 0.05为差异有统计学意义。
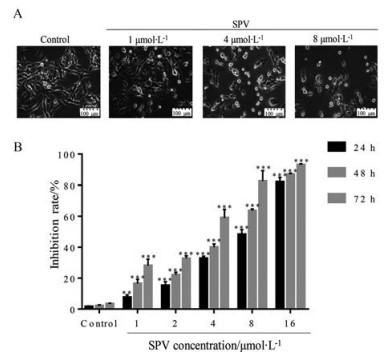
结果 1 常绿钩吻碱抑制U251细胞的增殖不同浓度常绿钩吻碱(0、1、4和8 μmol·L-1) 处理U251细胞48 h后发现, 随着给药剂量的增加U251细胞生长状态逐渐变差, 部分细胞变圆, 大小不一, 细胞间接触明显变少, 胞体皱缩明显, 突触萎缩, 且悬浮细胞碎片较多(图 2A)。MTT结果显示, 不同浓度常绿钩吻碱(0、1、2、4、8和16 μmol·L-1) 干预U251细胞能明显抑制U251细胞的增殖, 且常绿钩吻碱对U251细胞增殖的抑制作用表现为浓度依赖性和时间依赖性(图 2B)。计算常绿钩吻碱作用U251细胞48 h时IC50为4.981 μmol·L-1, 折算成质量浓度为1.361 μg·mL-1。
|
Figure 2 SPV inhibited U251 cells proliferation. A: Photograph (400×) of U251 cells on SPV treatment after 48 h; B: The effect of SPV on the inhibition rate of U251 cell proliferation at the indicated time, respectively. n = 5, x±s. **P < 0.01, ***P < 0.001 vs control |
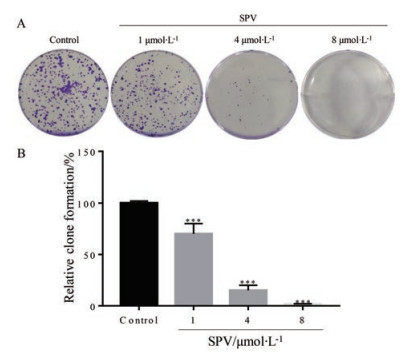
集落实验证实, 不同浓度常绿钩吻碱(0、1、4和8 μmol·L-1) 处理U251细胞48 h, 常绿钩吻碱能有效降低U251细胞的集落形成, 给药组细胞克隆形成显著减少(图 3)。
|
Figure 3 SPV inhibits U251 cells colony formation. A: The representative photos of the clones formed by U251 cells; B: The corresponding quantification results of colony formation. n = 3, x±s. ***P < 0.001 vs control |
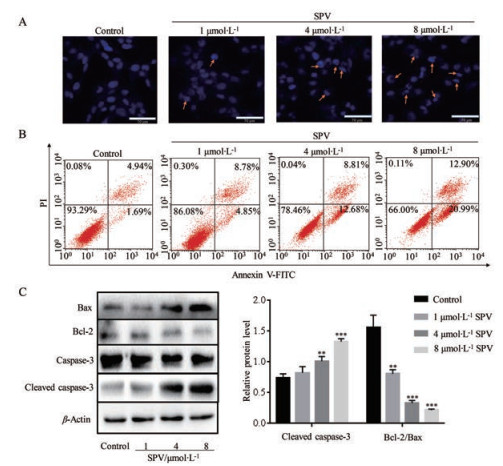
不同浓度常绿钩吻碱(0、1、4和8 μmol·L-1) 处理U251细胞48 h, 经Hoechst 33342染色, 发现对照组细胞核呈规则的圆形, 着色均匀; 随着常绿钩吻碱剂量的增加, U251细胞的细胞核固缩、碎裂, 形状不一, U251细胞的数量逐渐减少(图 4A); 流式细胞术检测结果表明, SPV能够显著诱导U251细胞凋亡(图 4B); Western blot结果显示, 其下游蛋白Bcl-2表达下调, Bax表达明显上调, caspase-3的切割活化明显增加(图 4C)。
|
Figure 4 Effect of SPV on apoptosis of U251 cells. U251 cells were treated with SPV (0, 1, 4, and 8 μmol·L-1) for 48 h. A: Cell nuclear morphological changes were measured by Hoechst 33342 stain and observed under a fluorescent microscope; B: Cell apoptosis was measured by Annexin V-FITC and propidium iodide (PI) stain and then detected by flow cytometry; C: Expression of apoptosis-related proteins was detected by Western blot. n = 3, x±s. **P < 0.01, ***P < 0.001 vs control |
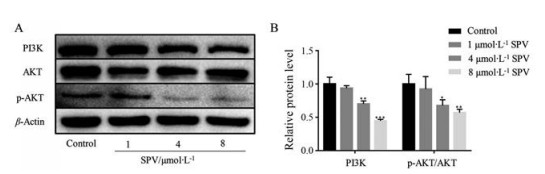
Western blot结果显示, 0、1、4和8 μmol·L-1常绿钩吻碱干预U251细胞48 h后, 与对照组相比, PI3K的表达明显下调, AKT的磷酸化水平显著下降(图 5)。
|
Figure 5 Expression of PI3K and AKT proteins was detected by Western blot at different doses of SPV for 48 h. n = 3, x±s. *P < 0.05, **P < 0.01, ***P < 0.001 vs control |
本研究检测了常绿钩吻碱体内抑制神经胶质瘤细胞生长的能力。结果显示, 与对照组相比, 给药常绿钩吻碱4和8 mg·kg-1·day-1对裸鼠肿瘤生长的抑制作用明显。对照组平均肿瘤体积是1 233.13 mm3, 常绿钩吻碱低和高剂量组分别为617.81和347.9 mm3 (图 6A、B); 两组裸鼠体重变化无显著差异(图 6C); 与对照组相比, 实验组的肿瘤重量分别减少了44.76%和61.26% (图 6D)。这些结果表明, 常绿钩吻碱能抑制体内神经胶质瘤细胞的生长。
|
Figure 6 SPV can inhibit proliferation of human glioma cells in vivo. A: SPV inhibited tumor cell proliferation; B: Tumor volume changes in three groups; C: The change of nude mice weight; D: Tumor weight difference in three groups. n = 5, x±s. *P < 0.05, **P < 0.01 vs control |
近年来, 中草药因在抗炎、抗氧化和抗肿瘤等方面具有较好的疗效成为医学研究的热点之一。传统中草药在肿瘤治疗上具有一定的优势, 但由于有效成分尚不明确或者毒性等原因, 导致其抗肿瘤的治疗应用受限。钩吻是世界著名的剧毒植物, 以中医“以毒攻毒理论”, 国内很早就有将钩吻应用于临床治疗肿瘤的案例, 并取得一定疗效[8], 但是, 由于钩吻的中毒剂量与有效治疗剂量相接近, 导致其临床应用受到极大的限制, 因此以钩吻总生物碱提取物为研究开发的途径受到毒性的阻碍, 如何更好地挖掘钩吻有效低毒单体成为近年来的研究热点[16]。到目前已有报道120多种钩吻生物碱, 主要分为humantenine、koumine、gelsemine、sarpagine、yohimbane和gelsedine型6种结构类型生物碱[7], 叶文才等课题组[17-21]对钩吻剧毒物质基础已有深入研究, 发现N1位甲氧基和C20位乙基是钩吻有毒生物碱类的结构特征并且具有笼状骨架, 毒性成分结构类型主要为humantenine和gelsedine型生物碱, 如胡蔓藤碱乙、钩吻素己等, 其中钩吻素己的毒性最强。
常绿钩吻碱不同于其他钩吻生物碱, 其属于yohimbane型, 已被文献报道具有良好的安全性[14, 15], 自被报道其结构和化学特性以来, 常绿钩吻碱已经实现全合成及其化学结构修饰[22, 23]。本课题组前期用1~16 μmol·L-1浓度常绿钩吻碱处理正常细胞(3T3-L1、小鼠原代星形胶质细胞和人单核细胞THP-1) 时发现其无细胞毒性, 用100 mg·kg-1常绿钩吻碱灌胃给药小鼠时发现其对正常小鼠也无毒性作用。借鉴常绿钩吻碱具有显著的抗肿瘤作用[24]和良好的抗中枢系统疾病作用(镇静、抗焦虑等)[12, 13], 课题组前期评价了钩吻总生物碱和分离制备的单体成分抗肿瘤作用[25], 发现常绿钩吻碱对人神经胶质瘤细胞U251具有明显的抑制作用。故而本研究以人胶质瘤细胞系U251为研究对象, 通过常绿钩吻碱对神经胶质瘤的体内外作用特征研究, 发现其在细胞水平对人神经胶质瘤细胞U251具有明显的抑制作用; 体内水平通过裸鼠体内移植瘤实验, 发现常绿钩吻碱能显著抑制U251细胞胶质瘤生长, 4和8 mg·kg-1·day-1剂量干预后的神经胶质瘤重量分别减少了44.76%和61.26%。
鉴于化疗和放疗的不良反应, 寻找对脑胶质瘤有效天然药物是国际研究的热点, 并发现大量的天然化合物具有抗胶质瘤作用, U251作为常用的细胞模型, 被广泛用于神经胶质瘤的活性筛选。文献研究表明, 小檗碱抗U251浓度为50~100 μmol·L-1 [26]。从苦豆槐中分离的生物碱苦豆碱能够促进U251细胞的凋亡, 其有效浓度为500~1 000 μmol·L-1 [27]。白藜芦醇诱导U251细胞增殖抑制和凋亡, 其有效作用浓度为25~200 μmol·L-1 [28]。雷公藤红素在不同浓度范围内对U251细胞有抑制作用, 其有效作用浓度为0.3~10 μmol·L-1 (折算质量浓度为0.135~4.506 μg·mL-1), 但其急性毒性大, 致其应用受限[29]。根皮素抗U251有效浓度为50~100 μmol·L-1 [30]。地骨皮甲素在40~80 μmol·L-1浓度下能有效抑制U251[31]。而临床上常用的化疗药物替莫唑胺, 其有效抗U251浓度也高达50~100 μmol·L-1 [32]。而本研究表明, 常绿钩吻碱有效抗U251细胞IC50为4.981 μmol·L-1 (折合质量浓度为1.361 μg·mL-1), 从体内水平来看, 4和8 mg·kg-1·day-1剂量干预后, 神经胶质瘤重量分别减少了44.76%和61.26%, 体内外的活性均优于多数报道的天然化合物。
本研究通过Hoechst 33342染色发现随常绿钩吻碱浓度的增加, U251细胞的细胞核固缩、碎裂, 形状不一, Annexin V-FITC/PI染色发现随着常绿钩吻碱浓度的增加, U251细胞凋亡率逐渐升高, 细胞凋亡明显增多; 细胞凋亡是一种由基因调控、细胞内自主激活死亡程序的死亡方式, 有研究表明通过抑制PI3K/AKT信号通路活性可抑制肿瘤细胞增殖并诱导其凋亡[33]。在蛋白层面, 通过检测常绿钩吻碱干预后U251细胞中PI3K和AKT等蛋白的表达, 发现常绿钩吻碱能抑制U251细胞中PI3K的表达, 降低AKT的磷酸化, 在预实验中, 除最终选择的凋亡时间点48 h外, 这些激酶的蛋白水平在细胞干预24 h时就有明显改变。另外, 常绿钩吻碱能上调Bax表达, 下调Bcl-2表达, 降低Bcl-2/Bax水平, 促进caspase-3切割。
综上所述, 本研究发现常绿钩吻碱能在体内外显著抑制神经胶质瘤U251细胞的增殖, 并能促进U251细胞凋亡, 本研究为常绿钩吻碱抗胶质瘤的先导物或抗胶质瘤的应用研究提供实验参考。
作者贡献: 吴水生教授负责项目经费, 吴水生和许文构思和设计了本项课题研究方案。李高攀、王文义、许文和王河山准备了实验材料和试剂, 李高攀、王文义、任丽和谌赛男开展执行动物实验, 李高攀、王文义、任丽、谌赛男和王河山开展执行细胞实验, 许文、李高攀、吴水生分析实验数据并反馈实验设计。李高攀、许文和吴水生撰写稿件。所有作者都参与了稿件的写作、专家意见论文修改和最终确认, 并同意稿件的出版。
利益冲突: 所有作者均声明无利益冲突。
| [1] |
Lapointe S, Perry A, Butowski NA. Primary brain tumours in adults[J]. Lancet, 2018, 392: 432-446. DOI:10.1016/S0140-6736(18)30990-5 |
| [2] |
Sathornsumetee S, Rich JN, Reardon DA, et al. Diagnosis and treatment of high-grade astrocytoma[J]. Neurol Clin, 2007, 25: 1111-1139. DOI:10.1016/j.ncl.2007.07.004 |
| [3] |
Lim M, Xia Y, Bettegowda C, et al. Current state of immunotherapy for glioblastoma[J]. Nat Rev Clin Oncol, 2018, 15: 422-442. DOI:10.1038/s41571-018-0003-5 |
| [4] |
Shaw EG, Wang M, Coons SW, et al. Randomized trial of radiation therapy plus procarbazine, lomustine, and vincristine chemotherapy for supratentorial adult low-grade glioma: initial results of RTOG 9802[J]. J Clin Oncol, 2012, 30: 3065-3070. DOI:10.1200/JCO.2011.35.8598 |
| [5] |
Lv YQ, Chen YX, Wei CX, et al. Research progress in immunotherapy for glioblastoma[J]. Acta Pharm Sin (药学学报), 2019, 54: 1792-1801. |
| [6] |
Johnson BE, Mazor T, Hong C, et al. Mutational analysis reveals the origin and therapy-driven evolution of recurrent glioma[J]. Science, 2014, 343: 189-193. DOI:10.1126/science.1239947 |
| [7] |
Jin GL, Su YP, Liu M, et al. Medicinal plants of the genus Gelsemium (Gelsemiaceae, Gentianales)-a review of their phytochemistry, pharmacology, toxicology and traditional use[J]. J Ethnopharmacol, 2014, 152: 33-52. DOI:10.1016/j.jep.2014.01.003 |
| [8] |
Yang KZ, Huang J, Wu YD, et al. Three cases report of Gelsemium elegans treating primary liver cancer surviving more than two years[J]. Chin J Cancer (癌症), 1983, 3: 174. |
| [9] |
Woodward RB, Witkop B. The structure of sempervirine[J]. J Am Chem Soc, 1949, 71: 379. |
| [10] |
Bentley R, Stevens TS. Structure of sempervirine[J]. Nature, 1949, 164: 141-142. DOI:10.1038/164141a0 |
| [11] |
Goutarel R, Janot MM, Prelog V. Über die Konstitution des Sempervirins[J]. Experientia, 1948, 4: 24-25. DOI:10.1007/BF02164284 |
| [12] |
Lipińska TM. Total synthesis of new indolo[2, 3-α]quinolizine alkaloids sempervirine type, potential pharmaceuticals[J]. Tetrahedron, 2006, 62: 5736-5747. DOI:10.1016/j.tet.2006.03.085 |
| [13] |
Bousta D, Soulimani R, Jarmouni I, et al. Neurotropic, immunological and gastric effects of low doses of Atropa belladonna L., Gelsemium sempervirens L. and Poumon histamine in stressed mice[J]. J Ethnopharmacol, 2001, 74: 205-215. DOI:10.1016/S0378-8741(00)00346-9 |
| [14] |
Beljanski M, Beljanski MS. Selective inhibition of in vitro synthesis of cancer DNA by alkaloids of beta-carboline class[J]. Exp Cell Biol, 1982, 50: 79-87. |
| [15] |
Beljanski M, Beljanski MS. Three alkaloids as selective destroyers of cancer cells in mice[J]. Oncology, 1986, 43: 198-203. DOI:10.1159/000226363 |
| [16] |
Wang PL, Gao Y, Ma DW. Divergent entry to gelsedine-type alkaloids: total syntheses of (-)-gelsedilam, (-)-gelsenicine, (-)-gelsedine, and (-)-gelsemoxonine[J]. J Am Chem Soc, 2018, 140: 11608-11612. DOI:10.1021/jacs.8b08127 |
| [17] |
Zhang W, Zhang SY, Wang GY, et al. Five new koumine-type alkaloids from the roots of Gelsemium elegans[J]. Fitoterapia, 2017, 118: 112-117. DOI:10.1016/j.fitote.2017.03.004 |
| [18] |
Zhang W, Huang XJ, Zhang SY, et al. Geleganidines A-C, unusual monoterpenoid indole alkaloids from Gelsemium elegans[J]. J Nat Prod, 2015, 78: 2036-2044. DOI:10.1021/acs.jnatprod.5b00351 |
| [19] |
Li NP, Liu M, Huang XJ, et al. Gelsecorydines A-E, five gelsedine-corynanthe-type bisindole alkaloids from the fruits of Gelsemium elegans[J]. J Org Chem, 2018, 83: 5707-5714. DOI:10.1021/acs.joc.8b00736 |
| [20] |
Zhang W, Xu W, Wang GY, et al. Gelsekoumidines A and B: two pairs of atropisomeric bisindole alkaloids from the roots of Gelsemium elegans[J]. Org Lett, 2017, 19: 5194-5197. DOI:10.1021/acs.orglett.7b02463 |
| [21] |
Wang L, Ye WC, Zhang W, et al. New monoterpenoid indole alkaloids from Gelsemium elegans[J]. Heterocycles, 2014, 89: 1245-1253. DOI:10.3987/COM-14-12970 |
| [22] |
Sucunza D, Cuadro AM, Alvarez-Builla J, et al. Recent advances in the synthesis of azonia aromatic heterocycles[J]. J Org Chem, 2016, 81: 10126-10135. DOI:10.1021/acs.joc.6b01092 |
| [23] |
Kerkovius JK, Kerr MA. Total synthesis of isodihydrokoumine, (19Z)-taberpsychine, and (4R)-isodihydroukoumine N4-oxide[J]. J Am Chem Soc, 2018, 140: 8415-8419. DOI:10.1021/jacs.8b05095 |
| [24] |
Pan XH, Yang CY, Cleveland JL, et al. Synthesis and cytoxicity of sempervirine and analogues[J]. J Org Chem, 2016, 81: 2194-2200. DOI:10.1021/acs.joc.6b00022 |
| [25] |
Lin MB, Chen L, Wu SS. Effect and mechanism of total alkaloids of Gelsmium elegans on human colonic carcinoma cells proliferation and apoptosis[J]. Chin J Exp Tradit Med Form (中国实验方剂学杂志), 2018, 24: 149-153. |
| [26] |
Tong L, Xie CC, Wei YF, et al. Antitumor effects of berberine on gliomas via inactivation of caspase-1-mediated IL-1β and IL-18 release[J]. Front Oncol, 2019, 9: 364-376. DOI:10.3389/fonc.2019.00364 |
| [27] |
Xu ZJ, Wang X, Chen X, et al. Identification of aloperine as an anti-apoptotic Bcl2 protein inhibitor in glioma cells[J]. Peer J, 2019, 7: e7652. DOI:10.7717/peerj.7652 |
| [28] |
Jiang H, Zhang LJ, Kuo J, et al. Resveratrol-induced apoptotic death in human U251 glioma cells[J]. Mol Cancer Ther, 2005, 4: 554-561. DOI:10.1158/1535-7163.MCT-04-0056 |
| [29] |
Liu XH, Zhao PY, Wang XJ, et al. Celastrol mediates autophagy and apoptosis via the ROS/JNK and Akt/mTOR signaling pathways in glioma cells[J]. J Exp Clin Canc Res, 2019, 38: 184-201. DOI:10.1186/s13046-019-1173-4 |
| [30] |
Hoa NT, Zhang JG, Delgado CL, et al. Human monocytes kill M-CSF-expressing glioma cells by BK channel activation[J]. Lab Invest, 2007, 87: 115-129. DOI:10.1038/labinvest.3700506 |
| [31] |
Wang QP, Li HY, Sun Z, et al. Kukoamine A inhibits human glioblastoma cell growth and migration through apoptosis induction and epithelial-mesenchymal transition attenuation[J]. Sci Rep, 2016, 6: 36543-36555. DOI:10.1038/srep36543 |
| [32] |
Kil WJ, Cerna D, Burgan WE, et al. In vitro and in vivo radiosensitization induced by the DNA methylating agent temozolomide[J]. Clin Cancer Res, 2008, 14: 931-938. DOI:10.1158/1078-0432.CCR-07-1856 |
| [33] |
Lau MT, Leung PCK. The PI3K/Akt/mTOR signaling pathway mediates insulin-like growth factor 1-induced E-cadherin down-regulation and cell proliferation in ovarian cancer cell[J]. Cancer Lett, 2012, 326: 191-198. DOI:10.1016/j.canlet.2012.08.016 |
 2021, Vol. 56
2021, Vol. 56


