2. 军事科学院军事医学研究院辐射医学研究所, 北京 100850
2. Beijing Institute of Radiation Medicine, Beijing 100850, China
血脑屏障(blood-brain barrier, BBB) 是指在脑微血管系统里, 由脑微血管内皮细胞(brain microvascular endothelial cell)、星形胶质细胞足端(astrocytes)、周细胞(pericyte) 及脑血管内皮细胞间的紧密连接(tight junctions) 和基膜(basal membrane) 共同构成的特殊结构[1, 2] (图 1)。BBB严格控制血液和脑内物质交换, 保护中枢神经系统(central nervous system, CNS) 免受循环毒素和感染细胞的侵袭, 维持大脑微环境稳态。但其不易渗透性也成为CNS药物脑靶向递送的主要障碍。

|
Figure 1 Structure of blood-brain barrier (BBB). A: The planar structure; B: The illustration scheme of BBB |
目前, 克服BBB阻碍的药物递送方法主要包括改变细胞旁路转运(如高渗溶液甘露醇[3])、跨细胞转运(如载体蛋白介导的转运[4])或利用循环系统外的递送途径(如颅内注射[5]、鼻腔给药[6, 7]) (图 2)。此外, 多种新剂型的出现(水凝胶[8]、微乳[9]、微球[10]和外泌体[11]等) 也加快了跨BBB药物递送研究。纳米药物递送系统在CNS疾病治疗中已显示出优越性, 如以薄荷醇修饰酪蛋白纳米粒负载10-羟基喜树碱[12]、以肽作为靶向配体修饰紫杉醇白蛋白纳米粒[13]用于治疗神经胶质瘤, 其脑肿瘤渗透能力和脑肿瘤内分布更显著。双重靶向BBB和神经胶质瘤细胞的胶束基因递药系统用于神经胶质瘤放射治疗效果明显[14]。脂质体由于其独特的磷脂双层结构, 与BBB的细胞脂质层相容性更好, 有助于将药物靶向递送进入脑部。脂质体表面修饰功能性配体(乳铁蛋白、转铁蛋白[15]等) 和载体分子(谷胱甘肽、葡萄糖[16]等) 可用于治疗阿尔茨海默病, 且脑靶向能力增强。采用Forster共振能量转移荧光成像技术证明了脂质体在体内能以完整形式穿过BBB和血脑肿瘤屏障以增加脑靶向递送效率[17]。纳米凝胶跨BBB递送胰岛素治疗神经退行性疾病[18]、纳米乳剂提高利培酮的脑生物利用度[19]也证明了纳米制剂用于脑靶向递送的有效性。但仅通过新剂型设计提高脑靶向递送的效率有限, 且设计较复杂, 有必要寻找高效、安全和方便的脑靶向递送策略。
|
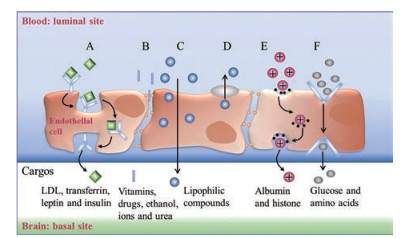
Figure 2 Transport processes at the capillary endothelium of BBB. A: Receptor-mediated transcytosis; B: Paracellular diffusion; C: Transellular diffusion; D: Efflux pumps; E: Adsorptive transcytosis; F: Transporter-mediated transcytosis. LDL: Low-density lipoproteins |
超声(ultrasound, US) 为脑部疾病治疗提供了新思路[20], 已用于脑部肿瘤[21]、神经退行性疾病(如阿尔茨海默病[22]、帕金森病[23]) 等。超声作为一种经济、有效、无创、实时和安全的治疗方式, 除用于分子水平诊断和病理过程监测外, 能通过机械效应和热效应深入机体内部定位组织和细胞, 已逐渐用于药物和基因的靶向递送。聚焦超声(focused ultrasound, FUS) 是将超声波聚焦在一个直径为1~2 mm、深度为8~15 mm的区域内, 达到局部定位和深度穿透组织的效果。“聚焦区”可以定义为超声强度(能量/单位面积) 高到足以产生损伤的区域[24]。高强度的超声能量集中于组织深处, 焦点处温度能在几秒钟内升高到60 ℃以上, 通过凝固坏死导致不可逆的细胞死亡, 且避免损伤周围能量密度较低的组织和中间层。当使用聚焦超声持续破坏BBB时, 静脉注射微泡作为空化位点可将所需的超声强度降低到阈值以下, 提高安全性。简言之, 聚焦超声利用微泡定位和放大声波对脉管系统的机械效应, 导致短暂的BBB开放而产生生物效应[25]。
微泡(microbubbles, MB) 作为一种超声造影剂, 在超声作用下, 能产生空化效应增强药物穿透机体物理屏障(BBB) 的效率(图 3)。近年来微泡联合聚焦超声用于脑靶向递送成为研究热点。优化超声参数和微泡设计, 提高其安全性, 以期在提高BBB通透性同时将组织损伤程度降到最低, 是其临床转化和应用的关键。

|
Figure 3 Cavitation effects of microbubbles combined with focused ultrasound |
本综述总结了近期聚焦超声联合微泡开放BBB增加脑靶向性的研究进展, 主要内容包括聚焦超声类型及作用机制、微泡膜壳材料、内核气体及主要制备方法、聚焦超声联合微泡开放BBB机制及其安全性评价, 旨在为聚焦超声联合微泡增强BBB通透性以促进药物脑靶向递送提供参考, 促进其临床转化和应用。
1 聚焦超声及其作用机制聚焦超声将超声波集中于病变局部, 具有无创性、深度穿透性和空间聚焦性。聚焦超声可引起3种不同类型的效应: 热效应、机械效应和空化效应。热效应是由于组织吸收超声能量导致温度升高引起的; 机械效应是指超声波振动引起组织细胞运动移位, 使细胞内部结构和功能发生变化; 空化效应则是指当超声波在液体中传播时, 液体中微小的水泡状核(空化核) 发生振荡、膨胀、收缩和塌陷, 从而导致巨大的剪切力破坏空化核周围的细胞壁和质膜[26]。高强度聚焦超声(连续波中的声波能量) 是一种治疗性的体外热消融技术, 已被用来替代放疗和手术治疗多种疾病。而低强度聚焦超声(脉冲模式下的声能) 被认为是一种安全、可逆开放BBB的方法, 可提高药物在大脑中的靶向传递; 可通过机械作用开放BBB, 较低强度加上周期性脉冲波可导致聚焦区域内温度只升高4~5 ℃, 避免脑组织的热损伤[27]。
28 kHz~8 MHz之间[28]的超声声波频率常用于增加BBB的渗透性, 但机械或空化效应有可能引起血管壁破裂并导致出血, 且随着超声频率增加组织损伤程度增加。聚焦超声不良反应可能与聚焦超声频率、强度、暴露时间和组织类型有关。机械指数(mechanical index, MI) 是衡量超声输出安全性的公认指标, MI越高, 机械强度影响生物组织的风险越高。采用3种不同程度的MI (0.47-MI、0.8-MI和1.4-MI) 对Sprague Dawley大鼠进行超声辐照, 3天1次, 间隔48 h[29]。大鼠经超声辐照后出现活动减退、运动失调和睡眠减少现象, 第7天消失, 大鼠恢复至正常。大鼠经高MI超声辐照后有明显脑内出血和组织坏死现象, 且组织创伤中血浆纤维蛋白原和急性期反应物显著升高。因此, 高声压与脑内出血、组织损伤密切相关。对于临床经颅应用, 有效频率范围为200 kHz~1.5 MHz[30], 其中200 kHz~700 kHz[31]超声是更优选择。
由于人体和动物生理结构的差异, 特别是具有一定厚度颅骨的存在给超声波穿透带来了困难。颅外立体定位手术通常需要长达几个小时的手术时间, 且在手术过程中需要磁共振成像(magnetic resonance imaging) 监测, 其复杂性导致患者依从性较差[32]。在患者颅骨部位植入超声换能器(植入式超声, implantable ultrasound), 在静脉注射微泡后, 超声换能器激活微泡, 机械性破坏BBB, 能使较大的极性分子通过。超声换能器能产生重复的超声波靶向脑组织, 因此不需要复杂的磁共振成像引导和声反馈来调整经颅超声穿过BBB所需的高能量脉冲, 简单易行。患者颅骨植入脉冲超声系统(SonoCloud®) 结合静脉注射微泡用于增强卡铂递送治疗胶质母细胞瘤, 当声压达到1.1 MPa时, 未发现有不良反应, 这有望成为一种脑部靶向递送化疗药物的新技术[33]。成功应用该技术治疗19例脑胶质瘤患者临床试验中且未发现有严重的神经系统症状和出血[34]。可植入超声也有一些问题, 包括可能扩大BBB破坏区域、从目前已有的单个超声发射器需过渡到多通道超声发射器[35]、药物定量和多种药物联用等, 克服上述缺点才能最终实现有效、安全和广泛的临床应用。
2 微泡微泡作为超声造影剂应用已有几十年, 其安全性和有效性在长期临床诊断中已得到证实, 主要原理是使后散射回声增强以提高超声诊断的分辨力、敏感性和特异性。近年来研究热点集中于作为药物载体实现靶向递送以实现诊疗一体化(theranostics)。
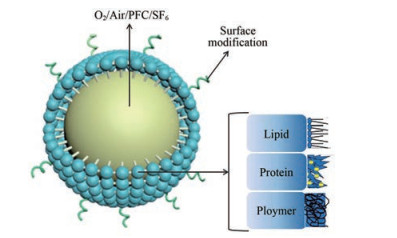
2.1 商品化微泡微泡直径一般约为1~10 μm, 外壳通常为脂质、蛋白质或聚合物, 内核气体常采用空气、氧气、全氟化碳(perfluorocarbon, PFC) 或六氟化硫(sulfur hexafluoride, SF6) (图 4)。外壳和内核气体的成分决定了微泡的物理化学性质, 磷脂是目前使用最广泛的外壳材料, 已应用于商用微泡SonoVue®。已批准上市使用的微泡类型详见表 1[36], 包括3种经FDA批准的微泡产品(Optison®、SonoVue®和Definity®)。
|
Figure 4 Schemes of microbubbles structure. PFC: Perfluorocarbon; SF6: Sulfur hexafluoride |
| Table 1 Clinical ultrasound contrast agents currently commercially available |
选择合适的外壳材料, 通过优化处方、工艺制备结构致密的微泡, 能防止聚结和扩散, 并提供一定的弹性来维持较高的压力, 对于增强微泡稳定性至关重要。
2.2.1 脂质外壳脂质是微泡外壳最常用的材料。典型的脂质分子通常由一个亲水头部和一个疏水尾部组成; 在水相中, 亲水部分与水相互作用, 而疏水部分之间由于疏水相互作用形成层状结构, 有助于将气体包封在微泡核心。为防止包封气体逸出, 要求脂质外壳结构致密, 因此采用在其相变温度以上对脂质进行热处理, 然后快速骤冷至室温的方式, 使脂质分子被密集地包裹在外壳中, 从而限制气体分子扩散, 延长微泡寿命。磷脂是应用最广泛的脂质材料, 包括二硬脂酰磷脂酰胆碱(1, 2-distearoyl-sn-glycero-3-phosphocholine, DSPC) 和二棕榈酰磷脂酰胆碱(1, 2-dipalmitoyl-sn-glycero-3-phosphocholine, DPPC) 等。磷脂壳包被的微泡向细胞膜的物质转移被认为在超声介导的药物递送中发挥着重要作用, 采用定量荧光显微镜技术证明了这种现象[37]。磷脂转移会改变细胞膜脂质的有序排列或堆积, 影响膜的机械性能和通透性。若制备的微泡制剂含有某种成分(除磷脂外) 能改变细胞膜脂质的顺序, 从而改变细胞膜的机械性能, 或许也能在超声诱导的生物效应中发挥作用。肿瘤穿膜肽iRGD修饰的紫杉醇脂质体-微泡复合物经超声处理后, 与肿瘤细胞亲和力升高, 表现出明显的肿瘤生长抑制效果[38]。
2.2.2 蛋白质外壳蛋白质外壳是由天然和变性白蛋白分子组成的单分子层, 通常使用白蛋白作为外壳材料, 采用预热的白蛋白溶液经超声处理形成, 如牛血清白蛋白、人血清白蛋白和血红蛋白, 这些白蛋白溶液的共同之处是蛋白质分子都含有半胱氨酸残基, 在蛋白质变性过程中, 半胱氨酸残基的二硫键断裂, 巯基暴露被氧化, 形成分子间二硫键, 即蛋白质分子的交联, 形成坚固的外壳结构[39]。另外, 通过改变化学试剂(十二烷基硫酸钠、氧自由基等) 的酸碱度和压力也可使蛋白质变性。除白蛋白外, 其他蛋白质如溶菌酶由于分子间二硫键形成膜状结构, 也被用于制备稳定且生物相容性好的微泡外壳[40]。蛋白质壳微泡中二硫键交联结构能够维持微泡在压力之下的球形结构, 使用Traut试剂(2-亚氨基硫氰酸盐酸盐) 处理牛血清蛋白, 将伯胺转化为硫醇后形成高稳定性微泡。傅里叶变换红外光谱和X射线光电子能谱表征其表面存在硫醇和伯胺基团, 通过耗散型石英晶体微天平吸附测试证明这些基团具有反应活性。Traut试剂用量影响伯胺向硫醇的转化率, 但并非剂量越高越好: 当Traut试剂用量为牛血清蛋白20倍摩尔量时, 能提供足够多的巯基表面覆盖率, 增强外壳厚度; 当用量持续增加则会产生过多的空间位阻, 影响稳定性。因此, Traut试剂与蛋白的最佳比例是构建高稳定性微泡的关键所在[41]。
纳米粒具有尺寸小、表面积大的特点, 足以通过组织渗透进入肿瘤, 并产生增强渗透与滞留效应, 与肿瘤细胞受体特异性结合[42]。将掺杂近红外染料的白蛋白纳米粒与N-羟基琥珀酰亚胺微泡结合, 制备超声敏感纳米粒复合物, 通过小鼠活体成像证明在超声作用下可打开BBB并将其有效递送至大脑, 且不会产生细胞毒性[43]。
2.2.3 聚合物外壳高分子聚合物作为微泡外壳厚度通常为50~150 nm。与脂质软壳微泡相比, 聚合物硬壳微泡能将大量的药物分子封装在更厚的壳中。常用聚合物材料生物相容性好、降解可控和毒性低, 如聚乳酸-羟基乙酸共聚物(poly lactic-co-glycolic acid, PLGA)、聚乙烯醇(polyvinyl alcohol, PVA)。以PVA为外壳材料、空气为核心气体制备的微泡具有更强的硬度和机械性, PVA微泡体积足够大, 通过数字全息显微镜、透射电子显微镜、共聚焦激光扫描显微镜等光学技术可获得其确切尺寸、壳厚度、折射率和表面成分等信息。采用与毛细管电泳耦合的紫外成像检测器可实现PVA微泡定量分析[44]。多聚氰基丙烯酸正丁脂[poly(butyl cyanoacrylate), PBCA] 是一种由阴离子聚合形成的生物相容性聚合物, PBCA壳厚度约为50~200 nm, 具有高度的疏水性; 以PBCA为外壳材料制备微泡封装4种皮质类固醇药物(地塞米松、布地奈德、氯氟舒松、环索奈德)和4种荧光染料(罗丹明B、尼罗红、香豆素6、芘), 考察其载药能力和封装效率。结果表明, PBCA微泡对超声产生良好响应性, 载药量随药物疏水性和分子量增加而增加, 但疏水性和分子量大的药物在超声破坏微泡后释放率相对较低。因此, 药物理化性质对PBCA微泡载药量和释放影响巨大, 该研究同时有力证明了PBCA微泡可包封多种不同类型的药物[45]。
聚合物微泡还可通过直接和间接的偶联机制实现表面功能化多样性。一种新型脂质/PLGA微泡将脂质掺入PLGA壳中, 并将可分解的碳酸氢铵作为内核气体调节微泡壳弹性, 形成软性外壳和多孔结构, 该多孔结构增强了微泡散射能力和超声响应性。载多柔比星后, 与普通脂质微泡相比, 药物包封率较高; 与普通聚合物微泡相比, 能提高超声成像能力。超声后, 该多柔比星-脂质/PLGA微泡在荷瘤小鼠中能有效释放药物、增强肿瘤抑制作用[46]。粒径1~3 μm的载多柔比星聚乳酸微泡表面同时采用聚乙二醇(PEG)、肿瘤坏死因子相关凋亡诱导配体(tumor necrosis factor related apoptosis inducing ligand, TRAIL) 修饰, PEG化降低微泡的免疫原性, TRAIL能靶向并附着于肿瘤细胞表面受体, 诱导细胞死亡; 超声聚焦于肿瘤部位, 利用其空化效应能实现肿瘤靶向递送[47]。聚合物外壳非常坚固, 可进行多种修饰和改造(如TRAIL连接), 而不会损害其完整性; 可根据临床需要定制个性化的微泡制剂, 对聚合物外壳成分进行调整使微泡响应不同的超声频率, 从而实现了不同深度组织治疗的灵活性, 扩大临床应用。
脂质壳较薄(3~5 nm)、柔软、结构灵活, 对超声响应性好, 但薄壳增加了核心气体扩散的可能性, 同时也限制了高载药量。蛋白质外壳厚度约为15~20 nm, 气体扩散阻力更大、稳定性更高, 较脂质壳能更有效携带药物。但蛋白质微泡的免疫原性使其从体循环中过早清除、生物利用度较低, 超声响应性低于脂质壳。因此, 理想的微泡制剂应具有超声响应性好、载药量高、生物相容性好(无免疫原性) 和体内外稳定性好等优点。
微泡外壳设计对微泡性能具有深远影响, 应了解外壳材料的物理特性及其对微泡的影响指导微泡制备。微泡建模能对微泡设计和制备提供理论支持, 如脂质分子间作用力模型能提供脂质化学与微泡性能之间的定量关系, 在分子动力学模拟的力场基础上, 基于脂质首尾之间的横向库仑力和范德华力相互作用提出脂质微泡壳模型, 能精准预测脂质微泡的单层渗透性、弹性和温度的函数变化及脂质在空气-水界面上的表面扩散平衡[48]。将来可使用分子间作用力模型来阐明更复杂的特性(表面剪切力和膨胀黏度等), 采用脂质和蛋白质动力学解释微泡动力学行为, 如研究蛋白质微泡溶解动力学来评估蛋白质壳的特性(壳电阻、表面张力和壳弹性等)[49]。此外, 需要扩展化学基团研究以丰富脂质和蛋白质的组成类别, 为新型医学微泡制备提供更多选择。
2.3 微泡内核气体常用的内核气体包括空气、氧气、全氟化碳类(perfluorocarbon, PFC) 或六氟化硫(sulfur hexafluoride, SF6) 等, 这些气体通常分子量较大, 以增强微泡贮存稳定性和体内稳定性。内核气体从微泡扩散到周围介质的过程影响微泡稳定性, 内核气体扩散会导致微气泡过早破裂。因此, 除了需要考察外壳材料对气体扩散的渗透性外, 也需评估气体特性, 如分子量和水中溶解度等。但关于包封气体对微泡稳定性及载药能力的影响研究较少。采用相同脂质壳装载全氟丙烷(C3F8)、全氟丁烷(C4F10) 和六氟化硫(SF6) 制备不同微泡, 探讨气体成分对微泡的影响, 这3种气体已被FDA批准用于微泡。与SF6微泡相比, C3F8和C4F10微泡体内外超声成像能力较强, 并能更有效地将模型药物-伊文思蓝递送到大脑, 说明C3F8和C4F10微泡稳定性更高, 可用于同步超声成像和药物递送[50]。氧气微泡在超声作用下于体内成像, 可实现图像引导治疗。同时, 氧气微泡能为低氧性肿瘤提供氧气, 增加放射敏感性, 降低肿瘤转移的风险, 实现真正的微创治疗。增加氧气微泡脂质壳的磷脂酰基链长度可使氧气微泡造影持久性和造影强度增强, 体内循环时间延长[51]。
2.4 微泡的制备方法传统的微泡制备方法是简单的机械搅拌和超声。机械搅拌是在振荡器中加入聚合物溶液, 从顶部灌注气体, 然后以每分钟几千次的振荡速度机械搅拌, 使外壳材料及时包裹所需的内核气体。机械搅拌是一种适用于工业化生产的微泡制备方法, 尤其适于脂质微泡的制备[52]。通过机械振荡制备了与抗PD-L1 (程序性死亡受体-配体1, programmed cell death-ligand 1) 单克隆抗体缀合的脂质壳微泡, 在超声介导下与顺铂联合可有效抑制宫颈癌生长, 比单独使用顺铂抗肿瘤活性更高, 对提高宫颈癌治疗效果具有重要意义[53]。
超声制备微泡主要基于液体暴露于超声中产生的空化作用。高强度超声引起液体压缩和扩张, 导致溶液中出现微小气泡, 加热使脂质达到玻璃化转变温度或使蛋白质变性, 以形成坚固外壳; 主要步骤包括预处理(加热) 和超声两个过程。通过低强度搅拌乳化流经样品溶液的气体, 再采用高强度超声产生空腔, 将乳化气体包封于壳膜中也可制备微泡[54]。
脂质微泡的制备过程简述如下: 将溶解在氯仿中的脂质在惰性环境(氮气或氩气) 中干燥, 干燥的脂质膜和乳化剂共溶于缓冲液(羟乙基哌嗪乙硫磺酸和磷酸盐缓冲液) 中, 并加热至其玻璃化转变温度, 通入内核气体, 超声处理产生微泡悬浮液后, 将微泡悬浮液骤冷至室温, 获得具有致密脂质外壳的微泡。需注意的是, 乳化剂是其中重要成分, 没有乳化剂不能形成微泡; 常用乳化剂包括二硬脂酰基磷脂酰乙醇胺-聚乙二醇2000 [1, 2-distearoyl-sn-glycero-3-phosphoethanolamine-N-methoxy(polyethylene glycol)-2000, DSPE-PEG2000] 和PEG40S。以牛血清白蛋白、N-乙酰基-D, L-色氨酸和二硬脂酰磷脂酰胆碱为主要成分, PEG40S为乳化剂, 内充全氟化碳气体, 采用超声制备微泡悬浮液, 通过差速离心法选出粒径3~5 μm微泡。超声成像显示脂质微泡比蛋白质微泡造影能力更好; 且微泡经PEG修饰后, 免疫原性消失, 贮存稳定性和体外稳定性增加。但超声制备的微泡一般直径较大, 多在50 μm以上, 远远大于医学用微泡的直径要求(一般 < 10 μm)。因此, 还需采用微泡尺寸分选技术进一步处理, 主要包括浮选、差速离心、夹流分馏技术、声学分选和流动聚焦。其中, 采用微流体装置的流动聚焦技术作为一种新兴趋势, 能允许液体(脂质/蛋白质或其他外壳材料溶液) 和气体以不同速率和压力流动, 由于剪切力和压力差异导致气体被包裹于液体中, 并在出口处拉伸断裂, 形成单个微泡。这种微流体装置制备的微泡尺寸通常在10 μm左右, 但产率较低。使用微流体技术, 以牛血清白蛋白和牛血浆蛋白作为外壳材料, 氮气作为核心气体, 能产生瞬时稳定的微泡, 但在2 min内迅速溶解, 可能是由于交联蛋白质分子之间氢键作用较弱, 形成外壳不牢固所致[55]。
其他微泡制备方法还包括冷冻干燥和盐水振摇。冷冻干燥法是首先使用高速剪切力实现乳化, 将液体分散在包含稳定剂的连续水相中, 这时稳定剂分子吸附在分散相和连续相之间的界面上形成乳液滴, 经低温干燥转化为微泡[56]; 盐水振摇装置由一对注射器和一个三通旋塞阀组成, 其中一个注射器装有10 mL生理盐水(0.9% NaCl), 另一个装有1 mL空气, 旋塞阀打开后生理盐水和空气充分混合产生空气微泡。该方法制备的微泡多用于超声心动图[57]。上述方法易于操作, 可快速制备得到高分散微泡悬浮液。
通过表面修饰(如靶向配体修饰) 微泡可作为药物和基因递送的有效递送载体。载药微泡暴露于低压超声下, 由于剧烈的气泡振荡而破裂从而释放药物。PEG常用于修饰微泡表面, 能增加脂质壳硬度, 还可与其他官能团联合增强微泡功能[58]。在微泡表面连接特定配体分子, 可实现炎症细胞或血管生成内皮细胞靶向[59]。另外, 一种磁靶向方法是将磁性材料包裹在微泡内制备磁响应性微泡, 已成功应用于增强体内外多种治疗药物的递送[60]。
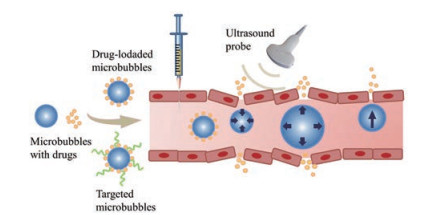
3 聚焦超声联合微泡增强BBB通透性的机制尚不完全清楚聚焦超声联合微泡提高BBB通透性的机制, 一种可能的解释是, 超声作用下微泡振荡引起细胞膜通透性瞬时增加, 即声穿孔作用, 使BBB中紧密连接开放。微泡在低超声强度(0.3~3 W·cm-2) 下, 以稳定的运动方式振荡, 即稳定空化; 在较高超声强度下(> 3 W·cm-2), 微泡剧烈增长和崩塌, 即惯性空化[27]。稳定空化对组织的负面影响最小, 但处于稳定振荡中的微泡也会产生充分压力使血管壁破裂; 而惯性空化的剧烈塌陷则会导致细胞凋亡、组织坏死和血管壁破裂等[61]。因此, 在使用聚焦超声联合微泡增加BBB通透性时, 需减少惯性空化。此外, 聚焦超声开放BBB引起的细胞凋亡并不依赖于超声, 可能与微泡剂量相关: 微泡剂量超过1.2×108 MBs·kg-1会引发细胞凋亡, 4.5×107 MBs·kg-1的微泡剂量在超声作用下是安全的[29]。因此, 对于载药微泡需要选择合适的超声参数以达到如下平衡: ①首先施加一定强度超声实现成像, 进一步增加强度使微泡破裂释放药物; ②当释放药物时, 超声能量既能使微泡破裂又不能对周围组织造成损失。控制超声的参数与微泡剂量或许能够在最大程度开放BBB的基础上, 将细胞和组织损伤的风险降到最低。微泡的空化效应是药物靶向递送的重要机制, 可对血管壁和周围组织施加机械力, 产生可逆的细胞膜渗透, 从而帮助药物进入组织。同时微泡破裂会产生二次机械现象, 包括液体喷射和微泡破裂产生的冲击波, 从而进一步增强递送效果[62] (图 5)。空化作用产生的机械效应可导致细胞形态变化、细胞通透性暂时性变化和细胞溶解等, 均能有效地增强药物转运和吸收。
|
Figure 5 Ultrasound-induced cavitation of microbubbles. Ultrasound triggers microbubble oscillation (expansion and shrinkage) and collapse, causing vessel deformation, rupture and permeability change, which allows efficient drug delivery |
“声微流”也被认为是BBB内皮细胞可逆开放的机制之一。气泡振荡带动周围的气体运动, 显著增强药物从血液进入组织的对流, 具有增强药物递送的协同作用, 这对于那些在靶组织不足以产生治疗药物浓度的实体瘤和血凝块治疗尤为重要[60]。
4 聚焦超声联合微泡开放BBB的安全性与聚焦超声联合微泡介导BBB开放的相关研究均表明, BBB通透性增加后会引发炎症反应, 这是超声主要不良反应之一[63]。炎症反应大小可能与微泡剂量有关, 当使用10倍微泡临床推荐剂量(Definity®, 10 μL·kg-1) 时, 可观察到与炎症反应、细胞凋亡过程相关的基因显著上调, 同时引发水肿、神经元变性和微出血的组织学病理变化。而使用推荐剂量的微泡时, 炎症标志物变化不明显[64]。在650 kHz超声作用下, 使用两个不同微泡剂量(10和250 μL·kg-1) 通过变化的声峰负压对小鼠进行治疗, 当声峰负压从0.15 MPa增加至0.20 MPa时, 发生轻度组织病理学改变并激活急性炎症反应, 如小胶质细胞和星形胶质细胞的活化, 且微泡剂量为10 μL·kg-1时, 活化最小[65]; 当使用更高的声峰负压或更高微泡剂量时, 均会导致更广泛、更严重的病理学改变和急性炎症反应。聚焦超声开放BBB后急性期海马微血管转录组学数据显示, 在BBB开放后6 h许多促炎基因上调, 24 h后大多恢复到基线水平[66]。短暂而受控的神经炎症水平可促进髓鞘碎片清除和修复、血管生成、淀粉样蛋白β斑块清除。但当炎症转变为慢性时, CNS内相关炎性因子的产生会引发继发性神经炎症, 进而导致细胞凋亡和神经退行性过程, 包括肿瘤坏死因子(tumor necrosis factor)、白介素-1 (interleukin-1)、白介素-6 (interleukin-6) 和活性氧(reactive oxygen species) 等。
因此, 临床应用聚焦超声联合微泡时应综合考虑超声介导BBB开放后潜在激活炎症反应, 优化聚焦超声联合微泡治疗的各项参数以减轻对脑组织的伤害; 通过比较不同超声方案, 采用较低微泡剂量结合超声的声反馈控制, 可降低炎症反应。磷脂酰丝氨酸修饰的微泡与超声结合可安全地开放BBB, 并能靶向激活炎症的小胶质细胞和巨噬细胞, 为脑内炎症区域靶向递送提供了一种新思路[67]。
5 展望载药微泡在聚焦超声作用下能在特定位置释放, 实现靶向递送, 如化学药物[68]、基因[69, 70]、抗体[71]、病毒载体[72]和脑源性神经营养因子[73], 甚至是干细胞[74]的脑内递送, 均取得了明显效果。但大多数证据来自体外或动物体内实验, 且以小型啮齿类动物为主, 非人类灵长类动物实验仅有少量研究[75]。尽管聚焦超声作为一种能瞬时增加BBB渗透性的方法已显示出其有效性和安全性, 但仍需要进一步全面表征其引发的长期生理变化, 尤其是脑组织和神经系统。目前关于聚焦超声改善BBB通透性的安全性评价数据多局限于动物实验[76, 77], 在该技术临床转化之前尚需很多的临床试验研究以探求两者之间适宜的平衡。另外, 超声治疗过程中也可通过MRI进行进一步引导和监测[78, 79], 首次使用MRI引导聚焦超声在肌萎缩性侧索硬化症患者的原始运动皮层中成功打开BBB并在24 h后恢复正常, 且耐受性良好没有产生严重的临床及脑电图不良影响[80]。
在大多数研究中, 诊断性微泡携带治疗药物能实现诊疗一体化, 但由于超声响应性取决于微泡的回声性和稳定性, 而微泡稳定性很大程度上取决于外壳和气体的组成[81]; 因此, 开发灵敏、稳定的微泡结合超声诱导BBB开放至关重要。由于微泡结构的复杂性, 其设计与开发面临巨大挑战, 外壳、内核气体、赋形剂和靶向配体的质量与安全性需要进行严格的筛选和监测。以脂质壳充气微泡为例, 其关键在于选择脂质成分和核心气体, 这些化学成分、结构(PEG化、靶向配体等表面修饰)、赋形剂和生产技术都会对微泡的声学特性和稳定性造成影响。因此, 需要对微泡粒径、浓度、zeta电位、渗透压、黏度、外壳片层性、机械性能和微生物测试等基本特性进行检测。若要进一步完成临床转化与应用, 还需要评价其药代动力学、药效学和毒理学, 以确定安全剂量和临床使用效果。
未来研究方向应着重于通过控制超声参数(声压、频率、辐照模式、最佳辐照时间、超声仪器类型等)、优化微泡类型、剂量和注射方式等实现高效药物递送。聚焦超声联合微泡可能是增强BBB通透性、改善药物脑靶向递送的有效策略, 具有广阔临床应用前景。
作者贡献: 李倩负责撰写; 杜丽娜负责设计与修改。
利益冲突: 作者声明不存在利益冲突。
| [1] |
Abbott NJ, Patabendige AA, Dolman DE, et al. Structure and function of the blood-brain barrier[J]. Neurobiol Dis, 2010, 37: 13-25. DOI:10.1016/j.nbd.2009.07.030 |
| [2] |
Saint-Pol J, Gosselet F, Duban-Deweer S, et al. Targeting and crossing the blood-brain barrier with extracellular vesicles[J]. Cell, 2020, 9: 851. DOI:10.3390/cells9040851 |
| [3] |
Doolittle ND, Miner ME, Hall WA, et al. Safety and efficacy of a multicenter study using intraarterial chemotherapy in conjunction with osmotic opening of the blood-brain barrier for the treatment of patients with malignant brain tumors[J]. Cancer, 2000, 88: 637-647. DOI:10.1002/(SICI)1097-0142(20000201)88:3<637::AID-CNCR22>3.0.CO;2-Y |
| [4] |
Tamai I, Tsuji A. Transporter-mediated permeation of drugs across the blood-brain barrier[J]. J Pharm Sci, 2000, 89: 1371-1388. DOI:10.1002/1520-6017(200011)89:11<1371::AID-JPS1>3.0.CO;2-D |
| [5] |
Tache Y, Goto Y, Gunion MW, et al. Inhibition of gastric acid secretion in rats by intracerebral injection of corticotropin-releasing factor[J]. Science, 1983, 222: 935-937. DOI:10.1126/science.6415815 |
| [6] |
Hanson LR, Frey WH. Intranasal delivery bypasses the blood-brain barrier to target therapeutic agents to the central nervous system and treat neurodegenerative disease[J]. BMC Neurosci, 2008, 9: 4. DOI:10.1186/1471-2202-9-4 |
| [7] |
Illum L. Nasal drug delivery-recent developments and future prospects[J]. J Control Release, 2012, 161: 254-263. DOI:10.1016/j.jconrel.2012.01.024 |
| [8] |
Wang YF, Cooke MJ, Morshead CM, et al. Hydrogel delivery of erythropoietin to the brain for endogenous stem cell stimulation after stroke injury[J]. Biomaterials, 2012, 33: 2681-2692. DOI:10.1016/j.biomaterials.2011.12.031 |
| [9] |
Wang H, Zhu Z, Zhang G, et al. AS1411 aptamer/hyaluronic acid-bifunctionalized microemulsion co-loading shikonin and docetaxel for enhanced antiglioma therapy[J]. J Pharm Sci, 2019, 108: 3684-3694. DOI:10.1016/j.xphs.2019.08.017 |
| [10] |
Zhang H, Gu J, Feng Y, et al. Absorption kinetics of flurbiprofen axetil microspheres in cerebrospinal fluid: a pilot study[J]. Int J Clin Pharmacol Ther, 2017, 55: 875-880. DOI:10.5414/CP203092 |
| [11] |
Jiang L, Dong H, Cao H, et al. Exosomes in pathogenesis, diagnosis, and treatment of alzheimer's disease[J]. Med Sci Monit, 2019, 25: 3329-3335. DOI:10.12659/MSM.914027 |
| [12] |
Gao C, Liang J, Zhu Y, et al. Menthol-modified casein nanoparticles loading 10-hydroxycamptothecin for glioma targeting therapy[J]. Acta Pharm Sin B, 2019, 9: 843-857. DOI:10.1016/j.apsb.2019.01.006 |
| [13] |
Ruan C, Liu L, Lu Y, et al. Substance P-modified human serum albumin nanoparticles loaded with paclitaxel for targeted therapy of glioma[J]. Acta Pharm Sin B, 2018, 8: 85-96. DOI:10.1016/j.apsb.2017.09.008 |
| [14] |
Jiao X, Yu Y, Meng J, et al. Dual-targeting and microenvironment-responsive micelles as a gene delivery system to improve the sensitivity of glioma to radiotherapy[J]. Acta Pharm Sin B, 2019, 9: 381-396. DOI:10.1016/j.apsb.2018.12.001 |
| [15] |
Kong L, Li XT, Ni YN, et al. Transferrin-modified osthole pegylated liposomes travel the blood-brain barrier and mitigate Alzheimer's disease-related pathology in APP/PS-1 mice[J]. Int J Nanomedicine, 2020, 15: 2841-2858. DOI:10.2147/IJN.S239608 |
| [16] |
Agrawal M, Ajazuddin, Tripathi DK, et al. Recent advancements in liposomes targeting strategies to cross blood-brain barrier (BBB) for the treatment of Alzheimer's disease[J]. J Control Release, 2017, 260: 61-77. DOI:10.1016/j.jconrel.2017.05.019 |
| [17] |
Dai T, Jiang K, Lu W. Liposomes and lipid disks traverse the BBB and BBTB as intact forms as revealed by two-step förster resonance energy transfer imaging[J]. Acta Pharm Sin B, 2018, 8: 261-271. DOI:10.1016/j.apsb.2018.01.004 |
| [18] |
Picone P, Ditta LA, Sabatino MA, et al. Ionizing radiation-engineered nanogels as insulin nanocarriers for the development of a new strategy for the treatment of Alzheimer's disease[J]. Biomaterials, 2016, 80: 179-194. DOI:10.1016/j.biomaterials.2015.11.057 |
| [19] |
Đorđević SM, Cekić ND, Savić MM, et al. Parenteral nanoemulsions as promising carriers for brain delivery of risperidone: design, characterization and in vivo pharmacokinetic evaluation[J]. Int J Pharm, 2015, 493: 40-54. DOI:10.1016/j.ijpharm.2015.07.007 |
| [20] |
Fry FJ, Ades HW, Fry WJ. Production of reversible changes in the central nervous system by ultrasound[J]. Science, 1958, 127: 83-84. DOI:10.1126/science.127.3289.83 |
| [21] |
Mainprize T, Lipsman N, Huang Y, et al. Blood-brain barrier opening in primary brain tumors with non-invasive MR-guided focused ultrasound: a clinical safety and feasibility study[J]. Sci Rep, 2019, 9: 321. DOI:10.1038/s41598-018-36340-0 |
| [22] |
Lipsman N, Meng Y, Bethune AJ, et al. Blood-brain barrier opening in Alzheimer's disease using MR-guided focused ultrasound[J]. Nat Commun, 2018, 9: 2336. DOI:10.1038/s41467-018-04529-6 |
| [23] |
Karakatsani ME, Blesa J, Konofagou EE. Blood-brain barrier opening with focused ultrasound in experimental models of Parkinson's disease[J]. Mov Disord, 2019, 34: 1252-1261. DOI:10.1002/mds.27804 |
| [24] |
Quadri SA, Waqas M, Khan I, et al. High-intensity focused ultrasound: past, present, and future in neurosurgery[J]. Neurosurg Focus, 2018, 44: E16. |
| [25] |
Pandit R, Chen L, Götz J. The blood-brain barrier: physiology and strategies for drug delivery[J]. Adv Drug Deliv Rev, 2020, 165-166: 1-14. DOI:10.1016/j.addr.2019.11.009 |
| [26] |
Wang LY, Zheng SS. Advances in low-frequency ultrasound combined with microbubbles in targeted tumor therapy[J]. J Zhejiang Univ Sci B, 2019, 20: 291-299. DOI:10.1631/jzus.B1800508 |
| [27] |
Arif WM, Elsinga PH, Gasca-Salas C, et al. Focused ultrasound for opening blood-brain barrier and drug delivery monitored with positron emission tomography[J]. J Control Release, 2020, 324: 303-316. DOI:10.1016/j.jconrel.2020.05.020 |
| [28] |
McMahon D, Poon C, Hynynen K. Evaluating the safety profile of focused ultrasound and microbubble-mediated treatments to increase blood-brain barrier permeability[J]. Expert Opin Drug Deliv, 2019, 16: 129-142. DOI:10.1080/17425247.2019.1567490 |
| [29] |
Tsai HC, Tsai CH, Chen WS, et al. Safety evaluation of frequent application of microbubble-enhanced focused ultrasound blood-brain-barrier opening[J]. Sci Rep, 2018, 8: 17720. DOI:10.1038/s41598-018-35677-w |
| [30] |
Pajek D, Hynynen K. The application of sparse arrays in high frequency transcranial focused ultrasound therapy: a simulation study[J]. Medical Physics, 2013, 40: 10. |
| [31] |
Cammalleri A, Croce P, Lee W, et al. Therapeutic potentials of localized blood-brain barrier disruption by noninvasive transcranial focused ultrasound: a technical review[J]. J Clin Neurophysiol, 2020, 37: 104-117. DOI:10.1097/WNP.0000000000000488 |
| [32] |
Monteith S, Sheehan J, Medel R, et al. Potential intracranial applications of magnetic resonance-guided focused ultrasound surgery[J]. J Neurosurg, 2013, 118: 215-221. DOI:10.3171/2012.10.JNS12449 |
| [33] |
Carpentier A, Canney M, Vignot A, et al. Clinical trial of blood-brain barrier disruption by pulsed ultrasound[J]. Sci Transl Med, 2016, 8: 343re342. |
| [34] |
Idbaih A, Canney M, Belin L, et al. Safety and feasibility of repeated and transient blood-brain barrier disruption by pulsed ultrasound in patients with recurrent glioblastoma[J]. Clin Cancer Res, 2019, 25: 3793-3801. DOI:10.1158/1078-0432.CCR-18-3643 |
| [35] |
Sonabend AM, Stupp R. Overcoming the blood-brain barrier with an implantable ultrasound device[J]. Clin Cancer Res, 2019, 25: 3750-3752. DOI:10.1158/1078-0432.CCR-19-0932 |
| [36] |
Frinking P, Segers T, Luan Y, et al. Three decades of ultrasound contrast agents: a review of the past, present and future improvements[J]. Ultrasound Med Biol, 2020, 46: 892-908. DOI:10.1016/j.ultrasmedbio.2019.12.008 |
| [37] |
Carugo D, Aron M, Sezgin E, et al. Modulation of the molecular arrangement in artificial and biological membranes by phospholipid-shelled microbubbles[J]. Biomaterials, 2017, 113: 105-117. DOI:10.1016/j.biomaterials.2016.10.034 |
| [38] |
Zhang J, Wang S, Deng Z, et al. Ultrasound-triggered drug delivery for breast tumor therapy through iRGD-targeted paclitaxel-loaded liposome-microbubble complexes[J]. J Biomed Nanotechnol, 2018, 14: 1384-1395. DOI:10.1166/jbn.2018.2594 |
| [39] |
Upadhyay A, Dalvi SV. Microbubble formulations: synthesis, stability, modeling and biomedical applications[J]. Ultrasound Med Biol, 2019, 45: 301-343. DOI:10.1016/j.ultrasmedbio.2018.09.022 |
| [40] |
Mahalingam S, Raimi-Abraham BT, Craig DQ, et al. Formation of protein and protein-gold nanoparticle stabilized microbubbles by pressurized gyration[J]. Langmuir, 2015, 31: 659-666. DOI:10.1021/la502181g |
| [41] |
Ma X, Bussonniere A, Liu Q. A facile sonochemical synthesis of shell-stabilized reactive microbubbles using surface-thiolated bovine serum albumin with the Traut's reagent[J]. Ultrason Sonochem, 2017, 36: 454-465. DOI:10.1016/j.ultsonch.2016.12.033 |
| [42] |
Jamburidze A, Huerre A, Baresch D, et al. Nanoparticle-coated microbubbles for combined ultrasound imaging and drug delivery[J]. Langmuir, 2019, 35: 10087-10096. DOI:10.1021/acs.langmuir.8b04008 |
| [43] |
Ha SW, Hwang K, Jin J, et al. Ultrasound-sensitizing nanoparticle complex for overcoming the blood-brain barrier: an effective drug delivery system[J]. Int J Nanomedicine, 2019, 14: 3743-3752. DOI:10.2147/IJN.S193258 |
| [44] |
Josefsson L, Goodall D, Emmer Å. Implementation of a ultraviolet area imaging detector for analysis of polyvinyl alcohol microbubbles by capillary electrophoresis[J]. J Chromatogr A, 2020, 1619: 460899. DOI:10.1016/j.chroma.2020.460899 |
| [45] |
Liu M, Dasgupta A, Koczera P, et al. Drug loading in poly(butyl cyanoacrylate)-based polymeric microbubbles[J]. Mol Pharm, 2020, 17: 2840-2848. DOI:10.1021/acs.molpharmaceut.0c00242 |
| [46] |
Chen Y, Liang Y, Jiang P, et al. Lipid/plga hybrid microbubbles as a versatile platform for noninvasive image-guided targeted drug delivery[J]. ACS Appl Mater Interfaces, 2019, 11: 41842-41852. DOI:10.1021/acsami.9b10188 |
| [47] |
Jablonowski LJ, Conover D, Teraphongphom NT, et al. Manipulating multifaceted microbubble shell composition to target both trail-sensitive and resistant cells[J]. J Biomed Mater Res A, 2018, 106: 1903-1915. DOI:10.1002/jbm.a.36389 |
| [48] |
Borden MA. Intermolecular forces model for lipid microbubble shells[J]. Langmuir, 2019, 35: 10042-10051. DOI:10.1021/acs.langmuir.8b03641 |
| [49] |
Khan AH, Dalvi SV. Kinetics of albumin microbubble dissolution in aqueous media[J]. Soft Matter, 2020, 16: 2149-2163. DOI:10.1039/C9SM01516G |
| [50] |
Omata D, Maruyama T, Unga J, et al. Effects of encapsulated gas on stability of lipid-based microbubbles and ultrasound-triggered drug delivery[J]. J Control Release, 2019, 311-312: 65-73. DOI:10.1016/j.jconrel.2019.08.023 |
| [51] |
Reusser TD, Song KH, Ramirez D, et al. Phospholipid oxygen microbubbles for image-guided therapy[J]. Nanotheranostics, 2020, 4: 83-90. DOI:10.7150/ntno.43808 |
| [52] |
Khan MS, Hwang J, Lee K, et al. Oxygen-carrying micro/nanobubbles: composition, synthesis techniques and potential prospects in photo-triggered theranostics[J]. Molecules, 2018, 23: 2210. DOI:10.3390/molecules23092210 |
| [53] |
Ma Y, Han J, Jiang J, et al. Ultrasound targeting of microbubble-bound anti PD-L1 mAb to enhance anti-tumor effect of cisplatin in cervical cancer xenografts treatment[J]. Life Sci, 2020, 262: 118565. DOI:10.1016/j.lfs.2020.118565 |
| [54] |
Upadhyay A, Dalvi SV, Gupta G, et al. Effect of pegylation on performance of protein microbubbles and its comparison with lipid microbubbles[J]. Mater Sci Eng C Mater Biol Appl, 2017, 71: 425-430. DOI:10.1016/j.msec.2016.10.021 |
| [55] |
Chen JL, Dhanaliwala AH, Dixon AJ, et al. Synthesis and characterization of transiently stable albumin-coated microbubbles via a flow-focusing microfluidic device[J]. Ultrasound Med Biol, 2014, 40: 400-409. DOI:10.1016/j.ultrasmedbio.2013.09.024 |
| [56] |
Lee M, Lee EY, Lee D, et al. Stabilization and fabrication of microbubbles: applications for medical purposes and functional materials[J]. Soft Matter, 2015, 11: 2067-2079. DOI:10.1039/C5SM00113G |
| [57] |
da Hora Passos R, Ribeiro M, Neves J, et al. Agitated saline bubble-enhanced ultrasound for assessing appropriate position of hemodialysis central venous catheter in critically Ill patients[J]. Kidney Int Rep, 2017, 2: 952-956. DOI:10.1016/j.ekir.2017.03.010 |
| [58] |
Omata D, Unga J, Suzuki R, et al. Lipid-based microbubbles and ultrasound for therapeutic application[J]. Adv Drug Deliv Rev, 2020, 154-155. |
| [59] |
Presset A, Bonneau C, Kazuyoshi S, et al. Endothelial cells, first target of drug delivery using microbubble-assisted ultrasound[J]. Ultrasound Med Biol, 2020, 46: 1565-1583. DOI:10.1016/j.ultrasmedbio.2020.03.013 |
| [60] |
Stride E, Segers T, Lajoinie G, et al. Microbubble agents: new directions[J]. Ultrasound Med Biol, 2020, 46: 1326-1343. DOI:10.1016/j.ultrasmedbio.2020.01.027 |
| [61] |
Jones RM, Hynynen K. Advances in acoustic monitoring and control of focused ultrasound-mediated increases in blood-brain barrier permeability[J]. Br J Radiol, 2019, 92: 13. |
| [62] |
Chowdhury SM, Abou-Elkacem L, Lee T, et al. Ultrasound and microbubble mediated therapeutic delivery: underlying mechanisms and future outlook[J]. J Control Release, 2020, 326: 75-90. DOI:10.1016/j.jconrel.2020.06.008 |
| [63] |
Todd N, Angolano C, Ferran C, et al. Secondary effects on brain physiology caused by focused ultrasound-mediated disruption of the blood-brain barrier[J]. J Control Release, 2020, 324: 450-459. DOI:10.1016/j.jconrel.2020.05.040 |
| [64] |
McMahon D, Hynynen K. Acute inflammatory response following increased blood-brain barrier permeability induced by focused ultrasound is dependent on microbubble dose[J]. Theranostics, 2017, 7: 3989-4000. DOI:10.7150/thno.21630 |
| [65] |
Pascal A, Li N, Lechtenberg KJ, et al. Histologic evaluation of activation of acute inflammatory response in a mouse model following ultrasound-mediated blood-brain barrier using different acoustic pressures and microbubble doses[J]. Nanotheranostics, 2020, 4: 210-223. DOI:10.7150/ntno.49898 |
| [66] |
McMahon D, Bendayan R, Hynynen K. Acute effects of focused ultrasound-induced increases in blood-brain barrier permeability on rat microvascular transcriptome[J]. Sci Rep, 2017, 7: 45657. DOI:10.1038/srep45657 |
| [67] |
Zhao R, Jiang J, Li H, et al. Phosphatidylserine-microbubble targeting-activated microglia/macrophage in inflammation combined with ultrasound for breaking through the blood-brain barrier[J]. J Neuroinflammation, 2018, 15: 334. DOI:10.1186/s12974-018-1368-1 |
| [68] |
Branca JJV, Carrino D, Pacini A. Targeting cannabidiol to specific areas of the brain: an ultrasound-based strategy[J]. Neural Regen Res, 2020, 15: 2247-2248. DOI:10.4103/1673-5374.284992 |
| [69] |
Stavarache MA, Petersen N, Jurgens EM, et al. Safe and stable noninvasive focal gene delivery to the mammalian brain following focused ultrasound[J]. J Neurosurg, 2018, 130: 989-998. |
| [70] |
Fan CH, Lin CY, Liu HL, et al. Ultrasound targeted cns gene delivery for Parkinson's disease treatment[J]. J Control Release, 2017, 261: 246-262. DOI:10.1016/j.jconrel.2017.07.004 |
| [71] |
Janowicz PW, Leinenga G, Götz J, et al. Ultrasound-mediated blood-brain barrier opening enhances delivery of therapeutically relevant formats of a tau-specific antibody[J]. Sci Rep, 2019, 9: 9255. DOI:10.1038/s41598-019-45577-2 |
| [72] |
Noroozian Z, Xhima K, Huang Y, et al. MRI-guided focused ultrasound for targeted delivery of rAAV to the brain[J]. Methods Mol Biol, 2019, 1950: 177-197. |
| [73] |
Ji R, Smith M, Niimi Y, et al. Focused ultrasound enhanced intranasal delivery of brain derived neurotrophic factor produces neurorestorative effects in a Parkinson's disease mouse model[J]. Sci Rep, 2019, 9: 19402. DOI:10.1038/s41598-019-55294-5 |
| [74] |
Cui H, Zhu Q, Xie Q, et al. Low intensity ultrasound targeted microbubble destruction assists MSCs delivery and improves neural function in brain ischaemic rats[J]. J Drug Target, 2020, 28: 320-329. DOI:10.1080/1061186X.2019.1656724 |
| [75] |
Kamimura HA, Flament J, Valette J, et al. Feedback control of microbubble cavitation for ultrasound-mediated blood-brain barrier disruption in non-human primates under magnetic resonance guidance[J]. J Cereb Blood Flow Metab, 2019, 39: 1191-1203. DOI:10.1177/0271678X17753514 |
| [76] |
O'Reilly MA, Jones RM, Barrett E, et al. Investigation of the safety of focused ultrasound-induced blood-brain barrier opening in a natural canine model of aging[J]. Theranostics, 2017, 7: 3573-3584. DOI:10.7150/thno.20621 |
| [77] |
Pasquinelli C, Hanson LG, Siebner HR, et al. Safety of transcranial focused ultrasound stimulation: a systematic review of the state of knowledge from both human and animal studies[J]. Brain Stimul, 2019, 12: 1367-1380. DOI:10.1016/j.brs.2019.07.024 |
| [78] |
Hynynen K, McDannold N, Vykhodtseva N, et al. Noninvasive MR imaging-guided focal opening of the blood-brain barrier in rabbits[J]. Radiology, 2001, 220: 640-646. DOI:10.1148/radiol.2202001804 |
| [79] |
Lamsam L, Johnson E, Connolly ID, et al. A review of potential applications of MR-guided focused ultrasound for targeting brain tumor therapy[J]. Neurosurg Focus, 2018, 44: E10. |
| [80] |
Abrahao A, Meng Y, Llinas M, et al. First-in-human trial of blood-brain barrier opening in amyotrophic lateral sclerosis using mr-guided focused ultrasound[J]. Nat Commun, 2019, 10: 4373. DOI:10.1038/s41467-019-12426-9 |
| [81] |
Al-Jawadi S, Thakur SS. Ultrasound-responsive lipid microbubbles for drug delivery: a review of preparation techniques to optimise formulation size, stability and drug loading[J]. Int J Pharm, 2020, 585: 119559. DOI:10.1016/j.ijpharm.2020.119559 |
 2021, Vol. 56
2021, Vol. 56


