体外溶出度测试是口服制剂的重要评价工具, 对难溶性药物口服制剂的开发和生物利用度评价具有重要作用。在传统的溶出度测试中, 考虑到药物在胃肠道被吸收的情况, 要求药物在溶出介质中的浓度远低于饱和浓度(即满足漏槽条件)。为了满足这个要求, 经常需要使用大量的溶出介质、添加表面活性剂或有机溶剂等方法, 这与体内的实际情况相差甚远, 无法获得良好的体内外相关性。因此, 寻找具有生理相关的体外溶出方法一直是药物溶出度研究的重要方向之一[1], 也取得了良好的进展, 如人工胃-十二指肠模型[2, 3]、溶出-渗透模型[4, 5]和两相溶出系统[6]等。
两相溶出系统是一种同时测定药物溶出和分配的体外方法, 由水相和与水不相溶的有机相组成, 药物在水相中溶出后, 不断分配进入有机相[6, 7]。两相溶出系统最早由Niebergall等[6]于1967年提出, 他们注意到一些因素(如表面活性剂) 虽然能提高难溶性药物的溶出, 但由于会降低分配速率, 从而导致了药物吸收的下降, 因此, 提出了一种能同时测定药物溶出和分配速率的简单测试系统(即两相溶出系统)。1983年, Stead等[8]首次将两相溶出系统的数据与药物的体内药动学数据进行比较, 证实了两相溶出系统具有更好的体内外相关性。此后, 两相溶出系统的报道日益增多, 测定装置从最早的烧杯发展到改进的药典篮法或桨法, 现常用药典桨法和流通池相结合的溶出装置。目前, 两相溶出方法已用于药物晶型[9]、固体分散体[10]、脂质处方[11]、纳米制剂[12]及各种缓控释制剂[13, 14]的质量评价。本文综合近年来该领域的相关研究, 对两相溶出系统的溶出装置、理论模型及其应用作简要综述。
1 两相溶出系统的优点 1.1 模拟体内吸收过程两相溶出系统由水相和与水不相溶的有机相组成。有机相充当吸收室, 药物在水相中溶出, 并不断地分配进入有机相, 可以同时考察药物溶出和分配动力学行为, 模拟在胃肠道的转运过程, 与体内溶出行为更加相似[6]。由于水相中的游离药物浓度是分配的唯一驱动力, 在有机相中积累的药物量可以用来衡量体内的吸收情况, 更利于建立体内外相关性。
1.2 克服表面活性剂的影响在传统的溶出度测试中, 为了满足难溶性药物的漏槽条件, 常需添加各种表面活性剂或有机溶剂来增加药物的溶解度。但是, 这些方法提供了非生理性的溶出环境, 与体内的溶出有较大差别。而两相溶出系统采用较少量生理相关的溶出介质, 使药物在非漏槽条件的水相中溶出, 加入与水不相容的有机相作为吸收室, 使水相中溶出的药物不断向有机相转运, 故不需要特意使用大容量的溶出介质、添加表面活性剂或有机溶剂, 更符合药物在胃肠道溶出的实际情况。
1.3 解决游离药物检测问题在传统的溶出度测试中, 水溶性差的药物在漏槽条件下测定时, 需要大量的溶出介质, 导致在溶出过程中药物浓度低于检测限; 在非漏槽条件下测定时, 一些超饱和给药系统会产生液液相分离并析出产生纳米大小的颗粒, 严重干扰游离药物浓度的测定。两相溶出系统中, 有机相中的药物浓度由水相中游离药物浓度决定。因此, 可通过测定有机相中的药物浓度, 有效地解决了水相中游离药物浓度过低或分离困难等问题[15]。
2 溶出装置及溶出介质的选择 2.1 溶出装置早期的两相溶出在烧杯中进行, 后期一般采用药典溶出装置, 并对搅拌做适当改进, 以提供足够的流体力学。Pillay等[16]考察了溶出装置对硝苯地平自乳化胶囊在磷酸缓冲液和正辛醇两相系统中溶出度的影响, 结果发现: 采用转篮将胶囊固定在溶出杯底和水相液面的正中间时(图 1a), 6 h内油相中的药物浓度可达50%左右; 采用筛网将胶囊固定在溶出杯底部, 将搅拌桨置于油相和空气的界面(图 1b), 不能有效地带动水相的流动, 故油相中的药物量很少; 将搅拌桨置于油水界面的中间(图 1c), 对水相和油相均有较好的搅拌作用, 故有较好的油相药物分配(6 h内药物达98%); 而将搅拌桨置于沉降网和油水界面中间的位置(图 1d), 药物可较好地溶出并分配至油相。虽然其分配速度略小于图 1c的装置, 但通过提高转速可达到相应的分配效果, 并具有更好的重复性。因此, 作者最终采用图 1d装置用于该制剂的体外溶出评价。
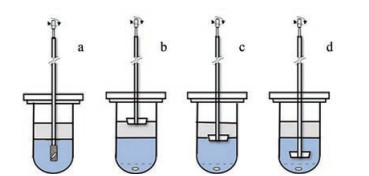
|
Figure 1 The biphasic dissolution systems. a: Rotating basket centrally positioned in the lower aqueous phase; b: A paddle positioned halfway at the air/organic phase interface; c: A paddle positioned halfway at the organic/aqueous phase interface; d: A paddle centrally positioned in the aqueous phase between the boundaries of the organic phase and the ring/mesh assembly |
美国药典篮法可有效地将制剂置于水相介质中, 但由于有机相流动较差, 使用不如桨法普遍。单桨装置一般不能使水相和油相均获得足够的流体力学, 提高桨的转速可以改善流体力学, 但是桨速的提高会使油水界面不能保持恒定甚至形成乳化, 会造成实验重复性差等问题。因此, 为了在低桨速下提供足够的流体力学条件, 可以在原本的桨轴上附加另一个桨。
采用桨法进行两相溶出度测试时, 为了避免制剂和油相的接触以及制剂上浮或下沉对测定的影响, 需用不锈钢网或适当的装置将药物束缚在水相中。这对于一些非崩解型的制剂有较好的效果, 但对于崩解型的片剂或胶囊, 这些固定装置不能保证药物颗粒不进入油相。因此, Vangani等[17]采用了药典流通池和桨法相结合的方法, 可将制剂放入流通池内, 水相溶出介质在流通池与桨法溶出杯水相系统闭合回路循环, 避免了制剂与油相的接触(图 2)。他们应用该装置评价了多种难溶性药物的片剂、胶囊剂和混悬剂的两相溶出, 证明了该装置对不同剂型的适用性。该装置能够区分洛伐他汀、卡马西平及灰黄霉素的生物等效和非生物等效产品, 同时揭示了极低水溶性药物AMG 517不同处方之间的体内外相关性。因此, 流通池和桨法相结合的方法具有操作简单、重复性好和适用性强的优点, 已成为两相溶出测试最常见的装置。
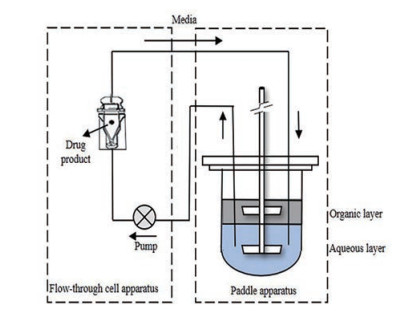
|
Figure 2 Biphasic system using paddle apparatus combined with the flow-through cell apparatus in a closed loop configuration |
采用美国药典装置测定两相溶出时, 水相和有机相的体积一般为200~500 mL。考虑到在新药开发的早期阶段, 生产的药物量有限, Frank等[18]对溶出杯和桨进行缩小, 满足少量药物在100 mL以下介质的两相溶出测定。利用这种小型溶出装置考察胃肠道pH值的变化下双嘧达莫和低溶解性-高渗透性(BCS Ⅱ类) 弱碱性模型化合物BIXX的溶出行为。结果发现, 这种装置能够有效地预测双嘧达莫的过饱和与沉淀行为, 正辛醇中的BIXX浓度与犬体内的吸收有良好的相关性。
采用透析袋装载制剂也可避免制剂与油相的接触。Takahashi等[19]采用旋转透析袋装置评价硝苯地平软胶囊的两相溶出行为。他们将透析袋附加在搅拌轴上, 透析袋内放置制剂, 并在袋内加缓冲液, 袋外为正辛醇。结果发现, 透析袋的种类对溶出有重要影响, 采用亲水性的透析袋时, 油相中的硝苯地平浓度低, 而采用疏水性的透析袋时, 油相中的硝苯地平量能反映药物的体内吸收情况。
2.2 溶出介质的选择溶出介质的成分和体积是依据药物的溶解度、稳定性实验、药物制剂的制剂学特征和预期的体内溶出环境而确定的[20]。水相的选择一般基于药典规定的溶出介质。弱酸或弱碱性药物的溶解度具有明显的pH依赖性, 可通过改变溶出介质pH来模拟胃肠道溶解度变化。Heigoldt等[14]报道了将桨法与自动pH滴定控制装置结合, 样品用沉降器置于水相底部, 水相中可以依次施加pH梯度。为了模拟处于空腹状态的胃肠道环境, 在测试开始时在pH 2水性介质中进行溶出, 1 h后用5 mol·L-1氢氧化钠溶液将pH调节至5.5。当溶出时间达3 h时, 重新调节至pH 5.5。最后, 累计溶出时间为5 h时, 将pH值设置为6.8, 进一步模拟肠道和结肠转运。因此, 整个测试过程中可以建立与生理相关的pH值条件。美国药典流通池和桨法相结合的方法, 也可以模拟胃肠道pH值变化过程[21]。将制剂装入流通池, 流通池最初填充模拟胃液, 以恒定流速闭环循环30 min, 模拟药物在胃中溶出过程。流通池回路连接到桨法装置的水相(模拟肠液), 溶出进行6 h, 模拟药物在小肠溶出阶段。当评估食物对溶出的影响, 通常采用生理相关性介质。
有机相的选择由药物在水相和有机相之间的分配系数决定, 且需要使得药物的总剂量小于有机溶剂溶解度的20%, 以确保足够的漏槽条件。已报道的有机相主要有甲苯、氯仿、环己烷、氯丁烷、异辛烷、正丁醇和正辛醇等[22, 23], 其中以正辛醇最为常见, 主要基于其物理化学特性: ①几乎不溶于水(0.05 g/100 g水); ②密度比水小(在20 ℃下相对密度为0.825), 易于取样; ③挥发性低(沸点195 ℃), 在37 ℃下不易蒸发, 可以保持相对恒定的有机相体积; ④具有较高的药物分配系数和溶解度[24]。
3 两相溶出系统动力学模型两相溶出系统涉及药物的溶解和分配过程, 对一些超饱和给药体系及pH值变化溶出体系还会涉及药物的沉淀析出, 故两相系统中药物浓度的变化行为非常复杂, 至今尚未建立具有普遍适用性的动力学模型, 但可通过一定的假设, 推导出适用于特定情况的药物浓度变化方程, 以更好地定量评价药物的溶出情况。
3.1 非崩解片剂溶出和分配动力学1967年, Nibergall等[6]在两相系统中研究了水杨酸非崩解片的溶出行为, 并考察搅拌速度、温度和水中表面活性剂浓度等影响。由于采用非崩解片, 故在溶出度较小时表面积设为恒定, 可用经典的溶出方程推导出片剂中的药物A、水中的药物B和有机相中的药物C随时间变化的规律。药物溶出系统可以被简单描述为:
| $ - \frac{{{\rm{d}}A}}{{{\rm{d}}t}} \ = \ {k_1}\left( {{W_{\rm{s}}} - B} \right)$ | (1) |
| $\frac{{{\rm{d}}B}}{{{\rm{d}}t}} \ = \ {k_1}\left( {{W_{\rm{s}}} - B} \right) - {k_2}B$ | (2) |
| $\frac{{{\rm{d}}C}}{{{\rm{d}}t}} \ = \ {k_2}B$ | (3) |
其中, Ws是水相饱和所需的药物量。在溶出起始阶段,
| $ - \frac{{{\rm{d}}A}}{{{\rm{d}}t}} \ = \ {k_1}{W_{\rm{s}}}$ | (4) |
| $\frac{{{\rm{d}}B \ }}{{{\rm{d}}t}} = \ {k_1}{W_{\rm{s}}} - {k_1}B - {k_2}B \ = \ K - K'B$ | (5) |
其中,
| $B \ = \frac{K}{{K'}}\left( {1 - {{\rm{e}}^{ - K't}}} \right)$ | (6) |
随着水相浓度的增加, 药物向有机相的转运速度也增加, 当药物从制剂中的溶出速度等于向有机相的转运速度时, 水相中的药物量达稳态, 即
| $\frac{{{\rm{d}}B \ }}{{{\rm{d}}t}} = \ 0$ | (7) |
| $\frac{{{\rm{d}}C}}{{{\rm{d}}t}} \ = \ {k_2}B \ = \ {k_1}\left( {{W_{\rm{s}}} - B} \right) \ = \ - \frac{{{\rm{d}}A}}{{{\rm{d}}t}}$ | (8) |
通过测定油相中的药物变化速率和水相中的药物量, 即可通过公式(8), 求得k2, 再根据药物在水相中的溶解度求得k1。测定了水杨酸片在pH 2盐酸氯化钾溶液-正辛醇两相系统中的溶出行为, 结果发现用公式(4)、(6)和(8) 算得k1分别为0.002 92、0.002 93和0.002 91 min-1, 用公式(6) 和(8) 算得k2值为0.031 6和0.031 4 min-1, 还考察了搅拌速度和温度对k值的影响, 结果分别符合指数方程和阿伦尼乌斯方程, 表明上述公式的正确性。
上述公式假定了药物溶出面积恒定及有机相提供漏槽作用, 忽略了药物从有机相向水相的反向扩散, 故有一定的局限性。随后, Nibergall等[25]引入了从有机相向水相中的分配速率常数(k3), 推导出油相中的药物浓度公式如下:
| $C \ = \ \frac{{{k_0}{k_2}}}{{{k_1}{k_3}}} + \frac{{{k_0}{k_2}}}{{{m_1}\left( {{m_1} - {m_2}} \right)}}{{\rm{e}}^{ - {m_1}t}} - \frac{{{k_0}{k_2}}}{{{m_2}\left( {{m_1} - {m_2}} \right)}}{{\rm{e}}^{ - {m_2}t}}$ | (9) |
| $ 其中, {{m}_{1}}=-{}^{1}\!\!\diagup\!\!{}_{2}\;\left[ -\left( {{k}_{1}}+{{k}_{2}}+{{k}_{3}} \right)+\\ \ \ \ \ \ \ \ \ \ \ \ \ \ \ \sqrt[{}]{{{({{k}_{1}}+{{k}_{2}}+{{k}_{3}})}^{2}}-4{{k}_{1}}{{k}_{3}}} \right] $ | (10) |
| $ \begin{align} & {{m}_{2}}=-{}^{1}\!\!\diagup\!\!{}_{2}\;[-\left( {{k}_{1}}+{{k}_{2}}+{{k}_{3}} \right)- \\ & \ \ \ \ \ \ \ \ \ \ \ \ \ \ \ \sqrt[{}]{{{({{k}_{1}}+{{k}_{2}}+{{k}_{3}})}^{2}}-4{{k}_{1}}{{k}_{3}}} \\ \end{align} $ | (11) |
根据k3和B的大小, 分成4种情况简化了油相中药物浓度的计算公式。
3.2 符合一级动力学的药物溶出和分配过程对于一些在水相中以一级动力学释放的处方, 可采用以下模型处理:
| $ A\overset{{{k}_{\text{d}}}}{\mathop{\to }}\, B\overset{{{k}_{\text{p}}}}{\mathop{\to }}\, C $ |
其中, A、B和C分别为制剂、水相和有机相中的药物量; kd为溶出速率常数; kp为分配速率常数。
| $\frac{\text{d}A}{\text{d}t} \ = \ -{{k}_{\text{d}}}A$ | (12) |
| $\frac{\text{d}B}{\text{d}t} \ = \ {{k}_{\text{d}}}A-{{k}_{\text{p}}}B$ | (13) |
| $\frac{\text{d}C}{\text{d}t} \ = \ {{k}_{\text{p}}}B$ | (14) |
将t = 0, A = A0, B = 0, C = 0代入, 解上述微分方程可得
| $A \ = \ {{A}_{0}}{{\text{e}}^{-{{k}_{\text{d}}}t}}$ | (15) |
| $B \ = \ \frac{{{k}_{\text{d}}}{{A}_{0}}}{{{k}_{\text{p}}}-{{k}_{\text{d}}}}\left( {{\text{e}}^{-{{k}_{\text{d}}}t}}-{{\text{e}}^{-{{k}_{\text{p}}}t}} \right)$ | (16) |
| $C \ = \ {{A}_{0}}-\frac{{{A}_{0}}{{k}_{\text{p}}}}{{{k}_{\text{p}}}-{{k}_{\text{d}}}}{{\text{e}}^{-{{k}_{\text{d}}}t}}+\frac{{{A}_{0}}{{k}_{\text{d}}}}{{{k}_{\text{p}}}-{{k}_{\text{d}}}}{{\text{e}}^{-{{k}_{\text{p}}}t}}$ | (17) |
若
| $C \ = \ {{A}_{0}}-{{A}_{0}}{{\text{e}}^{-{{k}_{\text{d}}}t}}$ | (18) |
| $\text{ln } \left( {{A}_{0}}-C \right) \ =\text{ln }\ {{A}_{0}}-{{K}_{\text{d}}}t$ | (19) |
因此, 选择合适的有机溶剂和实验条件, 使
上述模型的推导对药物的分配过程设定为一级动力学过程, 这种处理一般情况下是合适的, 但是当油相中的浓度很高时, 这种处理与实际偏差较大。因此, 随着两相溶出的应用日益广泛, 两相中的药物分配动力学又受到了重视。Grassi等[27]根据Waterbeemd等[28]的药物分配理论, 推导出水相中药物的变化方程为:
| ${{C}_{\text{w}}} \ = \ \frac{{{k}_{\text{ow}}}{{M}_{\text{o}}}}{{{k}_{\text{wo}}}{{V}_{\text{o}}}+{{k}_{\text{ow}}}{{V}_{\text{w}}}}-\left( \frac{{{k}_{\text{ow}}}{{M}_{\text{o}}}}{{{k}_{\text{wo}}}{{V}_{\text{o}}}+{{k}_{\text{ow}}}{{V}_{\text{w}}}}-\\ \ \ \ \ \ \ \ \ {{C}_{\text{wi}}} \right){{\text{e}}^{\left( -A\frac{{{k}_{\text{wo}}}{{V}_{\text{o}}}+{{k}_{\text{ow}}}{{V}_{\text{w}}}}{{{\text{V}}_{\text{o}}}{{\text{V}}_{\text{w}}}}t \right)}}$ | (20) |
其中, kwo和kow分别表示从水相到有机相的扩散速率常数和从有机相到水相的扩散速率常数; A为油水界面表面积; Vw和Vo分别表示水相体积和油相体积; Mo为总药量。
公式(20) 为定量描述两相系统中药物的经时变化规律提供了依据。但是, 对一些难溶性的药物来说, 计算的水相药物浓度很容易超过它的饱和浓度, 表明该公式具有一定的局限性。为此, Grassi等[27]提出了用未饱和百分数对两相间的分配通量进行校正, 即
| $\frac{\text{d}{{C}_{\text{w}}}}{\text{d}t} \ = \ {{C}_{\text{w}}}^{2}a \ + \ {{C}_{\text{w}}}b \ + \ f$ | (21) |
其中,
| $a \ = \ \frac{A}{{{V}_{\text{o}}}}\left( \frac{{{k}_{\text{ow}}}}{{{C}_{\text{sw}}}}-\frac{{{k}_{\text{wo}}}}{{{C}_{\text{so}}}} \right)$ | (22) |
| $b \ = \ A\left[ \frac{{{k}_{\text{ow}}}}{{{C}_{\text{so}}}{{V}_{\text{w}}}}\left( \frac{{{M}_{\text{o}}}}{{{V}_{\text{o}}}}-{{C}_{\text{so}}} \right)-\frac{{{k}_{\text{ow}}}}{{{C}_{\text{sw}}}{{V}_{\text{o}}}}\left( \frac{{{M}_{\text{o}}}}{{{V}_{\text{w}}}}+{{C}_{\text{sw}}} \right) \right]$ | (23) |
| $f \ = \ A{{k}_{\text{ow}}}\frac{{{M}_{\text{o}}}}{{{V}_{\text{w}}}{{V}_{\text{o}}}}$ | (24) |
根据a、b和f的取值, 可将上述微分方程转化为常规方程, 考察了吡罗昔康和尼美舒利在不同pH值和正辛醇中的分配动力学, 发现用实验数据和新模型拟合结果都非常好。
Grassi等[27]的新模型有效地解决了普遍适用性的问题, 但是需要测算kow、kwo、Csw和Cso等参数, 有时这些参数的测定有一定的难度, 故使其应用受到了限制。为此, Mudie等[7]根据扩散理论并通过表观分配系数(kap) 将油相中的药物浓度换算为水相中药物浓度, 得到水相和油相的药物浓度变化, 公式为:
| ${{C}_{a, t}} \ = \ \frac{{{M}_{\text{T}}}}{{{V}_{\text{a}}}\left( 1+\beta \right)}\left[ {{\text{e}}^{-\frac{{{A}_{\text{I}}}}{{{V}_{\text{a}}}}{{P}_{\text{I}}}\left( 1+\beta \right)t}}+\beta \right]$ | (25) |
| $ {{C}_{\text{o}, t}} \ = \ \frac{{{M}_{\text{T}}}}{{{V}_{\text{o}}}\left( 1+\beta \right)}\left[ 1-{{\text{e}}^{-\frac{{{A}_{\text{I}}}}{{{\text{V}}_{\text{a}}}}{{P}_{\text{I}}}\left( 1+\beta \right)t}} \right] $ | (26) |
其中, MT是系统中溶解药物的总质量; Vo是有机相的总体积; β是通过表观分布系数(kap) 归一化的水相与有机相的体积比
Xu等[29]以布洛芬为模型药物, 考察常见辅料对药物溶液分配速率的影响, 研究表明在各种常见辅料(小分子、聚合物和表面活性剂) 存在下, 辅料会存在或吸附于油水界面, 水-辛醇界面PI降低, 导致分配速率降低, 证明了该方法能够灵敏准确地评估药物在两相中的分配动力学行为。
4 两相溶出系统的生理相关性及其适用性由公式(26) 可得各时间点油相中的药物百分率(Fo, t) 为:
| ${{F}_{\text{o}, t}} \ = \ \frac{1}{\left( 1+\beta \right)}\left[ 1-{{\text{e}}^{-\frac{{{A}_{\text{I}}}}{{{\text{V}}_{\text{a}}}}{{P}_{\text{I}}}\left( 1+\beta \right)t}} \right]$ | (27) |
当药物表观分配系数(kap) 足够大时, β趋向于0, 则上式可变为:
| ${{F}_{\text{o}, t}}= \ 1-{{\text{e}}^{-\frac{{{A}_{\text{I}}}}{{{\text{V}}_{\text{a}}}}{{P}_{\text{I}}}t}} \ = \ 1-{{\text{e}}^{-{{k}_{\text{p}}}t}}$ | (28) |
其中, kp为药物在两相中的分配速率常数。
由于很多药物的体内吸收百分率(Fa, t)的公式为:
| $ {{F}_{\text{a}, t}} \ = \ 1-{{\text{e}}^{-{{k}_{\text{a}}}t}} \ = \ 1-{{\text{e}}^{-\frac{A}{\text{V}}{{P}_{\text{eff}}}\cdot t}} $ | (29) |
其中, ka为吸收速率常数; A是肠道表面积; V是肠道液体体积, Peff是体内渗透速率常数。
故当kp与ka相等时, 两相溶出系统各时间点分配到油相中的药物百分率和体内药物吸收百分率相等。这是两相溶出系统可获得良好体内外相关性的理论依据。
因此, 为使得两相溶出系统具有生理相关性, 应注意装置的设计及有机相的选择。由于实验装置的限制,
此外, 为达到体外溶出介质与肠腔之间具有相似的饱和条件, 可以使用生理相关性缓冲液, 并基于上述确定的适当
无定型固体分散体在胃肠道环境中易形成超饱和溶液, 其热力学具有不稳定性, 在到达吸收部位前, 药物分子易结晶析出, 使得其溶解度优势散失。因此, 对该剂型过饱和状态的表征是优化处方性能的关键。Sarode等[30]以非洛地平为模型药物, 采用两相溶出系统评价了不同辅料固体分散体的溶出吸收行为。结果发现, 使用Eudragit®EPO和AQOAT®AS-LF获得最高过饱和度, 但由于在水相中快速析出沉淀, 导致分配进入有机相药量较少。以Pharmacoat®603和Kollidon®VA-64为载体材料, 水相中过饱和度低于临界成核浓度, 可以实现药物在有机相中更高分配。研究表明, 分配进入有机相的量取决于载体维持过饱和状态的能力。
对于弱碱性药物的固体分散体, 在胃酸性条件下可以充分溶解, 进入小肠后, 经过短暂的热力学不稳定过饱和状态后, 会析出沉淀直至达到其热力学平衡溶解度。传统溶出测试中由于缺乏吸收过程往往会高估这种超饱和及沉淀趋势。Xu等[21]研究了弱碱性药物利托那韦无定型固体分散体在生理相关性介质中的体外溶出行为。结果表明, 由于水相中溶解的药物不断分配进入正辛醇, 两相溶出测试中的药物水相过饱和度远低于酸碱二阶转化法。6 h时有50%~70%药物分配进入正辛醇, 与各制剂在人体中的绝对生物利用度为60%~80%相一致。进一步分析各制剂在禁食和中等脂肪饮食条件下各时间点的吸收百分率和对应时间在正辛醇中的分配百分率, 发现两者间的线性关系良好, 相关系数(R2) 为0.93, 表明两相溶出系统较好地拟合了药物在体内的溶出、沉淀和转运过程。
5.2 自乳化给药系统考虑到自乳化脂质给药系统中脂质载体在体内易于消化, 可能会对药物递送系统的性能产生影响, 通常采用体外脂解方法进行评估。但是, 该体外脂解方法仍存在局限, 不能充分预测体内性能。Pestieau等[11]采用不同的体外溶出介质(0.1 mol·L-1 HCl+1%聚山梨酯80、0.1 mol·L-1 HCl、模拟空腹胃液、模拟空腹肠液和模拟进食肠液, 含有水和辛醇的两相介质) 来评价非诺贝特自乳化制剂。研究显示, 两相溶出介质中Cmax和AUC的预测误差均小于10%, 且能够建立A级体内相关性。Shi等[15]应用该系统评价了塞来昔布自乳化制剂的溶出行为。由于药物不断分配进入有机相, 与非漏槽条件下的单相溶出相比, 双相溶出系统的水相中能够达到更高的过饱和度, 这与体内溶出行为更为相似。
5.3 缓控释制剂体外溶出评价缓控释制剂的重点是区分处方释药能力, 预测药物在体内溶出行为。对难溶性药物来讲, 常需加入表面活性剂或有机溶剂增溶, 以满足漏槽条件, 但这些物质也改变了缓控释材料对药物释放的控制行为, 故与体内药物实际的溶出行为有较大差别。采用流通池法可以克服这个问题, 但需要使用大量的溶出介质, 且其装置较为昂贵, 目前未能普遍使用。Chaudhary等[13]研究了药典桨法装置测定硝苯地平缓释制剂的释药行为的可行性, 结果发现, 当采用0.54%十二烷基硫酸钠900 mL为溶出介质时, 测得的溶出数据与Baye公司用流通池装置测得的溶出度行为不相关, 而用人工胃液500 mL和正辛醇400 mL组成的两相溶出系统得到的结果与Baye公司报道的溶出行为相一致。因此, 在没有流通池装置时, 采用桨法装置的两相溶出系统可有效测定硝苯地平缓释片的释药行为, 可用于日常质量控制工作中。Phillips等[31]用两相溶出方法评估了3种释放速度的硝苯地平控释片的溶出行为。研究发现, 两相溶出可以提供药物溶出所需的漏槽条件, 能灵敏地区分骨架材料含量不同所致的释药行为差异, 含40%羟丙基甲基纤维素(HPMC) 的释药速率明显小于含20% HPMC的控释片, 两者曲线相似因子f2 = 23.1,后者的释药速率明显小于含10% HPMC的控释片(f2 = 26.3), 而在以水、磷酸钠和十二烷基硫酸钠溶液为介质的单相溶出测试中, 3种制剂的释药速率差别不大。
考虑到胃肠道pH值变化对缓控释制剂的影响, Heigoldt[14]采用pH调节的两相溶出系统与恒定pH条件的单相溶出系统研究双嘧达莫和BIMT 17的4种缓释制剂的溶出。结果发现, 与传统的pH值为1、5.5或6.8单相介质的溶出实验相比, pH调节的两相溶出方法能够模拟体内生理条件, 更好地预测这两种药物的多种缓释微丸和骨架片的体内溶出行为和生物利用度。
5.4 其他制剂两相溶出方法由于具有较高的灵敏度, 还可以用来区分常规制剂中处方或工艺的影响。Deng等[32]考察了3种制粒工艺对消旋卡多曲颗粒剂溶出度和生物利用度的影响。结果发现, 采用单相溶出方法无法区分各工艺的差异, 两相溶出正辛醇中观察到显著的溶出差异, 溶出顺序为: 添加粘合剂湿法制粒 > 没有粘合剂的湿法制粒 > 干法制粒制备的颗粒。3种制剂4 h时在有机相中溶出百分数与体内的AUC0-24 h和Cmax具有良好的相关性, R2分别为0.995和0.999。Al Durdunji等[33]采用两相溶出方法评价了不同粒径地拉罗司分散片的溶出行为。结果发现, 正辛醇相中能够区分不同粒径的释放速度, 且体外溶出分数与体内吸收分数建立了A级体内外相关性。Franc等[34]采用药典桨法和两相溶出方法研究了不同剂量及不同粒径华法林钠片的溶出行为。结果发现, 桨法测得的各样品溶出行为没有差异, 10 min内即可全部溶出。而两相溶出法测定结果表明, 剂量对小粒径华法林钠片的溶出没有影响, 但对大粒径华法林钠片的溶出有明显的影响。因此, 认为两相溶出法适用于药品的开发、临床评估和常规质量控制, 有助于降低创新药物和非专利药物的开发成本。
6 总结与展望两相溶出系统因采用有机相作为吸收室, 模拟体内的药物转运, 与传统溶出装置相比更具有生理相关性, 故受到了广泛的重视。两相溶出系统早期主要应用于为溶出测试提供漏槽条件, 对药物处方进行筛选, 随着该系统理论模型的发展, 目前主要将其应用于建立体内外相关性的研究。由于药物体内吸收的复杂性和实验装置的局限性等问题的存在, 能够建立A级体内外相关性的药物是相对有限的。考虑到两相溶出系统中分配的动力学评价主要基于界面扩散理论(药物转运受到水有机相界面的每一侧的流体力学控制), 该动力学模型未考虑相接触界面的障碍[28]。此外, 该装置还存在一些实际问题, 例如, 溶剂的挥发性和毒性等可能会限制有机相的选择, 含表面活性剂的介质可能会与有机相发生乳化。尽管两相溶出系统存在许多限制, 但是在预测药物体内溶出和吸收行为方面是一个很好的工具。随着该模型理论和测试装置的不断发展, 两相溶出系统在用于难溶性药物建立体内外相关性方面会有越来越广阔的发展空间。
作者贡献: 刘青与张雅琦负责论文的框架构思与撰写; 王文喜负责对论文进行整体设计与指导。
利益冲突: 本文不存在任何利益冲突。
| [1] |
Li ZQ, He X, Liu CX. Recent advances in drug dissolution/permeation synchronous evaluation technologies based on physiological characteristics of gastrointestinal tract[J]. Acta Pharm Sin (药学学报), 2016, 51: 1540-1550. |
| [2] |
Vatier J, Malikova-Sekera E, Vitre MT, et al. An artificial stomach-duodenum model for the in-vitro evaluation of antacids[J]. Aliment Pharmacol Ther, 1992, 6: 447-458. |
| [3] |
Carino SR, Sperry DC, Hawley M. Relative bioavailability estimation of carbamazepine crystal forms using an artificial stomach-duodenum model[J]. J Pharm Sci, 2006, 95: 116-125. DOI:10.1002/jps.20495 |
| [4] |
Kataoka M, Sugano K, Mathews CD, et al. Application of dissolution/permeation system for evaluation of formulation effect on oral absorption of poorly water-soluble drugs in drug development[J]. Pharm Res, 2012, 29: 1485-1494. DOI:10.1007/s11095-011-0623-2 |
| [5] |
Kataoka M, Itsubata S, Masaoka Y, et al. In vitro dissolution/permeation system to predict the oral absorption of poorly water-soluble drugs: effect of food and dose strength on it[J]. Biol Pharm Bull, 2011, 34: 401-407. DOI:10.1248/bpb.34.401 |
| [6] |
Niebergall PJ, Patil MY, Sugita ET. Simultaneous determination of dissolution and partitioning rates in vitro[J]. J Pharm Sci, 1967, 56: 943-947. DOI:10.1002/jps.2600560803 |
| [7] |
Mudie DM, Shi Y, Ping H, et al. Mechanistic analysis of solute transport in an in vitro physiological two-phase dissolution apparatus[J]. Biopharm Drug Dispos, 2012, 33: 378-402. DOI:10.1002/bdd.1803 |
| [8] |
Stead JA, Freeman M, John EG, et al. Ibuprofen tablets: dissolution and bioavailability studies[J]. Int J Pharm, 1983, 14: 59-72. DOI:10.1016/0378-5173(83)90114-X |
| [9] |
Deng J, Staufenbiel S, Bodmeier R. Evaluation of a biphasic in vitro dissolution test for estimating the bioavailability of carbamazepine polymorphic forms[J]. Eur J Pharm Sci, 2017, 105: 64-70. DOI:10.1016/j.ejps.2017.05.013 |
| [10] |
Thiry J, Kok MGM, Collard L, et al. Bioavailability enhancement of itraconazole-based solid dispersions produced by hot melt extrusion in the framework of the three Rs rule[J]. Eur J Pharm Sci, 2017, 99: 1-8. DOI:10.1016/j.ejps.2016.12.001 |
| [11] |
Pestieau A, Lebrun S, Cahay B, et al. Evaluation of different in vitro dissolution tests based on level A in vitro-in vivo correlations for fenofibrate self-emulsifying lipid-based formulations[J]. Eur J Pharm Biopharm, 2017, 112: 18-29. DOI:10.1016/j.ejpb.2016.10.030 |
| [12] |
Xu H, Shi Y, Vela S, et al. Developing quantitative in vitro-in vivo correlation (IVIVC) for fenofibrate immediate release formulations with the biphasic dissolution-partition test method[J]. J Pharm Sci, 2018, 107: 476-487. DOI:10.1016/j.xphs.2017.06.018 |
| [13] |
Chaudhary RS, Gangwal SS, Gupta VK, et al. Dissolution system for nifedipine sustained-release formulations[J]. Drug Dev Ind Pharm, 1993, 19: 1939-1946. DOI:10.3109/03639049309073900 |
| [14] |
Heigoldt U, Sommer F, Daniels R, et al. Predicting in vivo absorption behavior of oral modified release dosage forms containing pH-dependent poorly soluble drugs using a novel pH-adjusted biphasic in vitro dissolution test[J]. Eur J Pharm Biopharm, 2010, 76: 105-111. DOI:10.1016/j.ejpb.2010.05.006 |
| [15] |
Shi Y, Gao P, Gong Y, et al. Application of a biphasic test for characterization of in vitro drug release of immediate release formulations of celecoxib and its relevance to in vivo absorption[J]. Mol Pharm, 2010, 7: 1458-1465. DOI:10.1021/mp100114a |
| [16] |
Pillay V, Fassihi R. A new method for dissolution studies of lipid-filled capsules employing nifedipine as a model drug[J]. Pharm Res, 1999, 16: 333-337. DOI:10.1023/A:1011959914706 |
| [17] |
Vangani S, Li X, Zhou P, et al. Dissolution of poorly water-soluble drugs in biphasic media using USP 4 and fiber optic system[J]. Clin Res Regul Aff, 2009, 26: 8-19. DOI:10.1080/10601330902905887 |
| [18] |
Frank KJ, Locher K, Zecevic DE, et al. In vivo predictive mini-scale dissolution for weak bases: advantages of pH-shift in combination with an absorptive compartment[J]. Eur J Pharm Sci, 2014, 61: 32-39. DOI:10.1016/j.ejps.2013.12.015 |
| [19] |
Takahashi M, Mochizuki M, Itoh T, et al. Studies on dissolution tests for soft gelatin capsules. Ⅳ. Dissolution test of nifedipine soft gelatin capsule containing water soluble vehicles by the rotating dialysis cell method[J]. Chem Pharm Bull, 1994, 42: 333-336. DOI:10.1248/cpb.42.333 |
| [20] |
Zhao YQ, Zhou SH, Liu WJ, et al. Discussion of development and validation of dissolution methods for solid oral dosage forms[J]. Acta Pharm Sin (药学学报), 2018, 53: 202-209. |
| [21] |
Xu H, Vela S, Shi Y, et al. In vitro characterization of ritonavir drug products and correlation to human in vivo performance[J]. Mol Pharm, 2017, 14: 3801-3814. DOI:10.1021/acs.molpharmaceut.7b00552 |
| [22] |
Gabriels M, Plaizier-Vercammen J. Design of a dissolution system for the evaluation of the release rate characteristics of artemether and dihydroartemisinin from tablets[J]. Int J Pharm, 2004, 274: 245-260. DOI:10.1016/j.ijpharm.2004.01.022 |
| [23] |
Hoa NT, Kinget R. Design and evaluation of two-phase partition-dissolution method and its use in evaluating artemisinin tablets[J]. J Pharm Sci, 1996, 85: 1060-1063. DOI:10.1021/js960115u |
| [24] |
Grundy JS, Anderson KE, Rogers JA, et al. Studies on dissolution testing of the nifedipine gastrointestinal therapeutic system. 1. Description of a two-phase in vitro dissolution test[J]. J Control Release, 1997, 48: 1-8. DOI:10.1016/S0168-3659(97)00064-3 |
| [25] |
Niebergall PJ, Sugita ET, Schnaare RL. Dissolution rates under sink conditions[J]. J Pharm Sci, 1971, 60: 1575-1576. DOI:10.1002/jps.2600601033 |
| [26] |
Kinget R, Greef HD. In vitro assessment of drug release from semi-solid lipid matrices[J]. Eur J Pharm Sci, 1995, 3: 105-111. DOI:10.1016/0928-0987(94)00081-A |
| [27] |
Grassi M, Coceani N, Magarotto L. Modelling partitioning of sparingly soluble drugs in a two-phase liquid system[J]. Int J Pharm, 2002, 239: 157-169. DOI:10.1016/S0378-5173(02)00101-1 |
| [28] |
Waterbeemd JTMVD, Jansen ACA, Gerritsma KW. Transport in QSAR. Ⅱ. Rate-equilibrium relationships and the interfacial transfer of drugs[J]. Eur J Med Chem, 1980, 15: 279-282. |
| [29] |
Xu H, Wang W, Shi Y, et al. Characterization of the partition rate of ibuprofen across the water-octanol interface and the influence of common pharmaceutical excipients[J]. J Pharm Sci, 2019, 108: 525-537. DOI:10.1016/j.xphs.2018.11.026 |
| [30] |
Sarode AL, Wang P, Obara S, et al. Supersaturation, nucleation, and crystal growth during single- and biphasic dissolution of amorphous solid dispersions: polymer effects and implications for oral bioavailability enhancement of poorly water soluble drugs[J]. Eur J Pharm Biopharm, 2014, 86: 351-360. DOI:10.1016/j.ejpb.2013.10.005 |
| [31] |
Phillips DJ, Pygall SR, Cooper VB, et al. Toward biorelevant dissolution: application of a biphasic dissolution model as a discriminating tool for HPMC matrices containing a model BCS class Ⅱ drug[J]. Dissolut Technol, 2012, 19: 25-34. DOI:10.14227/DT190112P25 |
| [32] |
Deng J, Staufenbiel S, Hao SL, et al. Development of a discriminative biphasic in vitro dissolution test and correlation with in vivo pharmacokinetic studies for differently formulated racecadotril granules[J]. J Control Release, 2017, 255: 202-209. DOI:10.1016/j.jconrel.2017.04.034 |
| [33] |
Al Durdunji A, Alkhatib HS, Al-Ghazawi M. Development of a biphasic dissolution test for deferasirox dispersible tablets and its application in establishing an in vitro-in vivo correlation[J]. Eur J Pharm Biopharm, 2016, 102: 9-18. DOI:10.1016/j.ejpb.2016.02.006 |
| [34] |
Franc A, Muselik J, Gonec R, et al. Biphasic dissolution method for quality control and assurance of drugs containing active substances in the form of weak acid salts[J]. Acta Pharm, 2016, 66: 139-145. DOI:10.1515/acph-2016-0010 |
 2021, Vol. 56
2021, Vol. 56


