肿瘤免疫治疗通过激活或调动机体自身的免疫系统, 从而控制与清除肿瘤, 是继手术、放疗和化疗后又一重要肿瘤治疗手段, 包括免疫检查点抑制剂、肿瘤疫苗、过继免疫细胞治疗等多种方法[1]。其中, 免疫检查点抑制剂(CTLA-4和PD1/PD-L1通路) 已经成为晚期非小细胞肺癌和黑色素瘤的一线治疗方法, 但是这种方法只对部分患者有治疗作用[2]。因此, 迫切需要寻找其他能够改善肿瘤免疫治疗效果的新方法, 为肿瘤患者带来福音。IDO1是近年来受到广泛关注的潜在小分子免疫检查点, 2017年美国临床肿瘤学会年会上, IDO1抑制剂被誉为肿瘤免疫治疗的下一个热点研究领域。IDO1是催化色氨酸代谢的限速酶, 色氨酸的过度消耗会抑制T细胞免疫反应。IDO1在多种肿瘤组织中过度表达, 诱发机体免疫系统对其免疫耐受, 发生免疫逃逸[3]。
1 色氨酸代谢与IDO1L-色氨酸是人体8种必需氨基酸中含量最少的, 且不能通过人体自身合成, 只能从食物当中获取的氨基酸[4]。色氨酸在体内的代谢途径主要有犬尿氨酸途径和5-羟色胺途径(图 1)。其中犬尿氨酸途径是色氨酸代谢的最主要途径, 约95%的色氨酸都是通过该途径进行代谢[5]。色氨酸首先在IDO1、吲哚胺2, 3-双加氧酶2 (indoleamine 2, 3-dioxygenase 2, IDO2) 和色氨酸2, 3-双加氧酶(tryptophan 2, 3-dioxygenase, TDO) 这三种酶的作用下将吲哚环上2, 3位双键氧化断裂, 生成N-甲酰基犬尿氨酸, 这是犬尿氨酸途径的第一步也是限速步骤[6]。多种研究发现, 犬尿氨酸途径造成的色氨酸消耗和犬尿氨酸的生成除了可以在免疫应答方面起关键调节作用, 也与许多疾病密切相关, 如阿尔茨海默病、肌萎缩性侧索硬化症、亨廷顿氏病、抑郁症和精神分裂症[7]。
|
Figure 1 The metabolic pathway of the tryptophan |
IDO1、IDO2、TDO这3种同工酶在结构、组织分布和底物特异性上表现出明显的不同。IDO1由位于第8号染色体上INDO基因编码[8], 主要分布在肝脏外的各种组织和细胞中, 包括胸腺、小肠、附睾、胎盘、肾脏、脾脏、胰腺、中枢神经系统、巨噬细胞和小胶质细胞, IDO1底物识别性低, 可以识别D-色氨酸、L-色氨酸、5-羟基-L-色氨酸、色胺、5-羟色胺和褪黑素等多种色氨酸类似物[9]。IDO2由位于第8号染色体上INDO1基因编码, 主要分布在肾脏、肝脏和生殖器官中[8, 10], 氧化裂解L-色氨酸的能力较差[11]。TDO由位于第4号染色体上TDO2基因编码, 主要分布在肝脏中, 对L-色氨酸具有高度特异性[12]。虽然这3种酶都可以催化色氨酸转化成犬尿氨酸, 但他们对底物色氨酸的酶活性却有很大差异, IDO1 (Km ~20 μmol·L-1) > TDO (Km ~190 μmol·L-1) > IDO2 (Km ~6.8 mmol·L-1)[13]。这三种同工酶中由于IDO1分布广泛, 催化L-色氨酸活性高, 所以被研究的最为广泛。
2006年IDO1晶体结构(PDB code: 2D0T) 首次被报道[14], 其共晶配体是4-苯基咪唑(4-PI) 和两个结晶缓冲分子N-环己基-2-氨基乙磺酸, 共晶结构显示(图 2): IDO1是由403个氨基酸组成的血红素单体酶, IDO1的活性位点主要有两个疏水性口袋A和B, 其中口袋A底部可以与血红素中铁离子作用, 4-PI咪唑环中的N-H与血红素中铁离子络合, 并将苯环伸向口袋A, 两个缓冲分子位于口袋B活性位点入口处, 与血红素7-丙酸基形成氢键(图 2)[15]。之后的多种研究表明, IDO1的活性位点会呈现多种构象, 从而识别不同的抑制剂[16], 这种诱导契合效应既为IDO1抑制剂的设计带来机遇, 同时也增添了挑战。

|
Figure 2 The binding mode of 4-PI with IDO1 (PDB code: 2D0T) |
正常情况下, IDO1在大部分人体组织中是低表达的, 但多种炎性因子如IFN-γ、TNF-α、IL-10、IL-27、COX-2都可以诱导IDO1的表达[17]。IDO1在多种肿瘤组织中过度表达, 可以作为免疫抑制因子介导肿瘤免疫逃逸。目前, 已有多种IDO1介导肿瘤免疫逃逸的途径被报道, 主要包括以下几种方式: ① IDO1过度表达, 会使大量的色氨酸沿犬尿氨酸途径被降解, 造成肿瘤微环境中色氨酸减少, 色氨酸的缺乏导致T淋巴细胞的生长周期停留在G1期, 无法形成成熟的T淋巴细胞。另外, 在Fas配体存在下, 色氨酸的缺乏可以加快Fas介导的活化T细胞的凋亡[18]。②色氨酸含量下降会抑制雷帕霉素靶蛋白复合体1 (mTORC1) 信号传导通路, 当mTORC1被激活时可以促进蛋白质的合成、抑制细胞自噬。因此当mTORC1受到抑制, 可导致T细胞免疫能力下降, 诱导T细胞自噬[19]。③色氨酸的缺乏导致色氨酸转运核糖核酸(tRNA) 在细胞中积累, 激活一般性调控阻遏蛋白激酶2 (GCN2), 活化的GCN2诱导下游真核细胞转录起始因子2α (eIF2α) 磷酸化, 抑制蛋白的合成, 阻止T细胞的活化。此外, 激活的GCN2也能促进Treg的分化[20]。④色氨酸代谢产生犬尿氨酸, 而犬尿氨酸是芳香烃受体(AHR) 的内源性配体, 犬尿氨酸与T细胞上的AHR结合, 诱导FOXP3+Treg细胞的分化[21-23]。
IDO1使肿瘤微环境中的色氨酸耗竭, 导致GCN2激活和mTORC1抑制, 从而阻止T细胞发挥免疫作用。另外, 色氨酸降解产生的代谢产物, 激活AHR, 促进Treg分化。这些机制的共同作用导致肿瘤细胞发生免疫逃逸, 使IDO1成为潜在的肿瘤免疫治疗靶点。
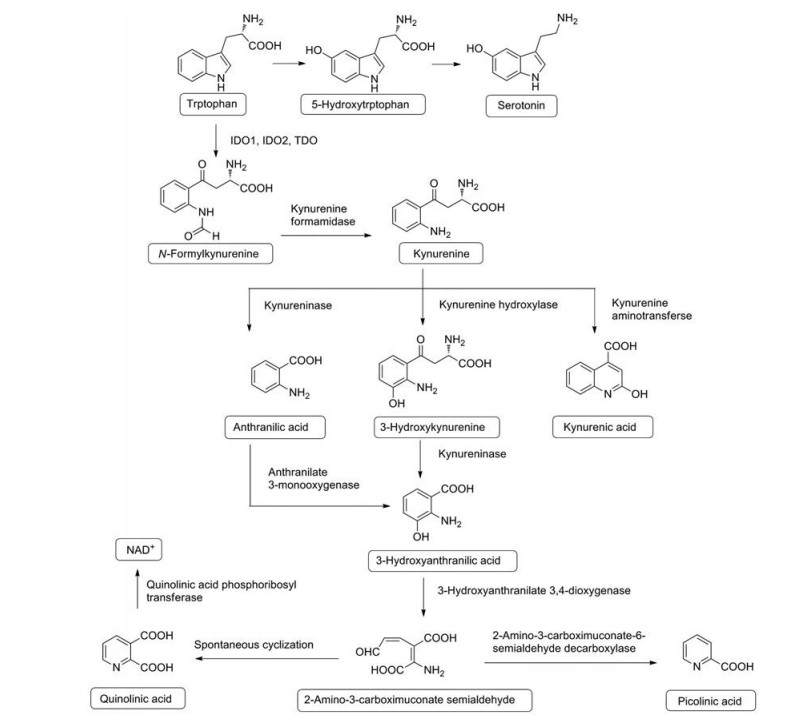
3 IDO1抑制剂研究进展在过去的20多年里, 通过高通量筛选、天然产物结构修饰、基于结构的药物设计等方式, 已经有多种结构类型的IDO1抑制剂被报道, 如: 吲哚、芳基咪唑、N-羟基脒、喹啉、醌。并且有多个IDO1抑制剂进入临床研究, 如Indoximod、PF-06840003、Navoximod、Epacadostat、Linrodostat。本文将通过查阅现有专利和文献, 对已报道IDO1抑制剂的构效关系进行总结。
3.1 吲哚类及其衍生物1991年, Candy课题组报道了第一个IDO1的竞争性抑制剂1-MT (Ki = 35 μmol·L-1, 化合物1, 图 3)[24], 它是色氨酸吲哚环上N甲基化后得到的外消旋体。在小鼠实验中, 1-MT单独或者联合IFN-γ或白介素(IL)-12使用, 均没有明显抑制肿瘤生长的作用。但在治疗的2周内, 将1-MT与紫杉醇联合使用可显著抑制肿瘤生长[25]。之后, 对两种异构体进行拆分, 相比较D-1-MT, L-1-MT在体外重组IDO1酶活性和HeLa细胞中建立IDO1酶活性检测中表现出更好的抑制活性。但是, 研究也发现对于人或小鼠树突状细胞中表达的天然IDO1, D-1-MT与L-1-MT的抑制活性基本相似。然而, D-1-MT对T细胞增殖的抑制作用要明显优于L-1-MT。在小鼠黑色素瘤和乳腺癌模型中, D-1-MT与环磷酰胺、紫杉醇和吉西他滨联合使用治疗肿瘤效果也更为有效, 这些研究结果说明D-1-MT更适合进入临床研究。D-1-MT与L-1-MT表现出的IDO1酶抑制活性与体内活性不一致, 这可能是因为不同的细胞类型对两种异构体的反应不同, 具体分子机制目前尚不清楚[26]。目前, Indoximod作为癌症治疗的临床候选药物, 主要与其他癌症治疗方法(例如癌症免疫疗法、化学疗法或放射疗法) 联合用药, 用于转移性实体瘤、浸润性乳腺癌[27]、胰腺癌[28]、黑色素瘤[29]、肝癌[30]等多种肿瘤的治疗。为了改善Indoximod在人体内药代动力学性质, NewLink公司又开发了其前药NLG802 (化合物3, 图 3), 它是将Indoximod羧基乙酯化、氨基末端与亮氨酸缩合得到二肽盐酸盐。在猴子试验中, 与Indoximod相比, NLG802的口服生物利用度提高了5倍, 药时曲线下面积(AUC) 提高2.9~5.2倍, 最高血药浓度(Cmax) 提高3.6~6.1倍, 在所有的实验物种中, NLG802均能在体内快速吸收并代谢为Indoximod[31]。

|
Figure 3 The structures of indole IDO1 inhibitors |
Crosignani等[32]通过高通量筛选发现了化合物4 (IC50 = 3.0 μmol·L-1, 图 3), 虽然它对IDO1只有中等的抑制效果, 但是它相对分子质量小, 拥有0.47的良好配体效率。对化合物4进行构效关系研究发现: ①琥珀酰亚胺结构是保持活性所必需的基团。将其替换成吡咯烷酮、吡咯烷或戊二酰亚胺, 得到化合物的IC50均大于30 μmol·L-1。在琥珀酰亚胺的氮原子或者碳原子上引入甲基, 活性降低至少一个数量级。用氧或氮原子取代琥珀酰亚胺CH2基团也会明显降低活性。②将吲哚环替换成苯并咪唑、苯并呋喃、苯并噻吩、萘、喹啉、异喹啉活性均降低。③吲哚5、6位上引入适当的取代基可以提高活性, 在5位引入卤素可以提高活性, 且氟(IC50 = 0.15 μmol·L-1) > 溴(IC50 = 0.37 μmol·L-1) > 氯(IC50 = 0.83 μmol·L-1), 而三氟甲基、甲基、甲氧基均会降低活性。在6位引入溴(IC50 = 0.42 μmol·L-1) 可以提高活性, 其他取代基团活性均没有明显改善。④在确定吲哚5位用氟原子取代后, 将6位用其他基团取代, 得到的双取代化合物结果均不如单取代化合物5 (PF-06840003, 图 3)。将PF-06840003进行手性拆分后发现, 对于重组IDO1酶R构型异构体(IC50 = 0.12 μmol·L-1) 抑制活性远远高于S构型(IC50 = 54 μmol·L-1), 但在HeLa细胞IDO1活性检测实验中, R构型(IC50 = 1 μmol·L-1) 与S构型(IC50 = 13 μmol·L-1) 的抑制活性差异较小, 这可能是因为在细胞测定条件下, 与羰基相邻的手性碳可以快速烯醇互变产生外消旋化, 因此选用外消旋混合物进行后续研究。PF-06840003在临床前研究中对IDO1具有高选择性, 目前PF-06840003作为治疗恶性胶质瘤药物已经进入Ⅰ期临床研究(NCT02764151)[33]。
Brassinin (化合物6, 图 3) 是植物来源的含有吲哚母核的天然产物, 研究发现Brassinin (Ki = 27.9 μmol·L-1) 及其衍生物5-溴-Brassinin (Ki = 24.5 μmol·L-1, 化合物7, 图 3) 具有IDO1的抑制活性, 这两种化合物与化疗药物联合使用均可以抑制小鼠肿瘤细胞生长。此外, 单独用5-溴-Brassinin给药治疗可高度抑制黑色素瘤的生长[34]。
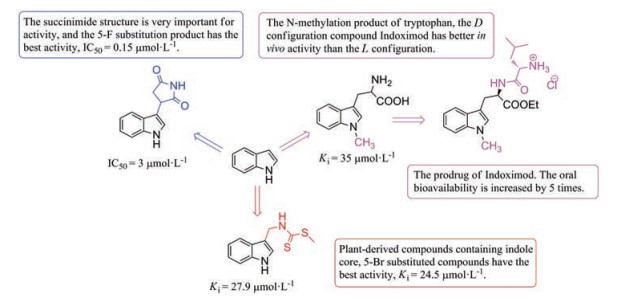
由于吲哚类IDO1抑制剂与色氨酸具有相同的母核, 其在体内的结合和代谢情况也与色氨酸最为接近, 因此, 它是研究最为广泛的一类IDO1抑制剂。该类型IDO1抑制剂主要是对吲哚侧链进行结构修饰, 改变连接侧链的结构类型、长度或引入不同的环系结构稳定构象。在苯环的结构改造中多为引入小的取代基, 其中多数化合物在5位引入卤素能够提高活性。另外, 吲哚的母核对维持活性至关重要, 用其他环系替代得到的化合物多数均丧失活性(图 4)。目前, 吲哚类IDO1抑制剂多数活性均处于微摩尔水平, 它的活性水平仍具有较大的进步空间, 这也是该结构类型的IDO1抑制剂研究广泛的另一个重要原因。
|
Figure 4 The structure activity information of indole IDO1 inhibitors |
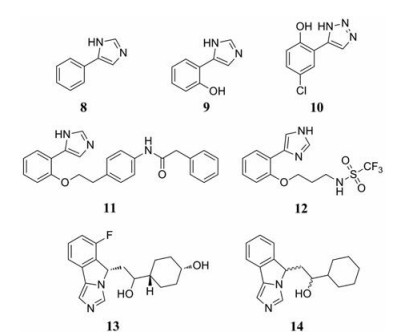
1989年, Sono等[35]研究发现4-PI (IC50 = 48 μmol·L-1, 化合物8, 图 5) 是一种较弱的非竞争性IDO1抑制剂。对4-PI进行构效关系研究发现: ①咪唑上1位N-H与血红素结合, 不能被其他基团取代。②在苯环2位引入-OH的化合物9 (IC50 = 4.8 μmol·L-1, 图 5) 活性最好, 在苯环的邻、间、对位引入-SH都可以提高活性, 且间位(IC50 = 7.6 μmol·L-1) > 对位(IC50 = 7.7 μmol·L-1) > 邻位(IC50 = 25 μmol·L-1)。③用吡啶、噻唑、吡唑、呋喃替换4-PI中的咪唑均不能使活性有明显提升, 仅当吡唑化合物的苯环上存在-OH时, 活性才比4-PI稍有提高[36]。三氮唑也可以用于替换4-PI中的咪唑基团, 且分子对接结果提示这类化合物苯环上的取代基倾向于小体积基团[37]。之后人们对三氮唑类化合物进行结构优化, 得到了低细胞毒性的MMG-0358 (化合物10, 图 5), 其酶抑制活性(IC50 = 0.33 μmol·L-1) 和细胞活性(IC50 = 0.08 μmol·L-1) 均得到提高[38]。为了充分利用IDO1的B口袋, 2011年NewLink公司公开了一系列含醚侧链的如化合物11 (IC50 < 1 μmol·L-1, 图 5)[39]。本课题组也对含醚侧链进行修饰, 引入极性基团得到了化合物12 (IC50 = 0.3 μmol·L-1, 图 5), 在ICR小鼠实验中(30 kg·mg-1), 化合物12的半衰期为4.6 h, 口服生物利用度为96%[40]。
|
Figure 5 The structure of aryl imidazole IDO1 inhibitors |
此外, NewLink公司公开了一系列三环类化合物, 将4-PI结构中的苯环和咪唑通过一个五元环连接在一起, 其中最具代表性的是Navoximod (NLG919, Ki = 7 nmol·L-1, 化合物13, 图 5), 它的口服生物利用度大于70%, 单次口服Navoximod可使血浆和组织中犬尿氨酸浓度降低50%[41]。与PD-L1抑制剂(Atezolizumab)联合使用的晚期实体瘤Ⅰ期临床结果显示, 其安全性、耐受性和药代动力学性质良好[42]。2016年, Navoximod的类似物(化合物14, IC50=38 nmol·L-1, 图 5) 与IDO1的晶体结构被报道(PDB code: 5EK3)[43], 共晶结果显示咪唑上N原子与血红素配位, 咪唑并异吲哚母核位于A口袋, 环己基部分延伸至B口袋, 并与周围的氨基酸残基相互作用。血红素7-丙酸与化合物14的-OH和Ala264上的-NH形成两个分子间氢键, 异吲哚上的N原子与化合物14上的-OH形成分子内氢键。化合物14含有2个手性中心, 共有4个异构体, 为了研究它们与IDO1结合的优势结构, 将这4个异构体构建到电子密度图中, 结果表明咪唑异吲哚环5位碳为S构型的两个异构体正确适合密度图, 并且与IDO1具有几乎相同的相互作用, 这也与它们的生物活性分析结果一致。
芳基咪唑类IDO1抑制剂多是利用4-PI与IDO1的晶体结构, 通过合理的药效团设计得到的(图 6)。该类型化合物的母核是通过电子等排体或环合得到的芳基含N杂环, 并且N杂环中的N负责结合血红素。另外, 氢键的形成有利于提高IDO1活性。通过对接结果显示: 利用B口袋的结构特点, 引入合适体积的含醚侧链也是该类型IDO1抑制剂设计的关键。

|
Figure 6 The structure activity information of aryl imidazole IDO1 inhibitors |
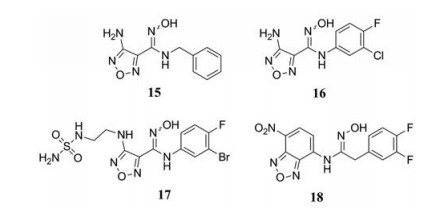
Incyte公司通过高通量筛选得到含有N-羟基脒结构的化合物15 (图 7), 具有微摩尔IDO1抑制活性(IC50 = 1 μmol·L-1), 是一种IDO1竞争性抑制剂(Ki = 1.5 μmol·L-1), 其相对分子质量小(MW = 233)、配体效率良好(LE = 0.49)、结直肠癌细胞Caco-2渗透性好(3.9×10-5 cm·s-1)。构效关系表明(图 4): ① N-羟基脒结构是这类化合物维持活性的关键, 用甲氧基替换羟基或者将羟胺用S、O替换, 活性会降低。②在苯环的间位增加卤素或较小的烷基, 活性会增强。③苄基用苯基取代活性提高。这些结构中化合物16活性最好(IC50 = 67 nmol·L-1, 图 7), 在小鼠实验中可以使血浆中犬尿氨酸降低 > 50%。但化合物16的口服生物利用度较差, 半衰期短(t1/2 < 0.5 h), 需要皮下给药[44]。为了改善药代性质, 科研人员在噁二唑环的氨基上引入了一系列极性侧链, 最终得到了候选药物化合物17 (Epacadosat, INCB024360, IC50 = 72 nmol·L-1, 图 7)[45]。
|
Figure 7 The structures of N-hydroxyamidine IDO1 inhibitors |
2017年, Epacadostat与IDO1的晶体结构被报道(PDB code: 5WN8), 共晶结果显示: Epacadostat羟基脒既可以与血红素中铁离子络合, 又可以与Ala264的N-H形成氢键, 同时羟肟上的氧与苯环上的N-H、肟上的氮与噁二唑环上的N-H形成分子内氢键。苯环位于A口袋, 噁二唑环及极性侧链伸入B口袋, 磺酰胺基团的氧原子与Arg231形成氢键[46]。Epacadostat是目前处于临床试验最多的IDO1抑制剂, 可以用于多种癌症的治疗。然而, 2018年4月, Epacadostat与PD-1单抗Pembrolizumab联合治疗转移性黑色素瘤的Ⅲ期临床试验(ECHO-301/KEYNOTE-252) 宣告失败, ECHO-301临床失败原因尚无明确解释, 可能原因有以下几点: ① Epacadosat的药代动力学实验是基于血浆而非肿瘤中犬尿氨酸的含量进行的, 因此Epacadosat给药剂量是否足够存在争议。② IDO1选择性阻断策略可能会在晚期癌症患者中产生耐药性[47]。③在临床实验设计上随着入组患者数量增加, 入组个体差异也可能对药物疗效产生影响[48]。④目前人们对IDO1的生物功能和肿瘤免疫治疗机制尚需更加深入的探索[49]。此外, Paul等[50]报道了一系列含硝基苯并噁二唑环结构的N-羟基脒类IDO1抑制剂, 如化合物18 (IDO1, IC50 = 59 nmol·L-1, TDO, IC50 = 94 μmol·L-1, 图 7), 配体效率为0.405, 在人乳腺癌细胞MDAMB-231中的细胞活性达到了10-8摩尔级(IC50 = 50 nmol·L-1), 是高选择的IDO1竞争性抑制剂。
羟基脒结构是该类型IDO1抑制剂保持活性的关键基团, 它与血红素络合, 被其他基团替换后活性明显下降。通过对多个该类型化合物的构效关系研究发现, 苯环上间、对位双卤素取代能够提高活性。噁二唑氨基上引入极性侧链, 可减少羟基脒结构通过葡萄糖醛酸化被代谢, 从而提高口服生物利用度。另外, 噁二唑环非必需基团, 可以被其他环系结构替代(图 8)。虽然ECHO-301/KEYNOTE-252临床试验失败, 但是该类型的化合物对于研究IDO1靶点依然具有重要意义。
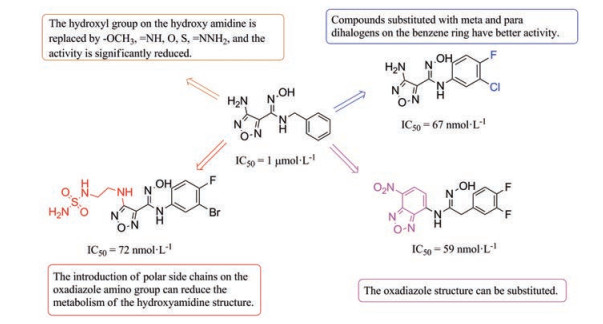
|
Figure 8 The structure activity information of N-hydroxyamidine IDO1 inhibitors |
2006年, 从海洋水蛭虫Garveia annulata的代谢产物中分离出的几种天然产物都具有很强的IDO1抑制活性, 它们都具有萘醌结构, 其中Annulins B (化合物19, 图 9) IDO1抑制活性最强(Ki = 0.12 μmol·L-1)[51]。随后, 研究人员对含有醌结构的化合物进行了IDO1活性的筛选, 发现1, 2-或1, 4-萘醌结构是维持IDO1活性所必需基团[52], 其中甲萘醌(IC50 = 1.1 μmol·L-1, 化合物20, 图 9) 作为一种已知的抗癌药, 与IDO1抑制剂在临床上具有相似的用途[53]。从美国国家癌症研究所提供的2800个潜在抑制剂中筛选得到了对IDO1/TDO均有抑制作用的NSC26326 (β-lapachone, 化合物21, 图 9), 它是一种天然存在的1, 2-萘醌类化合物, 可以从lapacho树中分离出来。NSC26326可以影响胰腺癌、乳腺癌、结肠癌、肺癌等癌细胞的存活率, 其IC50值在1~4 μmol·L-1 [54]。Carvalho等[55]合成了一系列苯并呋喃醌衍生物, 构效关系表明: ①苯并呋喃醌母核5或6位甲氧基取代并且3位有-CH2OH、-CH2OCH3或-CH2OAr基团的化合物IDO1活性较高如化合物22 (IC50 = 0.24 μmol·L-1, 图 9)。②在3位引入吸电子的酯基或者羧酸基团活性下降。③在杂环醌的改造中发现苯并咪唑醌的活性与苯并呋喃相当, 如化合物23 (IC50 = 0. 25μmol·L-1, 图 9)。
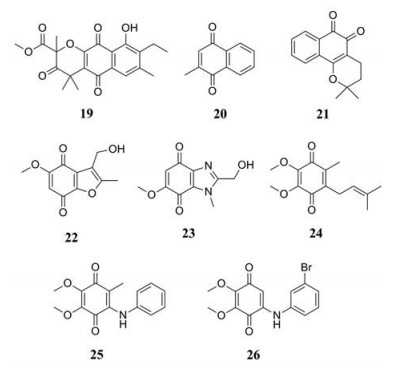
|
Figure 9 The structures of quinone IDO1 inhibitors |
辅酶Q1 (化合物24, 图 9) 是生物体内存在的一种含有对苯醌结构的脂溶性化合物, 在一项研究中发现辅酶Q1在酶水平具有IDO1活性, 其IC50值为1.3 μmol·L-1。根据对接结果显示(PDB code: 5XE1): 辅酶Q1的羰基氧原子与血红素中铁离子配位, 苯醌环与Phe163形成π-π相互作用。但是, 辅酶Q1的异烯丙基不能与疏水口袋A结合, 因此, 异烯丙基是一个可改造的位点。对其结构进行改造, 得到了活性较好的泛醌衍生物25 (IC50 = 0.7 μmol·L-1, 图 9), 其对接结果显示苯胺部分无法伸入到A口袋中, 很可能是由于甲基和苯胺部分的空间位阻使其无法进入狭窄的A口袋。另外, 很多研究表明卤代芳族化合物可以很好地结合A口袋, 最终得到了化合物26 (IC50 = 0.13 μmol·L-1, 图 9)。对接结果显示, Cys129上硫原子和化合物26上溴原子之间的相互作用可能对IDO1活性至关重要, 将溴原子换成氟或者氯活性减弱, 这可能是由于氟和氯的电负性弱, 与硫形成的相互作用没有溴强[56]。
醌类IDO1抑制剂主要是通过对天然产物活性筛选得到的, 因此该类抑制剂结构较为复杂、变化多样, 但许多该类化合物都具有1, 2-或1, 4-萘醌结构(图 10)。虽然有许多醌类结构的IDO1抑制剂被报道, 但目前这系列抑制剂尚未有化合物进入临床研究阶段。
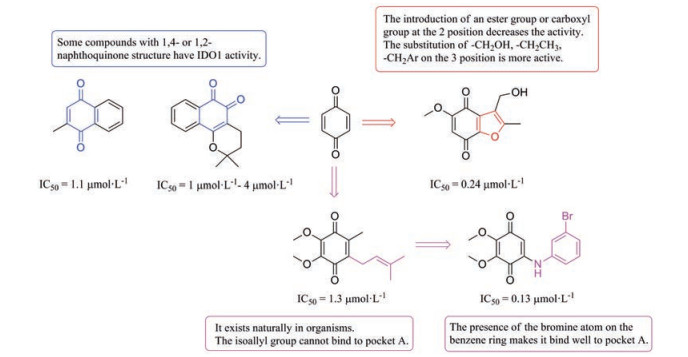
|
Figure 10 The structure activity information of quinone IDO1 inhibitors |
BMS-986205 (Linrodostat, 化合物27, 图 11) 是一种新型的IDO1选择性抑制剂, 由Bristol-Myers Squibb公司开发。在临床前研究中, BMS-986205在HEK293细胞中抑制IDO1的IC50值为1.1 nmol·L-1, 而对TDO没有抑制作用。2017年报道的BMS-986205单独或联合nivolumab使用治疗晚期癌症的Ⅰ/Ⅱ期临床研究结果显示, BMS-986205可每日一次口服给药, 在25 mg·d-1的剂量下, 肿瘤内的犬尿氨酸含量减少了90%[57]。然而在ECHO-301阴性结果发布后, BMS-986205与PD-1单抗nivolumab联合治疗头颈鳞癌的2项Ⅲ期临床试验和1项针对非小细胞肺癌的Ⅲ期临床试验被终止(NCT03386838, NCT03417037)。2018年, 氰基取代的BMS-116 (IC50 < 100 nmol·L-1, 化合物28, 图 11) 与IDO1的共晶结构被报道(PDB code: 6AZW), 值得关注的是BMS-116与不含亚铁血红素的IDO1结合, 这种独特的结合模式在其他类型的IDO1抑制剂中从未发现。氰基取代的苯环位于A口袋, 酰胺上的-NH与Ser167上-OH形成氢键, 环己基的连接作用使喹啉环处于由Phe270、Phe214、His 346和Arg 343形成的口袋中, 另外喹啉环上的N原子与Arg343上-NH形成氢键[58]。
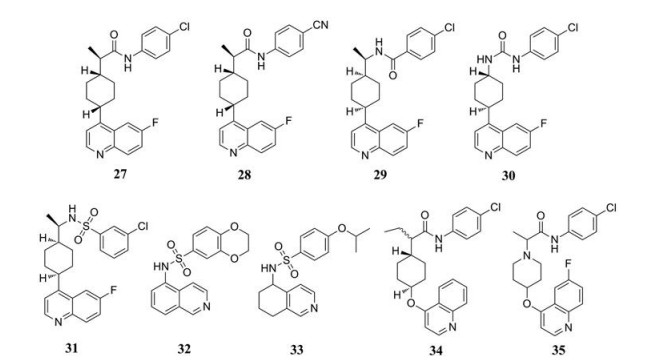
|
Figure 11 The structures of quinoline IDO1 inhibitors |
该类抑制剂多数是专利化合物, 并没有给出明确的活性数据, 该类化合物结构特点可以总结出以下几点规律(图 12): ①酰胺键替换成反转的酰胺键(化合物29, 图 11)、脲基(化合物30, 图 11)、反转的磺酰胺基(化合物31, 图 11) 后, 它们在HEK293细胞分析中均显示出对IDO1的有效抑制作用(IC50 < 50 nmol·L-1), 化合物31中的3-氯苯基比相应的4-氯苯基磺酰胺活性更好[59]。② 4-取代的异喹啉化合物32 (含酰胺或磺酰胺结构, 图 11) 具有IDO1/TDO活性, 而六氢喹啉衍生物33 (图 11) 显示出更高的IDO1抑制活性[60]。③以4-羟基环己烷(化合物34, IC50 < 250 nmol·L-1, 图 11) 替代环己烷活性下降, 4-羟基哌啶(化合物35, IC50 < 50 nmol·L-1, 图 11) 替代环己烷可以保持活性[61]。该类型抑制剂独特的结合模式, 为人们设计更多结构新颖的IDO1抑制剂提供了新思路。
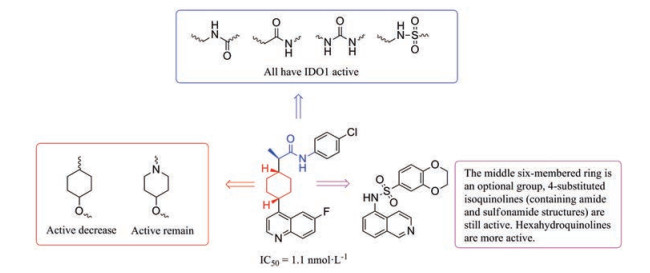
|
Figure 12 The structure activity information of quinoline IDO1 inhibitors |
除上述几类主要的抑制剂外, 还有许多其他结构IDO1抑制剂被报道。Cheng等[62]通过高通量筛选发现具有苯磺酰肼结构的化合物36具有IDO1抑制活性(IC50 = 167 nmol·L-1, 图 13), 但它在细胞水平却没有活性。为了提高细胞渗透性, 改造后得到了化合物37 (IDO1, IC50 = 61 nmol·L-1, HeLa EC50 = 172 nmol·L-1, 图 13), 将化合物37与IDO1 (PDB code: 2D0T) 对接结果显示: 砜结构中的一个氧原子与血红素配位, 另一个氧原子与Ala264主链上的N-H形成氢键, 羧基上的氧与Cys129的-SH形成氢键。然而, 化合物37在大鼠血浆中5分钟内降解80%。为了改善体内代谢性质, 进一步优化得到了化合物38 (IDO1, IC50 = 36 nmol·L-1, HeLa EC50 = 68 nmol·L-1, 图 13), 在大鼠中的口服生物利用度为59%, 血浆和肿瘤组织中的Kyn/Trp比分别降低42%和83%[63]。安进公司高通量筛选得到的Amg-1 (IC50 = 3μmol·L-1, 化合物39, 图 13), 是一种高效可逆的IDO1抑制剂, 其选择性是IDO2的80倍, TDO的30倍。Amg-1与IDO1 (PDB code: 4PK5) 共晶结果显示, 它可以直接与IDO1的B口袋相互作用, 并且表现出明显的诱导契合效应[64]。在对色胺酮类进行结构修饰中发现化合物40具有较强的IDO1抑制活性(IC50 = 0.534 μmol·L-1, 图 13), 并促进T细胞增殖, 构效关系显示色胺酮8位上的吸电子基团是保持IDO1活性所必需的[65]。
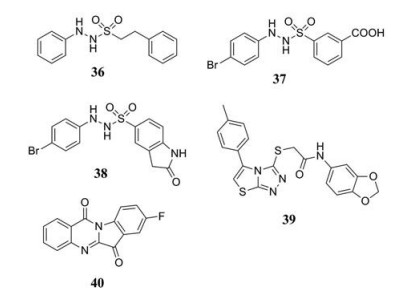
|
Figure 13 The structures of other IDO1 inhibitors |
IDO1介导多种免疫调节过程, 例如Treg细胞分化和激活, 抑制T细胞免疫反应和DC细胞功能, 从而削弱癌细胞的免疫识别能力并促进肿瘤生长。因此, IDO1是一个潜在的肿瘤免疫治疗药物靶标。在过去的20多年, 人们通过高通量筛选、天然产物结构修饰、基于结构的药物设计等方式发现了多种骨架的IDO1抑制剂, 并且多个候选药物已经进入临床研究阶段, 如Indoximod、PF-06840003、Navoximod、Epacadostat、Linrodostat。虽然ECHO-301项目失败, 但这并不代表IDO1靶点不具有成药性。从中总结经验教训, 加强机制研究, 合理设计实验, 避免类似事情再次发生。相信随着研究方法和检测技术的进步, 更多IDO1的作用机制被阐明, 一定会有更多结构新颖、疗效好、毒副作用小的IDO1抑制被设计出来, 为肿瘤免疫治疗带来新突破。
作者贡献: 王婷撰写论文初稿, 文辉、崔华清和尹大力修改论文并定稿。
利益冲突: 本文无相关利益冲突。
| [1] |
Farkona S, Diamandis EP, Blasutig IM. Cancer immunotherapy: the beginning of the end of cancer?[J]. BMC Med, 2016, 14: 1-18. DOI:10.1186/s12916-015-0545-7 |
| [2] |
Serafini M, Torre E, Aprile S, et al. Discovery of highly potent benzimidazole derivatives as indoleamine 2, 3-dioxygenase-1(IDO1) inhibitors: from structure-based virtual screening to in vivo pharmacodynamic activity[J]. J Med Chem, 2020, 63: 3047-3065. DOI:10.1021/acs.jmedchem.9b01809 |
| [3] |
Coletti A, Greco FA, Dolciami D, et al. Advances in indoleamine 2, 3-dioxygenase 1 medicinal chemistry[J]. MedChemComm, 2017, 8: 1378-1392. DOI:10.1039/C7MD00109F |
| [4] |
Takikawa O. Biochemical and medical aspects of the indoleamine 2, 3-dioxygenase-initiated L-tryptophan metabolism[J]. Biochem Biophys Res Commun, 2005, 338: 12-19. DOI:10.1016/j.bbrc.2005.09.032 |
| [5] |
Qin Y, Wang N, Zhang X, et al. IDO and TDO as a potential therapeutic target in different types of depression[J]. Metab Brain Dis, 2018, 33: 1787-1800. DOI:10.1007/s11011-018-0290-7 |
| [6] |
Bryleva EY, Brundin L. Kynurenine pathway metabolites and suicidality[J]. Neuropharmacology, 2017, 112: 324-330. DOI:10.1016/j.neuropharm.2016.01.034 |
| [7] |
Chen Y, Guillemin GJ. Kynurenine pathway metabolites in humans: disease and healthy states[J]. Int J Tryptophan Res, 2009, 2: 1-19. |
| [8] |
Brochez L, Chevolet I, Kruse V. The rationale of indoleamine 2, 3-dioxygenase inhibition for cancer therapy[J]. Eur J Cancer, 2017, 76: 167-182. DOI:10.1016/j.ejca.2017.01.011 |
| [9] |
Wang XX, Sun SY, Dong QQ, et al. Recent advances in the discovery of indoleamine 2, 3-dioxygenase 1(IDO1) inhibitors[J]. MedChemComm, 2019, 10: 1740-1754. DOI:10.1039/C9MD00208A |
| [10] |
Aitken JB, Austin CJD, Hunt NH, et al. The Fe-heme structure of met-indoleamine 2, 3-dioxygenase-2 determined by X-ray absorption fine structure[J]. Biochem Biophys Res Commun, 2014, 450: 25-29. DOI:10.1016/j.bbrc.2014.05.054 |
| [11] |
Pantouris G, Serys M, Yuasa HJ, et al. Human indoleamine 2, 3-dioxygenase-2 has substrate specificity and inhibition characteristics distinct from those of indoleamine 2, 3-dioxygenase-1[J]. Amino Acids, 2014, 46: 2155-2163. DOI:10.1007/s00726-014-1766-3 |
| [12] |
Yu CP, Pan ZZ, Luo DY. TDO as a therapeutic target in brain diseases[J]. Metab Brain Dis, 2016, 31: 737-747. DOI:10.1007/s11011-016-9824-z |
| [13] |
Zhai L, Ladomersky E, Lenzen A, et al. IDO1 in cancer: a Gemini of immune checkpoints[J]. Cell Mol Immunol, 2018, 15: 447-457. DOI:10.1038/cmi.2017.143 |
| [14] |
Sugimoto H, Oda S, Otsuki T, et al. Crystal structure of human indoleamine 2, 3-dioxygenase: catalytic mechanism of O2 incorporation by a heme-containing dioxygenase[J]. Proc Natl Acad Sci U S A, 2006, 103: 2611-2616. DOI:10.1073/pnas.0508996103 |
| [15] |
Dolušić E, Larrieu P, Blanc S, et al. Discovery and preliminary SARs of keto-indoles as novel indoleamine 2, 3-dioxygenase (IDO) inhibitors[J]. Eur J Med Chem, 2011, 46: 3058-3065. DOI:10.1016/j.ejmech.2011.02.049 |
| [16] |
Wu Y, Xu T, Liu J, et al. Structural insights into the binding mechanism of IDO1 with hydroxylamidine based inhibitor INCB14943[J]. Biochem Biophys Res Commun, 2017, 487: 339-343. DOI:10.1016/j.bbrc.2017.04.061 |
| [17] |
Hornyák L, Dobos N, Koncz G, et al. The role of indoleamine-2, 3-dioxygenase in cancer development, diagnostics, and therapy[J]. Front Immunol, 2018, 9: 151. DOI:10.3389/fimmu.2018.00151 |
| [18] |
Lee GK, Park HJ, Macleod M, et al. Tryptophan deprivation sensitizes activated T cells to apoptosis prior to cell division[J]. Immunology, 2002, 107: 452-460. DOI:10.1046/j.1365-2567.2002.01526.x |
| [19] |
Moon YW, Hajjar J, Hwu P, et al. Targeting the indoleamine 2, 3-dioxygenase pathway in cancer[J]. J Immunother Cancer, 2015, 3: 51. DOI:10.1186/s40425-015-0094-9 |
| [20] |
Sonner JK, Deumelandt K, Ott M, et al. The stress kinase GCN2 does not mediate suppression of antitumor T cell responses by tryptophan catabolism in experimental melanomas[J]. Oncoimmunology, 2016, 5: e1240858. DOI:10.1080/2162402X.2016.1240858 |
| [21] |
Opitz CA, Litzenburger UM, Sahm F, et al. An endogenous tumour-promoting ligand of the human aryl hydrocarbon receptor[J]. Nature, 2011, 478: 197-203. DOI:10.1038/nature10491 |
| [22] |
Mezrich JD, Fechner JH, Zhang X, et al. An interaction between kynurenine and the aryl hydrocarbon receptor can generate regulatory T cells[J]. J Immunol, 2010, 185: 3190-3198. DOI:10.4049/jimmunol.0903670 |
| [23] |
Zhang XY, Cui GN, Xu BL. The research progress of indoleamine 2, 3-dioxygenase 1(IDO1) inhibitors[J]. Acta Pharm Sin (药学学报), 2018, 53: 1784-1796. |
| [24] |
Cady SG, Sono M. 1-Methyl-dl-tryptophan, β-(3-benzofuranyl)-dl-alanine (the oxygen analog of tryptophan), and β-[3-benzo (b) thienyl]-dl-alanine (the sulfur analog of tryptophan) are competitive inhibitors for indoleamine 2, 3-dioxygenase[J]. Arch Biochem Biophys, 1991, 291: 326-333. DOI:10.1016/0003-9861(91)90142-6 |
| [25] |
Muller AJ, DuHadaway JB, Donover PS, et al. Inhibition of indoleamine 2, 3-dioxygenase, an immunoregulatory target of the cancer suppression gene Bin1, potentiates cancer chemotherapy[J]. Nat Med, 2005, 11: 312-319. DOI:10.1038/nm1196 |
| [26] |
Hou DY, Muller AJ, Sharma MD, et al. Inhibition of indoleamine 2, 3-dioxygenase in dendritic cells by stereoisomers of 1-methyl-tryptophan correlates with antitumor responses[J]. Cancer Res, 2007, 67: 792-801. DOI:10.1158/0008-5472.CAN-06-2925 |
| [27] |
Soliman H, Khambati F, Han HS, et al. A phase-1/2 study of adenovirus-p53 transduced dendritic cell vaccine in combination with indoximod in metastatic solid tumors and invasive breast cancer[J]. Oncotarget, 2018, 9: 10110. DOI:10.18632/oncotarget.24118 |
| [28] |
Bahary N, Garrido-Laguna I, Cinar P, et al. Phase 2 trial of the indoleamine 2, 3-dioxygenase pathway (IDO) inhibitor indoximod plus gemcitabine/nab-paclitaxel for the treatment of metastatic pancreas cancer: interim analysis[J]. J Clin Oncol, 2016, 34: 3020. DOI:10.1200/JCO.2016.34.15_suppl.3020 |
| [29] |
Johnson DB, Bordeaux J, Kim JY, et al. Quantitative spatial profiling of PD-1/PD-L1 interaction and HLA-DR/IDO-1 predicts improved outcomes of anti-PD-1 therapies in metastatic melanoma[J]. Clin Cancer Res, 2018, 24: 5250-5260. |
| [30] |
Huang TT, Yen MC, Lin CC, et al. Skin delivery of short hairpin RNA of indoleamine 2, 3-dioxygenase induces antitumor immunity against orthotopic and metastatic liver cancer[J]. Cancer Sci, 2011, 102: 2214-2220. DOI:10.1111/j.1349-7006.2011.02094.x |
| [31] |
Kumar S, Jaipuri FA, Waldo JP, et al. Discovery of indoximod prodrugs and characterization of clinical candidate NLG802[J]. Eur J Med Chem, 2020, 198: 112373. DOI:10.1016/j.ejmech.2020.112373 |
| [32] |
Crosignani S, Bingham P, Bottemanne P, et al. Discovery of a novel and selective indoleamine 2, 3-dioxygenase (IDO-1) inhibitor 3-(5-fluoro-1H-indol-3-yl) pyrrolidine-2, 5-dione (EOS200271/PF-06840003) and its characterization as a potential clinical candidate[J]. J Med Chem, 2017, 60: 9617-9629. DOI:10.1021/acs.jmedchem.7b00974 |
| [33] |
Reardon DA, Desjardins A, Rixe O, et al. A phase 1 study of PF-06840003, an oral indoleamine 2, 3-dioxygenase 1(IDO1) inhibitor in patients with recurrent malignant glioma[J]. Invest New Drugs, 2020, 2. DOI:10.1007/s10637-020-00950-1 |
| [34] |
Banerjee T, Duhadaway JB, Gaspari P, et al. A key in vivo anti+tumor mechanism of action of natural product-based brassinins is inhibition of indoleamine 2, 3-dioxygenase[J]. Oncogene, 2008, 27: 2851-2857. DOI:10.1038/sj.onc.1210939 |
| [35] |
Sono M, Cady SG. Enzyme kinetic and spectroscopic studies of inhibitor and effector interactions with indoleamine 2, 3-dioxygenase. 1. Norharman and 4-phenylimidazole binding to the enzyme as inhibitors and heme ligands[J]. Biochemistry, 5392-5399. |
| [36] |
Kumar S, Jaller D, Patel B, et al. Structure based development of phenylimidazole-derived inhibitors of indoleamine 2, 3-dioxygenase[J]. J Med Chem, 2008, 51: 4968-4977. DOI:10.1021/jm800512z |
| [37] |
Huang Q, Zheng M, Yang S, et al. Structure-activity relationship and enzyme kinetic studies on 4-aryl-1H-1, 2, 3-triazoles as indoleamine 2, 3-dioxygenase (IDO) inhibitors[J]. Eur J Med Chem, 2011, 46: 5680-5687. DOI:10.1016/j.ejmech.2011.08.044 |
| [38] |
Röhrig UF, Majjigapu SR, Grosdidier A, et al. Rational design of 4-aryl-1, 2, 3-triazoles for indoleamine 2, 3-dioxygenase 1 inhibition[J]. J Med Chem, 2012, 55: 5270-5290. DOI:10.1021/jm300260v |
| [39] |
Mautino M, Kumar S, Jaipuri F, et al. Imidazole derivatives as IDOinhibitors: WO, 2011056652[P]. 2011-05-12.
|
| [40] |
Wen H, Liu YK, Wang SF, et al. Design and synthesis of indoleamine 2, 3-dioxygenase 1 inhibitors and evaluation of their use as anti-tumor agents[J]. Molecules, 2019, 24: 2124. DOI:10.3390/molecules24112124 |
| [41] |
Mautino MR, Jaipuri FA, Waldo J, et al. NLG919, a novel indoleamine-2, 3-dioxygenase (IDO)-pathway inhibitor drug candidate for cancer therapy[J]. Cancer Res, 2013, 73: 491. |
| [42] |
Jung KH, LoRusso P, Burris H, et al. Phase I study of the indoleamine 2, 3-dioxygenase 1(IDO1) inhibitor navoximod (GDC-0919) administered with PD-L1 inhibitor (atezolizumab) in advanced solid tumors[J]. Clin Cancer Res, 2019, 25: 3220-3228. DOI:10.1158/1078-0432.CCR-18-2740 |
| [43] |
Peng YH, Ueng SH, Tseng CT, et al. Important hydrogen bond networks in indoleamine 2, 3-dioxygenase 1(IDO1) inhibitor design revealed by crystal structures of imidazoleisoindole derivatives with IDO1[J]. J Med Chem, 2016, 59: 282-293. DOI:10.1021/acs.jmedchem.5b01390 |
| [44] |
Yue EW, Douty B, Wayland B, et al. Discovery of potent competitive inhibitors of indoleamine 2, 3-dioxygenase with in vivo pharmacodynamic activity and efficacy in a mouse melanoma model[J]. J Med Chem, 2009, 52: 7364-7367. DOI:10.1021/jm900518f |
| [45] |
Yue EW, Sparks R, Polam P, et al. INCB24360(Epacadostat), a highly potent and selective indoleamine-2, 3-dioxygenase 1(IDO1) inhibitor for immuno-oncology[J]. ACS Med Chem Lett, 2017, 8: 486-491. DOI:10.1021/acsmedchemlett.6b00391 |
| [46] |
Lewis-Ballester A, Pham KN, Batabyal D, et al. Structural insights into substrate and inhibitor binding sites in human indoleamine 2, 3-dioxygenase 1[J]. Nat Commun, 2017, 8: 1-8. DOI:10.1038/s41467-016-0009-6 |
| [47] |
Muller AJ, Manfredi MG, Zakharia Y, et al. Inhibiting IDO pathways to treat cancer: lessons from the ECHO-301 trial and beyond[C]//Seminars in immunopathology. Springer Berlin Heidelberg, 2019, 41: 41-48.
|
| [48] |
Cao L, Zhang Y. Research progress of indoleamine 2, 3-dioxygenase 1 inhibitors in the treatment of malignant tumors[J]. Curr Immunol (现代免疫学), 2020, 40: 147-152. |
| [49] |
Ye K, Qiu YT, Zhang WH, et al. Research advances of indoleamine 2, 3-dioxygenase-1 and its inhibitors[J]. Prog Pharm Sci (药学进展), 2019, 43: 483-503. |
| [50] |
Paul S, Roy A, Deka SJ, et al. Nitrobenzofurazan derivatives of N'-hydroxyamidines as potent inhibitors of indoleamine-2, 3-dioxygenase 1[J]. Eur J Med Chem, 2016, 121: 364-375. DOI:10.1016/j.ejmech.2016.05.061 |
| [51] |
Pereira A, Vottero E, Roberge M, et al. Indoleamine 2, 3-dioxygenase inhibitors from the northeastern Pacific marine hydroid Garveia annulata[J]. J Nat Prod, 2006, 69: 1496-1499. DOI:10.1021/np060111x |
| [52] |
Kumar S, Malachowski WP, DuHadaway JB, et al. Indoleamine 2, 3-dioxygenase is the anticancer target for a novel series of potent naphthoquinone-based inhibitors[J]. J Med Chem, 2008, 51: 1706-1718. DOI:10.1021/jm7014155 |
| [53] |
Plaza SM. The anticancer effects of vitamin K[J]. Altern Med Rev, 2003, 8: 303-318. |
| [54] |
Pantouris G, Mowat CG. Antitumour agents as inhibitors of tryptophan 2, 3-dioxygenase[J]. Biochem Biophys Res Commun, 2014, 443: 28-31. DOI:10.1016/j.bbrc.2013.11.037 |
| [55] |
Carvalho C, Siegel D, Inman M, et al. Benzofuranquinones as inhibitors of indoleamine 2, 3-dioxygenase (IDO). Synthesis and biological evaluation[J]. Org Biomol Chem, 2014, 12: 2663-2674. DOI:10.1039/c3ob42258e |
| [56] |
Ding Y, Tang F, Xue X, et al. Rational design, synthesis and biological evaluation of ubiquinone derivatives as IDO1 inhibitors[J]. Bioorg Chem, 2019, 89: 102870. DOI:10.1016/j.bioorg.2019.03.044 |
| [57] |
Siu LL, Gelmon K, Chu Q, et al. Abstract CT116:BMS-986205, an optimized indoleamine 2, 3-dioxygenase 1(IDO1) inhibitor, is well tolerated with potent pharmacodynamic (PD) activity, alone and in combination with nivolumab (nivo) in advanced cancers in a phase 1/2a trial[J]. Cancer Res, 2017, 77: 116. |
| [58] |
Nelp MT, Kates PA, Hunt JT, et al. Immune-modulating enzyme indoleamine 2, 3-dioxygenase is effectively inhibited by targeting its apo-form[J]. Proc Natl Acad Sci U S A, 2018, 115: 3249-3254. DOI:10.1073/pnas.1719190115 |
| [59] |
Beck HP, Jaen JC, Osipov M, et al. Immunoregulatory agents: WO, 2016073774[P]. 2016-05-12.
|
| [60] |
Cowley P, Wise A. Inhibitors of tryptophan-2, 3-dioxygenase orindoleamine-2, 3-dioxygenase: WO, 2016071283[P]. 2016-05-12.
|
| [61] |
Beck HP, Jaen JC, Osipov M, et al. Immunoregulatory agents: WO, 2016073770[P]. 2016-05-12.
|
| [62] |
Cheng MF, Hung MS, Song JS, et al. Discovery and structure-activity relationships of phenyl benzenesulfonylhydrazides as novel indoleamine 2, 3-dioxygenase inhibitors[J]. Bioorg Med Chem Lett, 2014, 24: 3403-3406. DOI:10.1016/j.bmcl.2014.05.084 |
| [63] |
Lin SY, Yeh TK, Kuo CC, et al. Phenyl benzenesulfonylhydrazides exhibit selective indoleamine 2, 3-dioxygenase inhibition with potent in vivo pharmacodynamic activity and antitumor efficacy[J]. J Med Chem, 2016, 59: 419-430. DOI:10.1021/acs.jmedchem.5b01640 |
| [64] |
Meininger D, Zalameda L, Liu Y, et al. Purification and kinetic characterization of human indoleamine 2, 3-dioxygenases 1 and 2(IDO1 and IDO2) and discovery of selective IDO1 inhibitors[J]. Biochim Biophys Acta Proteins Proteomics, 2011, 1814: 1947-1954. DOI:10.1016/j.bbapap.2011.07.023 |
| [65] |
Yang S, Li X, Hu F, et al. Discovery of tryptanthrin derivatives as potent inhibitors of indoleamine 2, 3-dioxygenase with therapeutic activity in Lewis lung cancer (LLC) tumor-bearing mice[J]. J Med Chem, 2013, 56: 8321-8331. DOI:10.1021/jm401195n |
 2021, Vol. 56
2021, Vol. 56


