2. 中国医学科学院、北京协和医学院药物研究所, 天然药物活性物质与功能国家重点实验室, 北京 100050
2. State Key Laboratory of Bioactive Substance and Function of Natural Medicines, Institute of Materia Medica, Chinese Academy of Medical Sciences and Peking Union Medical College, Beijing 100050, China
神经病理性疼痛是一类严重的疾病, 世界上大约有5%的人口被该类疾病所困扰。由躯体感觉系统的损害或疾病导致的疼痛均称为神经病理性疼痛, 分为周围性和中枢性两种类型, 不同类型的疼痛具有相似或共同的发病机制。神经病理性疼痛诱因很常见, 病毒感染、缺血、外伤刺激、代谢性疾病和药物毒性等均可导致神经损伤, 进而诱导疼痛的发生。近年发现, 精神因素以及患者的心理状态也会影响神经病理性疼痛的发生。
神经病理性疼痛的临床症状和体征因人而异, 大多数人主诉为针刺感、持续的电击感和刺痛感。临床上诊断神经病理性疼痛的体征为不同感觉症状的共存, 即阴性体征和阳性体征。阴性体征表现为对伤害性和热刺激的感觉障碍, 阳性体征分为自发性疼痛和诱发性疼痛。自发性疼痛表现为不存在刺激的情况下, 机体仍感觉疼痛; 诱发性疼痛包括痛觉超敏(对非伤害性刺激产生伤害性反应) 和痛觉过敏(对伤害性刺激产生过强的伤害性反应), 有时会同时伴随抑郁、焦虑和紧张等精神症状[1]。
神经病理性疼痛因其发病率高、发病机制复杂、缺乏有效的治疗方法, 以及现有治疗药物的严重不良反应等, 使该类疾病难以得到根治。基于此, 本文将主要阐述神经病理性疼痛的发病机制、现有治疗神经病理性疼痛药物的有效性和局限性及新药发现现状, 旨在为该类疾病的药物发现研究提供依据。
1 神经病理性疼痛的发病机制神经病理性疼痛的发病机制复杂, 包括外周敏化、中枢敏化和中枢下行抑制性调控改变等。具体来说, 外周伤害性感受器接受物理、化学和各种机械刺激, 通过脊髓背角传到大脑, 此通路为伤害性信息的上行传导通路, 在大脑皮层形成痛感, 大脑皮层各种核团再通过调节下行通路来缓解疼痛(图 1)。
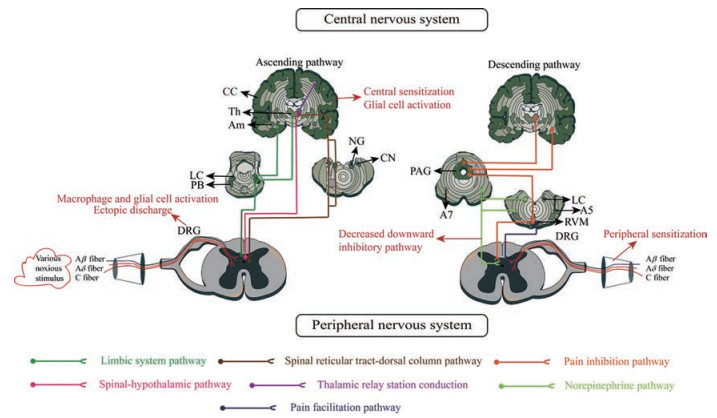
|
Figure 1 The main mechanisms of neuropathic pain. Various stimuli lead to nerve injury, which in turn triggers ectopic discharge and induces peripheral sensitization. The nociceptive information is transmitted into the spinal cord by A and C fibers, integrated by the neurons in the spinal cord. Pain information is projected to the thalamus through the limbic system pathway, spinal reticular tract-dorsal column pathway, and spinal-hypothaiamic pathway, and then projected to the cerebral cortex to perceive the location and intensity of pain. The descending pain information is projected from the amygdala and thalamus to the peri-aqueductal gray matter, causes the activation of the norepinephrine A5 and A7 nuclei and locus ceruleus, finally arrives at the ventro-medial medulla of the medulla. PB: Parabrachial nucleus; LC: Locus ceruleus; Am: Amygdala; Th: Thalamus; CC: Cerebral cortex; NG: Nucleus gracilis; CN: Cuneate nucleus; PAG: Periaqueductal gray matter; A5 and A7: Norepinephrine A5 and A7 nucleus; RVM: Rostro-ventral medial medulla; DRG: Dorsal root ganglion |
外周敏化[2]是指由于伤害性感受器异常兴奋或非神经细胞释放的炎性介质在受损组织中积聚, 导致伤害性感受器阈值降低, 被阈值以下的刺激激活, 放大伤害性反应的过程。外伤、感染和肿瘤浸润等刺激均可导致神经损伤, 继而触发异位放电或神经递质的释放, 最终引起周围神经病理性疼痛的产生。
外周伤害感受器的细胞体主要位于脊髓背根神经节(dorsal root ganglia, DRG), 分为A纤维和C纤维两种, 其中A纤维分为Aδ和Aβ。主要有3类受体(G蛋白偶联受体、离子型受体和酪氨酸激酶受体) 位于有髓Aδ纤维和无髓C纤维末端, 感受周围各种刺激如温度、神经肽、降钙素基因相关肽(calcitonin gene related protein, CGRP)、P物质以及各种炎性介质等的变化。
动作电位的产生依赖于电压门控钠通道, 当神经损伤后, 电压门控钠通道及钙通道表达和功能增强, 而调节动作电位复极的钾通道功能减弱。同时此过程中, 谷氨酸受体相关离子通道和酸敏感通道表达也增强。神经损伤后会诱发轴索横断和脱髓鞘等病理性改变, 触发受损的传入神经和未受损的邻近神经重塑, 传入神经末端出现新的突触。从本质上讲, 神经重塑导致神经元的放电阈值降低, 自发放电和重复刺激引起放电增加。同时, 外周非神经细胞如巨噬细胞等免疫细胞通过释放大量炎性介质如TNF-α (tumor necrosis factor-α)、IL-1β、神经生长因子和缓激肽等, 进一步促进外周敏化。
1.2 中枢敏化中枢敏化是指持续的伤害性信息通过有髓A纤维和无髓C纤维传入脊髓, 使脊髓水平兴奋性升高, 脊髓内神经元投射到丘脑和皮层, 导致投射到大脑皮层的疼痛信号放大。中枢敏化时, 外周伤害感受器对外周刺激阈值降低, 对阈上刺激反应增强, 产生自发活动。在正常生理性疼痛刺激下, 传入神经纤维末梢释放谷氨酸, 通过激活突触后离子型谷氨酸受体如N-甲基-D-天门冬胺酸受体(N-methyl-D-aspartic acid receptor, NMDA), 在脊髓背角神经元产生兴奋性突触后电位, 将疼痛信号传递到高级神经中枢。当神经受损时, 持续性的疼痛信号传入脊髓背角, 刺激突触前膜释放神经递质谷氨酸增加, 在炎症反应等作用下导致NMDA受体持续活化, 钙离子内流增加, 增加突触传递、膜兴奋性和细胞内的级联反应, 从而诱导突触长时程增强(long-term potentiation, LTP) 以及中枢敏化。
大量证据表明, 神经炎症也可促进中枢敏化的发生。神经炎症发生时, 激活脊髓和大脑的胶质细胞, 导致促炎症细胞因子和趋化因子的释放, 不但可诱导和维持中枢敏化, 同时还可通过中枢敏化驱动更广泛的疼痛产生[3]。研究表明, 神经损伤激活的胶质细胞主要是星形胶质细胞和小胶质细胞[4], 释放大量细胞因子和趋化因子, 通过调节神经递质受体如离子型谷氨酸受体、代谢型谷氨酸受体和γ-氨基丁酸受体(γ-aminobutyric acid receptor, GABA) 等, 增加兴奋性神经递质的释放并降低抑制性突触传递, 诱导中枢敏化, 产生痛觉过敏[5]。
1.3 下行抑制性调控改变痛觉信息投射到大脑皮层、丘脑及边缘区域后, 改变了导水管周围灰质到脑干的下行控制, 导致下行兴奋和抑制之间的不平衡, 产生疼痛。
脊髓背外侧束主要负责调控下行疼痛抑制通路, 包括从导水管周围灰质、延髓腹内侧髓质和蓝斑发出的下行通路, 其中导水管周围灰质和延髓腹内侧髓质之间存在的兴奋联系在疼痛调节中起着重要的作用[6]。疼痛可能伴随这些部位连通性、结构性和功能性的改变, 激活不同的大脑回路[7]。延髓腹内侧髓质是脑内重要的疼痛传感器, 具有双向调节疼痛的作用, 既可抑制疼痛又能促进疼痛。该处神经元具有异质性, 当接受刺激时, 一部分神经元表现为兴奋性增加, 一部分表现为兴奋性降低, 而一部分不发生改变, 表现为中性。而上述神经元的表现是由其内含有的多种核团决定的, 包括5-HT核团、中缝大核、GABA能核团和甘氨酸核团等, 这些核团将来自导水管周围灰质、丘脑、杏仁核、臂旁区域以及蓝斑等去甲肾上腺素能系统的信息进行整合并投射到脊髓背角和三叉神经节, 以调节神经元的活动。
总之, 神经病理性疼痛的发生过程中, 无论在外周还是中枢, 都有兴奋性的增加和抑制性的减少, 导致整个感觉系统处于过兴奋状态。
2 现有治疗疼痛药物及作用机制神经病理性疼痛一直是困扰人类的医学难题。目前一线治疗主要以抗抑郁药、抗癫痫药和加巴喷丁类药物为主; 曲马多和辣椒素被列为二线治疗药物; 强效阿片制剂和A型肉毒毒素被列为周围性神经病理性疼痛的三线治疗药物。其中有几种药物的主要适应症不是疼痛症状, 而是随后被发现具有镇痛特性, 故用于疼痛的治疗, 所以被归类为辅助性镇痛药。本部分将对上述药物作用机制及相关的药理学作用进行详细的阐述, 常见靶点和相关药物作用机制如图 2所示。
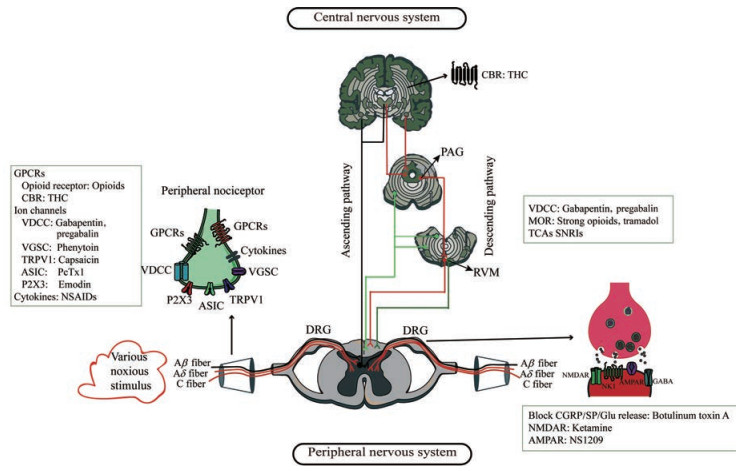
|
图 2 Diagram for therapeutic targets and drugs for neuropathic pain, including ion channel drugs, GPCR drugs, and NSAIDs, et al. Each drug in the box corresponds to its associated receptor. CBR: Cannabinoid receptor; THC: Tetrahydrocannabinol; VDCC: Voltage-gated calcium channel; VGSC: Voltage-gated sodium channel; TRPV1: Transient receptor potential V1 channels; ASIC: Acid-sensing family of ion channels; P2X3: Purinergic receptor P2X ligand-gated ion channel 3; MOR: µ-Opioid receptor; TCA: Tricyclic antidepressant; SNRI: Serotonin norepinephrine reuptake inhibitor; CGRP: Calcitonin gene related protein; SP: Substance P; Glu: Glutamate; NMDAR: N-Methyl-D-aspartic acid receptor; AMPAR: α-Amino-3-hydroxy-5-methyl-4-isoxazole-propionicacid receptor; GPCR: G-protein-coupled receptor; NSAID: Non-steroidal anti-inflammatory drugs |
神经病理性疼痛可伴发焦虑和抑郁等情绪障碍, 严重影响生活质量[8], 三环类抗抑郁药(tricyclic antidepressants, TCAs) 和5-羟色胺(5-hydroxytryptamine, 5-HT) 和去甲肾上腺素(noradrenaline, NA) 再摄取抑制剂(serotonin-noradrenaline reuptake inhibitors, SNRIs) 已作为一线治疗药物治疗神经病理性疼痛, 对不伴发抑郁的患者仍然有效, 因此, 抗抑郁药对疼痛和抑郁症的作用机制可能涉及一些不同的调节靶点。
抗抑郁药作用于疼痛下行传导系统, 抑制5-HT和NA的再摄取, 增加突触后NA和5-HT的含量, 从而加强下行疼痛抑制通路。抗抑郁药TCA比SNRI更早用于治疗神经病理性疼痛, 但因为患者服用后出现便秘、镇静、口干及体重增加等不良反应而被SNRI所取代[9]。
研究表明, 去甲肾上腺素α2受体参与抗抑郁药介导的镇痛作用, 在α2A基因敲除的小鼠实验中, 阿米替林的镇痛作用消失[10]。α2受体与抑制性G蛋白(Gi) 相偶联, 抗抑郁药通过阻断蓝斑(locus coeruleus, LC) 下行去甲肾上腺素能神经末梢的去甲肾上腺素转运体, 增加脊髓背角内的NA。神经损伤后, 脊髓内脑源性神经营养因子含量增加, 作用于活化胆碱能神经元上的α2受体, 脊髓内增加的NA与α2受体相结合, 增加乙酰胆碱(acetylcholine, Ach) 释放, Ach与M受体结合, 释放抑制性神经递质GABA产生镇痛作用。另一方面, 抗抑郁药可直接作用于蓝斑, 激活受损的去甲肾上腺抑制系统调节疼痛。最近一项研究报告表明, 用地昔帕明治疗7天可以导致α2A受体脱敏, 但未改变去甲肾上腺素的作用[11], 说明抗抑郁药的作用也可独立于α2A受体之外。虽然5-HT在疼痛传导通路的具体机制尚未明确, 但是通过在脊神经结扎疼痛模型研究比较发现5-HT可以增强去甲肾上腺素再摄取抑制剂治疗神经病理性疼痛的效力和有效性[12]。
抗抑郁药除了增加NA和5-HT浓度外, 还可以同时作用于其他靶点, 发挥对神经病理性疼痛的缓解作用。在小鼠强迫游泳实验中, 抗抑郁药(帕罗西汀、地昔帕明和丙咪嗪) 和电压门控钠通道阻滞剂(托吡酯和苯妥英钠) 具有相同的效果, 表明抗抑郁药也可作为钠通道阻滞剂缓解疼痛[13]。SNRI类药物米那普仑已被证实其镇痛的原因不仅抑制NA和5-HT的再摄取, 而且还可抑制NMDA受体[14]。TCA除阻滞钠通道之外, 还可以抑制自发钙震荡[15], 对组胺H2受体、胆碱能受体和α肾上腺素受体具有拮抗作用[16], 同时还可激活钾通道, 调节腺苷系统并增加GABA-B受体的功能, 与阿片受体结合, 抑制一氧化氮(nitric oxide, NO) 和前列腺素E的产生等[17]。
2.2 抗癫痫药癫痫是大脑中异常或过度的神经元活动引起的, 研究发现癫痫的实验模型和神经病理性疼痛的模型存在许多相似的病理生理现象, 抗癫痫药物已被广泛应用于神经病理性疼痛的治疗。主要包括: 卡马西平(carbamazepine)、拉莫三嗪(lamotrigine)、苯妥英(phenytoin)、丙戊酸(valproic acid)、氯硝西泮(clonazepam)、左乙拉西坦(levetiracetam)、托吡酯(topiramate)、加巴喷丁(gabapentin) 和普瑞巴林(pregabalin) 等。其中加巴喷丁和普瑞巴林被列为治疗神经病理性疼痛的一线药物, 卡马西平至今仍是治疗三叉神经痛的首选药物。
抗癫痫药主要作用于离子通道, 降低神经元兴奋性, 增加膜稳定性进而调节神经元的过度放电。离子通道在痛觉产生和疼痛处理中起着关键性作用, 是调节神经病理性疼痛的主要靶点。神经损伤使电压门控钠离子通道和钙离子通道表达和特性发生显著变化。目前, 用于治疗神经病理性疼痛的抗癫痫药主要为非选择性钠通道阻断剂。随着对离子通道的进一步了解, 发现疼痛和癫痫是由不同亚型的钠通道异常所导致的, 如Nav1.3、Nav1.6、Nav1.7、Nav1.8及Nav1.9等通道的异常均会介导疼痛的产生[18], 而癫痫的发生则与Nav1.1和Nav1.2等通道异常密切相关[19]。所以, 开发亚型选择性的钠通道阻断剂是改善该类药物治疗的主要方向, 目前已有该类药物处于临床试验阶段, 如选择性Nav1.7阻滞剂PF-05089771具有显著缓解疼痛的作用, 对Nav1.7的选择性是亚型Nav1.2的20倍[18]。
经典一线止痛药物加巴喷丁和普瑞巴林通过与电压门控钙通道的α2δ受体结合缓解疼痛; 氯硝西泮通过增强GABA能信号通路缓解疼痛[20]; 左乙拉西坦的作用机制与其他经典药物不同, 与脑特异性结合位点90 kDa突触囊泡蛋白2相结合调节神经递质的释放, 该机制已作为新的靶点进行药物研发[21]。虽然抗癫痫药物已被用来治疗疼痛多年, 但是其研发的初衷仍以治疗癫痫为主, 故此类药物用于疼痛疾病的治疗时, 可能或多或少的带来与治疗目的不和谐的不良反应。
2.3 加巴喷丁类化合物加巴喷丁类化合物为经典抗癫痫药物, 最初被设计为GABA类似物, 虽然与GABA的结构相似, 但是它并没有直接作用于GABA受体, 而是调节GABA的释放。在系统性给药方式, 该类药物主要作用于钙通道亚基α2δ-1, 减少初级神经元兴奋的传入和脊髓伤害感觉神经元的兴奋性。α2δ-1可调节NMDA受体, 增强NMDA受体的突触表达并靶向性促进神经病理性疼痛。加巴喷丁类药物通过作用于α2δ-1亚基降低NMDA受体引起的痛觉过敏[22]。
然而临床发现, 如果对慢性疼痛患者进行鞘内注射加巴喷丁, 却并未观察到疼痛缓解的作用, 所以研究者改变了一直聚焦于脊髓中枢的研究方式, 进一步发现加巴喷丁也可能作用于蓝斑-去甲肾上腺素下行抑制系统。在蓝斑中, 加巴喷丁与神经元α2δ-1受体结合减少抑制性神经递质GABA的释放, 同时通过Na+-Ca2+交换的反向模式激活谷氨酸转移酶-1, 诱导星形胶质细胞释放谷氨酸, 增加蓝斑神经元的兴奋性和NA的释放从而加强下行抑制系统的镇痛作用[23]。但是, 随着神经损伤时程的延长, 蓝斑核团的去甲肾上腺素神经元对加巴喷丁的反应减弱, 导致加巴喷丁镇痛作用减弱, 同时蓝斑胶质细胞的谷氨酸功能紊乱对于加巴喷丁的作用减弱也有至关重要的作用。此外, 加巴喷丁类药物还通过减少杏仁核的自发活动和阻断钠通道而抑制疼痛的传递。在脊髓水平, 加巴喷丁类药物抑制电压门控钙通道的RabⅡ循环, 导致突触膜通道表达减少, 兴奋性神经递质释放降低。由于存在嗜睡和头晕等不良反应, 加巴喷丁的应用受到限制, 最近一项研究发现, 褪黑素可以缓解加巴喷丁日常嗜睡的不良反应, 增加该类药物的依从性[24]。
2.4 阿片制剂阿片受体分布广泛, 在中枢和外周分布不均, 中枢主要分布于丘脑内侧、导水管周围灰质、延髓腹内侧髓质和蓝斑, 参与痛觉的整合, 外周主要分布于背根神经节, 参与疼痛的传递。内源性阿片样系统包括4种亚型: μ、δ、κ和孤啡肽受体1 (opioid related nociceptin receptor 1, OPRL1), 属于G蛋白偶联受体家族(G-protein coupled receptor, GPCR)。内源性阿片样物质配体包括β-内啡肽、脑啡肽、强啡肽和孤啡肽。阿片类药物已被用于治疗疼痛多年, 但是其对神经病理性疼痛的作用效果远不如其他类型疼痛明显, 加上恶心、呕吐、呼吸抑制、严重的成瘾性和戒断反应等不良反应, 出于安全考虑, 被推荐为二线或三线治疗药物, 其中选择性作用于外周受体的阿片类药物作为首选。阿片类药物根据镇痛强弱可分为弱阿片制剂和强效阿片制剂。
2.4.1 弱阿片制剂曲马多是实验室合成的弱阿片类药物, 具有调节阿片受体和单胺能系统的双重作用, 是由(+)-曲马多和(-)-曲马多组成的外消旋体。曲马多在肝脏内被细胞色素P450酶CYP2D6代谢为(+)-O-脱甲基曲马多(M1), (+)-曲马多和M1对µ-阿片受体(µ-opioid receptor, MOR) 有激动作用, 且代谢产物M1的作用效果是其母体的200~300倍。对映体(+)-曲马多抑制5-HT再摄取, 而(-)-曲马多则抑制去甲肾上腺素再摄取, 外消旋体共同作用增加脊髓内NA和5-HT的水平。曲马多还通过与星形胶质细胞的α2-肾上腺素受体结合抑制星形胶质细胞的活化[25], 从而产生镇痛效果。该药物由于产生不良反应较少, 成瘾性较低和耐受性较好, 被推荐为治疗神经病理性疼痛的二线药物, 用于缓解中度到重度疼痛, 但因其存在恶心、便秘、疲劳、头晕及口干等不良反应限制了该药物的临床应用。
近年来, 关于曲马多的研究更倾向于与其他药物联合使用来增加镇痛效果。曲马多与对乙酰氨基酚(如扑热息痛、双吡咯酮和酮咯酸) 联用已被制作口服制剂并应用多年, 该组合用药大大加强镇痛效果且对药物原有不良反应无增加作用。另外, 曲马多与加巴喷丁联用的镇痛效果也显著强于单独使用加巴喷丁或曲马多的效果, 然而同属加巴喷丁类药物的普瑞巴林与曲马多联合治疗与单一治疗的效果是相似的[26], 因此关于曲马多的联合治疗策略仍需进一步研究。由于曲马多在肝脏进行分解代谢, 如与其他同在肝脏内代谢的药物联用, 或在缺乏细胞色素P450酶CYP2D6的患者中使用, 均会降低曲马多的利用率, 产生不良反应, 故应谨慎使用。
2.4.2 强效阿片制剂由于弱阿片制剂对症状产生轻微控制的同时产生相当大的不良反应, 因此更有效的强效阿片制剂取代了越来越多的弱阿片制剂。
目前, 阿片类药物主要通过μ-阿片受体产生药理作用, 临床上常用的阿片类药物包括吗啡(morphine) 和羟考酮(oxycodone)。阿片受体与抑制性G蛋白相偶联, 当外源性或内源性激动剂作用于受体, Gα和Gβγ亚基彼此解离, 产生一系列细胞内级联反应, Gβγ亚基通过抑制突触前膜电压门控钙通道, 抑制神经递质的释放, 同时激活G蛋白门控内向整流钾通道, 导致突触后膜超极化; Gα亚基通过抑制腺苷酸环化酶, 抑制钙离子内流[27]。在痛觉传导通路中, 阿片受体被内源性和外源性阿片受体激动剂激活, 内源性阿片受体激动剂来自免疫细胞和神经元, 从而产生镇痛作用。然而阿片类药物可通过诱导神经胶质细胞活化, 增强C纤维传递和下行痛觉传导, 加剧神经损伤引起的痛觉过敏, 降低阿片类药物的镇痛效果, 因此阿片类药物与靶向抑制阿片类药物产生痛觉过敏的药物联合应用, 可大大提升阿片类药物的镇痛效果。目前, NMDA拮抗剂、加巴喷丁、α2激动剂和单胺再摄取抑制剂已被报道与阿片类药物联用, 用于降低阿片类药物引起的痛觉超敏, 增强阿片类药物的镇痛效果[28]。
阿片类药物也可与非甾体抗炎药联用, 虽然非甾体抗炎药(NASID) 对神经病理性疼痛无效, 但当与阿片类药物联合应用时对炎性疼痛和神经病理性疼痛均有协同镇痛作用[29]。
2.5 氯胺酮氯胺酮作为麻醉剂主要用于治疗发生中枢敏化、阿片类药物耐受的难治性神经病理性疼痛。氯胺酮是一种含有S-和R-异构体的外消旋混合物, 且S-氯胺酮是R-氯胺酮作用的3倍, 目前S-氯胺酮(艾司氯胺酮) 已被批准上市。氯胺酮通过肝脏内细胞色素P450酶进行代谢, 主要代谢产物包括去甲氯胺酮和羟基去甲氯胺酮。氯胺酮是NMDA受体拮抗剂, 抑制伤害信息的传入和中枢敏化, 通过激活下行抑制性单胺能痛觉通路产生抗伤害作用。氯胺酮还有抗炎和神经保护的作用, 除NMDA受体外, 氯胺酮还与其他几种受体和离子通道相互作用, 包括多巴胺、5-HT、阿片受体、胆碱能受体、超极化激活的环核苷酸门控通道、钠通道和钙通道等[30]。临床上小剂量氯胺酮常用作阿片类药物的佐剂, 显著降低阿片受体成瘾性, 但单独使用氯胺酮也会产生精神致幻的作用, 故应慎用。
2.6 局部给药辣椒素是瞬时受体电位香草酸亚型1 (transient receptor potential vanilloid-1, TRPV1) 天然配体, 美国食品药品管理局于2009年批准的8%浓度辣椒素贴剂(Qutenza, 8% capsaicin), 主要用于治疗带状疱疹后遗神经痛(postherpetic neuralgia, PHN) 患者的长期疼痛以及成年人非糖尿病性周围神经病理性疼痛。TRPV1是一种非选择性离子通道, 仅允许Na+和Ca2+通过, 当被高浓度辣椒素激活后, 引起电压门控钠通道失活和TRPV1受体脱敏, 导致神经元兴奋性降低, 细胞外Ca2+通过TRPV1通道进入细胞内, 辣椒素同时引起内质网Ca2+大量释放, 导致胞浆内Ca2+浓度急剧增加, 引起钙依赖性蛋白激酶活化和细胞骨架破坏。高浓度辣椒素可以直接作用于线粒体, 抑制线粒体呼吸, 这些变化将导致局部伤害性感受器(nociceptive receptor) 受损[31]。此外, 药物诱发的神经纤维变性也可缓解疼痛, 表皮神经纤维损失导致外周活动减少, 从而降低这些纤维诱导的中枢敏化。辣椒素在疼痛部位涂抹1 h (或脚上30 min) 的药效可维持3个月, 不良反应较低, 最常见的不良反应是疼痛和红肿。但是辣椒素的应用有限, 仅用于特定的神经病理性疼痛患者, 不太可能成为一线治疗药物, 常被用于一线药物的佐剂, 具有更好的疗效和低不良反应。
3 神经病理性疼痛的药物发现现状最初用于神经病理性疼痛的药物大多是偶然发现, 现阶段神经病理性疼痛的药物发现主要依赖于药物开发的线性模型, 即选择药物靶点→高通量筛选鉴定先导化合物并确定候选化合物→临床前研究(包括药理学、毒理学、药代动力学检测和制剂开发)→临床试验阶段进一步确证该化合物对神经病理性疼痛的有效性和安全性等流程。
药物发现过程中候选药物的成功与否与临床前研究阶段方法的选择有很大的关系。高通量筛选是药物发现早期阶段识别活性化合物的一项关键技术, 将化学、基因组学、生物信息以及自动化仪器等先进技术组合成一个高度程序化和自动化的新模式, 具有高效和快速等特点, 已被广泛应用于药物发现。通常情况下, 针对疼痛药物的高通量筛选主要是在重组的高表达神经元靶点细胞株或原代神经元进行筛选化合物。应用原代神经元进行筛选非常具有挑战性, 基于背根神经节(dorsal root ganglion, DRG) 损伤的病理生理学, 可筛选针对多种靶点的药物, 已被用于针对神经病理性疼痛的镇痛药物筛选[32]。临床前实验药理学部分主要研究先导化合物对神经病理性疼痛动物模型的有效性及安全性。大多情况下, 神经病理性疼痛动物模型的结果在向临床转化过程中的成功率较低。因此, 与传统研究方向相反的反向翻译已被用于临床研究中。反向翻译是将临床上有效的治疗方法转化为动物模型, 并进一步研究其机制或基于表型的治疗, 如A型肉毒毒素(botulinum toxin A)[33]。A型肉毒毒素最初主要用于缓解痉挛或肌张力障碍, 但在临床使用过程中发现其镇痛作用先于缓解肌张力, 且超过了仅仅因肌肉放松而产生的镇痛效果, 提示A型肉毒毒素的镇痛机制可能不依赖于其肌松作用, 体外实验研究表明, A型肉毒毒素主要通过抑制神经末梢和脊髓背根神经节疼痛介质(如CGRP、P物质和谷氨酸) 的分泌而产生的镇痛作用[33, 34]。目前转化研究最大的趋势是采用不同研究方式, 联合神经影像学技术和遗传学, 进一步了解其作用机制, 更好地实现神经病理性疼痛的靶向治疗[33]。
神经病理性疼痛药物靶点众多, 基于已上市药物靶点, 离子通道和GPCR是比重最多的两大类靶点。目前很多靶向神经病理性疼痛潜在靶点的小分子化合物正在研究开发中, 仍以离子通道和GPCR两类靶点居多。
3.1 离子通道类药物离子通道激活是维持细胞兴奋性的基础, 与神经病理性疼痛的发生和发展密切相关。目前多种类型的离子通道是疼痛的主要药物靶点, 其中包括: 电压门控离子通道(钠、钾和钙)、配体门控离子通道、酸敏感离子通道(acid-sensing family of ion channel, ASIC) 以及ATP门控离子通道P2X等。针对这类靶点, 已有很多开发成功的药物正用于临床研究。
Nav1通道亚型在神经病理性疼痛中的作用是近年来的研究热点, 亚型Nav1.3、Nav1.7、Nav1.8和Nav1.9已被证实在疼痛传导通路中发挥重要作用[18]。目前, 用于控制神经病理性疼痛的药物如抗癫痫药(卡马西平)、Ⅰ类抗心律失常药(美西律) 和局部麻醉剂(利多卡因) 均为非选择性钠通道阻断剂, 针对这些药物的研究显示[35], 如卡马西平衍生药物奥卡西平(oxcarbazepine) 与卡马西平疗效相似且不良反应较小, 已被推荐为治疗三叉神经性痛的一线代替药物。此外, 选择性Nav1.7阻断剂(BⅡB074)[18]和Nav1.8阻断剂(A-803467)[35]已广泛应用于临床研究, 但仍需进一步优化才可正式应用于临床。
研究发现, 神经病理性疼痛与钙离子内流密切相关, 其中N型和T型钙通道的作用尤为突出。靶向N型钙通道的阻断剂齐考诺肽(ziconotide) 已成功问世[36], T型钙通道阻断剂Z944处于临床前研究阶段[37]。然而, 目前针对钙通道的阻断剂只有齐考诺肽、加巴喷丁和普瑞巴林被批准治疗神经病理性疼痛, 且后两种是针对癫痫而研发的药物, 因此, 开发高选择性N型及T型钙通道靶向药物是未来主要研究方向。
除钠通道和钙通道外, 以钾离子通道为背景的药物也备受关注, 最近文献报导称靶向KCNQ2/3/5 (Kv7) 通道开放剂瑞替加滨(retigabine, RTG) 明显降低神经元兴奋性[38], 且在多种疼痛模型有效; 双孔钾通道亚型TREK1 (TWIK-related K+ channel 1) 是吗啡镇痛的关键靶点且无阿片样不良反应[39], 这为神经病理性疼痛提供新的治疗策略。
兴奋性递质谷氨酸是启动神经病理性疼痛的关键, 在神经病理性疼痛动物模型中, 离子型谷氨酸受体(NMDA、KA和AMPA) 阻断剂(radiprodil、LY-382884和NGX 426) 可有效缓解疼痛[40], 但目前仍处于临床前研究阶段。此外, 氯胺酮代谢产物(2R, 6R)-HNK在动物模型中显示具有更强的镇痛效果, 可能成为一种治疗疼痛的新型药物[41]。瞬时受体电位通道(TRPV1、TRPV4、TRPA1和TRPM8) 在初级感觉神经元和背根神经节的胶质细胞中广泛表达。顺式辣椒素(zucapsaicin) 是天然辣椒素的合成顺式异构体, 其具有更好的耐受性, 除神经病理性疼痛外, 对骨关节炎的疼痛和头痛也有效, 有潜力成为辣椒素的替代药物[42]。除辣椒素外, 脱敏软膏TRPV1拮抗剂已被研发用于缓解局部疼痛[43]。酸敏感离子通道广泛分布于感觉神经元, 在中枢神经系统的疼痛处理中起着重要作用, 鞘内注射沙门氏菌毒素1 (PcTx1) 选择性阻断ASIC1a可有效减轻疼痛, 非选择性ASIC抑制剂阿米洛利(amiloride) 已被批准治疗皮肤疼痛[43]。神经损伤后会释放大量的ATP, 其作为一种促过敏物质与伤害感受器的P2X受体结合可介导痛觉过敏, 目前P2X3受体拮抗剂(A-317491、RO3和RO4) 已显示出强效的镇痛作用, 同时大黄素(emodin) 和王草素(osthole) 等中药也通过作用于P2X受体调节疼痛[44]。除此之外, 其他离子通道型受体(如GABA受体和甘氨酸受体等) 也已被证实或多或少与神经病理性疼痛相关。因此, 靶向离子通道寻找阻断痛觉传导的调节剂是缓解神经病理性疼痛的重要研究方向。
3.2 GPCR类药物神经损伤后, 除伤害感受器自身可塑性改变, 细胞外多种介质的调节也会影响伤害性神经元的敏感性, 这些介质大多数作用于GPCR。GPCR种类繁多, 机体内(尤其是脑内) 毒蕈碱受体(M受体)、肾上腺能受体、五羟色胺能受体、多巴胺能受体、组胺受体、血管紧张素受体、大麻素受体(cannabinoid receptor, CBR)、阿片能受体及嘌呤受体等均参与神经病理性疼痛的调节。因此, GRCR已成为新型小分子药物的潜在靶点。
乙酰胆碱是中枢和外周胆碱能系统的化学神经递质, 通过与胆碱能受体[包括毒蕈碱受体(M受体) 和烟碱受体(N受体)] 结合参与疼痛调控。研究表明, 当M受体激活时会增加痛域, 而阻断时会降低痛域, 目前选择性M1受体激动剂PPBI已被研发用于治疗神经病理性疼痛[45]。单胺能系统在痛觉传导中具有复杂的调节作用, 最初用于抗抑郁的SNRI作为一线止痛药即通过作用于单胺能系统而发挥镇痛作用。目前临床上针对单胺能系统的药物靶点包括: 肾上腺素受体(adrenergicreceptor, AR)、5-HT受体、多巴胺能受体和组胺受体。肾上腺素受体有多种亚型, 其中α2-AR最常参与痛觉调控, 临床表明α2-AR激动剂可乐定(clonidine) 和右美托咪啶(dexmedetomidine) 可明显减轻患者的痛觉过敏, 且新型α2-AR激动剂rezatomidine也已进入临床Ⅱ期试验阶段[46]。不同于肾上腺素受体, 关于5-HT受体在疼痛中的作用争议颇多, 其作用是促进还是抑制取决于5-HT受体的种类, 目前尚无针对该受体的药物用于神经病理性疼痛, 因此, 5-HT受体的作用仍需进一步研究[47]。与去甲肾上腺素和5-HT相比, 多巴胺在疼痛中的作用所受关注较少, 多巴胺系统和去甲肾上腺系统在调控疼痛时存在相互调节作用, 在此基础上, 作用于多巴胺系统的抗抑郁药如安非他酮(bupropion) 可能成为治疗神经病理性疼痛的新型药物[47]。组胺受体在疼痛调控中的作用也取决于受体的种类, 选择性组胺受体(H3) 拮抗剂AZD-5213和ABT-652已相继被研发, 已处于临床Ⅱ期试验阶段[46]。目前新型单胺能系统三重再摄取抑制剂NS18283已被研发, 通过抑制NA、5-HT和多巴胺的再摄取, 显示更强效的镇痛作用[48]。血管紧张素2型受体(angiotensin 2 receptor, ATR2) 在人类伤害性感觉神经元中广泛表达, 其在神经病理性疼痛中的作用在临床试验中已被证实, 选择性ATR2拮抗剂EMA401在带状疱疹后遗神经痛患者中表现出良好的耐受性和依从性[49]。内源性大麻素系统是近些年的新型热门靶点, 由大麻素受体(CBR1和CBR2) 及其内源性配体以及参与这些配体合成降解的酶组成。目前更有效利用内源性大麻素受体的新策略是选择性靶向激活大麻素受体, 在特定组织内抑制内源性大麻素摄取代谢。在神经病理性疼痛临床前研究中发现, 选择性大麻素受体2 (CBR2) 激动剂(A-836339)[50]、单酰基甘油脂酶(KML29) 和脂肪酸酰胺水解酶抑制剂(URB597和OL135)[51, 52]已显示出强效镇痛作用, 此外, 发现大麻素类药物和阿片类制剂存在协同镇痛作用, 这两类药物联合应用会带来较强的治疗效果[52]。新型阿片受体靶标-孤啡肽受体(OPRL1), 因为其降低了阿片类药物的依赖性和其他中枢性药物的不良反应而被重视, 新型镇痛药cebranopadol是孤啡肽受体和μ-阿片受体的激动剂, 已被证实在动物模型中镇痛效果明显, 可以用于神经病理性疼痛的治疗[53]。μ-阿片受体激动剂他喷他多(tapentadol) 被认为是曲马多的升级版, 是一种新型治疗神经病理性疼痛的药物, 因其作用机制和曲马多非常相似, 保留MOR激动剂和NA再摄取作用, 且对5-HT受体仅有很小的作用, 与曲马多相比减少了不良反应, 成为一种非常有潜力治疗疼痛的药物[54]。此外, 其他GPCR也参与疼痛的调控, 如嘌呤受体P2家族-P2Y7, 选择性靶向P2Y7受体的拮抗剂GSK-1482160可在受体部位产生局部镇痛作用, 有望成为治疗神经病理性疼痛的新型靶标。
4 总结和展望目前, 随着对神经病理性疼痛的认知程度加深, 对于此疾病相关靶点以及治疗已经取得很大的进步。本文根据最新研究进展, 主要介绍了治疗神经病理性疼痛的经典止痛药和处于开发阶段的新型靶点。其中Nav1.7和内源性大麻素系统是目前比较有前景的治疗靶点, 高选择性Nav1.7阻断剂和CBR2激动剂有望成为有效的镇痛药物。但是由于现有治疗药物的不良反应和滥用情况仍未得到有效改善, 许多类型的神经病理性疼痛仍未找到有效治疗方法, 寻找疗效明显、不良反应低和无滥用风险的药物仍是现阶段的重要使命。因此目前阶段, 应更加关注神经病理性疼痛的发病机制, 寻找新颖药物靶点, 开发针对性治疗药物, 从根本上缓解患者症状, 最终提高患者生活质量。研究者不但要寻找新颖的疼痛靶点和候选药物, 也要针对现有治疗的不足寻求改善的策略。
作者贡献: 宋佳男、于海波和刘玉梅共同参与了文章的撰写以及修改。
利益冲突: 本文作者声明没有利益冲突。
| [1] |
Bannister K, Sachau J, Baron R, et al. Neuropathic pain: mechanism-based therapeutics[J]. Annu Rev Pharmacol Toxicol, 2020, 60: 257-274. DOI:10.1146/annurev-pharmtox-010818-021524 |
| [2] |
Loeser JD, Treede RD. The Kyoto protocol of IASP basic pain terminology[J]. Pain, 2008, 137: 473-477. DOI:10.1016/j.pain.2008.04.025 |
| [3] |
Ji RR, Nackley A, Huh Y, et al. Neuroinflammation and central sensitization in chronic and widespread pain[J]. Anesthesiology, 2018, 129: 343-366. DOI:10.1097/ALN.0000000000002130 |
| [4] |
White FA, Bhangoo SK, Miller RJ. Chemokines: integrators of pain and inflammation[J]. Nat Rev Drug Discov, 2005, 4: 834-844. DOI:10.1038/nrd1852 |
| [5] |
Kawasaki Y, Zhang L, Cheng JK, et al. Cytokine mechanisms of central sensitization: distinct and overlapping role of interleukin-1beta, interleukin-6, and tumor necrosis factor-alpha in regulating synaptic and neuronal activity in the superficial spinal cord[J]. J Neurosci, 2008, 28: 5189-5194. DOI:10.1523/JNEUROSCI.3338-07.2008 |
| [6] |
Bannister K, Dickenson AH. What the brain tells the spinal cord[J]. Pain, 2016, 157: 2148-2151. DOI:10.1097/j.pain.0000000000000568 |
| [7] |
Hashmi JA, Baliki MN, Huang L, et al. Shape shifting pain: chronification of back pain shifts brain representation from nociceptive to emotional circuits[J]. Brain Neurosci Adv, 2013, 136: 2751-2768. |
| [8] |
Means-Christensen AJ, Roy-Byrne PP, Sherbourne CD, et al. Relationships among pain, anxiety, and depression in primary care[J]. Depress Anxiety, 2008, 25: 593-600. DOI:10.1002/da.20342 |
| [9] |
Mika J, Zychowska M, Makuch W, et al. Neuronal and immunological basis of action of antidepressants in chronic pain-clinical and experimental studies[J]. Pharmacol Rep, 2013, 65: 1611-1621. DOI:10.1016/S1734-1140(13)71522-6 |
| [10] |
Ozdogan UK, Lahdesmaki J, Mansikka H, et al. Loss of amitriptyline analgesia in alpha 2A-adrenoceptor deficient mice[J]. Eur J Pharmacol, 2004, 485: 193-196. DOI:10.1016/j.ejphar.2003.11.047 |
| [11] |
Grandoso L, Pineda J, Ugedo L. Comparative study of the effects of desipramine and reboxetine on locus coeruleus neurons in rat brain slices[J]. Neuropharmacology, 2004, 46: 815-823. DOI:10.1016/j.neuropharm.2003.11.033 |
| [12] |
Leventhal L, Smith V, Hornby G, et al. Differential and synergistic effects of selective norepinephrine and serotonin reuptake inhibitors in rodent models of pain[J]. J Pharmacol Exp Ther, 2007, 320: 1178-1185. DOI:10.1124/jpet.106.109728 |
| [13] |
Bourin M, Chenu F, Hascoët M. The role of sodium channels in the mechanism of action of antidepressants and mood stabilizers[J]. Curr Drug Targets, 2009, 10: 1052-1060. DOI:10.2174/138945009789735138 |
| [14] |
Kohno T, Kimura M, Sasaki M, et al. Milnacipran inhibits glutamatergic N-methyl-D-aspartate receptor activity in spinal dorsal horn neurons[J]. Mol Pain, 2012, 8: 45. |
| [15] |
Shimizu M, Nishida A, Yamawaki S. Antidepressants inhibit spontaneous oscillations of intracellular Ca2+ concentration in rat cortical cultured neurons[J]. Neurosci Lett, 1992, 146: 101-104. DOI:10.1016/0304-3940(92)90182-7 |
| [16] |
Hall H, Ogren SO. Effects of antidepressant drugs on different receptors in the brain[J]. Eur J Pharmacol, 1981, 70: 393-407. DOI:10.1016/0014-2999(81)90172-2 |
| [17] |
Obata H. Analgesic mechanisms of antidepressants for neuropathic pain[J]. Int J Mol Sci, 2017, 18: 2483. DOI:10.3390/ijms18112483 |
| [18] |
Kushnarev M, Pirvulescu IP, Candido KD, et al. Neuropathic pain: preclinical and early clinical progress with voltage-gated sodium channel blockers[J]. Expert Opin Investig Drugs, 2020, 29: 259-271. DOI:10.1080/13543784.2020.1728254 |
| [19] |
Bialer M, White HS. Key factors in the discovery and development of new antiepileptic drugs[J]. Nat Rev Drug Discov, 2010, 9: 68-82. DOI:10.1038/nrd2997 |
| [20] |
Wiffen PJ, Derry S, Moore RA, et al. Antiepileptic drugs for neuropathic pain and fibromyalgia-an overview of Cochrane reviews[J]. Cochrane Database Syst Rev, 2013, 2013: CD010567. |
| [21] |
Malawska B, Kulig K. Brivaracetam: a new drug in development for epilepsy and neuropathic pain[J]. Expert Opin Investig Drugs, 2008, 17: 361-369. DOI:10.1517/13543784.17.3.361 |
| [22] |
Chen JJ, Li LY, Chen SR, et al. The alpha2delta-1-NMDA receptor complex is critically involved in neuropathic pain development and gabapentin therapeutic actions[J]. Cell Rep, 2018, 22: 2307-2321. DOI:10.1016/j.celrep.2018.02.021 |
| [23] |
Hayashida KI, Eisenach JC. Descending noradrenergic inhibition: an important mechanism of gabapentin analgesia in neuropathic pain[J]. Adv Exp Med Biol, 2018, 1099: 93-100. |
| [24] |
Altiparmak B, Cil H, Celebi N. Effect of melatonin on the daytime sleepiness side-effect of gabapentin in adults patients with neuropathic pain[J]. Rev Bras Anestesiol, 2019, 69: 137-143. DOI:10.1016/j.bjan.2018.08.003 |
| [25] |
Sakakiyama M, Maeda S, Isami K, et al. Preventive and alleviative effect of tramadol on neuropathic pain in rats: roles of alpha(2)-adrenoceptors and spinal astrocytes[J]. J Pharmacol Sci, 2014, 124: 244-257. DOI:10.1254/jphs.13223FP |
| [26] |
Lee S, Kim Y, Lee JJS, et al. A pharmacokinetic drug-drug interaction study between pregabalin and tramadol in healthy volunteers[J]. Eur J Clin Pharmacol, 2018, 74: 1605-1613. DOI:10.1007/s00228-018-2543-0 |
| [27] |
Corder G, Castro DC, Brucha MR, et al. Endogenous and exogenous opioids in pain[J]. Annu Rev Neurosci, 2018, 41: 453-473. DOI:10.1146/annurev-neuro-080317-061522 |
| [28] |
Martinez-Navarro M, Maldonado R, Banos JE. Why mu-opioid agonists have less analgesic efficacy in neuropathic pain[J]. Eur J Pain, 2019, 23: 435-454. DOI:10.1002/ejp.1328 |
| [29] |
Shinozaki T, Yamada T, Nonaka T, et al. Acetaminophen and non-steroidal anti-inflammatory drugs interact with morphine and tramadol analgesia for the treatment of neuropathic pain in rats[J]. J Anesth, 2015, 29: 386-395. DOI:10.1007/s00540-014-1953-0 |
| [30] |
Zanos P, Moaddel R, Morris PJ, et al. Ketamine and ketamine metabolite pharmacology: insights into therapeutic mechanisms[J]. Pharmacol Rev, 2018, 70: 621-660. DOI:10.1124/pr.117.015198 |
| [31] |
Anand P, Bley K. Topical capsaicin for pain management: therapeutic potential and mechanisms of action of the new high-concentration capsaicin 8% patch[J]. Br J Anaesth, 2011, 107: 490-502. DOI:10.1093/bja/aer260 |
| [32] |
Martinez AL, Brea J, Monroy X, et al. A new model of sensorial neuron-like cells for HTS of novel analgesics for neuropathic pain[J]. SLAS Discov, 2019, 24: 158-168. |
| [33] |
Attal N, Bouhassira D. Translational neuropathic pain research[J]. Pain, 2019, 160: 23-28. DOI:10.1097/j.pain.0000000000001522 |
| [34] |
Ranoux D, Attal N, Morain F, et al. Botulinum toxin type A induces direct analgesic effects in chronic neuropathic pain[J]. Ann Neurol, 2008, 64: 274-283. DOI:10.1002/ana.21427 |
| [35] |
Ma RSY, Kayani K, Whyte-Oshodi D, et al. Voltage gated sodium channels as therapeutic targets for chronic pain[J]. J Pain Res, 2019, 12: 2709-2722. DOI:10.2147/JPR.S207610 |
| [36] |
Pexton T, Moeller-Bertram T, Schilling J, et al. Targeting voltage-gated calcium channels for the treatment of neuropathic pain: a review of drug development[J]. Expert Opin Investig Drugs, 2011, 20: 1277-1284. DOI:10.1517/13543784.2011.600686 |
| [37] |
Bourinet E, Francois A, Laffray S. T-type calcium channels in neuropathic pain[J]. Pain, 2016, 157(Suppl 1): S15-S22. |
| [38] |
Yu T, Li L, Liu H, et al. KCNQ2/3/5 channels in dorsal root ganglion neurons can be therapeutic targets of neuropathic pain in diabetic rats[J]. Mol Pain, 2018, 14: 1744806918793229. |
| [39] |
Busserolles J, Tsantoulas C, Eschalier A, et al. Potassium channels in neuropathic pain: advances, challenges, and emerging ideas[J]. Pain, 2016, 157(Suppl 1): S7-S14. |
| [40] |
Colombo E, Francisconi S, Faravelli L, et al. Ion channel blockers for the treatment of neuropathic pain[J]. Future Med Chem, 2010, 2: 803-842. DOI:10.4155/fmc.10.19 |
| [41] |
Kroin JS, Das V, Moric M, et al. Efficacy of the ketamine metabolite (2R, 6R)-hydroxynorketamine in mice models of pain[J]. Reg Anesth Pain Med, 2019, 44: 111-117. DOI:10.1136/rapm-2018-000013 |
| [42] |
Sałat K, Jakubowska A, Kulig K. Zucapsaicin for the treatment of neuropathic pain[J]. Expert Opin Investig Drugs, 2014, 23: 1433-1440. DOI:10.1517/13543784.2014.956079 |
| [43] |
De Logu F, Geppetti P. Ion channel pharmacology for pain modulation[J]. Handb Exp Pharmacol, 2019, 260: 161-186. |
| [44] |
Li SH, Li L, Yang RN, et al. Compounds of traditional Chinese medicine and neuropathic pain[J]. Chin J Nat Med, 2020, 18: 28-35. |
| [45] |
Wood MW, Martino G, Coupal M, et al. Broad analgesic activity of a novel, selective M1 agonist[J]. Neuropharmacology, 2017, 123: 233-241. DOI:10.1016/j.neuropharm.2017.06.010 |
| [46] |
Gilron I, Dickenson AH. Emerging drugs for neuropathic pain[J]. Expert Opin Emerg Drugs, 2014, 19: 329-341. DOI:10.1517/14728214.2014.915025 |
| [47] |
Bravo L, Llorca-Torralba M, Berrocoso E, et al. Monoamines as drug targets in chronic pain: focusing on neuropathic pain[J]. Front Neurosci, 2019, 13: 1268. DOI:10.3389/fnins.2019.01268 |
| [48] |
Hache G, Guiard BP, TH N, et al. Antinociceptive activity of the new triple reuptake inhibitor NS18283 in a mouse model of chemotherapy-induced neuropathic pain[J]. Eur J Pain, 2015, 19: 322-333. DOI:10.1002/ejp.550 |
| [49] |
Bouhassira D, Attal N. Emerging therapies for neuropathic pain: new molecules or new indications for old treatments[J]. Pain, 2018, 159: 576-582. DOI:10.1097/j.pain.0000000000001136 |
| [50] |
Murineddu G, Deligia F, Dore A, et al. Different classes of CB2 ligands potentially useful in the treatment of pain[J]. Recent Pat CNS Drug Discov, 2013, 8: 42-69. |
| [51] |
Ignatowska-Jankowska BM, Ghosh S, Crowe MS, et al. In vivo characterization of the highly selective monoacylglycerol lipase inhibitor KML29:antinociceptive activity without cannabimimetic side effects[J]. Br J Pharmacol, 2014, 171: 1392-1407. DOI:10.1111/bph.12298 |
| [52] |
Dray A. Neuropathic pain: emerging treatments[J]. Br J Anaesth, 2008, 101: 48-58. DOI:10.1093/bja/aen107 |
| [53] |
Tzschentke TM, Linz K, Frosch S, et al. Antihyperalgesic, antiallodynic, and antinociceptive effects of cebranopadol, a novel potent nociceptin/orphanin FQ and opioid receptor agonist, after peripheral and central administration in rodent models of neuropathic pain[J]. Pain Pract, 2017, 17: 1032-1041. DOI:10.1111/papr.12558 |
| [54] |
Faria J, Barbosa J, Moreira R, et al. Comparative pharmacology and toxicology of tramadol and tapentadol[J]. Eur J Pain, 2018, 22: 827-844. DOI:10.1002/ejp.1196 |
 2021, Vol. 56
2021, Vol. 56


