中性粒细胞是机体免疫系统的重要组成部分, 当外来微生物入侵机体后, 中性粒细胞通过体内循环的血液迁移到受感染组织处, 并通过吞噬病原微生物、脱颗粒、产生细胞因子以及释放蛋白水解酶等方式杀灭入侵病菌[1]。除此之外, 研究人员于2004年发现, 受到抗原刺激后的中性粒细胞活化, 中性粒细胞弹性蛋白酶(neutrophil elastase, NE) 和髓过氧化物酶(myeloperoxidase, MPO) 移至核内, 导致组蛋白瓜氨酸化, 形成瓜氨酸化组蛋白3 (citrullinated histone 3, Cit-H3), 染色质由致密状变得疏松并释放到胞外, 同时附着来源于胞浆的酶类、抗菌肽于染色质构成的支架上, 形成网状复合体, 被称作中性粒细胞胞外诱捕网(neutrophil extracellular traps, NETs)[2, 3]。NETs能够利用其网状结构捕获并杀死细菌和其他病原体, 这是一种受调控的中性粒细胞死亡形式, 称为“NETosis”。
NETs对于先天免疫至关重要, 然而NETs除了对机体提供保护以外, 还参与了疾病发生发展的过程, 研究表明, NETs过度聚集或NETs清除机制受损, 即NETs的平衡失调可能会对机体产生严重的影响。首先, NETs的组成物质如DNA、组蛋白和颗粒蛋白会作为宿主的自身抗原, 导致自身免疫病[4]; 其次, 血液或组织中不能被完全降解的NETs, 可能导致毛细血管阻塞, 损伤机体微循环, 甚至引起组织损伤, 诱发各种疾病例如血栓、囊性纤维化和败血症等[3]。
因此, NETs是一把双刃剑。一方面, NETs可以杀灭病原微生物; 另一方面, NETs的清除失衡会加剧机体的慢性炎症, 导致器官损伤。本文以人体不同系统为主线, 对2016年以来NETs在炎症相关疾病中的作用进行综述, 并对靶向NETs改善炎症相关疾病的药物进行了总结(图 1)。
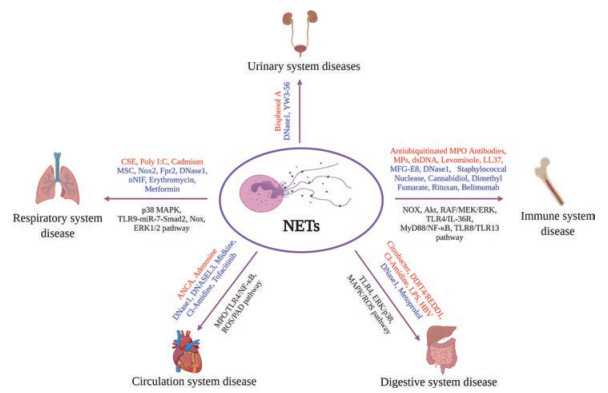
|
Figure 1 Neutrophil extracellular traps (NETs) in inflammation-related diseases, among them, NETs play an important role in promoting (red words) or inhibiting (blue words) the development of inflammation diseases through various pathways (black words), which indicates its regulation is of great significance to body health. Created with Biorender.com |
免疫系统是机体识别和清除外来入侵抗原以及体内突变或衰老细胞并维持机体内环境稳定的系统, 具有免疫监视、防御和调控的作用。免疫系统在机体中占据着十分重要的地位。体内外实验及临床诊断结果表明, NETs在免疫系统相关疾病, 如系统性红斑狼疮(systemic lupus erythematosus, SLE)、狼疮性肾炎(lupus nephritis, LN)、类风湿关节炎(rheumatoid arthritis, RA) 和银屑病等自身免疫病中发挥关键作用[5]。
SLE是一种威胁生命的慢性自身免疫性疾病, SLE患者能够产生大量的自身抗体并与自身抗原结合, 严重损害机体组织和器官的健康[6]。乳脂球表皮生长因子8 (milk fat globule-EGF factor 8, MFG-E8) 是一种糖蛋白, 可与体内吞噬细胞相互作用, 刺激其对凋亡细胞的吞噬。SLE患者和姥鲛烷诱导的SLE小鼠能够产生与MFG-E8相关的自身抗体, 致使机体缺乏MFG-E8, 从而引发了小鼠肺部和腹膜的早期炎症, 深入研究发现, MFG-E8不仅能够下调趋化因子受体2的表达来减少中性粒细胞迁移和NETosis的发生, 还可以促进对凋亡中性粒细胞的吞噬作用, 结果显示, MFG-E8具有减轻SLE患者早期炎症反应的能力, 从而保护患者组织器官免受损伤[7]。Barrera-Vargas等[8]首次对NETs中的泛素化蛋白进行研究, 研究发现MPO会诱发SLE患者的体液免疫反应, 因此, 正常情况下MPO以泛素化形式存在于NETs中, 而SLE患者会产生抗MPO泛素化的抗体(antiubiquitinated MPO antibodies), 并且抗体在体内的含量与SLE活动度评分呈正相关, 揭示了NETs中的泛素化蛋白对免疫系统以及SLE的调节作用。
LN作为SLE导致的一种器官损害疾病, 临床表现为肾脏功能受损, 是SLE患者死亡的主要原因。近年来研究表明, NETs在体内的持续存在能够构成自身抗原、加剧自身免疫反应, 促使SLE患者LN的发生[9]。凋亡细胞可形成富含甲基化或乙酰化组蛋白残基修饰的染色质的微粒(microparticles, MPs), SLE患者可针对此类凋亡相关的修饰, 形成自身抗体, 促进自身免疫反应。Rother等[10]研究发现, 在SLE患者中, MPs乙酰化组蛋白的含量决定了NETosis的发生, MPs可驱动SLE患者的活性氧(reactive oxygen species, ROS) 非依赖性NETs释放, 导致NETs在肾毛细血管中沉积, 介导LN发生。Lou等[11]揭示了SLE中一种新的致病机制: LN患者产生的抗双链DNA (double stranded DNA, dsDNA) 抗体的部分亚群能够通过在肾脏内的沉积并且抑制NETs降解、激活炎性免疫应答, 对肾脏造成损害。此外, 该抗体亚群可通过与免疫复合物结合刺激单核吞噬细胞中的I型干扰素应答, 并激活内皮细胞中核因子κB (nuclear factor kappa-B, NF-κB) 通路, 随后以Fc-γ受体(the Fc-γ receptor) 依赖性方式引发炎症反应, 在SLE中发挥重要作用。因此, NETs有望成为治疗LN潜在靶标。
RA是一种慢性全身性炎性疾病, 作为第二大普遍的自身免疫疾病, 严重影响着全球约1%人口滑膜关节的正常生理功能[12]。Bach等[13]对247名临床患者的血样研究后发现, RA与NETs的形成有关, 中性粒细胞在RA患者中显著活化, 并伴有NETosis加强、NETs降解能力受损。对中性粒细胞标志物的检测可以在RA患者病情的监测上表现出临床价值。大部分RA患者会产生与RA相关的自身抗原, 如类风湿因子和瓜氨酸化蛋白。NETs是机体内瓜氨酸化蛋白自身抗原的来源, 它能够激活RA成纤维样滑膜细胞, 导致关节损伤并诱发RA[14]。左旋咪唑(levomisole) 作为一种广谱驱虫药, 被报道能够诱发RA, Carmona-Rivera等[15]发现左旋咪唑能够刺激中性粒细胞表面毒蕈碱受体, 从而对其产生调节作用, 并且通过烟酰胺腺嘌呤二核苷酸磷酸氧化酶(nicotinamide adenine dinucleotide phosphate oxidase, NOX) 通路、丝氨酸苏氨酸蛋白激酶(serine/threonine protein kinase, Akt) 和RAF/丝裂原活化细胞外信号调节蛋白激酶/细胞外调节蛋白激酶(RAF/mitogen-activated extracellular signal regulated kinase/extracellular regulated protein kinases, RAF/MEK/ERK) 通路的激活, 介导NETs形成。
1型糖尿病是一种自身免疫性疾病, 其发病机制是产生胰岛素的β细胞遭到破坏所导致的胰岛素缺乏。葡萄球菌核酸酶(staphylococcal nuclease) 能够使非肥胖糖尿病(non-obese diabetic, NOD) 小鼠中NETs水平降低, 并且显著降低了NOD小鼠的血糖水平以及炎症状态, 并且伴随NOD的发作推迟和小鼠死亡率降低[16]。
皮肤作为人体重要的免疫器官, 是人体免疫系统的“第一道防线”, 发挥了重要的作用。银屑病是一种常见的慢性免疫性皮肤病, 其临床特征为皮肤上界限分明的红斑、伴有白色的鳞屑。除了对皮肤的损害, 一部分患者还可能伴有关节疼痛和畸形等症状, 严重影响了患者的身体健康与生活质量[5]。Hu等[17]对48例银屑病患者以及48例健康受试者的外周血样本进行分析, 发现银屑病患者外周血中发生NETosis的中性粒细胞数量明显较多, 表明NETs的形成与银屑病发病密切相关, 而NETs在其中起了关键的诱导作用, 众所周知, 辅助性T细胞17 (T helper cell 17, Th17) 分泌产生白细胞介素-17 (interleukin-17, IL-17) 是银屑病发病的重要机制, 而NETs可以诱导CD4+ T细胞获得Th17细胞表型并分泌IL-17A, 促进银屑病发生[18]。除此之外, 研究者还对银屑病患者的NETs形成通路进行了研究, 结果表明NETs能够直接与角质形成细胞相互作用并激活Toll样受体4/白细胞介素-36受体(Toll like receptor 4/interleukin-36 receptor, TLR4/IL-36R) 通路, 随后介导髓样分化因子88 (myeloid differentiation factor 88, MyD88)/NF-κB下游信号通路, 这导致了细胞因子和趋化因子的表达增加, 进一步导致免疫细胞(包括中性粒细胞) 在炎症反应中的激活, 加重银屑病的炎症反应。值得注意的是, TLR4抑制剂能够减轻银屑病模型小鼠中炎症反应, 并且减少NETs形成, 因此NETs/TLR4可能为银屑病治疗的潜在靶标[19]。除了TLR4之外, TLR8和TLR13也在银屑病中发挥重要功能, 银屑病患者中性粒细胞中含有大量可以与RNA结合形成复合体的抗菌肽(LL37), LL37-RNA通过TLR8/TLR13通路促进细胞因子和NETs的释放进而加剧炎症反应, 加重银屑病症状[20]。除此之外, Haskamp等[21]在泛发性脓疱型银屑病个体中进行了全外显子组测序, 发现其编码MPO的基因发生突变, 研究表明, MPO是机体炎症的调节剂, 可调控NETs的形成。因此, MPO或其下游蛋白可作为银屑病中诱导炎症消退的潜在靶标。
2.2 NETs与消化系统疾病肠道是人体重要的消化器官, 肠道相关的炎症性疾病如溃疡性结肠炎(ulcerative colitis, UC) 和坏死性小肠结肠炎(necrotizing enterocolitis, NEC) 等严重威胁人类健康。病原体是介导肠道感染的关键触发性介质, 柠檬酸杆菌(citrobacter) 感染会导致人食物中毒, 引起腹泻等症状, 受柠檬酸杆菌感染的野生型小鼠结肠中NETs的形成增加, 在14天时便能抑制感染; 而对于不能形成NETs的Pad4-/-小鼠, 则伴有加重的炎症反应, 且在11~14天达到感染峰值。用脱氧核糖核酸酶1 (deoxyribonuclease 1, DNase1) 或PAD4抑制剂处理野生型小鼠, 破坏其NETs的产生, 均会导致感染加重。因此, NETs在柠檬酸杆菌诱导的肠道炎症模型中具有抗感染功能, 对机体进行保护[22]。
UC是一种慢性炎症性肠病, 典型的症状是血性腹泻、腹痛和体弱。UC患者结肠中NETs及其相关蛋白过表达, 中性粒细胞能够响应肿瘤坏死因子-α (tumor necrosis factor-α, TNF-α) 的刺激产生NETs, 并激活ERK1/2蛋白表达, 增强TNF-α和IL-1β的产生。抑制NETs释放能够有效缓解小鼠结肠炎症反应[23]。此外, Angelidou等[24]提出DNA损伤诱导转录因子4/DNA损伤反应调节基因1 (DNA damage inducible transcript 4/regulated in development and DNA damage responses 1, DDIT4/REDD1) 蛋白在结肠中表达能够促进NETs产生, 介导UC特异性炎症反应。
NEC是一种多发于早产婴儿的破坏性胃肠疾病, 该疾病的特征在于白细胞在肠组织中浸润, 后期可发展为细胞坏死、穿孔, 并伴有肠道炎症反应, 甚至导致机体死亡。Chaaban等[25]收集了婴儿血液和肠道组织样本, 并且构建NEC小鼠模型, 研究发现NETs抑制剂Cl-Amidine能够增加NEC样肠损伤模型小鼠的全身炎症, 导致器官损伤, 增加了小鼠死亡率。因此, 机体对NETs的调控能力对NEC预防与治疗至关重要。
除了肠道以外, 肝脏在体内也发挥着重要的消化功能, 作为人体最大的实质性消化器官, 肝脏能够分泌胆汁, 从而促进小肠对食物的消化和吸收。肝脏缺血再灌注(ischemia reperfusion, I/R) 损伤主要指氧气迅速注入缺血组织, 导致肝脏内细胞死亡和组织坏死, 这是肝移植手术中的一个难题, 而NETs在肝脏I/R中发挥重要作用: 其可通过TLR4依赖性途径促进血小板的凝集, 导致血栓造成的远端器官损伤。因此, 在机体急性炎症过程中抑制NETs的形成对保护肝脏以及远端器官免受损伤十分重要[26]。肝窦内皮细胞导致I/R期间的无菌性炎症损伤是肝脏手术后典型的应激反应, 在此期间, 肝窦内皮细胞能够释放IL-33, 诱导NETs的形成, 导致机体无菌炎症的过度产生以及炎症的级联反应, 造成肝脏损伤[27]。
酒精会引起肝脏的氧化应激反应, 损害肝脏正常功能, Bukong等[28]揭示了过度摄入酒精使机体对NETs的调控失衡, 导致肝脏损伤。在脂多糖(lipopolysaccharide, LPS) 刺激下, 过度摄入酒精的小鼠最开始表现为NETs形成减少, 并导致中性粒细胞在肝脏的弥漫性分布, 15 h后表现出巨噬细胞对NETs的清除受损, 导致NETs含量增加。有趣的是, 除了酒精, 运动也会对NETs含量产生影响, Yazdani等[29]研究了运动训练对患癌小鼠肝脏的影响: 相比于缺乏运动组, 运动训练组小鼠肝脏组织坏死显著减少, 伴随着NETs形成减少和炎症反应消退。因此, 运动训练可减轻肝脏的炎症反应, 保护肝脏免受损伤和抑制肿瘤生长。
非酒精性脂肪性肝炎(non-alcoholic steatohepatitis, NASH) 是一种慢性炎症性疾病, van der Windt等[30]发现NASH患者血清中NETs含量比正常人更多, 并且在NASH模型小鼠的肝脏中观察到中性粒细胞浸润和NETs形成, 随后是单核细胞衍生的巨噬细胞浸润、炎性细胞因子的产生, 最终导致肝癌的发生。通过DNase1处理或Pad4-/-小鼠, 均抑制了NETs形成并改善了肝脏炎症, 最终抑制了肿瘤生长。因此, NETs抑制剂可降低NASH向肝癌发展的可能性。
ERK和p38丝裂原活化蛋白酶(p38 mitogen-activated protein kinase, p38 MAPK) 通路是肝脏中调节NETs的重要通路, 并且ROS在其中起关键作用。鞘氨醇1-磷酸受体能够通过ERK/p38 MAPK/ROS通路, 介导中性粒细胞由凋亡向NETosis的转化, 从而增加NETs的含量, 引起炎症反应加剧, 加重脂肪肝症状[31], 除此之外, 介导慢性乙型病毒性肝炎的乙型肝炎病毒(hepatitis B virus, HBV) 也能够通过下调ROS依赖性的ERK和p38 MAPK的活化, 从而抑制NETs的释放, 以逃脱被捕获的危险, NETs在抗HBV感染中发挥了积极作用[32]。
作为人体内的一种消化液, 胆汁由肝脏分泌并在胆囊中进行浓缩、储存, 而NETs能够在胆囊中促进胆结石的形成, 其具体机制为介导钙和胆固醇晶体在胆汁中的聚集, 并且胆固醇晶体能够诱导NETs的形成, 该过程依赖于ROS的产生, 因此通过抑制PAD4和ROS的产生, 或使用美托洛尔(metoprolol) 抑制中性粒细胞形成NETs, 能够有效抑制体内胆结石的形成[33]。
2.3 NETs与循环系统疾病研究显示, NETs在机体循环系统中起重要作用, 其能够介导血小板和纤维蛋白凝结, 阻塞血管甚至导致血栓, Jiménez-Alcázar等[34]提出: 血管内DNase1和DNase1样蛋白3 (deoxyribonuclease 1 like protein 3, DNASEL3) 能够控制NETs的含量, 在没有两种DNase的情况下, NETs会介导血管阻塞、形成血栓并造成器官损伤, 作者进一步研究发现, DNase1和DNASEL3是独立表达的, 为机体提供了双重保护, 免受NETs的不利影响。值得注意的是, 过度的NETosis会介导钙黏蛋白的水解、内皮细胞-细胞间的接触功能受损, 导致血管渗漏。Pieterse等[35]表明NETs中NE可能是血管渗漏的潜在治疗靶点, 抑制其生理功能能够缓解炎症状态下NETs介导的血管渗漏和促纤维化过程。Aldabbous等[36]研究首次提出NETs与血管生成相关, 其在体外通过MPO/TLR4/NF-κB信号依赖性途径诱导血管生成。
血管与心脏的炎症会介导机体循环系统障碍、威胁健康。抗中性粒细胞胞浆抗体(antineutrophil cytoplasmic antibody, ANCA) 通过与受体相互作用蛋白激酶1/3 (receptor-interacting protein kinases 1/3, RIPKs 1/3) 互作, 诱导中性粒细胞激活以及NETs生成, 从而导致内皮细胞损伤, 介导了ANCA相关的血管炎[37]。除此之外, 腺苷(adenosine) 也对NETs释放具有促进作用, 其能够通过ROS和PAD依赖性途径触发NETs形成, 引发机体血管炎[38]。然而, 以中期因子(midkine) 为靶点, 能够减弱体内NETs形成和中性粒细胞的浸润, 显著减少疾病的炎症反应。因此, 中期因子以及NETs具有作为治疗心脏炎症的新型治疗靶标的潜力[39]。
败血症是指病原体通过入侵人体的血液循环系统并在其中进行繁殖, 引发全身感染, Biron等[40]发现, NETs在败血症中起关键性作用, 而NETs抑制剂Cl-Amidine能够抑制NETs形成, 提高败血症模型小鼠的存活率。铜是机体生存代谢中重要的微量元素, 铜在体内的水平受到铜转运腺嘌呤核苷三磷酸(adenosine triphosphate, ATP) 酶如ATP7A和ATP7B的影响。Cichon等[41]构建了铜过量以及缺乏的小鼠模型: Wilson (ATP7B突变体) 和Menkes (ATP7A突变体) 探究疾病中铜对血管内毒素血症期间NETs形成的影响。结果表明, Wilson病模型小鼠中, 铜过量虽然能够影响中性粒细胞对NETs的形成能力, 但并非关键条件, 揭示了生物体内微环境能够影响NETs释放。
2.4 NETs与泌尿系统疾病肾脏是人体泌尿系统中的重要器官, 其主要功能是产生含有代谢废物的尿液, 肾脏炎症是由免疫介导的炎症介质(如补体、细胞因子和ROS等) 引起的, 以血尿和蛋白尿等为特征, 可能会引起血管栓塞和慢性肾炎最终导致肾功能衰竭。双酚A (bisphenol A) 在工业上用于生产酚醛树脂, 是一种常见的环境污染物, 能够在体内导致肾功能受损和肾脏形态改变, 包括肾小球系膜基质扩张和肾间质成纤维细胞增殖, 并伴随肾脏系统中NETosis, 诱发慢性肾损伤。Tong等[42]在慢性肾损伤小鼠血清中可以检测到NETs沉积在肾脏中。通过DNase1给药抑制NETs后, 双酚A诱导的损伤显著缓解。
缺血再灌注是患者发生急性肾损伤的常见原因, 而NETs在缺血再灌注诱导的急性肾损伤中起关键作用。Raup-Konsavage等[43]在小鼠肾脏缺血再灌注24 h后发现, 机体浸润的白细胞中PAD4表达增强, 并伴随着组蛋白的瓜氨酸化。相比之下, Pad4缺陷小鼠不形成NETs、降低了促炎细胞因子的表达, 因此, DNase1或PAD特异性抑制剂YW3-56, 可部分预防肾脏I/R诱导的急性肾损伤。
肾衰竭是一种常见的癌症相关疾病, 一半以上癌症患者患有肾衰竭。为了减轻肾脏负担, 使毒性作用最小化, 癌症患者通常会减小抗癌药物的剂量, 导致治疗效果欠佳。血管内肿瘤诱发的NETs的形成是肿瘤小鼠肾损伤的一个原因。患有癌症的小鼠的肾脏大多具有可逆的病理学症状, 通过用DNase1或PAD4抑制剂去除NETs, 可恢复患有癌症的小鼠的肾功能。除此之外, PAD4抑制剂还能够抑制肿瘤诱导的全身炎症和外周血管灌注受损, 这为预防癌症患者肾衰竭提供了新的理论基础[44]。
2.5 NETs与呼吸系统疾病肺部是同外部环境相通的重要脏器, 因此必须做好准备以识别并消除病原体, NETs能够杀灭病原体, 在肺部免疫反应中占据重要的地位。
急性肺损伤是由于肺部受到各种直接或间接损伤引起气体交换障碍, 导致急性低氧性呼吸衰竭综合征[45]。急性肺损伤患者存在过度炎症介导的机体免疫反应, 而NETs可能在其中作为固有免疫和适应性免疫之间的桥梁[46]。香烟烟雾提取物作为中性粒细胞NETosis的重要促进剂, 其诱导的NETs能够驱动固有免疫中浆细胞样树突状细胞的活化, 从而激活Th1和Th17, 并且启动T细胞介导的免疫应答。Pedrazza等[45]首次提出了间充质干细胞(mesenchymal stem cells, MSCs) 能够抑制NETs形成的假设。MSCs通过调节肺部炎症, 减少氧化损伤, 从而抑制LPS诱导的小鼠肺损伤, 提高小鼠存活率。细胞间的相互作用能够影响机体信号传导, 对维持机体内环境平衡至关重要, NADPH氧化酶2 (NADPH oxidase 2, Nox2) 能够调节血小板活化, 缺乏Nox2基因的小鼠外周血中性粒细胞与血小板之间的相互作用降低, 这引起了肺泡腔中中性粒细胞浸润, 为NETs的形成和组织损伤创造了条件, 即Nox2基因缺陷型小鼠会产生全身炎症反应综合征, 并且引起深度肺损伤[47]。除此之外, 中性粒细胞和巨噬细胞间相互作用也在急性肺损伤患者中起重要作用, 并且NETs在其中通过促进巨噬细胞向M1表型极化, 来促进机体炎症反应, 因此使用NETs抑制剂治疗可显著下调M1巨噬细胞数量并上调M2巨噬细胞数量, 减少机体炎症反应, 缓解急性肺损伤[48]。Gan等[49]对急性肺损伤患者体内信号通路进行研究, 研究显示, 聚肌胞苷酸(polyinosinic acid-polycytidylic acid, Poly I: C) 通过激活p38 MAPK和降低紧密连接蛋白的表达, 增强肺组织中中性粒细胞和NETs的含量, 诱发机体炎症反应, 主要表现为细胞因子IL-1β显著升高, 最终诱导急性肺损伤。阻断Poly I: C的受体TLR3, 能够抑制炎症反应和NETs的形成。
纤维化是一种炎症相关疾病, 机体组织过度纤维化具体表现为器官中实质细胞的减少和纤维结缔组织的增加, 导致器官结构和功能的破坏, 影响人类健康甚至威胁生命[50]。Suzuki等[51]研究发现纤维化程度与NETs表达相关, 除此之外, 年龄也会对机体纤维化造成影响, 老龄人的器官更易受损。Martinod等[52]猜想这是由于NETosis在老龄动物中的发生更为普遍, 研究发现Pad4缺乏降低了NETs在肺部的含量, 抑制纤维化基因的表达、肺泡上皮细胞和肺血管内皮细胞数量的减少, 在年龄相关器官纤维化中起积极的调节作用, 因此PAD4可作为肺纤维化治疗的潜在靶点。Zhang等[53]则揭示了NETs能够通过TLR9/微小RNA-7/细胞信号转导分子2 (microRNA-7/ mothers against decapentaplegic homolog 2, miR-7/ Smad2) 信号通路参与肺成纤维细胞的增殖以及向肌成纤维细胞的分化, 加速了间质性肺疾病的发展并促进肺纤维化。Gray等[54]对囊性纤维化患者中性粒细胞进行研究, 结果显示其具有与囊性纤维化跨膜传导调节蛋白功能缺失相关的表型, 可以导致NETs产生, 诱导组织炎症。Skopelja-Gardner等[55]揭示了LasR基因突变能够为囊性纤维化致病病原体——铜绿假单胞菌带来生存优势, 缺乏LasR的铜绿假单胞菌菌株无法在人和小鼠中性粒细胞中诱导NETs形成, 抑制了宿主炎症免疫反应, 缓解囊性纤维化症状。
急性呼吸窘迫综合征(acute respiratory distress syndrome, ARDS) 是一种由肺上皮细胞和毛细血管内皮细胞功能障碍介导的炎症性疾病, 伴有肺泡巨噬细胞和中性粒细胞浸润、细胞凋亡、坏死和NETosis发生[56, 57]。NETs在体内的平衡对机体至关重要, Lefrançais等[58]在严重细菌性肺炎小鼠模型中检测到NETs, 并且甲酰肽受体2 (formylpeptide receptor 2, Fpr2) 缺乏导致NETs在体内含量增多, 这促使小鼠肺损伤和死亡率增加。然而, Pad4敲除小鼠虽然显著减少了NETs形成, 但体内细菌增加并伴随过度炎症, 同样导致了机体损伤。因此, Fpr2激动剂具有在ARDS中调节NETs形成的潜力。由此可见, NETs的数量对预防肺损伤、维持微生物数量平衡以及机体内环境的稳态具有重要的意义。
慢性阻塞性肺病(chronic obstructive pulmonary disease, COPD) 是一种致死率高的炎性呼吸系统疾病, 其病理特征包括持续气流受限和肺部慢性炎症, COPD患者的疾病严重程度与NETs的水平相关[59]。Dicker等[60]发现COPD重症患者的痰液中NETs形成增加, 气管中性粒细胞在体外吞噬细菌能力减弱, 并且伴有气管微生物群多样性的丧失。此外, 其他因素也可以导致COPD的病发, 镉是一种工业重金属, 若过度暴露于镉污染的环境中则会引起机体过度激活免疫系统引发COPD。Wang等[61]研究了镉诱导的NETs对肺损伤的潜在影响, 结果表明: 镉处理显著增加了支气管肺泡灌洗液中NETs的含量并破坏了肺组织的结构完整性, DNase1能够明显地改善上述病症, 对该病理机制的深入研究发现, 镉通过激活Nox、ERK1/2和p38 MAPK信号通路诱导NETs形成, 该研究为镉诱导的COPD提供新的理论依据。
2.6 NETs与新型冠状病毒肺炎(COVID-19)COVID-19会引发肺炎或ARDS, 主要表现为血清中的细胞因子水平升高、气道黏液分泌增多、引发肺损伤和血栓[62]。截至2020年10月, COVID-19已导致全球110万人死亡, 而NETs在体内含量与COVID-19严重程度相关[63, 64]。COVID-19重症患者最常见的宿主反应是外周血中性粒细胞的异常激活, 这成为了NETs的主要来源[8]。进一步研究表明, COVID-19患者NETs主要存在于肺部间质的气道隔室和富含中性粒细胞的炎症区域, 而发生NETosis的中性粒细胞多存在于微动脉血栓处[65]。
COVID-19能够通过血管紧张素转换酶Ⅱ和丝氨酸蛋白酶介导, 引起NETs高表达, 从而诱导肺上皮细胞死亡、造成肺组织损伤[66]。Middleton等[63]从人脐带血中发现内源性NETs抑制因子(NET-inhibitory factor, nNIF), 该肽段是一种丝氨酸蛋白酶抑制剂, 能够显著降低血浆中NETs的含量。COVID-19部分患者具有并发症, 例如糖尿病和心血管疾病, 均会增强体内炎症反应, 从而加重COVID-19的病情。因此, 靶向中性粒细胞或NETs开发新型药物, 可作为辅助治疗COVID-19的新策略[67]。
3 NETs抑制剂对炎症性疾病的改善作用NETs的平衡对机体维持健康与稳态十分重要, 因此, 通过药物能够降低NETs在体内的含量, 改善由于其累积所导致的疾病。NETs的过量生成是其在体内累积的关键因素, 乳铁蛋白(lactoferrin) 作为NETs的组成部分, 在接到机体刺激信号后能够从细胞质转移到质膜, 抑制NETs的产生, 其可以单独作为药物和营养品使用, 也可以作为药物辅助剂, 减缓机体的炎症反应[68]。抗氧化剂大麻二酚(cannabidiol)[69]以及人们熟知的抗生素红霉素(erythromycin)[70]均能够抑制NETs的形成, 分别在银屑病以及COPD治疗中起积极作用, 其中红霉素能够阻断髓系树突状细胞的活化, 以及Th1和Th17在体外的分化, 抑制香烟引起的肺部炎症。Frangou等[71]则通过靶向抑制各阶段NETosis来抑制NETs的形成。例如, ET-1受体拮抗剂波生坦(bosentan) 和HIF-1α抑制剂L-抗坏血酸(L-ascorbic acid) 能够破坏NETosis的上游通路; 自噬抑制剂羟基胆碱(oxycholine) 可以阻止NETosis的发生; 靶向IL-17A通路的药物苏金单抗(secukinumab) 能够抑制NETosis的下游通路等。除此之外, NETs的生成抑制剂在临床上也得到广泛的应用: 富马酸二甲酯(dimethyl fumarate) 作为中、重度银屑病患者的一线临床用药, 不仅能够特异性地抑制NETs生成, 也能够介导机体炎症反应消退, 具体表现为ROS减少[72]。利妥昔(rituxan, 抗CD20单抗) 和贝利木(belimumab, IgG1γ单抗) 联合用药也能够减少NETs以及自身抗体的形成, 显著改善重症SLE患者的临床症状[73]。
除了生成过量, 降解受损也是NETs在体内过量累积的关键因素, 二甲双胍(metformin) 能够改善NETs清除受损现象, 具体机制为AMPK活化以及高迁移率族蛋白1特异性抑制, 其能降低ARDS患者肺部炎症、抑制肺泡损伤和肺纤维化进展, 成为ARDS的潜在治疗药物[74], 而托法替尼(tofacitinib, JAK抑制剂) 则能够同时调节NETs形成与降解, 并显著增加内皮依赖性血管舒张和内皮分化, 从而改善血管功能, 具有治疗血管损伤疾病的潜力[75]。
4 总结与展望2004年以来, NETs在炎症相关疾病中的作用以及发病机制逐渐受到人们的关注。临床及实验动物研究均提示, NETs参与了炎症相关疾病发病的不同环节, 在机体中作为固有免疫和适应性免疫之间的桥梁。研究表明, NETs发挥重要的杀菌作用, 同时也介导了炎症反应的发生发展。因此, NETs在体内的平衡对机体健康以及对内环境稳态的维持至关重要。
NETs的过度产生可能引发机体炎症级联反应, 造成器官损害甚至威胁生命。DNase1抑制剂和PAD4抑制剂作为抑制NETs的两大主力军, 在作用通路以及机制方面有待深入研究, 同时更多靶向NETs的新型抑制剂有待开发。近年来, NETs的新型抑制方式逐步进入研究人员的视野, 如NETs内泛素化蛋白以及对NETosis上下游通路的调节, 这些新发现对于机体生理功能的调节以及影响, 有待进一步研究。鉴于抑制NETs可能成为炎症相关疾病新的治疗方式, 深入研究其抗炎机制, 探明主要作用靶点, 并开发靶向药物, 具有重要的理论意义和临床前景。
NETs对体内病原体的杀灭发挥了不可或缺的作用, NETs的缺乏可能导致固有免疫系统能力衰退, 引发感染性疾病, 威胁人类健康。因此, 如何选择性抑制病理状态下的NETs而不干扰NETs的正常生理功能, 显得尤为重要。机体内环境失衡、外部环境的剧烈变化和药物等因素均能够造成机体对NETs调节的失控, 导致器官功能受损, 损害机体健康。因此, 进一步探究NETs在不同生理病理状态下的异同具有重要的研究意义。
作者贡献: 孙洋负责综述的指导和修改; 丁衍和瞿娇负责综述的撰写与修改。
利益冲突: 所有作者均声明不存在利益冲突。
| [1] |
Fernández-Ruiz I. Inflammation: NETs are involved in AAA[J]. Nat Rev Cardiol, 2018, 15: 257. |
| [2] |
Albrengues J, Shields MA, Ng D, et al. Neutrophil extracellular traps produced during inflammation awaken dormant cancer cells in mice[J]. Science, 2018, 361: eaao4227. DOI:10.1126/science.aao4227 |
| [3] |
Papayannopoulos V. Neutrophil extracellular traps in immunity and disease[J]. Nat Rev Immunol, 2018, 18: 134-147. DOI:10.1038/nri.2017.105 |
| [4] |
Jorch SK, Kubes P. An emerging role for neutrophil extracellular traps in noninfectious disease[J]. Nat Med, 2017, 23: 279-287. DOI:10.1038/nm.4294 |
| [5] |
Lee KH, Kronbichler A, Park DD, et al. Neutrophil extracellular traps (NETs) in autoimmune diseases: a comprehensive review[J]. Autoimmun Rev, 2017, 16: 1160-1173. DOI:10.1016/j.autrev.2017.09.012 |
| [6] |
Qian J, Li M, Zhao J, et al. Inflammation in SLE-PAH: good news or not?[J]. Ann Rheum Dis, 2019, 78: e135. DOI:10.1136/annrheumdis-2018-214605 |
| [7] |
Huang W, Wu J, Yang H, et al. Milk fat globule-EGF factor 8 suppresses the aberrant immune response of systemic lupus erythematosus-derived neutrophils and associated tissue damage[J]. Cell Death Differ, 2017, 24: 263-275. DOI:10.1038/cdd.2016.115 |
| [8] |
Barrera-Vargas A, Gómez-Martín D, Carmona-Rivera C, et al. Differential ubiquitination in NETs regulates macrophage responses in systemic lupus erythematosus[J]. Ann Rheum Dis, 2018, 77: 944-950. |
| [9] |
Hakkim A, Fürnrohr BG, Amann K, et al. Impairment of neutrophil extracellular trap degradation is associated with lupus nephritis[J]. Proc Natl Acad Sci U S A, 2010, 107: 9813-9818. DOI:10.1073/pnas.0909927107 |
| [10] |
Rother N, Pieterse E, Lubbers J, et al. Acetylated histones in apoptotic microparticles drive the formation of neutrophil extracellular traps in active lupus nephritis[J]. Front Immunol, 2017, 8: 1136. DOI:10.3389/fimmu.2017.01136 |
| [11] |
Lou H, Wojciak-Stothard B, Ruseva MM, et al. Autoantibody-dependent amplification of inflammation in SLE[J]. Cell Death Dis, 2020, 11: 729. DOI:10.1038/s41419-020-02928-6 |
| [12] |
Ummarino D. Rheumatoid arthritis: don't swallow the NETs[J]. Nat Rev Rheumatol, 2017, 13: 322. |
| [13] |
Bach M, Moon J, Moore R, et al. A neutrophil activation biomarker panel in prognosis and monitoring of patients with rheumatoid arthritis[J]. Arthritis Rheumatol, 2020, 72: 47-56. |
| [14] |
Carmona-Rivera C, Carlucci PM, Moore E, et al. Synovial fibroblast-neutrophil interactions promote pathogenic adaptive immunity in rheumatoid arthritis[J]. Sci Immunol, 2017, 2: eaag3358. DOI:10.1126/sciimmunol.aag3358 |
| [15] |
Carmona-Rivera C, Purmalek MM, Moore E, et al. A role for muscarinic receptors in neutrophil extracellular trap formation and levamisole-induced autoimmunity[J]. JCI Insight, 2017, 2: e89780. |
| [16] |
Lang J, Wang X, Liu K, et al. Oral delivery of staphylococcal nuclease by Lactococcus lactis prevents type 1 diabetes mellitus in NOD mice[J]. Appl Microbiol Biotechnol, 2017, 101: 7653-7662. DOI:10.1007/s00253-017-8480-5 |
| [17] |
Hu SC, Yu HS, Yen FL, et al. Neutrophil extracellular trap formation is increased in psoriasis and induces human β-defensin-2 production in epidermal keratinocytes[J]. Sci Rep, 2016, 6: 496-509. |
| [18] |
Lambert S, Hambro CA, Johnston A, et al. Neutrophil extracellular traps induce human Th17 cells: effect of psoriasis-associated TRAF3IP2 genotype[J]. J Invest Dermatol, 2019, 139: 1245-1253. DOI:10.1016/j.jid.2018.11.021 |
| [19] |
Shao S, Fang H, Dang E, et al. Neutrophil extracellular traps promote inflammatory responses in psoriasis via activating epidermal TLR4/IL-36R crosstalk[J]. Front Immunol, 2019, 10: 746. DOI:10.3389/fimmu.2019.00746 |
| [20] |
Herster F, Bittner Z, Archer NK, et al. Neutrophil extracellular trap-associated RNA and LL37 enable self-amplifying inflammation in psoriasis[J]. Nat Commun, 2020, 11: 105. DOI:10.1038/s41467-019-13756-4 |
| [21] |
Haskamp S, Bruns H, Hahn M, et al. Myeloperoxidase modulates inflammation in generalized pustular psoriasis and additional rare pustular skin diseases[J]. Am J Hum Genet, 2020, 107: 527-538. DOI:10.1016/j.ajhg.2020.07.001 |
| [22] |
Saha P, Yeoh BS, Xiao X, et al. PAD4-dependent NETs generation are indispensable for intestinal clearance of Citrobacter rodentium[J]. Mucosal Immunol, 2019, 12: 761-771. DOI:10.1038/s41385-019-0139-3 |
| [23] |
Dinallo V, Marafini I, Di Fusco D, et al. Neutrophil extracellular traps sustain inflammatory signals in ulcerative colitis[J]. J Crohns Colitis, 2019, 13: 772-784. DOI:10.1093/ecco-jcc/jjy215 |
| [24] |
Angelidou I, Chrysanthopoulou A, Mitsios A, et al. REDD1/autophagy pathway is associated with neutrophil-driven IL-1β inflammatory response in active ulcerative colitis[J]. J Immunol, 2018, 200: 3950-3961. DOI:10.4049/jimmunol.1701643 |
| [25] |
Chaaban H, Burge K, Eckert J, et al. Neutrophil extracellular trap inhibition increases inflammation, bacteraemia and mortality in murine necrotizing enterocolitis[J]. J Cell Mol Med, 2020. DOI:10.1111/jcmm.15338 |
| [26] |
Zhang H, Goswami J, Varley P, et al. Hepatic surgical stress promotes systemic immunothrombosis that results in distant organ injury[J]. Front Immunol, 2020, 11: 987. DOI:10.3389/fimmu.2020.00987 |
| [27] |
Yazdani HO, Chen HW, Tohme S, et al. IL-33 exacerbates liver sterile inflammation by amplifying neutrophil extracellular trap formation[J]. J Hepatol, 2018, 68: 130-139. DOI:10.1016/j.jhep.2017.09.010 |
| [28] |
Bukong TN, Cho Y, Iracheta-Vellve A, et al. Abnormal neutrophil traps and impaired efferocytosis contribute to liver injury and sepsis severity after binge alcohol use[J]. J Hepatol, 2018, 69: 1145-1154. DOI:10.1016/j.jhep.2018.07.005 |
| [29] |
Yazdani HO, Kaltenmeier C, Morder K, et al. Exercise training decreases hepatic injury via changes in immune response to liver ischemia/reperfusion in mice[J]. Hepatology, 2020. DOI:10.1002/hep.31552 |
| [30] |
van der Windt DJ, Sud V, Zhang H, et al. Neutrophil extracellular traps promote inflammation and development of hepatocellular carcinoma in nonalcoholic steatohepatitis[J]. Hepatology, 2018, 68: 1347-1360. DOI:10.1002/hep.29914 |
| [31] |
Zhao X, Yang L, Chang N, et al. Neutrophils undergo switch of apoptosis to NETosis during murine fatty liver injury via S1P receptor 2 signaling[J]. Cell Death Dis, 2020, 11: 1158-1172. |
| [32] |
Hu S, Liu X, Gao Y, et al. Hepatitis B virus inhibits neutrophil extracellular trap release by modulating reactive oxygen species production and autophagy[J]. J Immunol, 2019, 202: 805-815. DOI:10.4049/jimmunol.1800871 |
| [33] |
Muñoz LE, Boeltz S, Bilyy R, et al. Neutrophil extracellular traps initiate gallstone formation[J]. Immunity, 2019, 51: 443-450. DOI:10.1016/j.immuni.2019.07.002 |
| [34] |
Jiménez-Alcázar M, Rangaswamy C, Panda R, et al. Host DNases prevent vascular occlusion by neutrophil extracellular traps[J]. Science, 2017, 358: 1202-1206. DOI:10.1126/science.aam8897 |
| [35] |
Pieterse E, Rother N, Garsen M, et al. Neutrophil extracellular traps drive endothelial-to-mesenchymal transition[J]. Arterioscler Thromb Vasc Biol, 2017, 37: 1371-1379. DOI:10.1161/ATVBAHA.117.309002 |
| [36] |
Aldabbous L, Abdul-Salam V, McKinnon T, et al. Neutrophil extracellular traps promote angiogenesis: evidence from vascular pathology in pulmonary hypertension[J]. Arterioscler Thromb Vasc Biol, 2016, 36: 2078-2087. DOI:10.1161/ATVBAHA.116.307634 |
| [37] |
Schreiber A, Rousselle A, Becker JU, et al. Necroptosis controls NET generation and mediates complement activation, endothelial damage, and autoimmune vasculitis[J]. Proc Natl Acad Sci U S A, 2017, 114: E9618-E9625. DOI:10.1073/pnas.1708247114 |
| [38] |
Carmona-Rivera C, Khaznadar SS, Shwin KW, et al. Deficiency of adenosine deaminase 2 triggers adenosine-mediated NETosis and TNF production in patients with DADA2[J]. Blood, 2019, 134: 395-406. |
| [39] |
Weckbach LT, Grabmaier U, Uhl A, et al. Midkine drives cardiac inflammation by promoting neutrophil trafficking and NETosis in myocarditis[J]. J Exp Med, 2019, 216: 350-368. DOI:10.1084/jem.20181102 |
| [40] |
Biron BM, Chung CS, O'Brien XM, et al. Cl-Amidine prevents histone 3 citrullination and neutrophil extracellular trap formation, and improves survival in a murine sepsis model[J]. J Innate Immun, 2017, 9: 22-32. DOI:10.1159/000448808 |
| [41] |
Cichon I, Ortmann W, Bednarz A, et al. Reduced neutrophil extracellular trap (NET) formation during systemic inflammation in mice with menkes disease and Wilson disease: copper requirement for NET release[J]. Front Immunol, 2019, 10: 3021. |
| [42] |
Tong S, Yang S, Li T, et al. Role of neutrophil extracellular traps in chronic kidney injury induced by bisphenol-A[J]. J Endocrinol, 2019. DOI:10.1530/JOE-18-0608 |
| [43] |
Raup-Konsavage WM, Wang Y, Wang WW, et al. Neutrophil peptidyl arginine deiminase-4 has a pivotal role in ischemia/reperfusion-induced acute kidney injury[J]. Kidney Int, 2018, 93: 365-374. DOI:10.1016/j.kint.2017.08.014 |
| [44] |
Cedervall J, Dragomir A, Saupe F, et al. Pharmacological targeting of peptidylarginine deiminase 4 prevents cancer-associated kidney injury in mice[J]. Oncoimmunology, 2017, 6: e1320009. DOI:10.1080/2162402X.2017.1320009 |
| [45] |
Pedrazza L, Cunha AA, Luft C, et al. Mesenchymal stem cells improves survival in LPS-induced acute lung injury acting through inhibition of NETs formation[J]. J Cell Physiol, 2017, 232: 3552-3564. DOI:10.1002/jcp.25816 |
| [46] |
Qiu SL, Zhang H, Tang QY, et al. Neutrophil extracellular traps induced by cigarette smoke activate plasmacytoid dendritic cells[J]. Thorax, 2017, 72: 1084-1093. DOI:10.1136/thoraxjnl-2016-209887 |
| [47] |
Hook JS, Cao M, Potera RM, et al. Nox2 regulates platelet activation and NET formation in the lung[J]. Front Immunol, 2019, 10: 1472. DOI:10.3389/fimmu.2019.01472 |
| [48] |
Song C, Li H, Li Y, et al. NETs promote ALI/ARDS inflammation by regulating alveolar macrophage polarization[J]. Exp Cell Res, 2019, 382: 111486. DOI:10.1016/j.yexcr.2019.06.031 |
| [49] |
Gan T, Yang Y, Hu F, et al. TLR3 regulated poly I: C-induced neutrophil extracellular traps and acute lung injury partly through p38 MAP kinase[J]. Front Microbiol, 2018, 9: 3174. DOI:10.3389/fmicb.2018.03174 |
| [50] |
Rockey DC, Bell PD, Hill JA. Fibrosis-a common pathway to organ injury and failure[J]. N Engl J Med, 2015, 372: 1138-1149. DOI:10.1056/NEJMra1300575 |
| [51] |
Suzuki M, Ikari J, Anazawa R, et al. PAD4 deficiency improves bleomycin-induced neutrophil extracellular traps and fibrosis in mouse lung[J]. Am J Respir Cell Mol Biol, 2020. DOI:10.1165/rcmb.2019-0433OC |
| [52] |
Martinod K, Witsch T, Erpenbeck L, et al. Peptidylarginine deiminase 4 promotes age-related organ fibrosis[J]. J Exp Med, 2017, 214: 439-458. DOI:10.1084/jem.20160530 |
| [53] |
Zhang S, Jia X, Zhang Q, et al. Neutrophil extracellular traps activate lung fibroblast to induce polymyositis-related interstitial lung diseases via TLR9-miR-7-Smad2 pathway[J]. J Cell Mol Med, 2020, 24: 1658-1669. DOI:10.1111/jcmm.14858 |
| [54] |
Gray RD, Hardisty G, Regan KH, et al. Delayed neutrophil apoptosis enhances NET formation in cystic fibrosis[J]. Thorax, 2018, 73: 134-144. DOI:10.1136/thoraxjnl-2017-210134 |
| [55] |
Skopelja-Gardner S, Theprungsirikul J, Lewis KA, et al. Regulation of Pseudomonas aeruginosa-mediated neutrophil extracellular traps[J]. Front Immunol, 2019, 10: 1670. DOI:10.3389/fimmu.2019.01670 |
| [56] |
Yang CY, Chen CS, Yiang GT, et al. New insights into the immune molecular regulation of the pathogenesis of acute respiratory distress syndrome[J]. Int J Mol Sci, 2018, 19: 588. DOI:10.3390/ijms19020588 |
| [57] |
Mikacenic C, Moore R, Dmyterko V, et al. Neutrophil extracellular traps (NETs) are increased in the alveolar spaces of patients with ventilator-associated pneumonia[J]. Crit Care, 2018, 22: 358. DOI:10.1186/s13054-018-2290-8 |
| [58] |
Lefrançais E, Mallavia B, Zhuo H, et al. Maladaptive role of neutrophil extracellular traps in pathogen-induced lung injury[J]. JCI Insight, 2018, 3: e98178. DOI:10.1172/jci.insight.98178 |
| [59] |
Wright TK, Gibson PG, Simpson JL, et al. Neutrophil extracellular traps are associated with inflammation in chronic airway disease[J]. Respirology, 2016, 21: 467-475. DOI:10.1111/resp.12730 |
| [60] |
Dicker AJ, Crichton ML, Pumphrey EG, et al. Neutrophil extracellular traps are associated with disease severity and microbiota diversity in patients with chronic obstructive pulmonary disease[J]. J Allergy Clin Immuno, 2018, 141: 117-127. DOI:10.1016/j.jaci.2017.04.022 |
| [61] |
Wang C, Wei Z, Han Z, et al. Neutrophil extracellular traps promote cadmium chloride-induced lung injury in mice[J]. Environ Pollut, 2019, 254: 113021. DOI:10.1016/j.envpol.2019.113021 |
| [62] |
Yang CX, Qu J, Liu YT, et al. Immune imbalance mechanism and intervention strategy in patients with coronavirus disease 2019(COVID-19)[J]. Chin Pharmacol Bull (中国药理学通报), 2020, 36: 445-453. |
| [63] |
Middleton EA, He XY, Denorme F, et al. Neutrophil extracellular traps contribute to immunothrombosis in COVID-19 acute respiratory distress syndrome[J]. Blood, 2020, 136: 1169-1179. DOI:10.1182/blood.2020007008 |
| [64] |
Zuo Y, Yalavarthi S, Shi H, et al. Neutrophil extracellular traps in COVID-19[J]. JCI Insight, 2020, 5: e138999. |
| [65] |
Radermecker C, Detrembleur N, Guiot J, et al. Neutrophil extracellular traps infiltrate the lung airway, interstitial, and vascular compartments in severe COVID-19[J]. J Exp Med, 2020, 217: e20201012. DOI:10.1084/jem.20201012 |
| [66] |
Veras FP, Pontelli MC, Silva CM, et al. SARS-CoV-2-triggered neutrophil extracellular traps mediate COVID-19 pathology[J]. J Exp Med, 2020, 217: e20201129. DOI:10.1084/jem.20201129 |
| [67] |
Tomar B, Anders HJ, Desai J, et al. Neutrophils and neutrophil extracellular traps drive necroinflammation in COVID-19[J]. Cells, 2020, 9: 1383. DOI:10.3390/cells9061383 |
| [68] |
Okubo K, Kamiya M, Urano Y, et al. Lactoferrin suppresses neutrophil extracellular traps release in inflammation[J]. EBioMedicine, 2016, 10: 204-215. DOI:10.1016/j.ebiom.2016.07.012 |
| [69] |
Kraaij T, Kamerling SWA, de Rooij ENM, et al. The NET-effect of combining rituximab with belimumab in severe systemic lupus erythematosus[J]. J Autoimmun, 2018, 91: 45-54. DOI:10.1016/j.jaut.2018.03.003 |
| [70] |
Zhang H, Qiu SL, Tang QY, et al. Erythromycin suppresses neutrophil extracellular traps in smoking-related chronic pulmonary inflammation[J]. Cell Death Dis, 2019, 10: 678. DOI:10.1038/s41419-019-1909-2 |
| [71] |
Frangou E, Chrysanthopoulou A, Mitsios A, et al. REDD1/autophagy pathway promotes thromboinflammation and fibrosis in human systemic lupus erythematosus (SLE) through NETs decorated with tissue factor (TF) and interleukin-17A (IL-17A)[J]. Ann Rheum Dis, 2019, 78: 238-248. DOI:10.1136/annrheumdis-2018-213181 |
| [72] |
Hoffmann JHO, Schaekel K, Hartl D, et al. Dimethyl fumarate modulates neutrophil extracellular trap formation in a glutathione- and superoxide-dependent manner[J]. Br J Dermatol, 2018, 178: 207-214. DOI:10.1111/bjd.15839 |
| [73] |
Wójcik P, Garley M, Wroński A, et al. Cannabidiol modifies the formation of NETs in neutrophils of psoriatic patients[J]. Int J Mol Sci, 2020, 21: 6795. DOI:10.3390/ijms21186795 |
| [74] |
Grégoire M, Uhel F, Lesouhaitier M, et al. Impaired efferocytosis and neutrophil extracellular trap clearance by macrophages in ARDS[J]. Eur Respir J, 2018, 52: 1702590. DOI:10.1183/13993003.02590-2017 |
| [75] |
Furumoto Y, Smith CK, Blanco L, et al. Tofacitinib ameliorates murine lupus and its associated vascular dysfunction[J]. Arthritis Rheumatol, 2017, 69: 148-160. DOI:10.1002/art.39818 |
 2021, Vol. 56
2021, Vol. 56


