前列腺癌是最常见的恶性肿瘤之一, 也是世界范围内男性癌症死亡的主要原因[1]。前列腺癌通常发生在老年人群中, 病情发展缓慢, 在早期并无明显症状, 进展到达后期会出现尿频、排尿困难和尿血等症状, 并可能转移至其他部位, 一般患者被发现时已是癌症晚期。目前, 对前列腺癌的治疗方法主要有手术根治性切除、放疗、化疗和内分泌治疗等。治疗的常规思路是降低患者体内的雄激素水平, 临床上可通过外科手术去势或雄激素剥脱疗法(androgen deprivation therapy, ADT) 达到这一目的。这种手段初期可有较好的效果, 但多数患者会出现复发并最终进展为去势抵抗性前列腺癌(castration-resistant prostate cancer, CRPC)[2, 3]。因此, 对CRPC的治疗仍然是人类面临的一个巨大挑战。细胞周期相关转录因子1 (E2F transcription factor 1, E2F1) 是细胞周期相关转录因子E2F家族第一个被发现的成员[4], 近年来研究发现E2F1在多种肿瘤的发生发展中具有重要调控作用[5-7]。在前列腺癌中, E2F1的异常表达与细胞增殖、侵袭转移、代谢重编程、周期调控、雄激素受体(androgen receptor, AR) 通路改变等有着密切关联[8-11]。本文对E2F1在前列腺癌中调控作用作一综述。
1 E2F1概述 1.1 E2F转录因子家族E2F最初被认为是一种细胞因子, 可与腺病毒E2基因启动子结合[12, 13], 后来发现E2F是在高等真核生物中编码转录因子家族的一组基因, 其中3个为转录活化因子(E2F1、E2F2和E2F3a), 另外6个为抑制因子(E2F3b、E2F4~E2F8)[14]。这些因子都参与了哺乳动物细胞的细胞周期调控和DNA合成。随着研究发现, E2F家族蛋白包含高度保守的DNA结合域, 可以与靶基因启动子结合, 在转录水平抑制和激活调控细胞增殖、凋亡和分化相关的基因, 在哺乳动物细胞周期的G1/S期转变过程中扮演着重要角色。活化因子和抑制因子可以与口袋蛋白结合。其中, E2F1、E2F2和E2F3仅与视网膜母细胞瘤蛋白(retinoblastoma, RB) 结合, E2F5主要与视网膜母细胞瘤样蛋白2 (retinoblastoma-like protein 2, p130) 结合, 而E2F4可与任何口袋蛋白结合, E2F6~E2F8由于缺少与口袋蛋白结合的结构域而缺乏该作用[14-16]。
E2F1是该转录因子家族中最具代表性的一员, E2F1的表达水平上升与肿瘤高分期和肿瘤转移存在着重要联系, 并且与肿瘤患者的不良预后密切相关[17]。利用DNA微阵列技术对E2F1基因靶点进行全基因组分析, 发现了大量在细胞复制、凋亡、检查点控制和DNA修复等过程中受E2F1调控的基因[18]。
1.2 E2F1生物学功能视网膜母细胞瘤基因1 (RB transcriptional corepressor 1, RB1) 是最早发现的肿瘤抑制基因, 编码一个928氨基酸的磷酸化蛋白RB, 它诱导细胞G1期阻滞。RB在细胞周期中被磷酸化和去磷酸化, 在增殖细胞中, 磷酸化(无活性) 形式占主导地位, 而在静止或正在分化的细胞中, 非磷酸化(活性) 形式通常更为丰富[19]。RB在细胞周期调控中发挥着重要作用, 是多种肿瘤细胞发生致瘤突变的关键靶点。
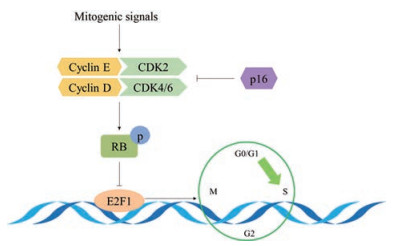
E2F转录因子家族结合位点存在于多种与周期相关基因的启动子中, 由于RB可以结合在E2F1转录活性结构域, 因此推断它可以抑制E2F1转录活性。这一猜想在体外实验中得到证实, RB在缺乏其他辅抑制因子的情况下抑制了E2F1的转录激活[20]。在静息和G0期细胞中, RB与E2F1结合抑制其活性。当细胞促有丝分裂信号通过细胞周期蛋白D (cyclin D)-周期蛋白依赖性激酶4/6 (cyclin-dependent kinase 4/6, CDK4/6) 与细胞周期蛋白E (cyclin E)-周期蛋白依赖性激酶2 (cyclin-dependent kinase 2, CDK2) 复合物转导使RB磷酸化, E2F1从RB的口袋结构域解离, E2F1得以活化。E2F1活化后触发其靶基因的转录, 促进组织细胞从G1期进入S期。E2F1在细胞周期G1/S聚集, 表达增高, 对细胞周期进程起促进作用, 在S期或G2期被细胞S期激酶相关蛋白2 (S-phase kinase associated protein 2, Skp2) 快速降解而失活[15, 21-23]。细胞周期蛋白依赖的激酶抑制剂2A (cyclin-dependent kinase inhibitor 2A, CDKN2A) 是一种肿瘤抑制基因, 编码细胞周期蛋白依赖性激酶抑制剂, 该基因翻译可表达几种不同亚型, 其中p16通过干扰细胞周期蛋白与CDK4/6的结合来抑制RB磷酸化, 从而阻止E2F1的激活[24]。多项研究已经证明了RB/E2F1通路在平衡增殖和凋亡方面的重要作用(图 1)。
|
Figure 1 Regulation of RB-E2F1 in cell cycle. Mitogenic signals activate cyclin D-CDK4/6 and cyclin E-CDK2 pathways, leading to phosphoration of RB, which causes E2F1 to be freed to activate proliferation genes. p16 blocks binding between cyclin D and CDK4/6 as a CDKs inhibitor. RB: Retinoblastoma; E2F1: E2F transcription factor 1; CDK: Cyclin-dependent kinase |
上世纪90年代, 研究人员就发现在原发性前列腺癌样本中存在RB基因的缺失[25, 26]。随着人们对疾病认识的深入, 发现RB基因缺失与前列腺癌进展为CRPC有着密切联系[27, 28], 尤其是在具有神经内分泌功能的小细胞癌中[29]。在上述RB-E2F1通路中, p16、cyclin D-CDK4/6、cyclin E/CDK2、RB等相关的基因突变与癌症发生密切, 因此, RB通路的缺失成为细胞癌变的标志性特征。
2.1 RB-E2F1通路在细胞周期与增殖方面的作用在人类肿瘤细胞中, 常见可以通过基因过表达、翻译后修饰、基因扩增和RB释放调节E2F1活性[14, 30]。在前列腺癌中, E2F1通常以RB通路的中断和E2F1状态的改变的方式被激活。然而, 这些途径并不是相互独立的, 例如RB缺失增加了前列腺癌中E2F1的异常表达。这其中, E2F1的翻译后修饰在前列腺癌中较少表现出来[31]。
在体外研究中, RB基因缺失使得RB-E2F1复合物形成受阻, 导致E2F1活性增强及其靶基因激活, 说明RB-E2F1在前列腺癌的发生发展中起到周期调控作用[32]。在体内模型中, 同样发现RB基因缺失导致小鼠前列腺过度增生并且与E2F1调控的周期相关基因活性增加有关[33, 34]。在条件性敲除小鼠中, 同时敲除RB与p53可以协同性地促进转移性前列腺癌发生[35]。
值得注意的是, 最近有文献报道RB的缺失(基因组缺失或突变) 与RB失活(CDK介导的磷酸化) 引起的E2F1介导的转录存在明显的不同, 以及在前列腺癌的发生发展中有着不同的作用[36]。RB失活与肿瘤细胞过度增殖的表型相关, 而RB缺失却不然。在LNCaP细胞中, 通过敲低RB蛋白表达不足以促进细胞增殖, 尤其是在雄激素存在的条件下[37]。而RB缺失诱导的E2F1重编程与CRPC阶段肿瘤侵袭性表型具有临床相关性[36]。
此外, 在该通路上cyclin-CDK通路的改变也可以使得RB磷酸化失活, 促进细胞增殖。除了上游有丝分裂信号通路活性增加可以激活cyclin-CDK外, 该通路组分或其调节剂的活性异常也是其上调的主要原因。其一是通过上调上游cyclin-CDK复合物的组分来实现, 如cyclin D1、CDK4和cyclin E等[38, 39]。在LNCaP细胞中, 过表达上游调控因子cyclin D可以促进细胞生长, 增强其致癌性[40]。有文献报道, 在人前列腺癌中, 发生突变的抑癌基因PTEN可以上调cyclin D, 从而使RB磷酸化而失活[41]。另一方面可以通过CDK抑制因子(p16INK4A和p27Kip1) 的缺失实现[38, 42]。CDK的活性受INK4蛋白家族控制, 其中就抑制肿瘤活性而言, p16INK4A被认为是最具相关性的抑制因子[43]。DNA突变、p16基因缺失、启动子区域过度甲基化都会导致p16失活, 促进肿瘤细胞生长[44]。
2.2 RB-E2F1通路在其他方面的作用最近研究中发现, 与癌旁正常组织相比, 透明质酸介导的细胞游走受体(receptor for hyaluronan mediated motility, RHAMM) 在前列腺癌组织中表达明显升高。RB/E2F1可以结合在RHAMM启动子区域, 上调RHAMM表达, 介导细胞上皮-间充质转化(epithelial-mesenchymal transition, EMT) 和迁移侵袭[9]。
DNA解旋酶RecQL4 (RecQ like helicase 4) 是人类RecQ解旋酶家族的一员, 在转移性前列腺癌中高表达, 是促进肿瘤生长的关键因子。RB-E2F1可以结合在启动子区域, 发挥对其的调控作用。在这项研究中, 前列腺癌细胞和组织中RB过度磷酸化与RecQL4表达具有相关性。实验结果提示, 在前列腺癌中RecQL4表达的升高可能受RB-E2F1通路的调控[45]。
3 E2F1-AR通路在前列腺癌细胞中的调控作用AR在前列腺癌中对肿瘤生长发挥着关键作用。AR是类固醇激素受体超家族成员之一, 通过与雄激素结合后作为核转录因子控制靶基因的表达。AR可通过直接与DNA上AR结合序列(AR binding sequence, ARBS) 结合[46], 或者间接与其他转录因子相互作用发挥对下游基因的调控作用。复发进展为转移性前列腺癌的患者体内低水平的雄激素有助于维持AR受体活性, 可以对后续抑制雄激素合成或AR拮抗剂治疗产生反应[47, 48]。在正常前列腺中, AR通路激活促进前列腺上皮细胞分化, 减少细胞增殖; 而在前列腺癌中, AR通路起到促进细胞增殖的作用[49]。
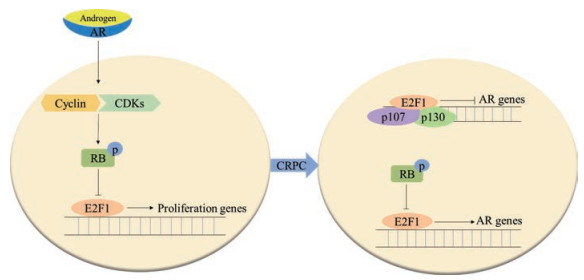
3.1 RB-E2F1与AR的相互作用RB-E2F1通路与AR存在复杂的相互作用, 早期发现天然或人工合成的雄激素激活AR可以诱导周期相关蛋白表达, 同时增强cyclin/CDK复合物的形成, 使RB磷酸化失活[50, 51]。随后, 染色质免疫沉淀实验验证了E2F1、E2F3、RB以及RB家族其他蛋白p107、p130可以结合到AR启动子上, 说明AR基因的转录可能受到RB-E2F复合物的调控[27, 49]。对前列腺组织样本的分析中显示, E2F1在良性和局限性前列腺癌中表达较低, 在激素治疗敏感的淋巴结转移患者中轻度升高, 在去势抵抗的前列腺癌患者转移组织中显著升高, 与AR表达趋势刚好相反[52]。在LNCaP细胞中过表达E2F1显著抑制了AR的转录和表达。并且ChIP实验结果显示, 口袋蛋白家族p107、p130与E2F1共同结合在AR启动子区域, 提示p107、p130可能与E2F1协同作用, 抑制AR活性[52]。随着研究深入, RB基因对E2F1的调控作用引起关注, 临床上CRPC患者样本表明, RB缺失、E2F1过表达与AR过表达之间存在相关性, RB缺失通过解除对E2F1的抑制从而诱导AR表达和活性增加[27], 这提示RB-E2F1-AR在CRPC的发展中起到关键作用。由此, E2F1对AR的调控作用可能与疾病进展阶段和个体差异等密切相关, 精确的调控机制还有待进一步阐明(图 2)。
|
Figure 2 RB-E2F1-AR interaction. Activated AR induces expression of cyclin D and enhances the formation of active CDK/cyclin complexes leading to phosphorylation of RB and transcription of E2F1 target genes. E2F1 binding with p107 and p130 could down-regulate the expression of AR. AR transcription is up-regulated by E2F1 through RB pathway in CRPC. AR: Androgen receptor; CRPC: Castration-resistant prostate cancer |
E2F1还可与AR相互作用发挥对其他基因的调控作用。细胞周期分裂蛋白6 (cell division cycle 6, CDC6) 是一种DNA复制起始的调节蛋白, 在调节复制前复合体的组装和保证DNA精确复制方面发挥着重要的作用。AR通过与CDC6启动子相互作用, 并以不同方式结合E2F1、E2F3形成复合物, 调控CDC6的转录[53]。
三磷酸腺苷酶家族蛋白2 (ATPase family AAA domain containing 2, ATAD2) 是AR与原癌蛋白MYC (proto-oncogene proteins MYC) 的共刺激因子, 通过ARBS受AR直接调控。ATAD2也受E2F1的调控。在ARBS与E2F1结合位点之间形成了ATAD2启动子区域上的DNA环, 从而实现了在雄激素依赖条件下AR与E2F1的功能协同作用。该研究还发现一些在前列腺癌中过表达并可能参与肿瘤发展的基因在其调控区域具有ARBS和E2F1结合位点, 并表现出与ATAD2相同的转录因子调节机制[11]。
细胞周期蛋白B1 (cyclin B1) 是调控细胞周期的关键蛋白, 有文献报道, 在缺少雄激素的条件下, E2F1可以结合到cyclin B1的启动子上, 启动cyclin B1的转录, 促进细胞周期进展。而在雄激素存在的情况下, 激活的AR与E2F1形成复合物, 并将其从E2F结合位点移除。同时, E2F4、视黄酸和甲状腺激素受体沉默中介蛋白(silencing mediator for retinoid and thyroid receptors, SMRT)、组蛋白去乙酰化酶3 (histone deacetylase 3, HDAC3) 从细胞质转运到细胞核, 结合在E2F结合位点, 阻断cyclin B1的转录, 抑制细胞增殖[54]。
尽管AR被视为一种促进前列腺癌生长的转录激活因子, 但也有研究表明AR可以以直接或间接的方式作为一种转录抑制因子发挥作用[55, 56]。在高浓度雄激素条件下, AR可以通过增强RB与E2F调控的DNA复制相关基因的结合, 与E2F协同作用抑制这些基因转录[57]。由此, AR在不同细胞及不同条件下发挥作用的分子机制还有待深入研究。
4 E2F1在前列腺癌中的其他调控作用许多受E2F1调控的基因在前列腺癌的发生发展的不同方面起到作用。在PC-3和DU145细胞中, 细胞中敲除E2F1后, 原肌球调节蛋白2 (tropomodulin 2, TMOD2) 与同种异体移植炎症因子1样(allograft inflammatory factor 1-like, AIF1L) 蛋白表达随之减少, 二者与癌细胞获得侵袭转移能力相关。在此基础上, 在PC-3细胞中过表达TMOD2可以增强细胞侵袭和迁移能力[58]。
E2F1还可以对细胞凋亡进程产生影响。在RB失活释放E2F1后, E2F1可以激活下游促凋亡基因, 如p73、凋亡蛋白酶活化因子-1 (apoptotic protease activating factor-1, APAF-1) 和桥接整合因子-1 (bridging integrator 1, BIN1), 诱导细胞凋亡[59, 60]。在LNCaP细胞中, 转录因子Dp家族成员3 (transcription factor Dp family member 3, TFDP3) 具有抑制E2F1诱导的凋亡作用, 而E2F1增加了TFDP3的表达, 提示TFDP3与E2F1之间存在负反馈回路[31]。
E2F1还可以通过翻译后修饰, 从转录因子转变为DNA修复调节因子在应对DNA损伤中发挥作用。并且RB可以在DNA双链断裂位点(double-strand breaks, DSBs) 与E2F1协同促进DNA末端切除和同源重组修复[61]。
最近有研究发现, 恩杂鲁胺与多西他赛联用对前列腺癌耐药细胞具有较好的抑制作用, 该作用是通过抑制E2F1转录和表达实现的。E2F1表达下调是通过E2F1启动子与AR转录本3 (androgen receptor variant 3, AR3) 片段特异性结合, 而非AR全长[62]。这提示AR与E2F1的相互作用在细胞耐药性方面也发挥作用。
此外, 在PC-3细胞中, E2F1还可以通过抑制一种与代谢相关的NAD+依赖的去乙酰化酶sirtuin6, 上调糖酵解途径中的关键因子, 增强糖酵解, 与细胞转移能力增强密切相关[63]。
5 结语E2F1通过调控参与细胞生长、增殖、侵袭和代谢等一系列细胞过程中许多基因的转录, 在前列腺癌的发生发展中起着至关重要的作用。随着对E2F家族在肿瘤中的广泛作用被揭示, 多项研究阐明E2F1可以作为潜在治疗靶点, 开发针对一个或多个E2F转录活化因子抑制剂是一个重要的抗肿瘤策略。早期研究探索了多种方法, 主要手段是阻断E2F的DNA结合位点, 抑制细胞增殖。在细胞中引入可以阻断E2F的DNA结合位点与DP1之间二聚化的多肽片段, 降低E2F1活性, 可诱导细胞G1期阻滞(一项研究中发现可以诱导细胞凋亡)[64]。随后, 有研究者利用小RNA与E2F1结合并封闭其DNA结合位点[64], 达到抑制E2F1介导的下游基因转录的目的。此外, 有研究者开发一种作为E2F的DNA结合位点的“诱饵”寡核苷酸片段, 可以抑制E2F激活内源性目标[64]。根据这种思路, 近年也有从噬菌体中分离出的可以与E2F1序列结合的肽段, 可以下调E2F1活性, 在体内具有抑制肿瘤生长的作用[65]。
此外, 针对E2F1上游CDK的抑制剂开发也为发现新的抗肿瘤药物提供选择。CDK抑制剂作用于RB上游, 抑制RB磷酸化失活发挥作用, 这类药物需要RB保持完整基因和活性, 在RB缺失的患者中并不适用。而在RB缺失的CRPC阶段, 有文献报道其在体内外对卡巴他赛(第二代紫杉醇) 治疗有很高的敏感性[66]。在DU145细胞中, 靶向血管内皮生长因子(vascular endothelial growth factor, VEGF) 的shRNA与紫杉醇联合应用具有协同作用, 显著提高抑瘤率[67]。另外, 由于RB与AR的相互作用, RB失活可能会影响抗雄激素治疗的疗效。由于E2F1在不同细胞背景和环境条件下表现出不同的特性, 对E2F1更深入的探索, 针对前列腺癌进展的不同阶段和患者个体基因差异选择开发更具有针对性和特异性的药物还有很长的路。
| [1] |
Siegel RL, Miller KD, Jemal A. Cancer statistics, 2019[J]. CA Cancer J Clin, 2019, 69: 7-34. DOI:10.3322/caac.21551 |
| [2] |
Watson PA, Arora VK, Sawyers CL. Emerging mechanisms of resistance to androgen receptor inhibitors in prostate cancer[J]. Nat Rev Cancer, 2015, 15: 701-711. DOI:10.1038/nrc4016 |
| [3] |
Sumanasuriya S, De Bono J. Treatment of advanced prostate cancer-a review of current therapies and future promise[J]. Cold Spring Harbor Perspect Med, 2018, 8: a030635. DOI:10.1101/cshperspect.a030635 |
| [4] |
Pützer BM, Engelmann D. E2F1 apoptosis counterattacked: evil strikes back[J]. Trends Mol Med, 2013, 19: 89-98. DOI:10.1016/j.molmed.2012.10.009 |
| [5] |
Ramos-Montoya A, Lamb AD, Russell R, et al. HES6 drives a critical AR transcriptional programme to induce castration-resistant prostate cancer through activation of an E2F1-mediated cell cycle network[J]. EMBO Mol Med, 2014, 6: 651-661. DOI:10.1002/emmm.201303581 |
| [6] |
Rouaud F, Hamouda-Tekaya N, Cerezo M, et al. E2F1 inhibition mediates cell death of metastatic melanoma[J]. Cell Death Dis, 2018, 9: 527. DOI:10.1038/s41419-018-0566-1 |
| [7] |
Wang B, Ma A, Zhang L, et al. POH1 deubiquitylates and stabilizes E2F1 to promote tumour formation[J]. Nat Commun, 2015, 6: 8704. DOI:10.1038/ncomms9704 |
| [8] |
Hallstrom TC, Mori S, Nevins JR. An E2F1-dependent gene expression program that determines the balance between proliferation and cell death[J]. Cancer Cell, 2008, 13: 11-22. DOI:10.1016/j.ccr.2007.11.031 |
| [9] |
Thangavel C, Boopathi E, Liu Y, et al. RB loss promotes prostate cancer metastasis[J]. Cancer Res, 2017, 77: 982-995. DOI:10.1158/0008-5472.CAN-16-1589 |
| [10] |
Blanchet E, Annicotte JS, Lagarrigue S, et al. E2F transcription factor-1 regulates oxidative metabolism[J]. Nat Cell Biol, 2011, 13: 1146-1152. DOI:10.1038/ncb2309 |
| [11] |
Altintas D, Shukla MS, Goutte-Gattat D, et al. Direct cooperation between androgen receptor and E2F1 reveals a common regulation mechanism for androgen-responsive genes in prostate cells[J]. Mol Endocrinol, 2012, 26: 1531-1541. DOI:10.1210/me.2012-1016 |
| [12] |
Attwooll C, Denchi EL, Helin K. The E2F family: specific functions and overlapping interests[J]. EMBO J, 2004, 23: 4709-4716. DOI:10.1038/sj.emboj.7600481 |
| [13] |
Dimova DK, Dyson NJ. The E2F transcriptional network: old acquaintances with new faces[J]. Oncogene, 2005, 24: 2810-2826. DOI:10.1038/sj.onc.1208612 |
| [14] |
Chen HZ, Tsai SY, Leone G. Emerging roles of E2Fs in cancer: an exit from cell cycle control[J]. Nat Rev Cancer, 2009, 9: 785-797. DOI:10.1038/nrc2696 |
| [15] |
Polager S, Ginsberg D. E2F-at the crossroads of life and death[J]. Trends Cell Biol, 2008, 18: 528-535. DOI:10.1016/j.tcb.2008.08.003 |
| [16] |
Xanthoulis A, Tiniakos DG. E2F transcription factors and digestive system malignancies: how much do we know?[J]. World J Gastroenterol, 2013, 19: 3189. DOI:10.3748/wjg.v19.i21.3189 |
| [17] |
Lee JS, Leem SH, Lee SY, et al. Expression signature of E2F1 and its associated genes predict superficial to invasive progression of bladder tumors[J]. J Clin Oncol, 2010, 28: 2660-2667. DOI:10.1200/JCO.2009.25.0977 |
| [18] |
Udayakumar T, Shareef MM, Diaz DA, et al. The E2F1/Rb and p53/MDM2 pathways in DNA repair and apoptosis: understanding the crosstalk to develop novel strategies for prostate cancer radiotherapy[J]. Semin Radiat Oncol, 2010, 20: 258-266. DOI:10.1016/j.semradonc.2010.05.007 |
| [19] |
Chen PL, Scully P, Shew JY, et al. Phosphorylation of the retinoblastoma gene product is modulated during the cell cycle and cellular differentiation[J]. Cell, 1989, 58: 1193-1198. DOI:10.1016/0092-8674(89)90517-5 |
| [20] |
Harbour JW, Dean DC. The Rb/E2F pathway: expanding roles and emerging paradigms[J]. Genes Dev, 2000, 14: 2393-2409. DOI:10.1101/gad.813200 |
| [21] |
van den Heuvel S, Dyson NJ. Conserved functions of the pRB and E2F families[J]. Nat Rev Mol Cell Biol, 2008, 9: 713-724. DOI:10.1038/nrm2469 |
| [22] |
Poppy Roworth A, Ghari F, La Thangue NB. To live or let die-complexity within the E2F1 pathway[J]. Mol Cell Oncol, 2015, 2: e970480. DOI:10.4161/23723548.2014.970480 |
| [23] |
Marti A, Wirbelauer C, Scheffner M, et al. Interaction between ubiquitin-protein ligase SCF SKP2 and E2F-1 underlies the regulation of E2F-1 degradation[J]. Nat Cell Biol, 1999, 1: 14-19. DOI:10.1038/8984 |
| [24] |
Bottillo I, Valiante M, Menale L, et al. A novel CDKN2A in-frame deletion associated with pancreatic cancer-melanoma syndrome[J]. Dermatol Online J, 2020, 26: 12. |
| [25] |
Bookstein R, Allred DC. Recessive oncogenes[J]. Cancer, 1993, 71: 1179-1186. DOI:10.1002/1097-0142(19930201)71:3+<1179::AID-CNCR2820711442>3.0.CO;2-B |
| [26] |
Carter BS, Ewing CM, Ward WS, et al. Allelic loss of chromosomes 16q and 10q in human prostate cancer[J]. Proc Natl Acad Sci U S A, 1990, 87: 8751-8755. DOI:10.1073/pnas.87.22.8751 |
| [27] |
Sharma A, Yeow WS, Ertel A, et al. The retinoblastoma tumor suppressor controls androgen signaling and human prostate cancer progression[J]. J Clin Invest, 2010, 120: 4478-4492. DOI:10.1172/JCI44239 |
| [28] |
Hamid AA, Gray KP, Shaw G, et al. Compound genomic alterations of TP53, PTEN, and RB1 tumor suppressors in localized and metastatic prostate cancer[J]. Eur Urol, 2019, 76: 89-97. DOI:10.1016/j.eururo.2018.11.045 |
| [29] |
Tan HL, Sood A, Rahimi HA, et al. Rb loss is characteristic of prostatic small cell neuroendocrine carcinoma[J]. Clin Cancer Res, 2014, 20: 890-903. DOI:10.1158/1078-0432.CCR-13-1982 |
| [30] |
Kent LN, Leone G. The broken cycle: E2F dysfunction in cancer[J]. Nat Rev Cancer, 2019, 19: 326-338. DOI:10.1038/s41568-019-0143-7 |
| [31] |
Chun JN, Cho M, Park S, et al. The conflicting role of E2F1 in prostate cancer: a matter of cell context or interpretational flexibility?[J]. Biochim Biophys Acta Rev Cancer, 2020, 1873: 188336. DOI:10.1016/j.bbcan.2019.188336 |
| [32] |
Davis JN, McCabe MT, Hayward SW, et al. Disruption of Rb/E2F pathway results in increased cyclooxygenase-2 expression and activity in prostate epithelial cells[J]. Cancer Res, 2005, 65: 3633-3642. DOI:10.1158/0008-5472.CAN-04-3129 |
| [33] |
Wang Y, Hayward SW, Donjacour AA, et al. Sex hormone-induced carcinogenesis in Rb-deficient prostate tissue[J]. Cancer Res, 2000, 60: 6008-6017. |
| [34] |
Maddison LA, Sutherland BW, Barrios RJ, et al. Conditional deletion of Rb causes early stage prostate cancer[J]. Cancer Res, 2004, 64: 6018-6025. DOI:10.1158/0008-5472.CAN-03-2509 |
| [35] |
Zhou Z, Flesken-Nikitin A, Corney DC, et al. Synergy of p53 and Rb deficiency in a conditional mouse model for metastatic prostate cancer[J]. Cancer Res, 2006, 66: 7889-7898. DOI:10.1158/0008-5472.CAN-06-0486 |
| [36] |
McNair C, Xu K, Mandigo AC, et al. Differential impact of RB status on E2F1 reprogramming in human cancer[J]. J Clin Invest, 2018, 128: 341-358. |
| [37] |
Sharma A, Comstock CE, Knudsen ES, et al. Retinoblastoma tumor suppressor status is a critical determinant of therapeutic response in prostate cancer cells[J]. Cancer Res, 2007, 67: 6192-6203. DOI:10.1158/0008-5472.CAN-06-4424 |
| [38] |
Sherr CJ, Beach D, Shapiro GI. Targeting CDK4 and CDK6:from discovery to therapy[J]. Cancer Discov, 2016, 6: 353-367. DOI:10.1158/2159-8290.CD-15-0894 |
| [39] |
Asghar U, Witkiewicz AK, Turner NC, et al. The history and future of targeting cyclin-dependent kinases in cancer therapy[J]. Nat Rev Drug Discov, 2015, 14: 130-146. DOI:10.1038/nrd4504 |
| [40] |
Chen Y, Martinez LA, LaCava M, et al. Increased cell growth and tumorigenicity in human prostate LNCaP cells by overexpression to cyclin D1[J]. Oncogene, 1998, 16: 1913-1920. DOI:10.1038/sj.onc.1201719 |
| [41] |
Radu A, Neubauer V, Akagi T, et al. PTEN induces cell cycle arrest by decreasing the level and nuclear localization of cyclin D1[J]. Mol Cell Biol, 2003, 23: 6139-6149. DOI:10.1128/MCB.23.17.6139-6149.2003 |
| [42] |
Knudsen ES, Knudsen KE. Tailoring to RB: tumour suppressor status and therapeutic response[J]. Nat Rev Cancer, 2008, 8: 714-724. DOI:10.1038/nrc2401 |
| [43] |
Hamilton E, Infante JR. Targeting CDK4/6 in patients with cancer[J]. Cancer Treat Rev, 2016, 45: 129-138. DOI:10.1016/j.ctrv.2016.03.002 |
| [44] |
Steiner MS, Wang Y, Zhang Y, et al. p16/MTS1/INK4A suppresses prostate cancer by both pRb dependent and independent pathways[J]. Oncogene, 2000, 19: 1297-1306. DOI:10.1038/sj.onc.1203428 |
| [45] |
Su Y, Meador JA, Calaf GM, et al. Human RecQL4 helicase plays critical roles in prostate carcinogenesis[J]. Cancer Res, 2010, 70: 9207-9217. DOI:10.1158/0008-5472.CAN-10-1743 |
| [46] |
Cleutjens KB, van Eekelen CC, van der Korput HA, et al. Two androgen response regions cooperate in steroid hormone regulated activity of the prostate-specific antigen promoter[J]. J Biol Chem, 1996, 271: 6379-6388. DOI:10.1074/jbc.271.11.6379 |
| [47] |
De Bono JS, Logothetis CJ, Molina A, et al. Abiraterone and increased survival in metastatic prostate cancer[J]. N Eng J Med, 2011, 364: 1995-2005. DOI:10.1056/NEJMoa1014618 |
| [48] |
Scher HI, Fizazi K, Saad F, et al. Increased survival with enzalutamide in prostate cancer after chemotherapy[J]. N Eng J Med, 2012, 367: 1187-1197. DOI:10.1056/NEJMoa1207506 |
| [49] |
Antony L, Van Der Schoor F, Dalrymple SL, et al. Androgen receptor (AR) suppresses normal human prostate epithelial cell proliferation via AR/β-catenin/TCF-4 complex inhibition of c-MYC transcription[J]. Prostate, 2014, 74: 1118-1131. DOI:10.1002/pros.22828 |
| [50] |
Hofman K, Swinnen JV, Verhoeven G, et al. E2F activity is biphasically regulated by androgens in LNCaP cells[J]. Biochem Biophys Res Commun, 2001, 283: 97-101. DOI:10.1006/bbrc.2001.4738 |
| [51] |
Taneja SS, Ha S, Garabedian MJ. Androgen stimulated cellular proliferation in the human prostate cancer cell line LNCaP is associated with reduced retinoblastoma protein expression[J]. J Cell Biochem, 2002, 84: 188-200. DOI:10.1002/jcb.1278 |
| [52] |
Davis JN, Wojno KJ, Daignault S, et al. Elevated E2F1 inhibits transcription of the androgen receptor in metastatic hormone-resistant prostate cancer[J]. Cancer Res, 2006, 66: 11897-11906. DOI:10.1158/0008-5472.CAN-06-2497 |
| [53] |
Mallik I, Davila M, Tapia T, et al. Androgen regulates Cdc6 transcription through interactions between androgen receptor and E2F transcription factor in prostate cancer cells[J]. Biochim Biophys Acta Mol Cell Res, 2008, 1783: 1737-1744. DOI:10.1016/j.bbamcr.2008.05.006 |
| [54] |
Li Y, Zhang DY, Ren Q, et al. Regulation of a novel androgen receptor target gene, the cyclin B1 gene, through androgen-dependent E2F family member switching[J]. Mol Cell Biol, 2012, 32: 2454-2466. DOI:10.1128/MCB.06663-11 |
| [55] |
Cai C, He HH, Chen S, et al. Androgen receptor gene expression in prostate cancer is directly suppressed by the androgen receptor through recruitment of lysine-specific demethylase 1[J]. Cancer Cell, 2011, 20: 457-471. DOI:10.1016/j.ccr.2011.09.001 |
| [56] |
Zhao JC, Yu J, Runkle C, et al. Cooperation between polycomb and androgen receptor during oncogenic transformation[J]. Genome Res, 2012, 22: 322-331. DOI:10.1101/gr.131508.111 |
| [57] |
Gao S, Gao Y, He HH, et al. Androgen receptor tumor suppressor function is mediated by recruitment of retinoblastoma protein[J]. Cell Rep, 2016, 17: 966-976. DOI:10.1016/j.celrep.2016.09.064 |
| [58] |
Zhou Q, Wang C, Zhu Y, et al. Key genes and pathways controlled by E2F1 in human castration-resistant prostate cancer cells[J]. Onco Targets Ther, 2019, 12: 8961-8976. DOI:10.2147/OTT.S217347 |
| [59] |
Indovina P, Pentimalli F, Casini N, et al. RB1 dual role in proliferation and apoptosis: cell fate control and implications for cancer therapy[J]. Oncotarget, 2015, 6: 17873-17890. DOI:10.18632/oncotarget.4286 |
| [60] |
Kinney EL, Tanida S, Rodrigue AA, et al. Adenovirus E1A oncoprotein liberates c-Myc activity to promote cell proliferation through abating Bin1 expression via an Rb/E2F1-dependent mechanism[J]. J Cell Physiol, 2008, 216: 621-631. DOI:10.1002/jcp.21437 |
| [61] |
Manickavinayaham S, Velez-Cruz R, Biswas AK, et al. The E2F1 transcription factor and RB tumor suppressor moonlight as DNA repair factors[J]. Cell Cycle, 2020, 19: 2260-2269. DOI:10.1080/15384101.2020.1801190 |
| [62] |
Xu J, Yang X, Deshmukh D, et al. The role of crosstalk between AR3 and E2F1 in drug resistance in prostate cancer cells[J]. Cells, 2020, 9: 1094. DOI:10.3390/cells9051094 |
| [63] |
Wu M, Seto E, Zhang J. E2F1 enhances glycolysis through suppressing Sirt6 transcription in cancer cells[J]. Oncotarget, 2015, 6: 11252-11263. DOI:10.18632/oncotarget.3594 |
| [64] |
Kaelin J, William G. E2F1 as a target: promoter-driven suicide and small molecule modulators[J]. Cancer Biol Ther, 2003, 2: 47-53. DOI:10.4161/cbt.202 |
| [65] |
Xie X, Bansal N, Shaik T, et al. A novel peptide that inhibits E2F transcription and regresses prostate tumor xenografts[J]. Oncotarget, 2014, 5: 901-907. DOI:10.18632/oncotarget.1809 |
| [66] |
de Leeuw R, Berman-Booty LD, Schiewer MJ, et al. Novel actions of next-generation taxanes benefit advanced stages of prostate cancer[J]. Clin Cancer Res, 2015, 21: 795-807. DOI:10.1158/1078-0432.CCR-14-1358 |
| [67] |
Li BW, Zhang M, He HW, et al. Synergic effects of the combination of VEGF-targeted shRNA and taxol on human prostate cancer DU145 both in vitro and in vivo[J]. Acta Pharm Sin (药学学报), 2009, 44: 296-302. |
 2021, Vol. 56
2021, Vol. 56


