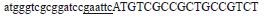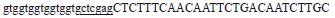2. 包头医学院, 内蒙古 包头 014060
2. Baotou Medical College, Baotou 014060, China
白木香Aquilaria sinensis (Lour.) Gilg为瑞香科沉香属植物, 是《中国药典》中名贵中药材沉香的唯一植物基原[1]。白木香树在受到自然因素(如雷劈、火烧、微生物感染等) 或人为因素(如刀斧砍伤、接菌、化学试剂刺激等) 的作用下, 在伤口附近逐渐形成含有特殊香味的树脂, 这种含有树脂的木材称为沉香[2]。沉香为临床常用名贵中药, 具有行气止痛、温中止呕、纳气平喘等功效, 用于治疗胸腹胀闷疼痛、胃寒呕吐呃逆、肾虚气逆喘急[1]。现代药理研究表明, 沉香具有镇痛、镇静、抗菌、抗炎、改善心肌缺血、抗肿瘤等药理作用[3]。除了药用外, 沉香在香薰和香水产业、工艺品制造及收藏等方面都占有非常重要的地位[4]。但自然条件下, 沉香的形成极其困难, 形成周期异常漫长, 加上部分商业炒作等, 导致优质沉香的价格贵比黄金, 被称为“木中钻石”[5]。受巨大的利益驱使, 野生产香树种遭到毁灭性的砍伐, 野生白木香因此被列为国家二级濒危保护植物, 同时也被列入《濒危野生动植物国际贸易公约》 (ITES, 华盛顿公约)[6]。为了缓解沉香的资源危机, 我国在广东、海南、广西等地开始大规模的人工种植白木香, 国内学者还创造性的发明了人工输液结香技术, 极大程度的提高了结香效率[7, 8]。但与自然条件下经历漫长周期形成的沉香相比, 人工结香技术快速生产的沉香在质量和香味上还有一定差距, 在资源的利用效率(如单株成年白木香树经人工结香技术处理后最终产沉香的量) 上也有很大的提升空间。因此, 彻底阐明白木香树受到外界刺激后产生沉香的分子机制, 并在此基础上对结香的过程进行人为的干预, 进一步提高结香的效率和质量, 是当前彻底解决沉香资源危机的关键。
目前, “诱导防御反应结香”假说被普遍接受, 白木香在受到外界生物或非生物胁迫时, 诱发自我防御反应, 进而引起一系列与植物体防御反应相关的基因表达, 并伴随着防御反应物质的合成[2]。国内外学者在沉香特征性成分倍半萜的生物合成与调控研究方面取得了系列进展, 对于解析沉香形成的分子机制具有重要意义[9-14]。但植物体自身的防御反应机制异常复杂, 除了从特征性防御物质合成机制进行研究外, 利用比较转录组测序结果结合体外组织培养技术, 挖掘与白木香自身防御反应相关基因, 尝试从不同角度和维度解析沉香形成的分子机制倍受关注[15-17]。有研究发现, 外加合适浓度的内源黄酮类化合物可辅助白木香植株应对机械和化学损伤, 同时可干预白木香中黄酮类化合物的合成, 提示内源黄酮类化合物在白木香应对损伤的过程中发挥重要作用[18]。为了进一步探究黄酮类成分合成与白木香防御反应间可能的相关性, 基于课题组前期对白木香转录组测序结果, 从白木香愈伤组织中成功克隆鉴定了一个黄酮类成分生物合成的关键酶查尔酮异构酶(AsCHI1), 并对该查尔酮异构酶基因AsCHI1在非生物胁迫和植物激素处理条件下的表达模式进行考察, 为研究白木香中黄酮类成分的合成与白木香防御反应的相关性提供参考。
材料与方法材料 白木香愈伤组织由课题组培养制备, 方法简介如下: 取白木香幼嫩叶片, 切成1 cm左右小段。2.5%的次氯酸钠溶液表面消毒10 min, 再用70%乙醇消毒30 s后, 用无菌蒸馏水洗涤4次。处理过的叶片置于含2 μg·mL-1 α-萘乙酸(NAA) 和1 μg·mL-1 6-苄氨基腺嘌呤(6-BA) 的MS培养基中, 避光室温下诱导培养1个月后, 将生成的愈伤组织继代于含2 μg·mL-1 NAA、1 μg·mL-1 6-BA、1 μg·mL-1 2, 4-D、1 μg·mL-1 VB5和1 μg·mL-1 6-糠基氨基嘌呤(KT) 的新鲜MS培养基中继代培养。
大肠杆菌(E. coli) DH5α、BL21 (DE3), 购自天根生物科技有限公司; pET28a (Novagen) 由本实验室保存。柚皮素查尔酮(2', 4, 4', 6'-四羟基查尔酮, 纯度≥98%) 和异甘草素(2', 4, 4'-三羟基查尔酮, 纯度≥98%) 标准品均购自上海源叶生物科技有限公司。
RNA的提取与cDNA的合成 取新鲜的白木香愈伤组织(300~500 mg), 按照植物RNA快速提取试剂盒(Omega, Cat R6827) 实验操作步骤进行总RNA提取, 利用NanoDrop 2000C检测RNA浓度, 同时利用1.2%琼脂糖凝胶电泳检测RNA的完整性和质量。使用反转录酶M-MLV (Sigma, Cat M1302) 将白木香的总RNA反转录为第一链(cDNA), 实验操作遵照说明书进行。
AsCHI1基因序列全长克隆 利用课题组前期对白木香愈伤组织转录组测序数据[16], 分析挖掘出1个具有完整开放阅读框的AsCHI基因, 依据该序列设计两端特异性引物(AsCHI-F, AsCHI-R), 引物序列见表 1。以白木香总RNA的反转录产物为模板, 利用表 1中特异引物对AsCHI1基因进行扩增, 扩增体系为: cDNA 2 µL、10×Pyrobest Buffer Ⅱ 5 µL、dNTP Mix (2.5 mmol·L-1) 4 µL、Pyrobest DNA Polymerase (5 U·µL-1) 0.25 µL、10 µmol·L-1引物各2 µL, 终体积为50 µL。反应条件为: 94 ℃预变性5 min; 然后进行35个循环: 94 ℃ 40 s, 56 ℃ 30 s, 72 ℃ 1 min, 程序循环结束后72 ℃延伸反应10 min。1%的琼脂糖凝胶电泳检测PCR产物, 切胶回收。将回收后的PCR产物与pMD19-T连接, 转化到DH5α菌株后培养, 测序确认。
| 表 1 Primers used in this study |
AsCHI1蛋白的生物信息学分析 利用在线软件ProtParam预测蛋白结构参数; 通过ExPASY中的SOPMA工具分析蛋白质序列的二级结构; 利用SWISS-MODEL Workspace在线分析软件构建蛋白质三级结构模型; 利用软件TMHMM 2.0进行蛋白质跨膜结构分析; 利用DNAMAN将AsCHI1与其他物种的CHI氨基酸序列进行同源性比对; 通过MEGA 6.0软件构建Neighbor-joining系统进化树, 进化距离的计算采用泊松校正法, Bootstrap重复次数为1 000次。
AsCHI1原核表达载体的构建及异源表达 设计带有酶切位点的引物AsCHI-FE和AsCHI-RX (表 1), 扩增AsCHI1的CDS区(除去终止密码子)。通过EcoR Ⅰ和Xho I双酶切pET-28a表达载体, 获得其线性化载体。将目的片段与线性化的pET-28a载体按摩尔比为2∶1混合, 在Exnase Ⅱ连接酶的催化下, 37 ℃反应30 min。将重组产物转入大肠杆菌DH5α中, 涂布于含有卡那霉素的LB固体培养基上37 ℃过夜培养, 挑选阳性菌落抽提质粒进行测序验证。
经测序验证后的pET28a-AsCHI1质粒转入E. coli BL21 (DE3) 中, 挑选阳性菌落接种到10 mL含50 μg·mL-1卡那霉素的LB培养基中, 37 ℃下200 r·min-1过夜活化。把活化后的菌液按照1∶100比例接种到适量新鲜含有50 μg·mL-1卡那霉素的LB液体培养基中, 37 ℃下培养至菌液OD600为0.4~0.6时加入终浓度为0.8 mmol·L-1的异丙基-β-D-硫代半乳糖苷(IPTG), 调节温度至20 ℃继续振荡培养16 h; 4 ℃、12 000 r·min-1离心收集菌体, 于40 mmol·L-1 KPB缓冲液(pH 7.0, 含有100 mmol·L-1 NaCl和5 mmol·L-1咪唑) 中超声破碎提取, 破碎液7 500 r·min-1离心30 min, 上清液用0.45 µm滤膜过滤后上样于预平衡好的Ni2+螯合树脂亲和色谱柱, 先以20 mmol·L-1 KPB缓冲液(pH 7.0, 含有500 mmol·L-1 NaCl和40 mmol·L-1咪唑) 洗脱除去杂蛋白, 再以15 mmol·L-1 KPB缓冲液(pH 7.5, 含10%甘油和500 mmol·L-1咪唑) 洗脱目的蛋白。目的蛋白经超滤管(10 kDa, Millipore) 离心浓缩脱盐后, 于20 mmol·L-1 KPB缓冲液(pH 7.5, 含10%甘油和1 mmol·L-1 EDTA) 中4 ℃保存。
AsCHI1酶活性测定 酶活性分析于室温(25 ℃) 250 μL反应体积中进行, 将2 μg纯化的重组AsCHI1蛋白加入到50 mmol·L-1 KPB (pH 7.5) 缓冲液中孵育1 min, 迅速加入50 μmol·L-1底物, 继续孵育反应5 min, 立即加入500 μL乙酸乙酯终止反应并连续萃取两次, 真空离心除去溶剂, 加入100 μL甲醇复溶, 0.45 μm滤膜滤过, 吸取20 µL注入液相色谱仪(色谱柱: Eclipse XDB-C18, 4.6 mm×250 mm, 5 µm) 进行分析。当以柚皮素查尔酮为底物时, 流动相洗脱梯度: 0~40 min, 45%甲醇; 40~50 min, 95%甲醇; 当以异甘草素为底物时, 流动相洗脱梯度: 0~25 min, 30%甲醇; 25~35 min, 95%甲醇; 流速: 1.0 mL·min-1。质谱(Shimadzu LCMS-IT-TOF质谱仪) 分析条件: 电喷雾离子源(ESI), 扫描模式为正、负离子同时扫描并自动触发多级质谱, MS1的质量扫描范围m/z 100~1 000, MS2的质量扫描范围m/z 50~1 000。喷雾室电压4.5, -3.5 kV; 雾化气(N2) 流量1.5 L·min-1; 干燥气体压力100 MPa; 检测电压1.5 kV; CDL温度200 ℃; 碰撞诱导解离(CID) 能量为70%。
AsCHI1在不同胁迫及诱导条件下的表达分析 选取室温下培养20 d后, 长势相同的愈伤组织, 分别转移至含NaCl (150 mmol·L-1)、CdCl2 (500 µmol·L-1)、甘露醇(750 mmol·L-1)、脱落酸(ABA) (150 µmol·L-1)、赤霉素GA3 (150 µmol·L-1)、水杨酸(SA) (1 µmol·L-1)的培养基上进行培养, 同时设置低温(4 ℃) 处理组和未处理正常培养对照组。各组样品分别于处理后0、12、24、36和48 h取样并提取总RNA。
利用实时荧光定量PCR检测在不同处理条件下不同时间点的表达情况。分析使用SYBR Green I荧光染料法, 在qRT-PCR仪上进行。选取白木香β-actin基因作为目标基因定量表达的内参基因, 引物序列见表 1。反应体系为: 2×PerfectStartTM Green qPCR SuperMix 5 μL、上下游引物(10 μmol·L-1) 各0.5 μL、模板0.5 μL (50 mg·L-1), 补充ddH2O至10 μL。反应程序: 95 ℃预变性3 min, 95 ℃变性30 s, 60 ℃退火/延伸30 s (每次循环后采集荧光), 40个循环后, 95 ℃变性10 s, 65~95 ℃做熔解曲线分析, 每个温度以每步0.5 ℃上升, 每个温度停留5 s。实验数据通过Excel进行分析, 采用2-ΔΔCt法计算获得AsCHI1基因的相对表达量。
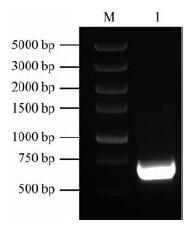
1 结果与分析 1 白木香AsCHI1基因全长cDNA的克隆分析挖掘白木香转录组测序结果[16], 获得一条具有完整开放阅读框的CHI基因, 以白木香愈伤组织的cDNA为模板进行扩增, 利用PCR方法扩增得到一条约为650 bp的条带, 扩增结果见图 1。将PCR产物连接到pMD19-T载体上, 测序结果经过NCBI的BLAST比对分析, 确定该扩增产物为具有完整ORF框的CHI基因, 命名为AsCHI1, 其序列长度为654 bp, 编码217个氨基酸。
|
图 1 Cloning of AsCHI1 gene from A.sinensis Calli. M: DNA marker; 1: AsCHI1 |
通过ProtParam软件预测AsCHI1编码的蛋白分子式为C1051H1668N262O315S3, 相对分子质量为23 110.55; 理论等电点为5.04; 不稳定系数II为33.95, 属于稳定蛋白; 总平均亲水性GRAVY为0.073, 为疏水性蛋白。利用TMHMM 2.0预测分析表明AsCHI1中不包含跨膜域。
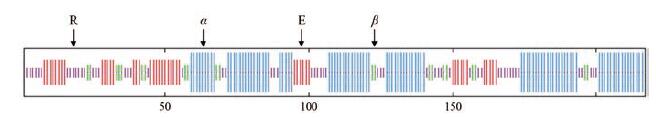
2.2 AsCHI1蛋白的二级结构分析及三维结构预测利用ExPASY中的SOPMA工具对AsCHI1基因编码蛋白的二级结构进行预测。结果显示AsCHI1蛋白的二级结构由43.78%的α-螺旋(α-helices)、26.27%的随机卷曲(random coil)、20.28%的延伸链(extended strand) 和9.68%的β-折叠(β-turn)组成(图 2), 推测α-螺旋是其最大量的二级结构元件, 而随机卷曲、延伸链和β-折叠散布于整个蛋白中。
|
图 2 Predicted secondary structure of AsCHI1 protein with SOPMA. α: α-Helices; β: β-Turn; E: Extended strand; R: Random coil |
选择拟南芥CHI的晶体结构为模板, 利用SWISS-MODEL Workspace在线分析软件对白木香AsCHI1的结构进行模建预测。结果表明, 白木香AsCHI1与拟南芥CHI一致性为70.09%, 具有参考价值。具体三维结构如图 3所示。
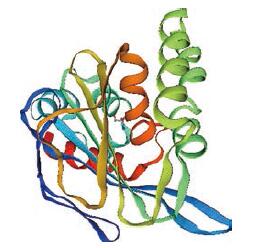
|
图 3 The deduced three-dimensional structure of AsCHI1 protein |
利用DNAMAN软件将白木香AsCHI1氨基酸序列与GenBank中其他植物中6个不同的CHI氨基酸序列进行比对分析(图 4)。结果表明AsCHI1氨基酸序列与橙子(Citrus sinensis, BAA36552)、葡萄(Vitis vinifera, P51117)、拟南芥(Arabidopsis thaliana, P41088)、玉米(Zea mays, Q08704)、葛根(Pueraria lobate, Q43056)、紫花苜蓿(Medicago sativa, P28012) 中CHI的氨基酸序列具有较高的相似度, 依次为72.2%、65.98%、60.98%、57.45%、49.55%、49.11%。说明AsCHI1基因在进化过程中具有较高程度的保守性, 但也存在较为明显的差异。同时, AsCHI1氨基酸序列具有查尔酮异构酶典型的活性位点[19] (如Arg-38、Gly-39、Leu-40、Phe-49、Thr-50、Tyr-108、Lys-111、Val-112、Asn-115和Cys-116)。

|
图 4 Alignment of the deduced amino acid sequence of AsCHI1 with CHI proteins from other plants. The residues that compose the active site are indicated with asterisks. The residues marked with yellow box supposedly play an important role in substrate preference. As: Aquilaria sinensis; At: Arabidopsis thaliana; Vv: Vitis vinifera; Ms: Medicago sativa; Zm: Zea mays; Pl: Pueraria lobate; Cs: Citrus sinensis |
通过进化树构建软件MEGA 6.0, 采用邻接法构建CHI进化树, 进行CHI的聚类分析(图 5)。从图 5可以看出, 34个物种的CHI氨基酸序列被划分为4个主支, 从上到下分别为Type Ⅰ、Type Ⅱ、Type Ⅳ和Type Ⅲ。白木香AsCHI1与棉花(Gossypium hirsutum) GhCHI蛋白亲缘关系比较接近, 同属于I型CHI。值得注意的是在II型CHIs (如PlCHI, MsCHI) 中决定底物偏好的Thr和Met这两个残基在I型CHIs中多为Ser和Ile (图 4), 因此在底物选择性上有所不同, I型CHIs仅可将柚皮素查尔酮异构化, 而II型CHIs则接受异甘草素和柚皮素查尔酮作为底物[20]。
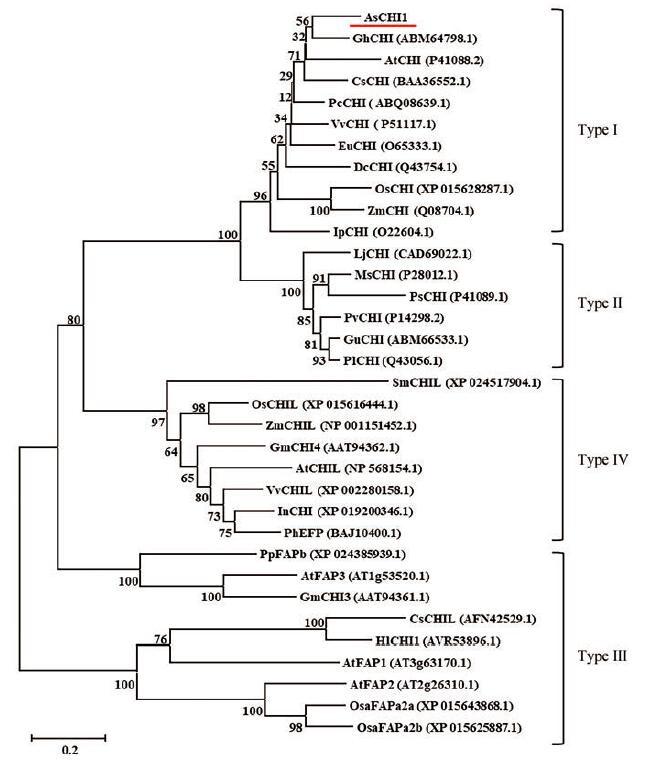
|
图 5 Phylogenetic analysis of CHI proteins |
将原核表达载体pET28a-AsCHI1质粒转化于大肠杆菌BL21 (DE3) 后, 通过对不同IPTG浓度、诱导培养时间及温度的考察, 最终选择IPTG终浓度为0.8 mmol·L-1于20 ℃下诱导表达16 h为最佳条件。由于AsCHI1在其氨基酸序列使用pET28a自带的His (组氨酸) 标签, 故采用镍离子亲和色谱柱对AsCHI1蛋白进行纯化, SDS-PAGE分析在27 kDa附近出现目标条带, 确定AsCHI1成功表达(图 6)。

|
图 6 SDS-PAGE analysis of AsCHI1 protein. M: Marker; 1: AsCHI1 |
查尔酮异构酶能将柚皮素查尔酮转化为柚皮素(4', 5, 7-三羟基二氢黄酮)。为了鉴定AsCHI1的活性, 以柚皮素查尔酮为底物进行分析, 反应产物经HPLC分析发现, AsCHI1可以快速将柚皮素查尔酮转化为相对分子质量为272的产物峰。在产物的高分辨质谱中出现[M-H]-峰m/z 271.059 6 (计算值: 271.061 2, 预测分子式C15H12O5), MS2图谱中出现特征碎片m/z 177.023 1和151.003 8, 与文献中报道的柚皮素的质谱裂解行为一致[21], 进一步比较产物的紫外吸收与柚皮素完全一致[22]。相比之下, 在将高温灭活的AsCHI1蛋白与柚皮素查尔酮孵育的反应中, 相同反应时间下, 仅见少量的环化产物柚皮素生成(图 7), 是由柚皮素查尔酮底物在溶液中自发环合转化产生。值得注意的是, 柚皮素查尔酮在溶液中不稳定, 容易自动环化为柚皮素, 因此在对CHI的催化活性进行测定时, 所有反应中底物加入的时间及加入底物后反应时间要保持一致, 并且不能反应时间过长, 否则对照反应中的底物也有可能完全转化为柚皮素而无法测定酶的活性。本研究中, 经对不同时间点反应体系中柚皮素的分析考察, 在5 min时, AsCHI1可以将底物全部转化, 而对照反应中仅少量底物自发转化, 证明AsCHI1确实具有查尔酮异构酶活性, 但当以异甘草素为底物对AsCHI1进行酶活分析时, 发现AsCHI1不能催化异甘草素。文献报道, 异甘草素只能被II型CHIs接受, 而不能被I型CHIs接受, 说明AsCHI1为I型CHIs, 这与进化树分析结果一致[20]。
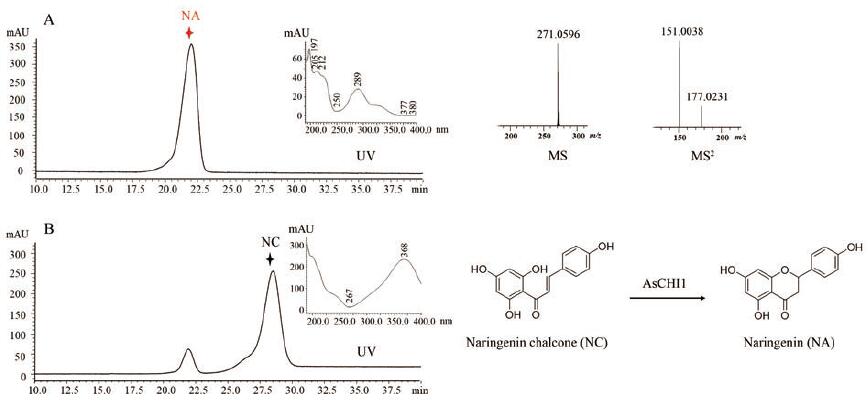
|
图 7 LC-MS charts for the formation of naringenin (NA) from naringenin chalcone (NC) by AsCHI1 (A) and the control (B). The HPLC chromatograms were measured at 198 nm |
为了考察AsCHI1与白木香防御反应的相关性, 对白木香愈伤组织分别进行盐、干旱(用甘露醇处理)、低温及重金属处理, 以相同生长情况下未进行任何处理的愈伤组织作对照, 不同时间点取样提取RNA后进行实时荧光定量PCR分析, 检测AsCHI1的表达水平。实验结果显示(图 8), 盐(NaCl) 和重金属(CdCl2) 胁迫下, AsCHI1的表达水平在12 h内升高, 之后随时间的增加表达量基本持平; 低温处理AsCHI1的表达水平在36 h达到最高, 随后缓慢下降; 而甘露醇诱导产生的干旱胁迫条件下, AsCHI1表达量在24 h达到最高, 是对照的125.5倍, 之后48 h内表达量逐渐下降。

|
图 8 Expression analysis of AsCHI1 in A. sinensis Calli treated with NaCl, CdCl2, cold temperature and mannitol, respectively |
三种植物生长调节物质ABA、GA3和SA对愈伤组织处理不同时间后, AsCHI1基因的表达分析结果显示(图 9), AsCHI1基因在受到外源ABA和SA处理后表达量均上升, ABA处理下24 h表达量最高, SA处理下36 h表达量最高; 在外源GA3处理下, 出现双峰现象, 在24 h表达量升高, 36 h降低, 之后上升在48 h达到最高, 是对照的6.3倍。
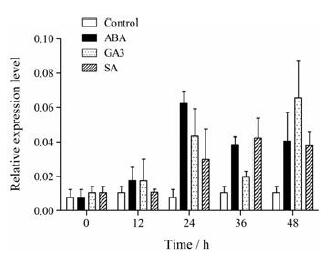
|
图 9 Expression analysis of AsCHI1 in A. sinensis calli treated with abscisic acid (ABA), gibberellic acid (GA3), and salicylic acid (SA), respectively |
查尔酮异构酶(CHI) 是黄酮类成分生物合成中的关键酶, 有关其研究非常广泛, 例如对矮牵牛[23]、刺甘草[24]、百脉根[25]中CHI的研究等。CHI通常分为4个类型, 其中I型CHIs主要存在于维管植物中, 而II型CHIs特异性的存在于豆科植物中, I型和II型CHIs均可催化查尔酮底物发生分子内环化生成黄酮类成分, 其中I型CHIs将柚皮素查尔酮异构化以形成柚皮素, 而II型CHIs具有更广泛的底物特异性。除了将柚皮素查尔酮转化外, 它们还可催化异甘草素转化为甘草素(7, 4'-二羟基二氢黄酮); III型CHIs则不具有查尔酮环化活性, IV型CHIs蛋白可能充当类黄酮生成和花色素沉着的增强剂[20]。本文中克隆鉴定的AsCHI1经系统进化分析发现其为I型CHI, 进一步的酶催化活性分析发现AsCHI1仅能催化柚皮素查尔酮而不能催化异甘草素, 结果与进化树分析结果一致。
黄酮类化合物在植物界中广泛存在, 是植物在长期的进化过程中为适应生态环境或抵御外界侵袭而形成的一大类次生代谢产物, 在长期的生态适应过程中发挥重要的作用[26]。目前研究已经证明紫外辐射、强光、低温、高CO2浓度、干旱等生理胁迫条件均可以促进植物体内黄酮类化合物的合成[27]。白木香的茎木及叶中含有大量的黄酮类成分[28-30], 同时其内源黄酮类化合物在白木香应对损伤的过程中发挥重要作用[18]。查尔酮异构酶是黄酮生物合成途径中的关键催化酶, 研究表明, CHI基因的功能与植物的胁迫反应和激素信号转导相关, 如经酵母提取物诱导的过表达CHI甘草毛状根突变体, CHI的转录水平和CHI活性大大提高[31]; 伤害胁迫和茉莉酸甲酯均可诱导黄芩愈伤组织中CHI基因表达的增加[32]; 玉米幼苗在10 ℃的低温胁迫下, CHI的基因转录水平在前6 h可大幅度增加[33]; 水黄皮经海水或NaCl (500 mmol·L-1) 处理后CHI基因转录水平增强, 可提高其对盐胁迫的抗性[34]。目前, 有关白木香中CHI的研究尤其是进行克隆表达后确定催化功能的相关研究鲜见报道。本研究成功从白木香愈伤组织中克隆鉴定了一个查尔酮异构酶AsCHI1, 并对其进行了异源表达和催化活性分析, 发现重组蛋白AsCHI1确实能够催化柚皮素查尔酮快速转化为柚皮素。进一步对其在不同的非生物胁迫及植物激素诱导条件下的表达情况进行考察, 发现无论是非生物胁迫还是植物激素诱导, 均能引起AsCHI1基因表达上调, 提示AsCHI1基因在白木香的植物防御反应中可能发挥作用, 这与文献报道的CHI在植物防御反应中的作用以及内源黄酮类化合物可以辅助白木香应对损伤的研究结果一致。
值得注意的是, 沉香药材中主要含有倍半萜和苯乙基色酮类成分[35-37], 而黄酮类成分却鲜见报道, 这似乎与本文中胁迫和激素诱导均能导致I型查尔酮异构酶AsCHI1的表达上调进而导致黄酮生物合成能力增强的研究结果不一致。有学者认为白木香受外界刺激后, 在抵御外界侵害时, 白木香体内的黄酮类化合物会在相关酶的作用下逐步“转化”为沉香的苯乙基色酮类特征性成分[18], 这种观点虽然可以解释沉香药材中少见黄酮类成分这一现象, 但目前尚无任何直接证据支持白木香在胁迫条件下可以将黄酮类成分转化为苯乙基色酮。需特别考虑的是, 白木香树在受到胁迫后, 是否能够结香与树龄有关, 而且结香部位主要在粗壮的主干内部, 而在幼枝、叶或年幼的白木香树则不能结香或结香困难, 提示同作为白木香防御性物质的黄酮类成分或者沉香药材中的倍半萜及苯乙基色酮类成分的合成与积累可能具有组织特异性。另外, 由于沉香是含有树脂的木材, 因此在对其进行化学成分研究中, 白木(非树脂类部分) 部分无法除去, 也就是说沉香药材中实际上是含有部分未结香的茎木的, 但却无黄酮类成分从沉香药材中分离报道, 有可能胁迫条件下, 白木香树的叶及嫩枝中黄酮类成分的合成会增加, 以提高白木香的抗逆境胁迫能力, 而白木香树可结香部位本身就不含有黄酮类成分。因此, 黄酮类成分虽在白木香防御反应中起作用, 但黄酮类成分的合成与沉香形成之间的确切关系尚需更加深入系统的研究。
作者贡献: 丁宁负责AsCHI1基因克隆和原核表达、体外酶活鉴定以及论文初稿的撰写; 海燕负责AsCHI1基因的生物信息学分析和不同胁迫下的表达分析; 王晓晖为本研究提供实验指导并对论文初稿进行修改; 屠鹏飞为选题及研究思路提供指导; 高博闻、史社坡负责实验方案设计、实验技术指导、论文撰写及修改。
利益冲突: 本研究不存在研究者与公开研究成果有关的利益冲突。
| [1] |
Chinese Pharmacopoeia Commission. Pharmacopoeia of the People's Republic of China(中华人民共和国药典: 一部)[S]. Beijing: China Medical Science Press, 2015.
|
| [2] |
Zhang Z, Yang Y, Wei JH, et al. Advances in studies on mechanism of agarwood formation in Aquilaria sinensis and its hypothesis of agarwood formation induced by defense response[J]. Chin Tradit Herb Drugs(中草药), 2010, 41: 156-159. |
| [3] |
Li L, Zhang GQ, Shi XF. Advances in pharmacological research and clinical application of agarwood[J]. Asia-Pac Tradit Med(亚太传统医药), 2019, 15: 199-204. |
| [4] |
Zheng SZ, Zheng PJ, Yang RH, et al. Historical and cultural accumulation of agarwood[J]. Chaoshan Businessman(潮商), 2010, 2: 66-71. |
| [5] |
Persoon GA, Van Beek HH. Growing'the Wood of the Gods': agarwood production in southeast Asia[M]//Snelder DJ, Lasco RD, editors. Smallholder Tree Growing for Rural Development and Environmental Service: Lessons from Asia. Netherlands: Springer, 2008, 5: 245-262.
|
| [6] |
CITES. Amendments to Appendix I and II of CITES[C]. Bangkok: Proceedings of Thirteenth Meeting of the Conference of the Parties, 2004: 2-14.
|
| [7] |
Wei JH, Yang Y, Zhang Z, et al. Artificial liquid transfusion technology in inducing agarwood formation in the whole body of cultivated Aquilaria sinensis(Lour. )Gilg trees: CN, 201010104119.5[P]. 2010-06-30.
|
| [8] |
Zhang XL, Liu YY, Wei JH, et al. Production of high-quality agarwood in Aquilaria sinensis trees via whole-tree agarwood induction technology[J]. Chin Chem Lett, 2012, 23: 727-730. DOI:10.1016/j.cclet.2012.04.019 |
| [9] |
Kumeta Y, Ito M. Characterization of δ-guaiene synthases from cultured cells of Aquilaria, responsible for the formation of the sesquiterpenes in agarwood[J]. Plant Physiol, 2010, 154: 1998-2007. DOI:10.1104/pp.110.161828 |
| [10] |
Ito M, Okimoto KI, Yagura T, et al. Induction of sesquiterpenoid production by methyl jasmonate in Aquilaria sinensis cell suspension culture[J]. J Essent Oil Res, 2005, 17: 175-180. DOI:10.1080/10412905.2005.9698867 |
| [11] |
Naef R. The volatile and semi-volatile constituents of agarwood, the infected heartwood of Aquilaria species: a review[J]. Flavour Fragr J, 2011, 26: 73-89. DOI:10.1002/ffj.2034 |
| [12] |
Xu YH, Liao YC, Zhang Z, et al. Jasmonic acid is a crucial signal transducer in heat shock induced sesquiterpene formation in Aquilaria sinensis[J]. Sci Rep, 2016, 6: 21843. DOI:10.1038/srep21843 |
| [13] |
Zhang Z, Zhang XL, Yang Y, et al. Hydrogen peroxide induces vessel occlusions and stimulates sesquiterpenes accumulation in stems of Aquilaria sinensis[J]. Plant Growth Regul, 2014, 72: 81-87. DOI:10.1007/s10725-013-9838-z |
| [14] |
Ye W, He X, Wu HQ, et al. Identification and characterization of a novel sesquiterpene synthase from Aquilaria sinensis: an important gene for agarwood formation[J]. Int J Biol Macromol, 2018, 108: 884-892. DOI:10.1016/j.ijbiomac.2017.10.183 |
| [15] |
Xu YH, Zhang Z, Wang MX, et al. Identification of genes related to agarwood formation: transcriptome analysis of healthy and wounded tissues of Aquilaria sinensis[J]. BMC Genomics, 2013, 14: 227. DOI:10.1186/1471-2164-14-227 |
| [16] |
Wang XH, Gao BW, Liu X, et al. Salinity stress induces the production of 2-(2-phenylethyl)chromones and regulates novel classes of responsive genes involved in signal transduction in Aquilaria sinensis calli[J]. BMC Plant Biol, 2016, 16: 119. DOI:10.1186/s12870-016-0803-7 |
| [17] |
Ye W, Wu HQ, He X, et al. Transcriptome sequencing of chemically induced Aquilaria sinensis to identify genes related to agarwood formation[J]. PLo S One, 2016, 11: e0155505. DOI:10.1371/journal.pone.0155505 |
| [18] |
Yang MX. Flavonoids from Wild Aquilaria sinensis Leaves, Their Anti-cancer Activities and the Preliminary Studies on Chemical Intervention Effect in Agarwood Formation Induced by Wounding(野生白木香叶中的黄酮类化合物, 抗癌活性及对伤害诱导结香化学干预作用初步研究)[D]. Jinan: Jinan University, 2016.
|
| [19] |
Jez JM, Bowman ME, Dixon RA, et al. Structure and mechanism of the evolutionarily unique plant enzyme chalcone isomerase[J]. Nat Struct Biol, 2000, 7: 786-791. DOI:10.1038/79025 |
| [20] |
Cheng AX, Zhang XB, Han XJ, et al. Identification of chalcone isomerase in the basal land plants reveals an ancient evolution of enzymatic cyclization activity for synthesis of flavonoids[J]. New Phytol, 2018, 217: 909-924. DOI:10.1111/nph.14852 |
| [21] |
Sun MJ, Wang HJ, Ding FJ, et al. Qualitative analysis of flavonoids in Tetrastigma hemsleyanum based on UPLC-Quadrupole/Exactive Orbitrap mass spectrometry and mass defect filter method[J]. J Chin Mass Spectr Soc, 2020, 41: 359-367. |
| [22] |
Ribeiro IA, Ribeiro MHL. Naringin and naringenin determination and control in grapefruit juice by a validated HPLC method[J]. Food Control, 2008, 19: 432-438. DOI:10.1016/j.foodcont.2007.05.007 |
| [23] |
Tunen AJ, Koes RE, Spelt CE, et al. Cloning of the two chalcone flavanone isomerase genes from Petunia hybrida: coordinate, light-regulated and differential expression of flavonoid genes[J]. EMBO J, 1988, 7: 1257-1263. DOI:10.1002/j.1460-2075.1988.tb02939.x |
| [24] |
Kimura Y, Aoki T, Ayabe S. Chalcone isomerase isozymes with different substrate specificities towards 6'-hydroxy-and6'-deoxychalcones in cultured cells of Glycyrrhiza echinata, a leguminous plant producing 5-deoxyflavonoids[J]. Plant Cell Physiol, 2001, 42: 1169-1173. DOI:10.1093/pcp/pce130 |
| [25] |
Shimada N, Aoki T, Sato S, et al. A cluster of genes encodes the two types of chalcone isomerase involved in the biosynthesis of general flavonoids and legume-specific 5-deoxy(iso)flavonoid in Lotus Japonicus[J]. Plant Physiol, 2003, 131: 941-951. DOI:10.1104/pp.004820 |
| [26] |
Zhu H, Hu HY, Lu CY, et al. Progresses on flavonoid metabolism in plants and its regulation[J]. J Xiamen Univ(厦门大学学报), 2007, 46: 136-143. |
| [27] |
Xu WY, Gao WW, He CN. The influences of environmental factors on flavonoid biosynthesis[J]. World Sci Technol/Mod Tradit Chin Med Mater Med(世界科学技术一中医药现代化), 2006, 8: 68-72. |
| [28] |
Chen D, Bi D, Song YL, et al. Flavanoids from the stems of Aquilaria sinensis[J]. Chin J Nat Med, 2012, 10: 287-291. |
| [29] |
Peng K, Mei WL, Wu J. Flavones from the stem of Aquilaria sinensis[J]. J Trop Subtrop Bot(热带亚热带植物学报), 2010, 18: 97-100. |
| [30] |
Lin HZ, Li HN, Mei QX, et al. Research progress of agarwood leaves[J]. Pharm Today(今日药学), 2011, 21: 547-549. |
| [31] |
Zhang HC, Liu JM, Lu HY, et al. Enhanced flavonoid production in hairy root cultures of Glycyrrhiza uralensis Fisch by combining the over-expression of chalcone isomerase gene with the elicitation treatment[J]. Plant Cell Rep, 2009, 28: 1205-1213. |
| [32] |
Park NI, Xu H, Li XH, et al. Enhancement of flavone levels through overexpression of chalcone isomerase in hairy root cultures of Scutellaria baicalensis[J]. Funct Integr Genomics, 2011, 11: 491-496. |
| [33] |
Christie PJ, Alfenito MR, Walbot V. Impact of low-temperature stress on general phenylpropanoid and anthocyanin pathways: enhancement of transcript abundance and anthocyanin pigmentation in maize seedlings[J]. Planta(Heidelberg), 1994, 194: 541-549. |
| [34] |
Wang H, Hu TJ, Huang JZ, et al. The expression of Millettia pinnata chalcone isomerase in Saccharomyces cerevisiae saltsensitive mutants enhances salt-tolerance[J]. Int J Mol Sci, 2013, 14: 8775-8786. |
| [35] |
Chen HQ, Wei JH, Yang JS, et al. Chemical constituents of agarwood originating from the endemic genus Aquilaria plants[J]. Chem Biodivers, 2012, 9: 236-250. |
| [36] |
Yagura T, Ito M, Kiuchi F, et al. Four new 2-(2phenylethyl)chromone derivatives from withered wood of Aquilaria sinensis[J]. Chem Pharm Bull, 2003, 51: 560-564. |
| [37] |
Ibrahim SR, Mohamed GA. Natural occurring 2-(2-phenylethyl)chromones, structure elucidation and biological activities[J]. Nat Prod Res, 2015, 29: 1489-1520. |
 2021, Vol. 56
2021, Vol. 56