2. 北京大学第三医院妇产科, 北京 100191
2. Obstetrics and Gynecology Department, Peking University Third Hospital, Beijing 100191, China
随着纳米技术的发展, 纳米材料在疾病诊断和药物递送等生物医学领域得到了广泛的应用。主动靶向递药系统通过在纳米粒表面修饰特定的靶向分子, 使得纳米粒可以选择性地将药物递送到能与特定靶向分子结合的受体、转运体的组织或者细胞中而发挥药效, 最终实现疾病的精准治疗[1]。但是, 由于体内微环境的复杂性, 大部分纳米粒达不到预期的递送效果, 主动靶向递药系统的有效性仍然存在很大的争议[2]。
究其原因, 纳米递药系统的“蛋白冠(protein corona)”效应是影响递送效率的关键因素[3]。蛋白冠是指纳米粒进入生理环境中后, 体液中的蛋白质和脂类等生物大分子会自发地吸附在纳米粒表面所形成的一层或多层复合物[4, 5]。与原始纳米粒相比, 蛋白冠的形成不仅改变了纳米粒本身的结构, 而且影响了纳米粒的功能, 包括其细胞摄取、免疫反应、组织分布、清除和毒性等[6, 7]。因此, 深入了解纳米粒形成蛋白冠后对其后续生物学行为的影响, 有助于了解纳米粒和机体的相互作用, 对加快纳米药物的临床转化具有深远的意义[8, 9]。
蛋白冠的组成与纳米粒面临的体液环境密切相关[10]。在病理条件下, 体内的蛋白质种类和丰度发生改变, 并且这种变化与特定的疾病有关[11]。卵巢癌(ovarian cancer)是一种常见的恶性肿瘤, 也是导致妇科癌症死亡的主要原因[12, 13]。截止目前, 还没有主动靶向纳米药物进入临床, 此外, 一些进入临床研究的纳米药物的试验结果也不尽如人意[14, 15]。在卵巢癌患者体内, 血浆蛋白的含量和成分在疾病发生、发展过程中发生的动态变化, 可能影响纳米粒表面的蛋白冠组成, 从而进一步影响其体内行为[16]。对主动靶向纳米递药系统与病理状态下的体液环境之间相互作用的了解, 有助于阐明纳米药物在体内的行为, 从而预测其治疗效果[17]。
良好的生物降解性和生物相容性使得聚乳酸-羟基乙酸共聚物(PLGA)成为目前研究最多的纳米递药系统之一[18, 19]。靶向分子叶酸(FA)因其体积小、成本低、对肿瘤组织的特异性高和非免疫原性被广泛应用于抗癌药物的传递, 与卵巢癌细胞高表达的叶酸受体具有很高的结合亲和力[20]。在本研究中, 将未修饰和靶向分子FA修饰的PLGA纳米粒分别与健康人血浆和卵巢癌患者血浆孵育, 在体外对纳米粒进入体内后产生蛋白冠的情况进行模拟, 并探究蛋白冠的形成对纳米粒靶向性的影响。
材料与方法实验材料 健康人血浆和卵巢癌患者血浆取自北京大学第三医院[北京大学第三医院医学科学研究伦理委员会伦理审查批件号码: (2019)医伦审第(409-1)号], 其中健康人血样为2例, 患者(Ⅳ期卵巢癌)血样为3例; PLGA (西安瑞禧生物科技有限公司); 二棕榈酰磷脂酰乙醇胺-聚乙二醇2000-甲氧基(DSPE-PEG2000-OCH3)、二棕榈酰磷脂酰乙醇胺-聚乙二醇2000-氨基(DSPE-PEG2000-NH2)、二棕榈酰磷脂酰乙醇胺-聚乙二醇5000-甲氧基(DSPE-PEG5000-OCH3)(上海芃硕生物科技有限公司); BCA蛋白浓度测定试剂盒、十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)快速凝胶配制试剂盒、快速银染试剂盒、考马斯亮蓝快速染色液、蛋白上样缓冲液(上海碧云天生物技术有限公司); FA (科龙试剂); DMEM培养基、双抗、香豆素-6、乙腈(Sigma公司); 1-乙基-3-(3-二甲基氨基丙基)碳二亚胺盐酸盐(EDC)、N-羟基丁二酰亚胺(NHS)、三乙胺(上海阿拉丁生化科技股份有限公司); 胰酶、葡聚糖凝胶G-25和琼脂糖凝胶CL-4B (索莱宝科技有限公司)。
DSPE-PEG5000-FA的合成 通过FA中羧基和DSPE-PEG5000-NH2的氨基之间的共价反应合成DSPE-PEG5000-FA[21], 具体步骤如下: 称取FA 1 mg、DSPE-PEG5000-NH2 10 mg、EDC 1 mg和NHS 1 mg置于圆底烧瓶中, 加入5 mL DMSO使其充分溶解, 再加1~2滴三乙胺, 在室温、无水无氧的条件下反应24 h。反应结束后得到的反应液在蒸馏水中透析(MVCO 1 000)48 h, 除去未反应完全的FA, 冷冻干燥, 得到的DSPE-PEG5000-FA呈淡黄色的粉末状物质。
PLGA纳米粒的制备与表征 用探头超声法制备PLGA纳米粒, 具体步骤如下: 称取PLGA 5 mg、香豆素-6 50μg溶于0.5 mL乙腈中制成有机相, DSPE-PEG2000-OCH3 2 mg和DSPE-PEG5000-OCH3 1 mg溶于4.5 mL超纯水中制成水相。将水相逐滴加入有机相中反应5 min后, 探头超声5 min (间隔时间5 s, 功率15%, 同时冰浴)。之后减压蒸馏去除有机溶剂, 用尺寸排阻色谱法(葡聚糖凝胶G-25)除去未包封的香豆素-6, 制成均一的未修饰纳米粒(PLGA-PEG)。同理, 将DSPE-PEG5000-OCH3换为含有FA分子的DSPE-PEG5000-FA, 制得叶酸修饰的纳米粒(PLGA-FA)。通过动态光散射法(DLS)测定两种纳米粒的水合粒径和ζ-电位对其进行了表征。
PLGA纳米粒蛋白冠的形成 取80 mg·mL-1PLGA-PEG和PLGA-FA各300μL, 分别加入两个EP管中, 各加入健康人血浆600μL, 充分混合后将其置于摇床中, 在75 r·min-1、37℃的条件避光孵育1 h达到平衡状态, 即得到在健康人血浆中形成蛋白冠的PLGA纳米粒; 另取80 mg·mL-1PLGA-PEG和PLGA-FA各300μL, 分别加入两个EP管中, 各加入卵巢癌患者的血浆600μL, 充分混合后避光孵育1 h达到平衡状态, 即得到在卵巢癌患者血浆中形成蛋白冠的PLGA纳米粒[22]。作者将血浆中回收的PLGA-PEG缩写为HC-PEG-NPs (PLGA-PEG with protein corona in healthy plasma)和OC-PEG-NPs (PLGA-PEG with protein corona in ovarian plasma), 健康人血浆和卵巢癌患者的血浆中回收的PLGA-FA缩写为HC-FA-NPs (PLGA-FA with protein corona in healthy plasma)和OC-FA-NPs (PLGA-PEG with protein corona in ovarian plasma)。
PLGA纳米粒蛋白冠的形成 用尺寸排阻色谱法从血浆中分离出吸附蛋白冠的纳米粒。将琼脂糖凝胶CL-4B填充至1×15 cm色谱柱内, 磷酸盐缓冲液(PBS, pH 7.4)洗脱。分别将PLGA-FA、PLGA-PEG和人血浆加样于凝胶柱上端后, 从下端收集洗脱液(1 mL/管), 直至所有的样品成分均流出为止。从PLGA-FA和PLGA-PEG组收集到的洗脱液在450 nm处检测其吸光度值, 人血浆组收集到的洗脱液用BCA试剂盒定量后测其在562 nm处的吸光度值, 绘制洗脱曲线[23]。另外, 收集纳米粒组在流出曲线中吸光度值变大的部分, 测定回收率。
蛋白冠的表征 成功分离出蛋白冠包覆的纳米粒HC-PEG-NPs、OC-PEG-NPs、HC-FA-NPs和OC-FA-NPs后, DLS法测定纳米粒的粒径和电位变化。
PLGA纳米粒蛋白吸附量的测定 将回收后的HC-PEG-NPs、OC-PEG-NPs、HC-FA-NPs和OC-FA-NPs的质量浓度浓缩至20 mg·mL-1, 用BCA蛋白定量试剂盒测定回收后纳米粒上的血浆蛋白含量。
SDS-PAGE凝胶电泳分析吸附的蛋白质种类和含量 首先探讨了健康人血浆和卵巢癌患者血浆的区别。取卵巢癌患者血浆和健康人血浆进行BCA定量后, 将血浆的浓度均调为3 mg·mL-1。每组取血浆100μL, 加入蛋白上样缓冲液25μL, 混合均匀后100℃水浴条件下煮沸7 min, 使蛋白完全变性, 置于-80℃冰箱中备用。
用SDS-PAGE凝胶配制试剂盒制得12%的聚丙烯酰胺凝胶。每种血浆的上样量为15μL, 电压为90 V运行至样品到达浓缩胶底部后, 将条件换为150 V运行至样品到达分离胶底部。最后用考马斯亮蓝染色, 观察健康人血浆和卵巢癌患者血浆的蛋白条带。取上一步获得的浓度一致的纳米粒100μL, 加入蛋白上样缓冲液25μL, 混合均匀后煮沸, 使蛋白完全变性, 放置于-80℃冰箱中备用。用市售4%~15%聚丙烯酰胺梯度胶分离吸附在纳米粒上的蛋白, 用银染法观察吸附在纳米粒上蛋白条带。
流式细胞仪考察PLGA纳米粒在蛋白冠形成前后的靶向性 用高表达FA受体的人卵巢癌细胞SKOV3评价PLGA纳米粒的细胞摄取行为。含10%胎牛血清, 1%双抗(青霉素/链霉素)的DMEM培养基培养SKOV3细胞至稳定状态后, 0.25%胰酶消化细胞使细胞成单细胞悬液, 以细胞数5×105/孔接种于12孔板上, 37℃、5% CO2的孵箱中孵育36 h。之后, 弃去孔内培养基, 用PBS洗去残余培养基, 将PLGA-PEG、PLGA-FA、HC-PEG-NPs、OC-PEG-NPs、HC-FA-NPs和OC-FA-NPs用无血清的DMEM培养基配制成0.1 mg·mL-1的含药溶液加入孔板中, 避光孵育2 h。孵育结束后弃去培养基, 用PBS洗去残留培养基, 加入胰酶消化成单细胞悬液, 离心去除胰酶, 将细胞用PBS (pH 7.4)重悬, 转移至流式管中进行流式细胞分析[24]。
统计学方法 数据采用Graph Pad Prism8.3软件进行统计学分析和作图, 显著性差异比较采用t检验法进行, 以P < 0.05表示差异具有统计学意义。
结果与讨论 1 PLGA-FA和PLGA-PEG的表征FA修饰的PLGA-FA和未修饰的PLGA-PEG的粒径和电位如表 1所示。由表 1可以看出, 得到的PLGA-PEG的粒径为152.9 nm; 在修饰了靶向分子FA后, 纳米粒的粒径明显增加到167.2 nm。分散度指数小于0.3, 说明纳米粒的粒径分布较为均一。PLGA-FA和PLGA-PEG的电位都在-40 mV左右。
| 表 1 Size and zeta-potential for polylactic acid-polyglycolic acid copolymer (PLGA). PLGA-PEG: PEGylated PLGA nanoparticles; PLGA-FA: Folic acid (FA)-modified PLGA nanoparticles; PDI: Polymer dispersity index. n = 3, x±s |
在1×15 cm规格的CL-4B琼脂糖凝胶柱中, 血浆和纳米粒的洗脱曲线如图 1所示。纳米粒的流出段和血浆的流出段没有重合, 证明这种方法对纳米粒和血浆蛋白具有良好的分离效果。

|
Figure 1 The elution curves of plasma and PLGA NPs with phosphate buffered solution (PBS).The black curve represents plasma and the red and yellow represents PLGA-FA and PLGA-PEG, respectively.The left side of the ordinate represents the PLGA-PEG and PLGA-FA, and the right side represents plasma, respectively |
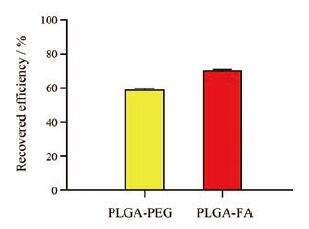
纳米粒经过琼脂糖凝胶柱后的回收率结果如图 2所示, 可见PLGA-PEG和PLGA-FA的回收率均大于60%, 说明这种方法具有较高的回收率[25]。
|
Figure 2 Recovery efficiency of PLGA-PEG and PLGA-FA.n=3, x ± s |
综上所述, CL-4B琼脂糖凝胶柱可用于从血浆中分离形成蛋白冠后的纳米粒, 其相对良好的分离效率和回收率是后续实验成功开展的基础。
3 蛋白冠的表征纳米粒在吸附了健康人和卵巢癌患者的血浆蛋白形成蛋白冠后, 粒径变化如表 2所示。PLGA-PEG吸附了血浆蛋白形成蛋白冠后, HC-PEG-NPs和OC-PEG-NPs的粒径分别增加到192.3 nm和197.1 nm。PLGA-FA吸附了健康人血浆形成蛋白冠后, HC-FA-NPs的粒径增加到171.8 nm, 而在卵巢癌患者血浆中, OC-FA-NPs的粒径在187.8 nm左右。另外, 由于静电吸附作用, 带负电荷的纳米粒优先吸附了血浆中带正电荷的蛋白质, 所以其电位有显著地上升, 也证明了纳米粒表面蛋白冠的形成。
| 表 2 Size and zeta-potential for protein coated PLGA NPs. HC-PEG-NPs: PLGA-PEG with protein corona in healthy plasma; OC-PEG-NPs: PLGA-PEG with protein corona in ovarian plasma; HC-FA-NPs: PLGA-FA with protein corona in healthy plasma; OC-FA-NPs: PLGA-FA with protein corona in ovarian plasma. n = 3, x ± s |
BCA浓度检测表明, PLGA-PEG在健康人和卵巢癌患者血浆中的蛋白质吸附量均为15μg·mg-1, 而PLGA-FA在健康人血浆中的蛋白吸附量为13μg·mg-1, 在卵巢癌患者血浆中的蛋白吸附量为19μg·mg-1(图 3)。结果说明, PLGA-PEG组吸附的蛋白质总量相同, 但PLGA-FA组吸附的蛋白质总量是不同的, 也就是说靶向分子的存在可以影响纳米粒在不同血浆中蛋白的吸附情况。

|
Figure 3 The amount of plasma proteins adsorbed onto PLGA-PEG and PLGA-FA.n=3, x ± s.**P < 0.01 |
健康人和卵巢癌患者血浆进行凝胶电泳后, 凝胶经考马斯亮蓝染色, 得到图 4所示的蛋白条带。由图可见, 在分子质量为12和35 kDa左右时, 健康人血浆和卵巢癌患者血浆的蛋白含量明显不同, 证明在病理条件下体内的蛋白质丰度会发生明显的变化。
|
Figure 4 Human plasma proteins were stained with Coomassie brilliant blue after electrophoresis.H: Healthy plasma; O: Ovarian plasma |
PLGA纳米粒与血浆分离纯化后进行凝胶电泳, 接着取凝胶进行银染。由于银染比考马斯亮蓝染色具有更高的灵敏度, 故在这里选择用银染的方法来使蛋白凝胶成像。如图 5所示, 在分子质量为55、110和大于180 kDa时, 吸附在PLGA-PEG上的健康人血浆蛋白和卵巢癌患者血浆蛋白的含量明显不同; 在分子质量为55和大于180 kDa时, 吸附在PLGA-FA上的健康人血浆蛋白和卵巢癌患者血浆蛋白的含量明显不同。这些结果证明, 在病理状态下血浆蛋白丰度的改变, 使纳米粒在进入体内后所形成的蛋白冠不同。

|
Figure 5 Sliver stained SDS-PAGE gel of proteins associated with healthy and ovarian plasma corona |
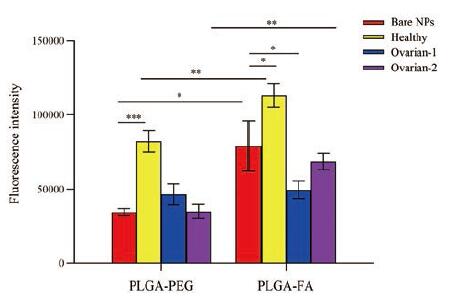
利用流式细胞仪首先探索了在形成蛋白冠之前, PLGA-PEG和PLGA-FA的靶向性。如图 6所示, 在连接了靶向分子FA后, PLGA-FA在SKOV3细胞中的摄取明显增加, 证明了PLGA-FA具有主动靶向性。之后, 探讨了形成蛋白冠后纳米粒的靶向性。流式细胞分析表明, 两种PLGA纳米粒在健康人血浆中形成蛋白质后摄取量明显增加, 但PLGA-FA在患者血浆中形成蛋白冠后摄取明显降低(图 6)。以上结果说明, 在不同的生理状态下蛋白丰度的变化、蛋白冠的形成对纳米粒靶向性的影响不同。

|
Figure 6 Targeting capability studies.Flow cytometry quantitatively confirmed the active targeting capability of PLGA-FA and the impact of the formed protein corona on their internalization efficiency of SKOV3 cells.n=3, x ± s.*P < 0.05, **P < 0.01, ***P < 0.001 |
主动靶向递药系统是纳米药物的重要研究方向, 在设计递药系统时将药物递送至病变部位时, 要综合考虑纳米粒和生理环境之间的相互作用, 以及纳米粒进入体内的生物学特性。本课题成功构建了FA修饰的PLGA纳米粒, 并且证明了卵巢癌患者血浆的蛋白丰度与健康人血浆相比发生了明显的改变。健康人血浆和卵巢癌患者血浆来源的蛋白冠对主动靶向纳米粒PLGA-FA的靶向性影响具有显著不同。作者近期关于非小细胞肺癌的研究也显示, 健康人血浆和患者血浆对纳米药物的靶向性具有不同的影响[26]。这也提示, 病理状态下体内血浆蛋白丰度的变化及其对纳米粒蛋白冠的影响是未来在研究主动靶向药物递送系统时需要密切关注的问题之一。在疾病的诊断方面, 通过纳米药物吸附患者来源的血浆后, 用蛋白组学分析蛋白冠的成分找到此种疾病的特定标记物, 可以为疾病不同时期的诊断提供参考; 在疾病的治疗方面, 通用的设计策略是通过在纳米材料上进行涂层修饰或者预吸附来减少非特异性蛋白质的吸附, 降低蛋白冠对纳米粒原本生物学性能的影响。明确纳米粒与机体环境的相互作用并加以规避和利用, 可以指导更好地设计主动靶向递药系统[9]。
作者贡献: 王雅蓁是本研究的实验设计者和实验研究的执行人, 完成数据分析, 论文初稿的写作; 龚涛参与实验设计和实验结果分析; 李圆和高会乐是项目的构思者及负责人, 指导实验设计、数据分析、论文写作与修改。
利益冲突: 本文作者声明该论文没有涉及任何利益冲突。
| [1] |
Zamboni WC, Torchilin V, Patri AK, et al. Best practices in cancer nanotechnology: perspective from NCI nanotechnology alliance[J]. Clin Cancer Res, 2012, 18: 3229-3241. DOI:10.1158/1078-0432.CCR-11-2938 |
| [2] |
Wilhelm S, Tavares AJ, Dai Q, et al. Analysis of nanoparticle delivery to tumours[J]. Nat Rev Mater, 2016. DOI:10.1038/natrevmats.2016.14 |
| [3] |
Schulze C, Kroll A, Lehr C, et al. Not ready to use-overcoming pitfalls when dispersing nanoparticles in physiological media[J]. Nanotoxicology, 2008, 2: 51-61. DOI:10.1080/17435390802018378 |
| [4] |
Cedervall T, Lynch I, Lindman S, et al. Understanding the nanoparticle-protein corona using methods to quantify exchange rates and affinities of proteins for nanoparticles[J]. Proc Natl Acad Sci U S A, 2007, 104: 2050-2055. DOI:10.1073/pnas.0608582104 |
| [5] |
Monopoli MP, Walczyk D, Campbell A, et al. Physical-chemical aspects of protein corona: relevance to in vitro and in vivo biological impacts of nanoparticles[J]. J Am Chem Soc, 2011, 133: 2525-2534. DOI:10.1021/ja107583h |
| [6] |
Chetwynd AJ, Wheeler KE, Lynch I. Best practice in reporting corona studies: minimum information about Nanomaterial Biocorona Experiments(MINBE)[J]. Nano Today, 2019, 28: 100758. DOI:10.1016/j.nantod.2019.06.004 |
| [7] |
Piloni A, Wong CK, Chen F, et al. Surface roughness influences the protein corona formation of glycosylated nanoparticles and alter their cellular uptake[J]. Nanoscale, 2019, 11: 23259-23267. DOI:10.1039/C9NR06835J |
| [8] |
Cai R, Chen C. The crown and the scepter: roles of the protein corona in nanomedicine[J]. Adv Mater, 2018, 31: 1805740. |
| [9] |
Guan J, Lu WY, Zhan CY. Plasma proteins regulating in vivo performance of liposomes[J]. Acta Pharm Sin(药学学报), 2019, 54: 2240-2250. |
| [10] |
Lundqvist M, Stigler J, Cedervall T, et al. The evolution of the protein corona around nanoparticles: a test study[J]. ACS Nano, 2011, 5: 7503-7509. DOI:10.1021/nn202458g |
| [11] |
Rajendran P, Rengarajan T, Thangavel J, et al. The vascular endothelium and human diseases[J]. Int J Biol Sci, 2013, 9: 1057-1069. DOI:10.7150/ijbs.7502 |
| [12] |
Miow QH, Tan TZ, Ye J, et al. Epithelial-mesenchymal status renders differential responses to cisplatin in ovarian cancer[J]. Oncogene, 2015, 34: 1899-1907. DOI:10.1038/onc.2014.136 |
| [13] |
Khalifa AM, Elsheikh MA, Khalifa AM, et al. Current strategies for different paclitaxel-loaded nano-delivery systems towards therapeutic applications for ovarian carcinoma: a review article[J]. J Control Release, 2019, 311-312: 125-137. DOI:10.1016/j.jconrel.2019.08.034 |
| [14] |
Wang H, Ding T, Guan J, et al. Interrogation of folic acidfunctionalized nanomedicines: the regulatory roles of plasma proteins reexamined[J]. ACS Nano, 2020. DOI:10.1021/acsnano.0c02821 |
| [15] |
Li Y, Gao Y, Zhang X, et al. Nanoparticles in precision medicine for ovarian cancer: from chemotherapy to immunotherapy[J]. Int J Pharm, 2020, 591: 119986. DOI:10.1016/j.ijpharm.2020.119986 |
| [16] |
Arvizo RR, Giri K, Moyano D, et al. Identifying new therapeutic targets via modulation of protein corona formation by engineered nanoparticles[J]. PLoS One, 2012, 7: e33650. DOI:10.1371/journal.pone.0033650 |
| [17] |
Ren J, Cai R, Wang J, et al. Precision nanomedicine development based on specific opsonization of human cancer patientpersonalized protein coronas[J]. Nano Lett, 2019, 19: 4692-4701. DOI:10.1021/acs.nanolett.9b01774 |
| [18] |
Swider E, Koshkina O, Tel J, et al. Customizing poly(lactic-co-glycolic acid)particles for biomedical applications[J]. Acta Biomater, 2018, 73: 38-51. DOI:10.1016/j.actbio.2018.04.006 |
| [19] |
Makadia HK, Siegel SJ. Poly lactic-co-glycolic acid(PLGA)as biodegradable controlled drug delivery carrier[J]. Polymers(Basel), 2011, 3: 1377-1397. |
| [20] |
Saul JM, Annapragada A, Natarajan JV, et al. Controlled targeting of liposomal doxorubicin via the folate receptor in vitro[J]. J Control Release, 2003, 92: 49-67. DOI:10.1016/S0168-3659(03)00295-5 |
| [21] |
Han X, Liu J, Liu M, et al. 9-NC-loaded folate-conjugated polymer micelles as tumor targeted drug delivery system: preparation and evaluation in vitro[J]. Int J Pharm, 2009, 372: 125-131. DOI:10.1016/j.ijpharm.2008.12.035 |
| [22] |
Corbo C, Molinaro R, Tabatabaei M, et al. Personalized protein corona on nanoparticles and its clinical implications[J]. Biomater Sci, 2017, 5: 378-387. DOI:10.1039/C6BM00921B |
| [23] |
Zhang H, Wu T, Yu W, et al. Ligand size and conformation affect the behavior of nanoparticles coated with in vitro and in vivo protein corona[J]. ACS Appl Mater Inter, 2018, 10: 9094-9103. DOI:10.1021/acsami.7b16096 |
| [24] |
Hadjidemetriou M, Al-Ahmady Z, Mazza M, et al. In vivo biomolecule corona around blood-circulating, clinically used and antibody-targeted lipid bilayer nanoscale vesicles[J]. ACS Nano, 2015, 9: 8142-8156. DOI:10.1021/acsnano.5b03300 |
| [25] |
Kristensen K, Engel TB, Stensballe A, et al. The hard protein corona of stealth liposomes is sparse[J]. J Control Release, 2019, 307: 1-15. DOI:10.1016/j.jconrel.2019.05.042 |
| [26] |
Yu L, Xu M, Xu W, et al. Enhanced cancer-targeted drug delivery using precoated nanoparticles[J]. Nano Lett, 2020. DOI:10.1021/acs.nanolett.0c03982 |
 2021, Vol. 56
2021, Vol. 56


